LIG4综合征四例并文献复习
2019年3月
中华儿科杂志,第57卷第3期 第217页-第221页
越桐,李建国,周志轩,侯俊,许瑛杰,刘嵘,师晓东
LIG4综合征(OMIO#606593)为罕见联合免疫缺陷病,其发病率极低,为非同源DNA末端连接(nonhomologous DNA end joining,NHEJ)通路缺陷病中的一种[1]。NHEJ是人和哺乳动物细胞DNA双链断裂修复的主要通路,DNA连接酶Ⅳ作为其中重要组成部分在识别和纠正DNA复制、分裂时的错误起到至关重要的作用,并且在淋巴细胞、造血干细胞及神经细胞的发育中起到了关键作用,故其编码基因LIG4缺陷会导致联合免疫缺陷、小头畸形、特殊面容("鸟头样"面容)、生长发育迟缓、智力及运动落后等一系列表现,称为LIG4综合征[1,2]。检索文献发现目前报道LIG4综合征病例仅为37例,多为个例报道,其临床表型差异较大。为此,对首都儿科研究所附属儿童医院风湿免疫科2017年6月至2018年5月诊治的来自3个家系的4例LIG4综合征的临床资料、实验室检查结果和遗传学结果进行总结,并结合文献复习进行分析报道。
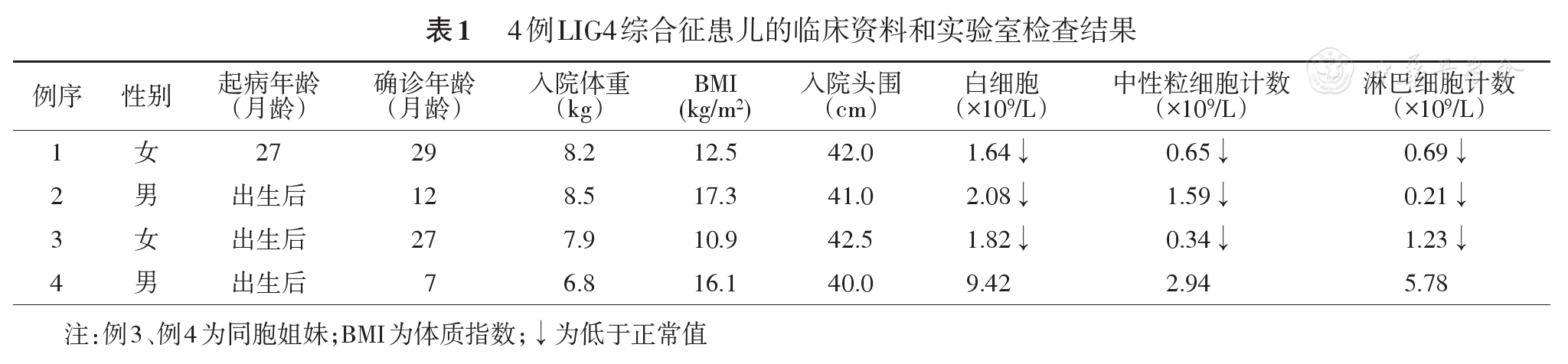
(1)4例均为住院患儿,来自3个家系(其中例4因其姐姐例3确诊而确诊),男2例,女2例,年龄8月龄~2岁11月龄,平均确诊年龄1岁6月龄。4例均为足月出生,出生体重均在正常范围内。例1起病年龄为2岁3月龄,首发症状为鹅口疮,其余3例自生后即表现为卡介苗疤痕反复破溃。4例患儿均有特殊面容,即窄额头、大鼻、尖鼻头、小下颌,3例有生长发育落后,表现为矮小及营养不良,例3还存在喂养困难。父母非近亲婚配,例1和例2无类似家族史,例3和例4为姐妹;(2)感染病原,3例卡介苗疤痕破溃,其中2例患儿存在卡介苗感染;其他感染包括EB病毒2例、巨细胞病毒2例、真菌1例(例1表现为严重口周及声带真菌感染),病毒感染为常规感染筛查发现,患儿均无相应临床症状。(3)其他系统检查情况,呼吸系统:3例患儿反复肺炎,发病年龄为1岁左右,多为肺炎链球菌及耐甲氧西林金黄色葡萄球菌;消化系统:1例患儿长期严重腹泻,予抗感染及肠内喂养无明显效果,未做胃肠镜;神经系统:均有小头畸形,例3有智力、运动落后(表现为不能独走、仅可说叠字)。(4)实验室检查:例1~3血常规提示白细胞计数明显减低,其中2例患儿间断使用粒细胞集落刺激因子;均有贫血,其中例3患儿为直接Coombs实验阳性的溶血性贫血;例1和例3有血小板减少,予输注血小板等对症治疗后可恢复正常。头颅磁共振成像提示4例患儿均存在脑沟明显,以额顶叶为著,其中例1左侧枕叶存在异常强化灶,考虑感染,例3有鼻窦炎。(5)治疗:4例患儿中,例1采用单倍体异基因造血干细胞移植(EBMT方案),移植过程未见严重感染,未见Ⅲ~Ⅳ度的移植物抗宿主病发生,最终达到完全嵌合状态,移植后随访1年未发生反复感染。另外3例患儿长期口服预防量抗真菌药、复方磺胺甲
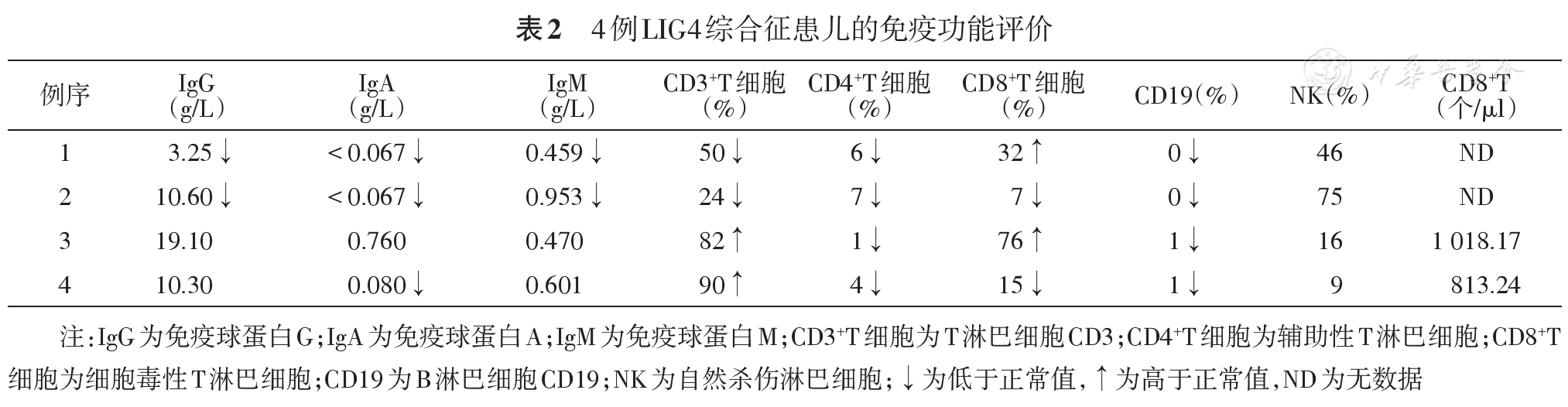
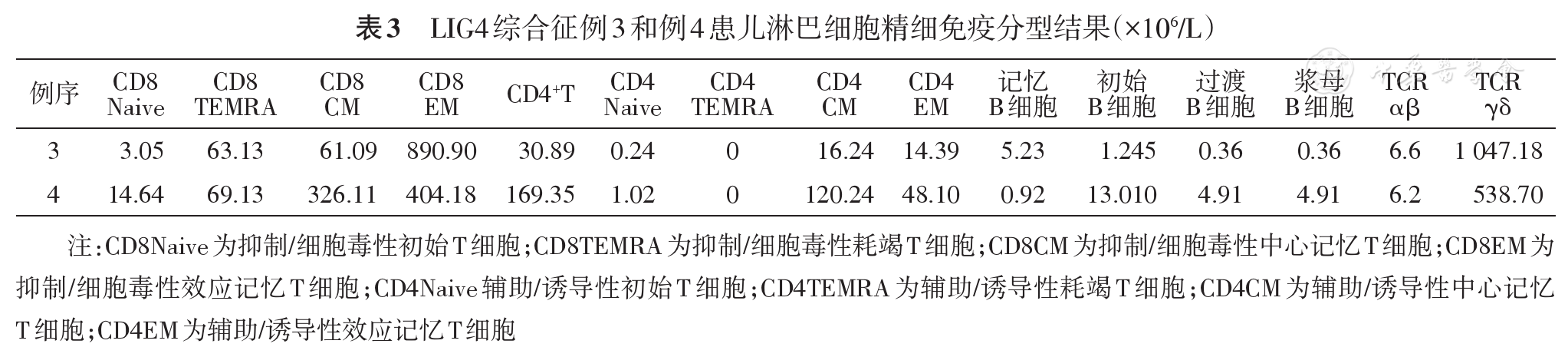
例1、例2免疫球蛋白降低,例3免疫球蛋白正常,例4为IgA降低。所有患儿CD4+T细胞及CD8+T细胞及B细胞比例明显降低,NK细胞比例正常。例3、例4淋巴细胞精细免疫分型突出表现为CD4/CD8倒置,CD4+T淋巴细胞及B细胞比例及绝对计数均明显降低,Naive CD8+、Naive CD4+、Naive B细胞比例及绝对计数明显降低,TCRαβ比例及绝对计数降低,TCR γ δ比例及绝对计数明显升高。
4例患儿均在外院接受了二代DNA测序检测及Sanger测序验证(分别由北京迈基诺科技有限公司、嘉检科技有限公司完成检测),均为LIG4基因变异(

以"LIG4综合征"为主题词检索中国知网、万方数据库、中国生物医学文献数据库(建库至2019年1月),检索到相关文献报道1篇,LIG4综合征病例1例,以"DNA ligase Ⅳ syndrome"为检索词在PubMed数据库(建库至2019年1月)中检索,检索到相关文献66篇,共LIG4综合征病例36例,合计37例[3,4,5,6,7,8,9,10,11,12]。患儿确诊本病年龄为2~17岁[4,7]。综合文献报道及本例,所有患儿均表现为小头畸形,14例伴有生长发育受限,9例描述有特殊面容。本病患儿对放射线敏感性明显增加,文献报道有2例合并恶性肿瘤患儿在接受放射线治疗过程中出现严重感染。本病患儿多以反复感染起病,其中以反复呼吸道感染、慢性腹泻及中耳炎较为常见[5,7],感染病原方面主要包括肺炎链球菌、诺如病毒、巨细胞病毒及EB病毒等,绝大部分患儿死于呼吸道感染后的呼吸衰竭。患儿多有不同程度血液系统受累表现,其中以贫血和(或)血小板减少较常见,少数表现为全血细胞减少。文献报道9例患儿合并恶性肿瘤,其中7例为淋巴瘤。免疫学方面,大部分患儿表现为免疫球蛋白降低,其中以IgA、IgM降低为主,包括本例在内,共有2例患儿免疫球蛋白水平表现为完全正常。淋巴细胞检查显示本病患儿B淋巴细胞数量明显降低,CD3+、CD4+淋巴细胞比例降低,CD8+淋巴细胞比例升高。本病患儿均存在基因变异,其中多为复合杂合变异,父母为健康携带者。治疗方面,主要为骨髓移植,目前全球共有3例患儿成功行骨髓移植治疗,其余均死于严重感染、造血干细胞移植后排异反应及感染等。
LIG4综合征由Riballo等[13]1999年首次报道。DNA连接酶Ⅳ的编码基因LIG4(OMIM 601837)位于13q33-q34,基因变异导致DNA连接酶Ⅳ功能缺陷或部分功能丧失[14],为常染色体隐性遗传(AR)。小头畸形是本病的典型表现之一,LIG4基因敲除小鼠神经细胞凋亡数量明显增加[15],是导致小头畸形的因素,小头畸形的表现多在胎儿时期即可发生,本组4例患儿出生时均有小头畸形表现,但是未引起重视,提示临床医师应重视体检所见的异常,对早期发现罕见病至关重要。LIG4综合征表现为"鸟样"特殊面容,呈鼻大、额头窄,本组4例患儿均有上述特征面容。生长发育落后及喂养困难是本病的另一特征,主要表现为矮小及体重不增,但是不同患儿临床表型差异较大[6,10],这可能与患儿的基因变异类型、感染及喂养困难程度有关系。智力、运动发育落后是本病的另一特征性表现,动物实验显示DNA连接酶Ⅳ缺乏可引起产前神经细胞的分化受损[16],但其神经系统受累异质性较大[2,8],本组4例患儿中3例无明显智力、运动发育落后,例3严重腹泻后出现智力、运动倒退,表现为可独坐,不能扶走,仅可说叠字。感染是该病的重要特征,LIG4综合征感染多发生于1岁后[17],以呼吸道及消化系统感染为主,其常见病原为细菌、病毒、真菌,本组4例患儿亦符合该特点。慢性腹泻是本病一个常见的临床表现,例3存在慢性腹泻,并伴有持续性诺如病毒感染,与Enders等[4]报道的该病临床表现类似。另外,文献报道本病可合并骨发育异常[10]。
本组3例患儿均存在外周血白细胞计数明显降低(例4因为姐姐确诊行相关筛查而较早获确诊),应引起临床医师的重视,对于白细胞降低,同时伴有小头畸形等特征者,应该想到LIG4综合征的可能性。文献报道本病为T、B细胞数量降低而NK细胞正常(T-B-NK+)[18],本组4例患儿均符合上述表现,例3、例4进一步的淋巴细胞精细免疫分型表现为CD4+T淋巴细胞及B淋巴细胞绝对计数均明显降低,CD4/CD8倒置,同时Naive CD8+、Naive CD4+、Naive B细胞比例及绝对计数明显降低,该情况在文献中尚未检索到。由于初始T细胞没有接受过抗原刺激,在人体产生针对新抗原的免疫应答中起到至关重要的作用,而NaiveCD8+T细胞、NaiveCD4+T细胞及NaiveB细胞的明显降低导致患儿在初次感染时不能产生有效的特异性免疫应答。成熟T细胞(约95%)的TCR分子由α链和β链两条异二聚体肽链组成,小部分由γ、δ链组成。T细胞发育的过程中,编码α及β的基因决定TCR的高度多态性,不同的T细胞克隆有不同的TCR,能识别不同的抗原表位,Enders等[4]的报道示本病患儿αβ T细胞数量减少10倍,而γδ T细胞数量正常,本研究例3、例4患儿精细免疫分析提示αβ T细胞比例降低、γδ T细胞比例明显升高,提示存在TCR多态性受损。文献报道本病患儿免疫球蛋白可正常或降低,本组4例患儿中2例降低,提示患儿B细胞数量虽然降低但部分B细胞仍具有发育为浆细胞进而产生抗体的能力,故表现为体液免疫正常或功能受损。
LIG4综合征患儿对放射线敏感性明显增加,有研究表明患儿皮肤成纤维细胞在放射线下更容易出现损伤及修复延迟,这可能也与DNA连接酶缺陷使DNA损伤不能得到及时修复相关,因此确诊本病的患儿应尽可能的避免放射线暴露。本病可合并白血病、非霍奇金淋巴瘤及自身免疫性疾病,合并恶性肿瘤患儿往往起病年龄较大[3],本组4例患儿尚未发现恶性肿瘤表现。例3存在免疫性全血细胞减少表现。
LIG4综合征的临床表型与LIG4基因变异的类型相关[18],在动物实验中,DNA连接酶Ⅳ的活性完全丧失导致广泛的神经元凋亡,导致胚胎不能存活[19]。由此推测其临床严重程度与DNA连接酶Ⅳ的活性相关,文献报道LIG4基因C.833G>T(R278)及C.2440C>T(R814X)突变[20]生长发育正常或轻度受限,甚至可以无免疫缺陷。本组4例患儿均为复合杂合变异,分别为一个错义变异和一个严重变异,其中例2临床表型明显较其他3例患儿轻,该患儿无生长发育及智力运动落后,感染相对轻且容易控制,其临床表型轻跟基因变异的关系尚待进一步研究。Jiang等[11]报道LIG4基因C.833G>T可能为中国儿童热点变异,本组例3、4患儿均存在该位点变异,支持其为中国LIG4综合征患儿热点的观点。本研究发现的C. 1347A>T、C. 584-585 insarA、C.1296A>T、C.1672C>T 4种变异在此前的文献中均未见报道,其在人群中的变异率极低,所在区域氨基酸序列高度保守,为蛋白质的重要组成部分,临床符合LIG4综合征特点,考虑为致病性变异。
关于治疗,本病一旦确诊,即应开始预防性应用抗真菌药、复方磺胺甲唑、抗菌药物等,定期予人免疫球蛋白免疫支持治疗[10],本组病例即使给予上述治疗,例2~4患儿仍有反复感染。目前公认骨髓移植是有效的根治本病的方法,但是也存在很多问题,因为骨髓移植仅可根治免疫缺陷,对矮小及神经系统的症状改善效果欠佳[4,8],这可能是由于患儿在胚胎时期神经系统发育已受到损害。同时移植本身也具有风险,在移植失败的报道中[7,9,10],患儿主要死于感染,包括真菌、病毒感染(BK、EB病毒),在出现感染症状之前进行骨髓移植成功率更高[21],故对本类疾病的早期确诊极为重要,诊断程序上,对于出生后头围小、鸟嘴样外观、反复感染的患儿,应该及早进行血常规及免疫方面的检查,一旦发现白细胞减少,细胞免疫检测显示T、B细胞降低且CD4/CD8比值倒置,即高度提示该病,再进一步行基因分析验证诊断,尽早确诊并尽量在患儿发生感染之前进行干预,可改善预后。本病患儿大多死于重症细菌和(或)病毒感染、真菌性肺炎、移植预处理阶段及移植后的排异、感染[3,4,11]。
总之,LIG4综合征是一种极为罕见的、AR联合免疫缺陷病,可表现为小头畸形,特征性面容及神经发育障碍、放射敏感性和免疫缺陷。LIG4综合征疾病的严重程度可能与基因变异位点有关系,有待于积累更多病例和功能验证;该病一旦确诊尽早预防性应用抗生素及免疫球蛋白替代治疗,并积极创造条件进行骨髓移植,是治疗免疫缺陷的关键,但是移植对免疫系统以外的获益情况有待商榷。
[1] O′Driscoll M, Cerosaletti KM, Girard PM, et al. DNA ligase IV mutations identified in patients exhibiting developmental delay and immunodeficiency [J]. Mol Cell, 2001, 8(6):1175-1185.
[2] Murray JE, Bicknell LS, Yigit G, et al. Extreme growth failure is a common presentation of ligase IV deficiency [J]. Hum Mutat, 2014, 35(1):76-85.
[3] Toita N, Hatano N, Ono S, et al. Epstein-Barr virus-associated B-cell lymphoma in a patient with DNA ligase IV (LIG4) syndrome [J]. Am J Med Genet A, 2007, 143A(7):742-745.
[4] Enders A, Fisch P, Schwarz K, et al. A severe form of human combined immunodeficiency due to mutations in DNA ligase IV [J]. J Immunol, 2006, 176(8):5060-5068.
[5] Unal S, Cerosaletti K, Uckan-Cetinkaya D, et al. A novel mutation in a family with DNA ligase IV deficiency syndrome [J]. Pediatr Blood Cancer, 2009, 53(3):482-484.
[6] Fadda A, Butt F, Tomei S, et al. Two hits in one: whole genome sequencing unveils LIG4 syndrome and urofacial syndrome in a case report of a child with complex phenotype[J]. BMC Med Genet, 2016, 17(1):84.
[7] Tamura S1, Higuchi K2, Tamaki M1, et al. Novel compound heterozygous DNA ligase IV mutations in an adolescent with a slowly-progressing radiosensitive-severe combined immunodeficiency[J]. Clin Immunol, 2015, 160(2):255-260.
[8] Gruhn B, Seidel J, Zintl F, et al. Successful bone marrow transplantation in a patient with DNA ligase IV deficiency and bonemarrow failure [J]. Orphanet J Rare Dis, 2007, 15, 2:5.
[9] Buck D, Moshous D, de Chasseval R, et al. Severe combined immunodeficiency and microcephaly in siblings with hypomorphic mutations in DNA ligase IV [J]. Eur J Immunol, 2006, 36(1):224-235.
[10] IJspeert H, Warris A, van der Flier M, et al. Clinical spectrum of LIG4 deficiency is broadened with severe dysmaturity, primordial dwarfism, and neurological abnormalities [J]. Hum Mutat, 2013, 34(12):1611-1614.
[11] Jiang J, Tang W, An Y, et al. Molecular and immunological characterization of DNA ligase IV deficiency [J]. Clin Immunol, 2016, 163(2):75-83.
[12] 张鑫丽,沈国松,李雯雯,等.一个LIG4综合征家系基因突变分析和产前诊断[J].浙江医学, 2018, 40(13):1495-1497.
[13] Riballo E, Critchlow SE, Teo SH, et al. Identification of a defect in DNA ligase IV in a radiosensitive leukaemia patient [J]. Curr Biol, 1999, 9(13):699-702.
[14] Marchetti C, Walker SA, Odreman F, et al. Identification of a novel motif in DNA ligases exemplified by DNA ligase IV [J]. DNA Repair (Amst), 2006, 5(7):788-798.
[15] Frank KM, Sharpless NE, Gao Y, et al. DNA ligase IV deficiency in mice leads to defective neurogenesis and embryonic lethality via the p53 pathway[J]. Mol Cell, 2000, 5(6):993-1002.
[16] Orii KE, Lee Y, Kondo N. etal. Selective utilization of nonhomologous end-joining and homologous recombination DNA repairpathways during nervous system development [J]. Proc Natl Acad Sci U S A, 2006, 103(26):10017-10022.
[17] 唐茂芝,安云飞,蒋金秋,等. NHEJ通路缺陷与原发性免疫缺陷病[J].中华儿科杂志, 2015, 53(12):962-966.
[18] Altmann T, Gennery AR, DNA ligase IV syndrome; a review[J]. Orphanet J Rare Dis, 2016, 11(1):137.
[19] Woodbine L, Gennery AR, Jeggo PA. The clinical impact of deficiency in DNA non-homologous end-joining[J]. DNA Repair (Amst), 2014, 16(4):84-96.
[20] Ben-Omran TI, Cerosaletti K, Concannon P, et al. A patient with mutations in DNA Ligase IV: clinical features and overlap with Nijmegen breakage syndrome [J]. Am J Med Genet A, 2005, 137A(3):283-287.
[21] Kwan A, Abraham RS, Currier R, et al. Newborn screening for severe combined immunodeficiency in 11 screening programs in the United States [J]. JAMA, 2014, 312(7):729-738.

收藏此内容
推荐给朋友