比较扩散加权成像单指数模型和扩散峰度成像模型在预测局部晚期乳腺癌新辅助化疗疗效中的价值
2019年1月
中华放射学杂志,第53卷第1期 第26页-第32页
李相生,冯瑞,王东,祝红线,孟利民,任娥,方红,周纯武
新辅助化疗(neoadjuvant chemotherapy,NAC)已经广泛用于局部晚期乳腺癌的术前治疗,但是,部分患者对NAC不敏感,在化疗后病灶没有明显缩小甚至出现进一步增大[1]。对这部分患者,如能及早预测疗效,可使临床医师及时调整化疗方案,从而提高患者的疗效。研究结果显示,DWI可以用于乳腺癌NAC的早期疗效预测[2,3]。常规单指数DWI是基于体内水分子扩散符合高斯分布的假设,但实际上生物体内大部分水分子扩散符合非高斯分布[4]。扩散峰度成像(diffusion kurtosis imaging,DKI)模型可以修正单指数DWI模型的偏移,从而更真实反映组织内非高斯分布的水分子运动状态,有望用于肿瘤化疗疗效的预测及评价[5]。鉴于此,笔者对拟接受NAC的局部晚期乳腺癌患者行DWI和DKI模型成像,旨在寻找预测乳腺癌NAC的最佳扩散加权成像模型,从而为临床提供一个能无创预测乳腺癌NAC疗效的影像技术。
本研究为前瞻性临床研究,获得了解放军空军总医院伦理委员会的批准(批准号:KZ13-0231),所有患者均提供了书面的知情同意书。
收集2013年1月1日至2016年12月31日解放军空军总医院符合以下标准的患者。纳入标准:(1)临床怀疑为乳腺癌;(2)诊断最终经组织病理结果证实;(3)病灶直径≥2 cm,或不论病灶大小有腋窝淋巴结转移;(4)临床分期处于Ⅱ或Ⅲ期;(5)患者准备接受整个疗程的NAC,然后接受保乳手术;(6)年龄小于70岁;(7)NAC前未接受过手术治疗。排除标准:(1)没有完成化疗疗程;(2)影像资料或病理资料不全;(3)有MRI检查禁忌证;(4)扫描技术及图像质量不能满足要求;(5)化疗后没有接受手术治疗。最终80例局部晚期乳腺癌患者被纳入本研究。
患者均行乳腺MRI平扫和增强检查。采用美国GE Discovery 750 3.0 T MR扫描仪和8通道双侧乳腺相控线圈。患者取俯卧位,双侧乳腺自然悬垂于专用的乳腺线圈内,平静自由呼吸。扫描序列包括:(1)轴面FSE T2WI:采用三点法非对称性水脂分离成像序列,TR 4 787.0 ms,TE 85.0 ms,FOV 30 cm×30 cm,矩阵256×256,层厚5.0 mm,层间距1.0 mm,激励次数1次,带宽50 kHz,扫描时间2 min 58 s。(2)常规单指数DWI序列:TR 2 450.0 ms,TE 64.2 ms,FOV 32 cm×32 cm,矩阵512×512,层厚5.0 mm,层间距1.0 mm,激励次数2次,带宽50 kHz,b=0、1 000 s/mm2,扫描时间1 min 58 s。(3)DKI序列:TR 4 200.0 ms,TE 70.8 ms,FOV 32 cm×32 cm,矩阵256×256,层厚5.0 mm,层间距5.0 mm,激励次数2次,带宽250 kHz,b=0、1 000、2 000 s/mm2,每个b值均施加15个方向的扩散敏感梯度场,扫描时间4 min 30 s。(4)动态对比增强MRI(dyn amic contrast-enhanced MRI,DCE-MRI):采用横轴面动态容积成像序列,TR 4.3 ms,TE 1.7 ms,FOV 32 cm×32 cm,矩阵256×256,层厚2.0 mm,无间距扫描,激励角12°,激励次数1次,带宽125 kHz。扫描9期(第1期为增强前蒙片,随后8期为增强后扫描),每期扫描时间约45 s,每期间隔2 s。对比剂使用Gd-DTPA,剂量为0.1 mmol/kg,经肘静脉以2.0 ml/s流率团注,随后注射20 ml生理盐水冲管。增强扫描前先扫描蒙片,注射对比剂15 s后开始扫描,扫描8期。扫描时间共6 min 31 s。
将常规单指数DWI及DKI成像的原始图像传输到美国GE AW 5.0工作站,采用Functool软件进行后处理,由2名年资相近的影像科副主任医师(均有10年以上的MRI诊断经验)先采用双盲法分析,以电子化读片的方式阅读图像,用于评价不同观察者间的一致性,再讨论达成一致意见作为最终结果进行组间分析。
分析流程如下:(1)结合T2WI及DCE-MRI图像,在DWI原始图像(选择b=1 000 mm/s2的图像)上观察病变大小、形态、范围和边界,选取病灶最大层面;(2)在DWI原始图像上选取病灶实性部分较大范围勾画ROI,ROI要避开内部出血、坏死及囊变区;(3)用相同原则在DKI原始图像(选择b=1 000 mm/s2的图像)勾画ROI。利用软件自动放置ROI,从而保证ROI在ADC图和DKI图的同一层面的同一位置。
单指数模型的评价指标为ADC值[6]。DKI评价指标为:平均扩散系数(mean diffusivity,MD),代表非高斯分布状态下的校正ADC值的平均值;平均扩散峰度(mean kurtosis,MK),代表扩散峰度的平均值,MK值越大,代表偏离常规单指数DWI模型的幅度越大。
MRI扫描完成后,患者接受了4~8个周期的NAC,每个化疗周期21 d。NAC方案有2种,分别为:(1)蒽环类药物和紫杉醇类药物(序贯使用):疗程包括4、6或8个化疗周期,37例患者采用此化疗方案。(2)蒽环类和紫杉醇类药物:疗程为4+4个周期,前4个周期使用蒽环类药物和环磷酰胺,后4个周期为紫杉醇类药物(CA-T),或以相反顺序使用化疗药物(T-CA)[7],43例患者采用此化疗方案。对人表皮生长因子受体2/原癌基因(Her2/Neu)阳性的患者,化疗药物要联合使用曲妥珠单抗(序贯使用而不是同时使用)。
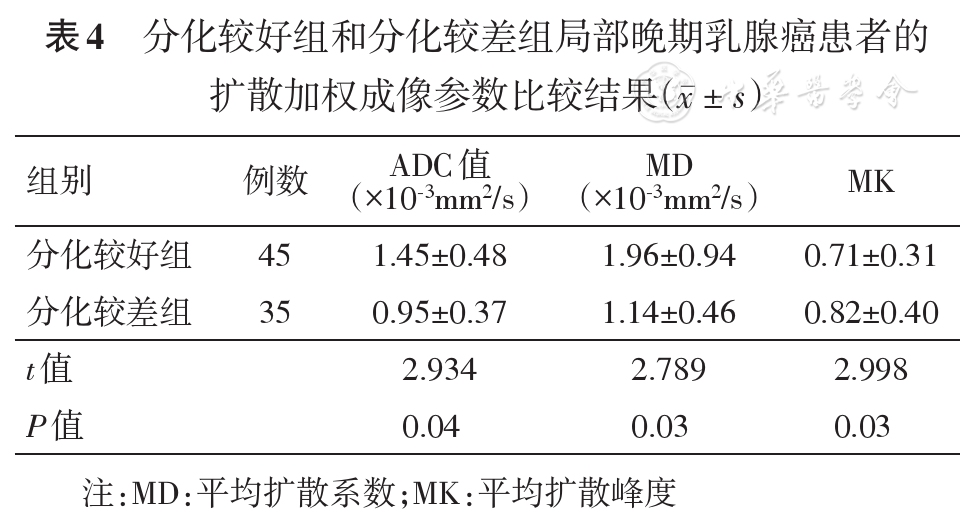
80例患者中,73例在MRI检查后进行了穿刺活检(相隔时间1~3 d),7例在穿刺活检后接受了MRI检查(相隔时间1~3 d)。根据化疗前穿刺活检的组织分级,将患者分为分化较好组(中等分化组)和分化较差组(未分化组)[8]。
根据术后病理结果,与化疗前穿刺活检切片对比,按照Miller和Payne分级方法[9],将化疗的疗效分为5个级别。分别为:1级:肿瘤细胞密度无改变或个别癌细胞发生改变;2级:肿瘤细胞密度轻度减少,但减少比例<30%;3级:肿瘤细胞密度减少为30%~90%;4级:肿瘤细胞密度减少>90%,仅仅残留肿瘤细胞团或零散分布的单个肿瘤细胞;5级:无肿瘤细胞残留,但可以残留导管原位癌成分。疗效分为病理完全缓解组(pathologic complete response,pCR)和病理非完全缓解组(pathologic non-complete response,non-pCR)。非完全缓解组包括1~4级,完全缓解组为5级。
使用统计软件SPSS 19.0进行统计学分析。采用Bland-Altman方法检验DWI、DKI成像参数在不同观察者之间的可重复性。采用Shapiro Wilk检验确定实验数据是否符合正态分布,正态分布的计量资料以
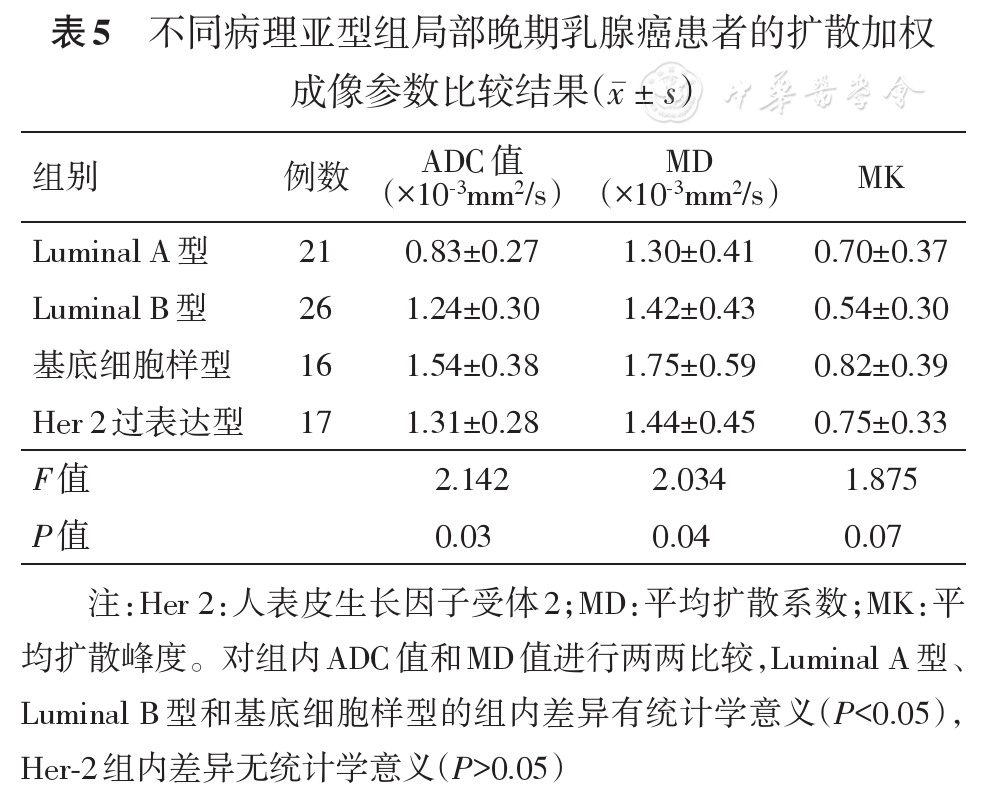
80例患者中,完全缓解组30例,非完全缓解组50例。两组患者的年龄、月经状态、肿瘤强化方式、病理类型、腋窝淋巴结转移、NAC周期及手术方式差异均无统计学意义;临床分期、分子亚型和组织学分级的差异有统计学意义,非完全缓解组的Ⅲ期肿瘤的构成比更高,基底细胞样亚型的完全缓解率最低,Luminal A亚型的完全缓解率最高,分化较差的完全缓解率高于分化较好组(
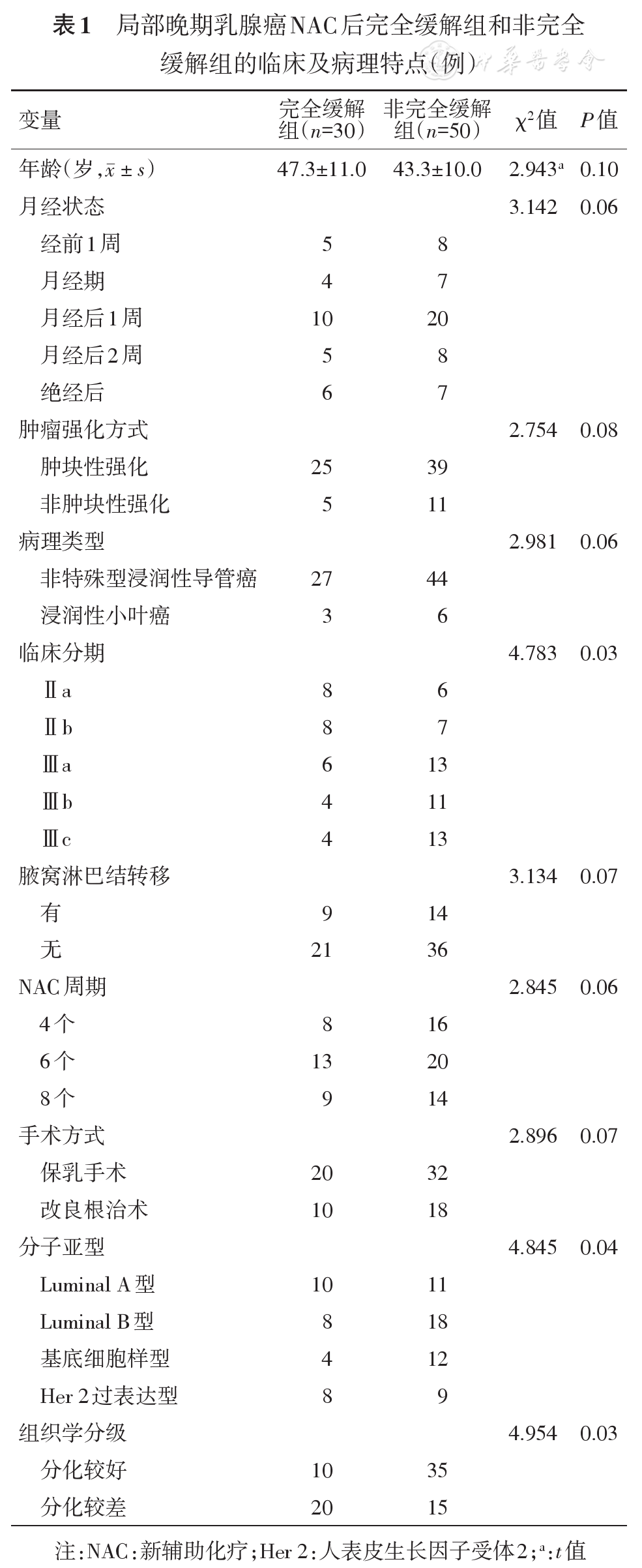
ADC、MD、MK值在2名医师间均有较好的一致性,但MD、MK测量值的标准差系数高于ADC测量值,表明MD、MK测量数据的离散程度较高(
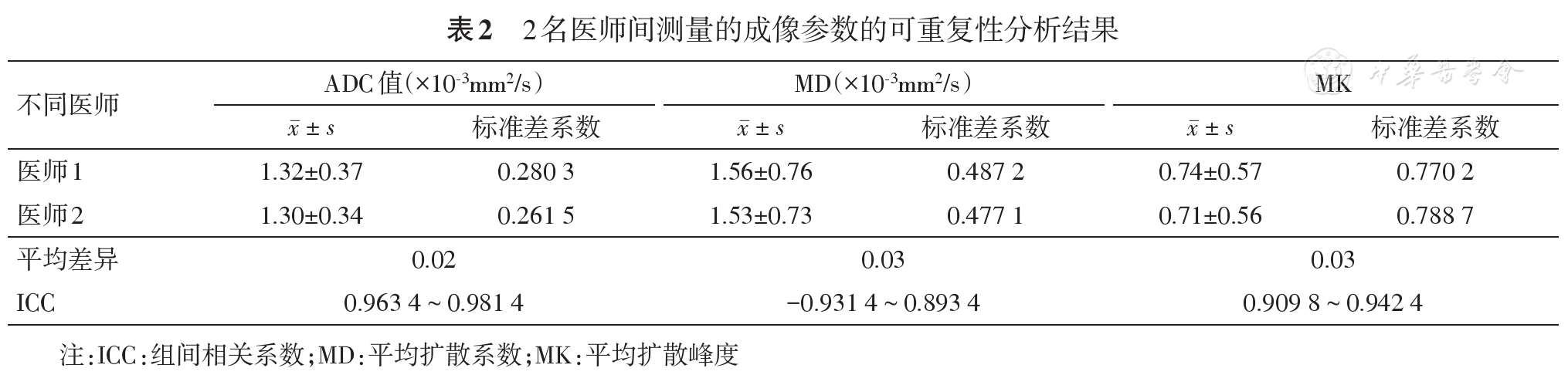
完全缓解组的ADC、MD值低于非完全缓解组,完全缓解组的MK值高于非完全缓解组(
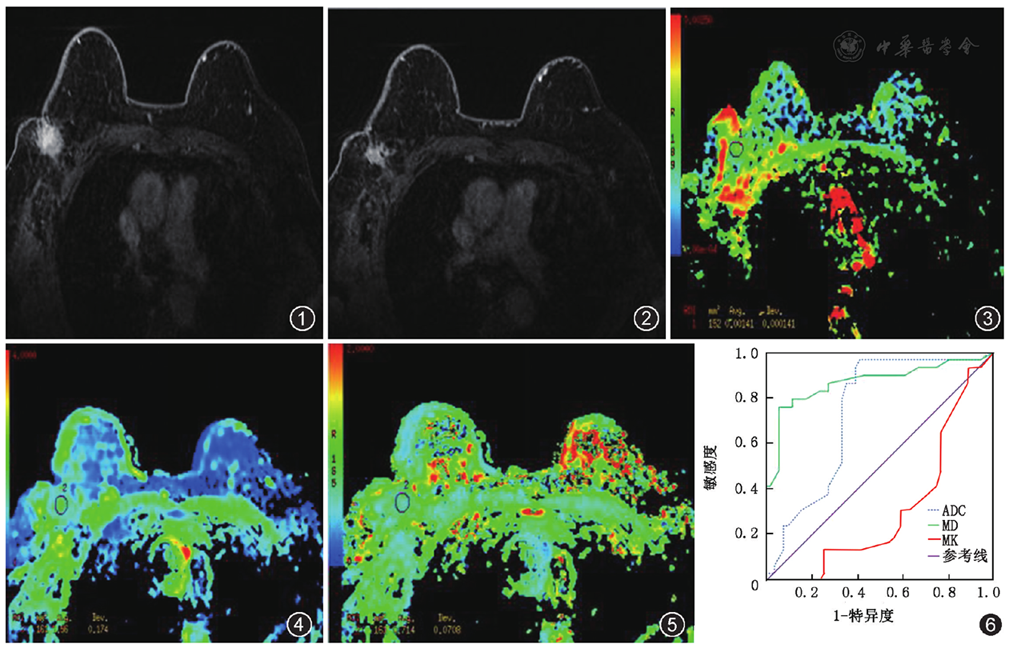
分化较差组的ADC、MD值低于分化较好组,差异有统计学意义;分化较差组的MK值高于分化较好组,差异也有统计学意义(
MD和ADC值呈正相关(r=0.643,P=0.02),MK和ADC值呈轻度负相关(r=-0.402,P=0.04)。ADC、MD和MK值预测疗效的ROC下面积分别为0.732(95%可信区间为0.634~0.843)、0.866(95%可信区间为0.725~0.901)和0.683(95%可信区间为0.614~0.803)(
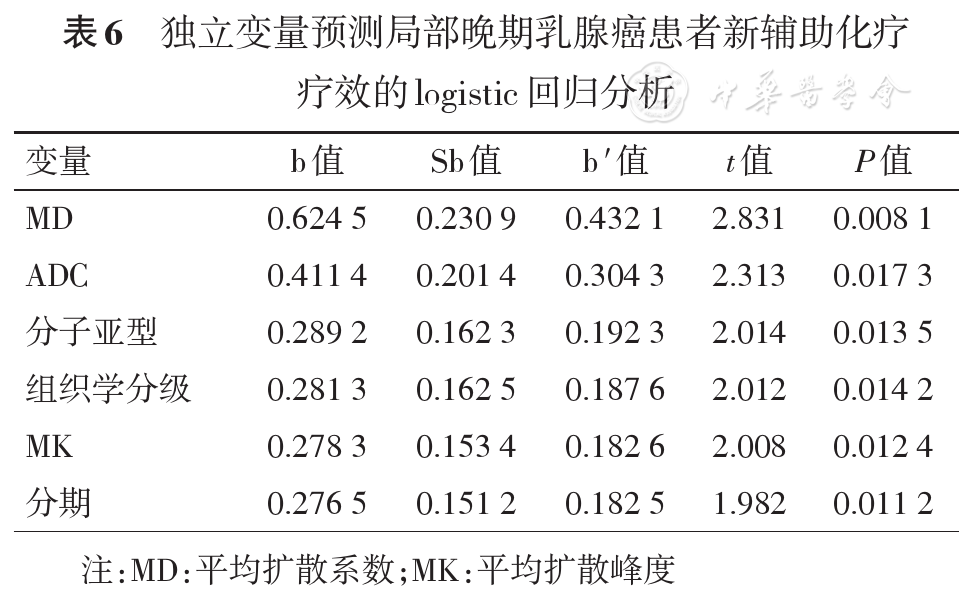
把MD、ADC、MK、肿瘤大小、分期、分子亚型、组织学分级、化疗方案、化疗周期、病灶强化方式和背景强化作为自变量建立logistic回归模型,采用逐步回归分析法将作用不显著的自变量排除在外,危险因素的筛选标准为α入=0.10,α出=0.15。模型的危险因素按照预测效能依次为MD、ADC、分子亚型、组织学分级、MK及分期(
针对化疗前基线ADC值能否预测乳腺癌NAC的疗效还存在一定争议,有学者认为,基线ADC值较低的乳腺癌可以获得较好的疗效[10,11,12];但是也有研究显示基线ADC值与化疗疗效无相关性[13]。本研究中,单指数扩散模型参数ADC值在预测局部晚期乳腺癌NAC疗效方面有一定价值,化疗前ADC值较低,完全缓解率较高。这些研究结果不一致的原因可能由于肿瘤病理类型、组织学分级、分子亚型、扫描技术、测量方法等方面不同所致。例如笔者发现,组织学分级对ADC值有一定影响,肿瘤分级越高,ADC值越低,对NAC越敏感。另外,不同分子亚型的ADC值存在一定差异,Luminal A亚型的ADC值最低。因此,组织学分级和分子亚型构成比的不同是各个研究结果不一致的重要原因。值得注意的是,在本研究中,鉴别完全缓解组和非完全缓解组的ADC临界值高于耿小川等[3]的研究结果(分别为1.432×10-3mm2/s和1.111×10-3mm2/s),其原因可能在于两项研究的患者组成和图像后处理方法存在一定差异;另外,当病灶较小或病灶内存在未能分辨的坏死时,ROI未能完全避开病灶内坏死或周围正常组织,也会导致测量值轻度增加。
本研究中,不同疗效组的DKI模型成像参数差异有统计学意义,完全缓解组的MD值低于非完全缓解组。MD值较低,往往是由于肿瘤细胞密度增加、细胞外间隙减少,肿瘤血管较多所引起的扩散受限程度增加所致,但是,此时,肿瘤往往对化疗比较敏感,从而获得较好的疗效[10]。另外,非完全缓解组的MK值高于完全缓解组。MK代表空间各梯度方向的扩散峰度平均值,是衡量组织结构复杂程度的指标,是无单位参数,MK越高,肿瘤微结构的复杂程度越高,肿瘤不均匀性往往增加,常常出现组织坏死,此时,NAC的疗效相对较差[11]。
经ROC分析发现,MD值预测化疗疗效的曲线下面积为0.866,敏感度和特异度为80.0%(64/80)和83.8%(67/80);而ADC值预测化疗疗效的曲线下面积为0.732,敏感度和特异度为81.3%(65/80)和63.8%(51/80)。因此,在预测效能方面,DKI模型要优于单指数模型,可能的原因在于:第一,ADC值不能反映组织内水分子的真实扩散程度,往往受微血管灌注的影响,从而削弱了此参数在预测NAC疗效中的价值[10,11]。然而,DKI模型参数反映了在非高斯分布状态下的水分子扩散状态,更接近于肿瘤微环境的真实状态,因此,DKI模型参数更适合作为预测乳腺癌化疗疗效的成像参数。第二,DKI模型可以量化评价组织结构的复杂性和不均匀性[13,14],这是常规单指数扩散模型所不能提供的。但是,需要注意的是,MD、MK测量值的离散程度高于ADC值,因此,DKI模型成像参数的稳定性和可重复性不如单指数模型成像参数。另外,笔者也对两组模型成像参数的相关性进行了探讨,发现MD值与ADC值呈正相关,MD测量值高于ADC值,MK值与ADC值呈现轻度负相关。
本研究结果显示,乳腺癌的临床和病理特点对NAC疗效也有一定影响,如临床分期、组织学分级及分子亚型。因此,对这些特点与扩散加权成像参数和NAC疗效的相关性进行了多元logistic回归分析,统计学分析表明,根据预测效能大小,NAC疗效的独立预测参数依次是MD、ADC、分子亚型、组织学分级、MK及分期。因此,利用MD、ADC、MK值预测NAC疗效时要结合肿瘤的临床、病理特点,这样会大大提高NAC疗效预测的准确性和可靠性。
目前,DCE-MRI是乳腺影像检查中的常规技术,主要根据NAC前后病灶大小的动态变化来判断NAC疗效,比较准确可靠,但是,往往在化疗后数周或数月才能观察到病灶大小的明显变化[15],不能在治疗前或治疗早期评价或预测疗效。与之相比,DKI技术可以反映肿瘤内非高斯状态下的水分子扩散情况,可提供除病灶形态之外的肿瘤微结构的功能信息,有望在化疗前就能根据功能信息预测肿瘤的化疗疗效[14]。迄今为止,还缺乏针对两种成像技术预测化疗疗效的对照性研究。
虽然DKI模型成像参数在预测乳腺癌NAC疗效方面较常规单指数模型成像参数更有意义,但是,DKI模型存在一些技术局限性。首先,DKI成像所需的b值较大,信噪比较低,图像质量较差。其次,高阶峰度成像较扩散加权成像更容易出现点状伪影,需要对DKI信号进行谨慎处理,增加信号采集重复次数有利于提高信噪比,但是,却延长了信号采集时间,从而限制了此成像技术在临床中的广泛应用[16,17]。再次,本研究中,根据NAC规范的要求,针对不同情况的乳腺癌患者采用了不同的化疗方案及化疗周期,这样可能会导致研究出现轻度偏倚。最后,少部分患者(7/80)在MRI检查前进行了穿刺活检,可能会影响ADC、MK、MD三者的测量结果,导致出现轻度测量误差。但是,随着DKI技术的不断完善、成像参数的不断优化以及临床研究的不断深入,DKI定量分析有望更准确地反映乳腺癌的肿瘤微环境,在乳腺癌NAC疗效的预测中有更大价值。
综上所述,对拟接受NAC的局部晚期乳腺癌,ADC、MD和MK值在完全缓解组和非完全缓解组之间存在差异,因此,在预测乳腺癌NAC疗效中有一定意义。并且,与单指数扩散模型相比,DKI模型更能真实反映乳腺癌的肿瘤微环境及其内水分子扩散受限状态,预测化疗疗效的效能更高,因此,更适合作为局部晚期乳腺癌NAC疗效预测的成像参数。
[1] Untch M, Konecny GE, Paepke S, et al.Current and future role of neoadjuvant therapy for breast cancer[J]. Breast, 2014,23(5): 526-537.
[2] Bufi E, Belli P, Costantini M, et al. Role of the apparent diffusion coefficient in the prediction of response to neoadjuvant chemotherapy in patients with locally advanced breast cancer[J]. Clin Breast Cancer, 2015,15(5):370-380.
[3] 耿小川,张庆,华佳,等.比较DWI体素不相干运动模型与单指数模型对乳腺癌新辅助化疗疗效评估的应用价值研究[J].磁共振成像, 2017,8(3): 176-181.
[4] Minarikova L, Bogner W, Pinker K, et al. Investigating the prediction value of multiparametric magnetic resonance imaging at 3 T in response to neoadjuvant chemotherapy in breast cancer[J]. Eur Radiol, 2017, 27(5):1901-1911.
[5] Jensen JH, Helpern JA, Ramani A, et al. Diffusional kurtosis imaging: the quantification of non-gaussian water diffusion by means of magnetic resonance imaging[J]. Magn Reson Med, 2005,53(6):1432-1440.
[6] Sun K, Chen X, Chai W, et al. Breast cancer: diffusion kurtosis MR imaging-diagnostic accuracy and correlation with clinical-pathologic factors[J]. Radiology, 2015,277(1):46-55.
[7] Kaufmann M, von Minckwitz G, Mamounas E, et al. Recommendations from an international consensus conference on the current status and future of neoadjuvant systemic therapy in primary breast cancer[J]. Ann Surg Oncol, 2012,19(5):1508-1516.
[8] 蔡媛,翁寿田,车潇良,等.乳腺癌组织学类型及分级对预测新辅助化疗的价值[J].现代肿瘤医学, 2013,21(1): 78-80.
[9] Ogston KN, Miller ID, Payne S, et al. A new histological grading system to assess response of breast cancers to primary chemotherapy: prognostic significance and survival[J]. Breast, 2003,12(5): 320-327.
[10] Park SH, Moon WK, Cho N, et al. Diffusion-weighted MR imaging: pretreatment prediction of response to neoadjuvant chemotherapy in patients with breast cancer[J]. Radiology, 2010,257(1):56-63.
[11] Li XR, Cheng LQ, Liu M, et al. DW-MRI ADC values can predict treatment response in patients with locally advanced breast cancer undergoing neoadjuvant chemotherapy[J]. Med Oncol, 2012,29(2):425-431.
[12] Bedair R, Priest AN, Patterson AJ, et al. Assessment of early treatment response to neoadjuvant chemotherapy in breast cancer using non-mono-exponential diffusion models: a feasibility study comparing the baseline and mid-treatment MRI examinations[J]. Eur Radiol, 2017,27(7):2726-2736.
[13] Nilsen L, Fangberget A, Geier O, et al. Diffusion-weighted magnetic resonance imaging for pretreatment prediction and monitoring of treatment response of patients with locally advanced breast cancer undergoing neoadjuvant chemotherapy[J]. Acta Oncol, 2010,49(3):354-360.
[14] Jensen JH, Helpern JA, Ramani A, et al. Diffusional kurtosis imaging: the quantification of non-gaussian water diffusion by means of magnetic resonance imaging[J]. Magn Res Med, 2005,53(6):1432-1440.
[15] Nadrljanski MM, Milo?evic ZC, Ple?inac-Karapand?ic V, et al. MRI in the evaluation of breast cancer patient response to neoadjuvant chemotherapy: predictive factors for breast conservative surgery[J]. Diagn Interv Radiol,2013,19(6):463-470.
[16] Nogueira L, Brand?o S, Matos E, et al. Application of the diffusion kurtosis model for the study of breast lesions[J]. Eur Radiol, 2014,24(6):1197-203.
[17] Wu D, Li G, Zhang J, et al. Characterization of breast tumors using diffusion kurtosis imaging (DKI)[J]. PLoS One, 2014,9(11):e113240.
