基于静息态功能MRI对不同运动亚型帕金森病患者脑功能局部一致性改变的研究
2019年9月
中华放射学杂志,第53卷第9期 第748页-第754页
王敏,王建伟,张克忠,王德杭,王杰
帕金森病(Parkinson disease,PD)是一种临床上常见的中枢神经系统变性疾病,是老年人群中最常见的运动障碍性疾病。PD具有非常典型的临床表现,根据其运动症状表现的不同,可以将PD分为震颤型(tremor dominant,TD)、姿势不稳/步态障碍型(postural instability gait difficulty,PIGD)。局部一致性(regional homogeneity,ReHo)是静息态fMRI(resting-state fMRI,rs-fMRI)的一种新的分析方法[1],它基于功能分离的原则,通过评价在某一相同时间序列中空间上相邻的多个体素血氧水平依赖(BOLD)信号的相似性来反映神经元活动的一致性,从而探测脑神经元自发性活动状况,ReHo的增高或降低反映了患者局部脑区神经元自发活动一致性的增高或降低,反映脑功能活动同质性的变化。有研究表明,PD患者与正常人存在着不同的局部脑活动改变[2,3],但是到目前为止,PD不同运动亚型的异常脑活动模式尚不清楚,也很少有研究报道各运动亚型PD患者之间的脑功能差异。本研究采用基于BOLD的rs-fMRI技术,通过比较TD患者、PIGD患者与健康对照局部脑活动一致性的变化,为进一步了解不同运动亚型PD患者的病理生理机制、诊断以及临床治疗提供新的思路。
收集南京医科大学第一附属医院2014年12月至2018年5月间收治的PD患者84例,其中男60例,女24例;所有病例均经PD专病门诊确诊,均符合英国PD学会脑库的临床诊断标准[4],所有患者均为右利手。所有患者在停用所有抗PD药物至少12 h(关期)进行临床评估及MRI扫描。PD患者临床评估包括统一帕金森病评定量表(Unified Parkinson Disease Rating Scale,UPDRS)、简易智能精神状态检查量表(MMSE)、Hoehn-Yahr分级等。
排除标准:(1)严重的震颤或步态障碍而无法配合检查的患者;(2)有多系统萎缩、进行性核上性麻痹等帕金森叠加综合征患者;(3)对左旋多巴治疗无反应;(4)影响步态的其他疾病如视觉障碍、骨骼肌肉疾病或卒中;(5)严重的认知障碍(MMSE<24);(6)有幽闭恐惧症、心脏起搏器植入等MRI检查禁忌证的患者。
PD运动分型标准[5]:根据UPDRS中震颤、静止性震颤和动作或姿势性震颤等9项震颤评分之和除以9得出平均震颤评分,跌倒、行走中冻结、行走、步态和姿势的稳定性5项评分之和除以5得出平均姿势不稳/步态障碍评分,将平均震颤评分与平均姿势不稳/步态障碍评分相比,比值≥1.5,则为震颤型,比值≤1.0则为姿势不稳/步态障碍型。本研究84例PD患者分为TD组45例,PIGD组39例,有43例TD、34例PIGD纳入最后的数据分析,2例TD和5例PIGD因头动过大(头动平移>2 mm或旋转移动>2°)去除。
同期从患者家属及社区招募性别、年龄、受教育程度与PD组相匹配的健康中老年人29名作为健康对照组(HC),其中男16名,女13名。所有HC均为右利手。排除标准为有神经精神疾病、主诉认知减退或是MMSE得分<24分及结构MRI发现直径>1 cm梗死灶等明显神经系统病变。
本研究经我院伦理委员会批准(2014-SRFA-097),所有受试者均签署知情同意书。
采用德国Siemens公司MAGNETOM Verio Tim 3.0 T MR成像扫描仪,头颅8通道正交线圈。在检查前告知受试者详细的检查情况和注意事项。扫描过程中受试者平卧于检查床上,保持安静、闭眼、清醒的状态,不做任何思维活动和自主运动。为防止和减少受试者头动,使用配套泡沫垫固定头部,同时给予弹力耳塞以降低机器噪声干扰。首先采集液体衰减反转恢复序列(FLAIR)T2WI以排除脑内病变,采用三维磁化强度预备梯度回波(3D-MPRAGE)序列获取解剖图像,扫描参数:TR 1 900 ms,TE 2.95 ms,反转角(FA)9°,层厚1 mm,层数160层,FOV 256 mm×256 mm,矩阵256×256,扫描时间3 min 21 s。rs-fMRI扫描序列采用梯度回波平面成像(EPI)序列,扫描参数:TR 2 000 ms,TE 21 ms,FA 90°,FOV 256 mm×256 mm,矩阵64×64,层厚3 mm,层数35层,采集240帧,扫描时间8 min 4 s。
1.在MATLAB 2012a平台上应用rs-fMRI数据处理助手(data processing assistant for resting-state fMRI,DPARSF)V2.0软件和数据分析处理工具包(resting-state fMRI data analysis Toolkit,REST)V1.8(http://www.restfmri.net)进行数据预处理及ReHo计算。
2.统计分析:(1)对于受试者的一般资料及临床量表资料运用SPSS 20.0软件进行统计分析。其中性别属于定性资料,采用χ2检验,其余均为定量资料。定量资料先进行正态性检验(Kolmogorov-Smirnov检验)和方差齐性检验(Bartlett检验),符合正态分布且方差齐的定量资料以
本研究3组间年龄、性别和教育年限差异均无统计学意义(P>0.05);TD组与PIGD组病程、UPDRS-Ⅲ评分及MMSE差异均无统计学意义(P>0.05);每日左旋多巴治疗量PIGD组高于TD组,两者差异有统计学意义(P<0.001)。具体结果详见
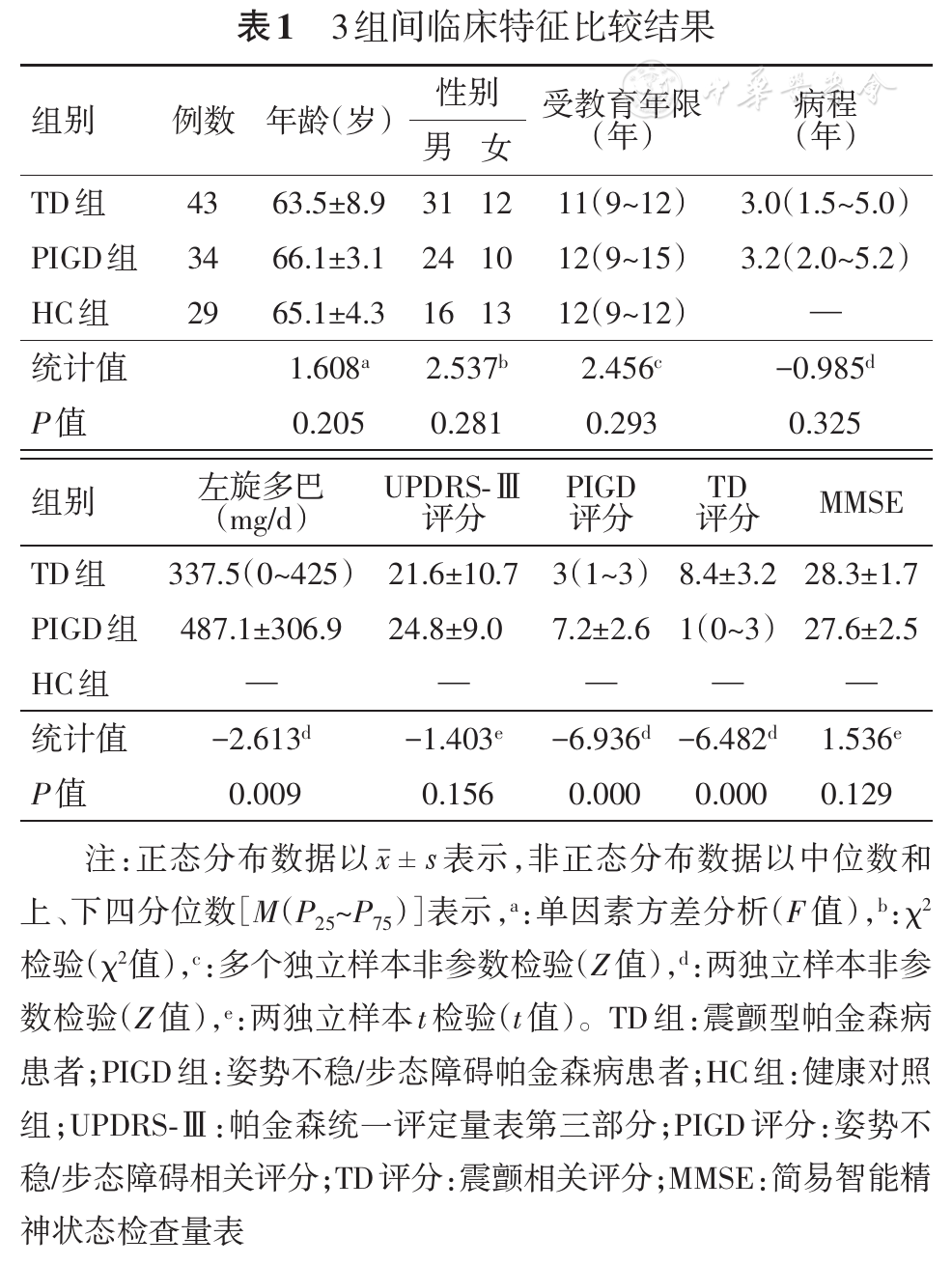
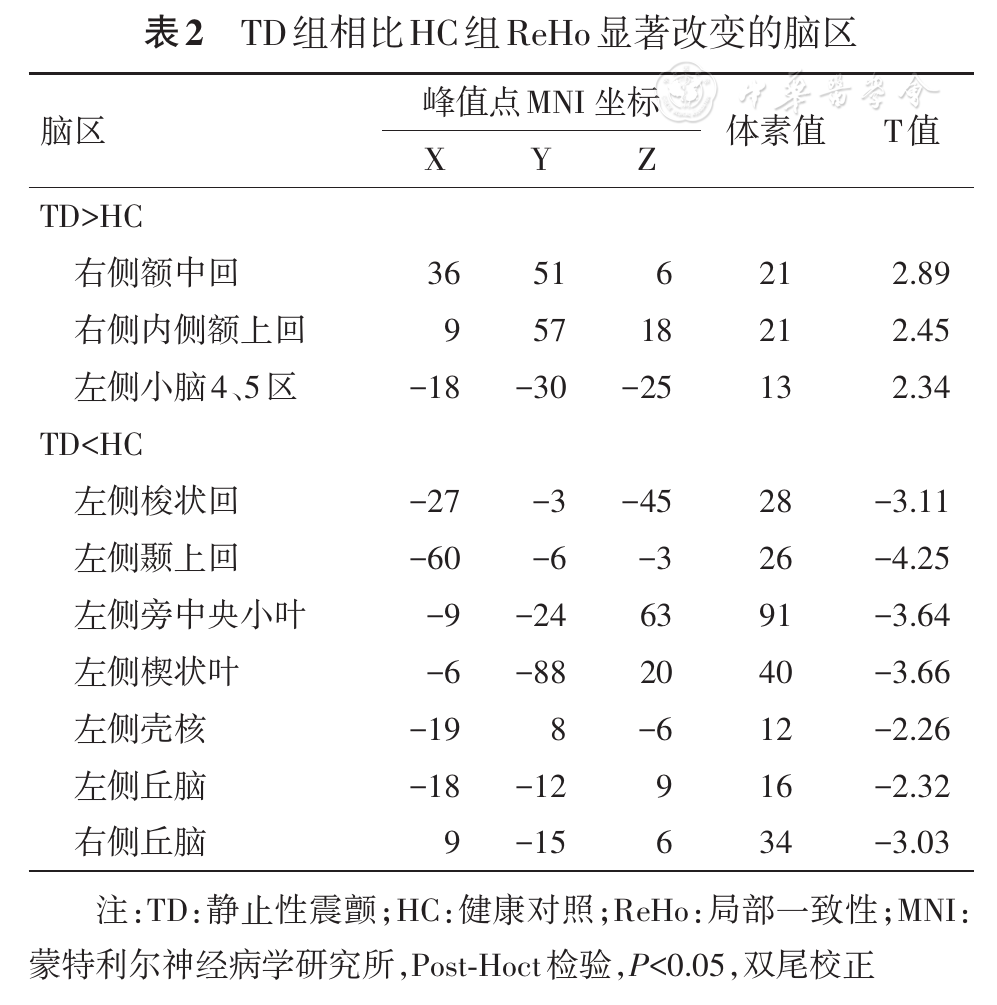
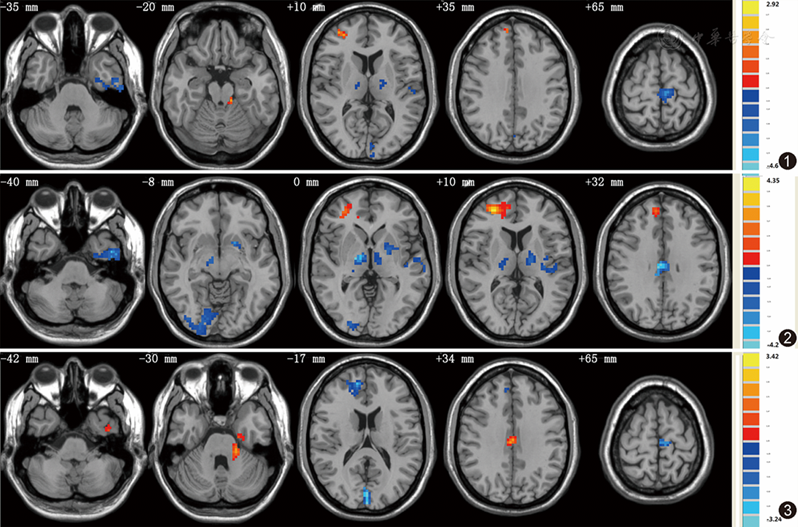
3组间协方差分析(ANCOVA)差异主要在双侧额叶、颞叶、丘脑、壳核、尾状核、小脑等区域,差异具有统计学意义。组间Post-Hoct检验显示,TD与HC相比,右侧额中回、右侧额上回、左侧小脑ReHo增强;左侧颞叶、左侧壳核、左侧旁中央小叶、双侧丘脑ReHo减低(
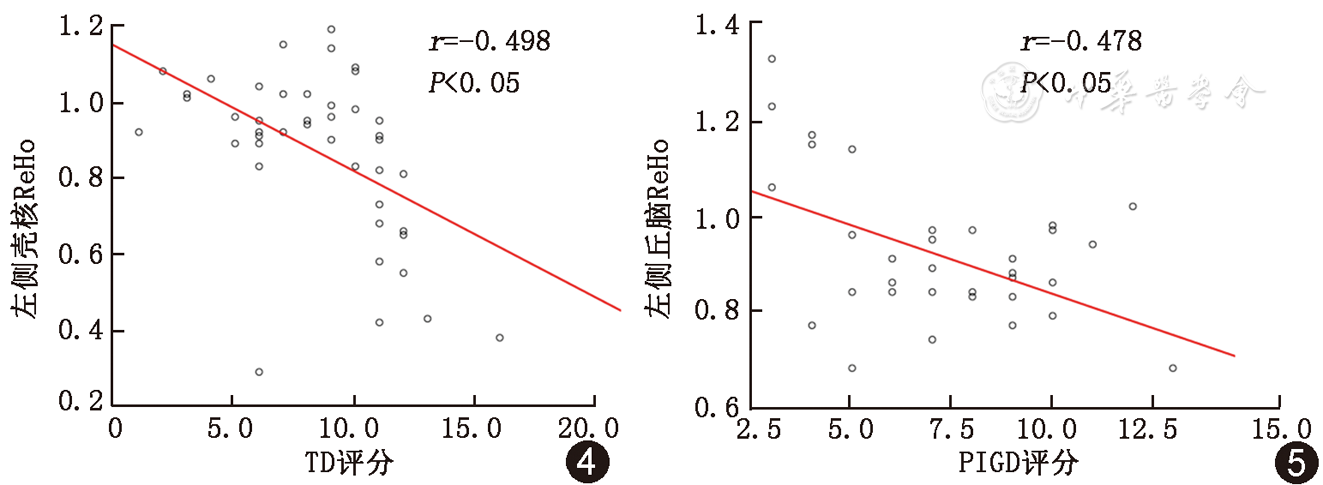
Pearson相关分析结果显示,TD组TD评分与左侧丘脑、左侧壳核ReHo值呈负相关,r值分别为-0.355、-0.498,P均<0.05,见
本研究通过采用ReHo分析方法观察了静息状态下TD组、PIGD组与健康对照组的局部脑活动差异,发现TD组患者的壳核、丘脑、小脑、边缘系统等脑区存在着脑活动局部一致性的改变,提示TD可能与纹状体-丘脑-皮层环路、小脑-丘脑-皮层环路等相关脑区损伤有关,PIGD组患者则体现了壳核、苍白球、丘脑、枕叶皮层(距状裂及周围皮层及枕下回)等相关脑区的功能活动异常,提示PIGD可能与纹状体-丘脑-皮层环路及视觉网络皮层等相关脑区损伤有关,这对进一步了解不同运动亚型PD的病理生理机制提供了有力的帮助。
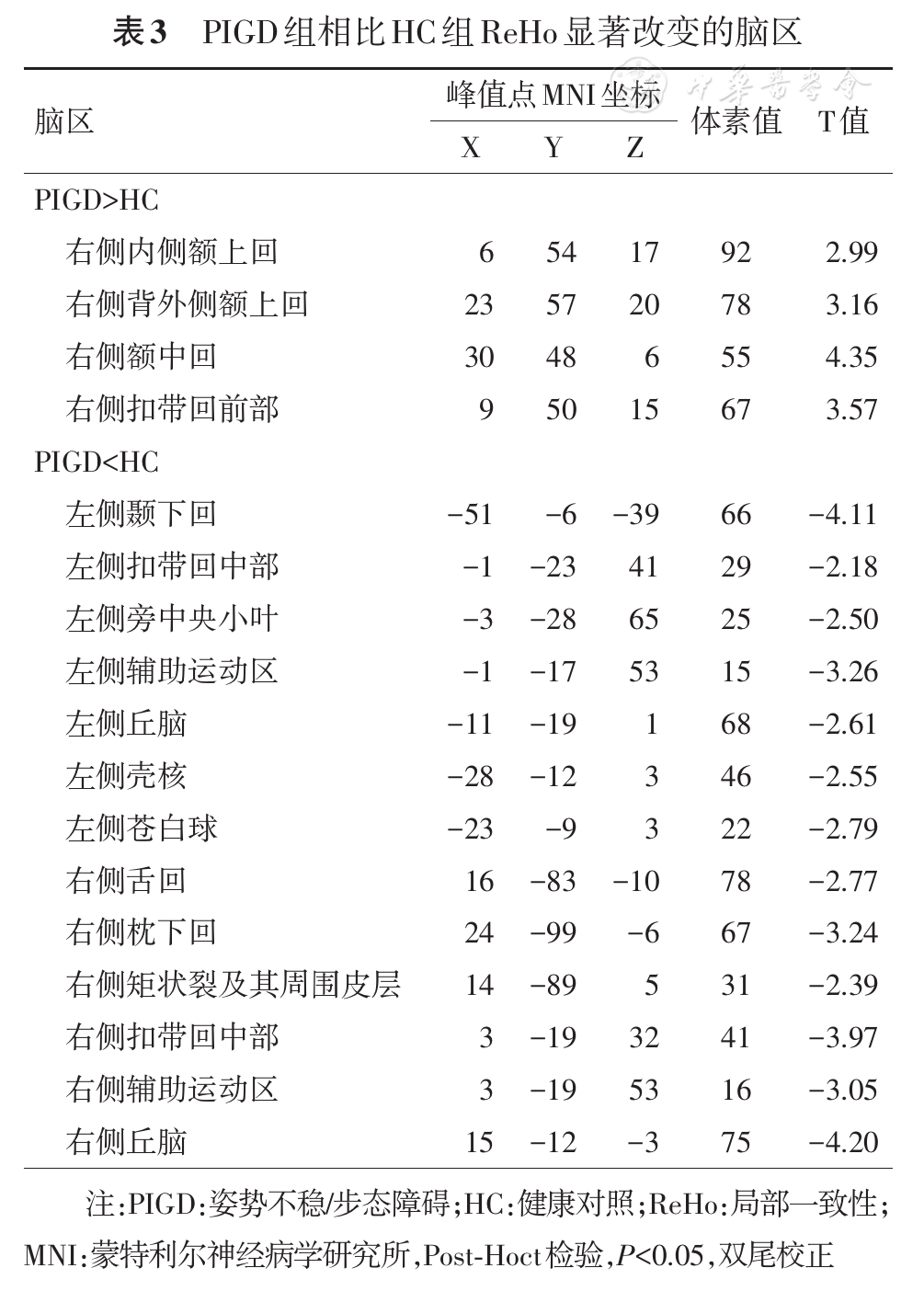
本研究中,与HC组相比,TD组的左侧壳核、双侧丘脑功能活动局部一致性减低,PIGD组左侧壳核、左侧苍白球、双侧丘脑也存在着局部一致性减低。壳核、苍白球、丘脑是大脑纹状体-丘脑-皮质(striatal-thalamo-cortical,STC)环路的重要组成部分,本研究中TD组和PIGD组均出现上述脑区的ReHo减低,提示两组PD患者均存在着STC环路神经元功能的损伤,这正与PD目前已知的基本病理机制是相吻合的[6]。同时,本研究还发现,TD组的左侧壳核、左侧丘脑与TD评分呈负相关,而且PIGD组的双侧丘脑ReHo值也与PIGD评分呈负相关,提示PD患者震颤、运动迟缓及步态僵化的症状越严重,丘脑、壳核等STC环路组成区功能活动局部一致性越低,这也就意味着STC环路相关脑区的损伤越严重。Wu等[7]通过对22例PD患者的脑局部一致性观察发现,PD较正常组在壳核、丘脑等组成STC环路的相关脑区存在ReHo的减低,且UPDRS评分与壳核等区域呈负相关。侯亚男等[8]采用静息态fMRI的低频振幅算法也发现PIGD和TD患者存在着STC环路相关脑区神经元低频活动的减弱,且PIGD评分和TD评分均与双侧壳核的低频振幅值呈负相关。和本研究一样,这些结果均提示PD患者出现运动迟缓、步态僵化及震颤等相关运动症状与STC环路功能损伤有关。另外,本研究还在两组亚型PD患者的额叶存在ReHo增高的情况,有研究认为PD患者额叶功能的增强是对STC环路损伤的一种控制反应[9,10]。
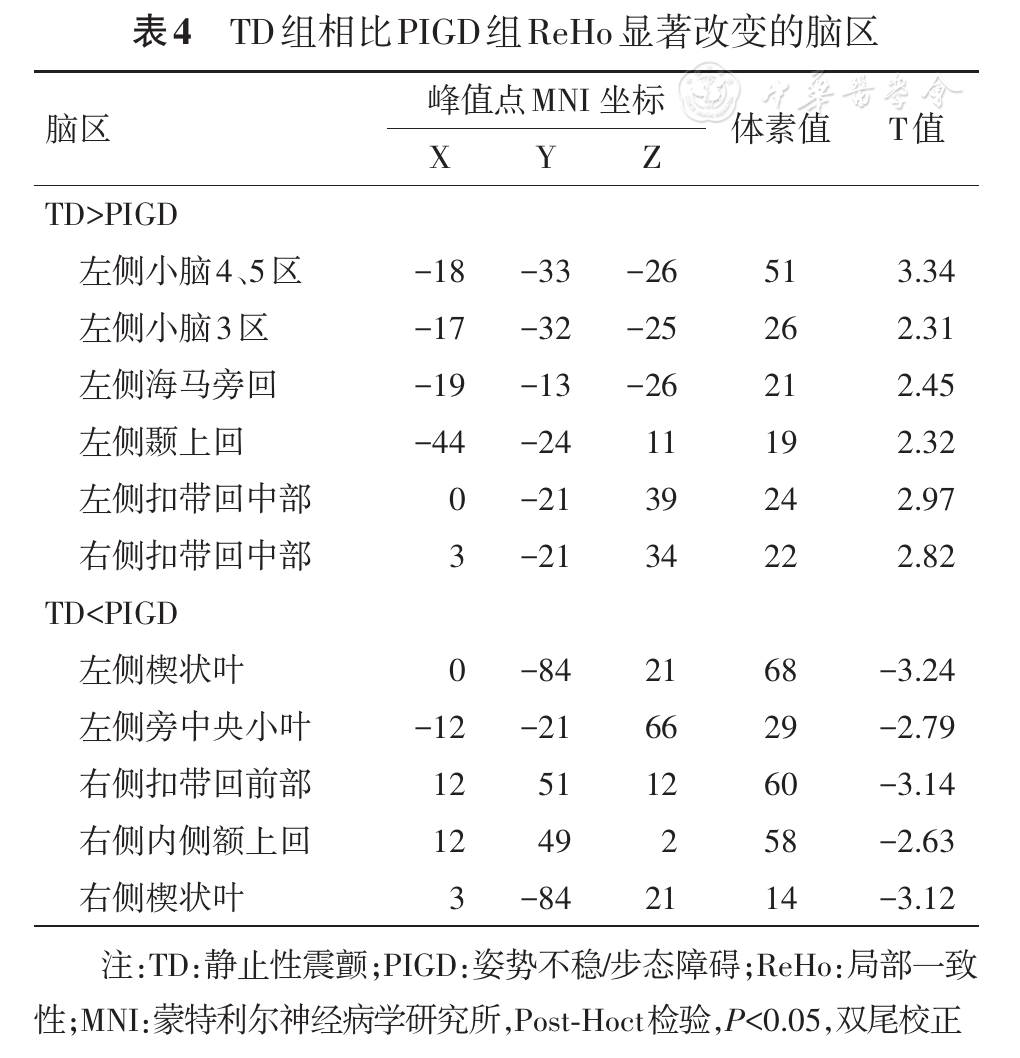
与HC组及PIGD组比较,TD组的左侧小脑4、5区出现脑活动ReHo增高,提示小脑神经元自发活动的异常。小脑是控制和协调人体运动的一个非常重要的中枢部位,同时也是小脑-丘脑-皮层(cerebello-thalamo -cortical,CTC)运动环路的关键节点[11,12]。PD患者由于黑质致密带的多巴胺能神经元的大量死亡,导致纹状体多巴胺传入减少,引起STC环路的异常,可能导致锥体外系其他神经通路如黑质-纹状体环路或CTC环路脑活动的代偿增加[13]。因此,本研究发现的TD患者小脑局部脑活动的增强可能是对STC环路损害的一种代偿[14,15]。此外有研究表明,小脑还可能参与了PD静止性震颤的发生,并认为静止性震颤可能与CTC环路及丘脑腹侧中间核存在一定的关联[13,16]。
本研究还发现,与HC组相比,PIGD组表现出明显的双侧距状裂及其周围皮层、枕下回等视觉网络皮层功能活动一致性减低的现象,提示PIGD患者的视觉皮层功能受损。以往的研究表明,PD患者存在着视觉集合能力下降、视空间翻转能力的损害、空间知觉能力下降等情况[17,18,19]。另外,人类走路与维持姿势其实并非是完全的自动化过程,它需要整合运动、空间、视觉、平衡等众多信息,因此,我们推测PIGD患者典型的步态障碍、姿势不稳的临床表现可能与视觉网络皮层功能活动受损有着密切的关系。
此外,PIGD组患者在双侧辅助运动区(SMA)和双侧扣带回中部ReHo减低,这与以往的PD rs-fMRI研究结果[20]相一致。辅助运动区位于大脑半球内侧面、初级运动皮层前方,它不仅参与组成STC环路与PD的相关运动症状发生有关,同时还与个体的学习、认知功能密切相关[21]。在一项长达39年的有关不同类型的PD患者的临床发展过程的纵向研究结果中,研究者发现伴有步态障碍的PD患者较伴有其他运动症状的患者更易出现认知、言语、平衡等功能的损害[22]。
本研究存在着一些不足之处。首先,虽然本研究所有PD患者在检查前均停止服用左旋多巴药物12 h以上以减小左旋多巴对其神经元活动的影响,且已将患者每日左旋多巴治疗量作为协变量加以去除,但可能并非能绝对消除长期服用左旋多巴对神经元的潜在影响;其次,本研究也未将研究的结果与左旋多巴剂量做相关分析,我们将在今后的研究中进一步关注和改进。
总之,本研究通过观察分析不同运动亚型PD患者在静息状态的脑功能活动,发现不同运动亚型PD患者存在着特异性的脑功能活动改变,TD患者脑功能活动局部改变体现了纹状体-丘脑-皮层环路和小脑-丘脑-皮层环路的共同作用的结果,而PIGD患者则主要体现了纹状体-丘脑-皮层环路相关脑区和视觉网络皮层的功能活动异常,这为进一步揭示不同运动亚型PD患者的神经病理机制、临床诊断和针对性的治疗提供新的思路。
[1] Zang Y, Jiang T, Lu Y, et al. Regional homogeneity approach to fMRI data analysis[J]. Neuroimage, 2004, 22(1): 394-400.
[2] Li Y, Liang P, Jia X, et al. Abnormal regional homogeneity in Parkinson′s disease: a resting state fMRI study[J]. Clin Radiol, 2016, 71(1): e28-34.
[3] Manza P, Zhang S, Li CS, et al. Resting-state functional connectivity of the striatum in early-stage Parkinson′s disease: Cognitive decline and motor symptomatology [J]. Hum Brain Mapp, 2016, 37(2): 648-662.
[4] Hughes AJ, Daniel SE, Kilford L, et al. Accuracy of clinical diagnosis of idiopathic Parkinson′s disease: a clinic-pathological study of 100 cases[J]. J Neurol Neurosurg Psychiatry, 1992, 55(3): 181-184.
[5] Jankovic J, McDermott M, Carter J, et al. Variable expression of Parkinsont′s disease:a base-line analysis of the DATATOP cohort.the Parkinson Study Group[J]. Neurology, 1990, 40(10): 1529-1534.
[6] Chen HM, Wang ZJ, Fang JP, et al. Different patterns of spontaneous brain activity between tremor-dominant and postural instability/gait difficulty subtypes of Parkinson′s disease: a resting-state fMRI study[J]. CNS Neurosci Ther, 2015, 21(10):855-866.
[7] Wu T, Long X, Zang Y, et al. Regional homogeneity changes in patients with Parkinson′s disease[J]. Hum Brain Mapp,2009, 30(5): 1502-1510.
[8] 侯亚男,张佳荣,陈彪,等.帕金森病不同运动分型患者局部脑活动的功能磁共振观察[J].中华医学杂志,2015,95(7):483-488.
[9] Lucas-Jiménez O, Ojeda N, Pe?a J, et al.Altered functional connectivity in the default mode network is associated with cognitive impairment and brain anatomical changes in Parkinson′s disease[J]. Parkinsonism Relat Disord, 2016,33:58-64.
[10] Spraker MB, Corcos DM, Vaillancourt DE. Cortical and subcortical mechanisms for precisely controlled force generation and force relaxation[J]. Cereb Cortex, 2009, 19(11): 2640-2650.
[11] Wang M, Jiang S, Yuan Y, et al. Alterations of functional and structural connectivity of freezing of gait in Parkinson′s disease[J]. J Neurol,2016, 263(8):1583-1592.
[12] Hu XF, Zhang JQ, Jiang XM, et al. Amplitude of low-frequency oscillations in Parkinson′s disease: a 2-year longitudinal resting-state functional magnetic resonance imaging study[J]. Chin Med J (Engl), 2015, 128(5):593-601.
[13] 刘岘,刘波,雒晓东,等.静息状态下帕金森病患者脑部功能连接的MR研究[J].中华放射学杂志,2009,43(3):253-257.
[14] Lewis MM, Slagle CG, Smith AB, et al. Task specific influences of Parkinson′s disease on the striato-thalamo-cortical and cerebello-thalamo-cortical motor circuitries [J]. Neuroscience, 2007, 147(1): 224-235.
[15] Wu T, Hallett M. A functional MRI study of automatic movements in patients with Parkinson′s disease[J]. Brain, 2005, 128(
[16] Deuschl G, Raethjen J, Baron R, et al.The pathophysiology of parkinsonian tremor: a review[J]. J Neurol, 2000, 247: 33-48.
[17] Ridder A, Müller ML, Kotagal V, et al. Impaired contrast sensitivity is associated with more severe cognitive impairment in Parkinson disease[J]. Parkinsonism Relat Disord, 2017,34:15-19.
[18] Garcia-Diaz AI, Segura B, Baggio HC, et al. Cortical thinning correlates of changes in visuospatial and visuoperceptual performance in Parkinson′s disease: a 4-year follow-up[J]. Parkinsonism Relat Disord, 2018, 46: 62-68.
[19] 贺娜英,凌华威,陈克敏,等.早期偏侧帕金森病患者的脑半球间功能连接改变的初步研究[J].中华放射学杂志, 2014,48(8):621-626.
[20] Choe IH, Yeo S, Chung KC, et al. Decreased and increased cerebral regional homogeneity in early Parkinson′s disease[J]. Brain Res, 2013, 1527: 230-237.
[21] Nachev P, Kennard C, Husain M. Functional role of the supplementary and pre-supplementary motor areas[J]. Nat Rev Neurosci,2008,9(11):856-869.
[22] Rajput AH, Voll A, Rajput ML, et al. Course in Parkinson disease subtypes: a 39-year clinicopathologic study[J]. Neurology, 2009, 73(3): 206-212.
