黄色肉芽肿性骨髓炎影像表现及相关病理分析
2019年9月
中华放射学杂志,第53卷第9期 第778页-第779页
李超伟,房娜,刘翠玉,曾磊,姜雯雯,王艳丽
患者 男2例、女1例,年龄分别为45、46、49岁;临床表现为无明显诱因的背部疼痛2例(其中1例不能活动)、左侧胸痛1例,均有压痛、叩痛病史10余天至8个月不等。患者的症状及体征与病变部位基本相符。影像检查:2例行CT(Philips Brilliance16 CT机,荷兰)及PET-CT扫描(Siemens Biograph16,德国),1例行CT平扫+MR平扫(Siemens Symphony P1.5 T MR,德国)+PET-CT扫描。CT扫描:电压120 kV,电流100 mA,层厚0.5 mm,层间距0.5 mm;MR检查:SE序列获取轴面、冠状面及矢状面T1WI(TR 500 ms,TE 10 ms)图像,FSE序列获取T2WI(TR 4 000 ms,TE 116 ms)图像,脂肪抑制序列(TR 6 410 ms,TE 116 ms)图像,扫描层厚3.00 mm,层距3.30 mm;PET-CT检查:电压120 kV,电流50 mA,0.5 s/周,螺距0.75,骨算法重建,重建层厚为1.00 mm。
影像表现:3例病变分别位于右侧第8后肋(累及胸T7、T8椎体、T8右侧附件)、左侧第3肋骨、T8椎体。CT图像显示病灶呈溶骨性骨质破坏伴软组织肿块(
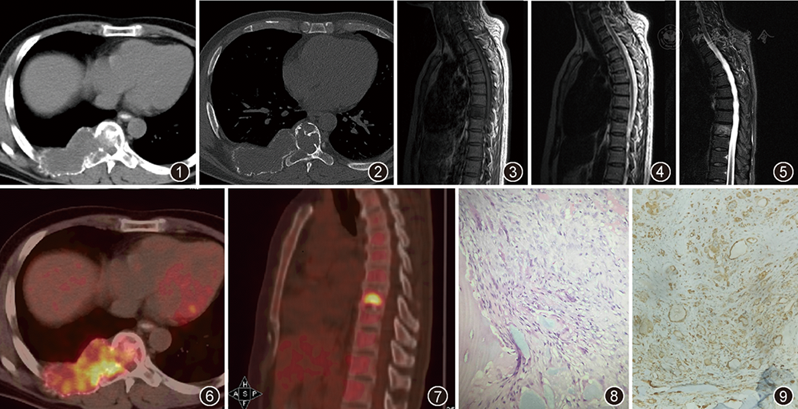
手术及病理表现:2例行病灶切除术,1例经皮穿刺活检。病理检查:骨皮质内见少量炎性细胞、大量组织细胞,有泡沫巨噬细胞浸润,伴纤维组织增生及灶性骨坏死(
关于本病的影像和病理表现及鉴别诊断等,文献报道的观点不一。本组3例均为中年患者。文献报道患者最小5岁[1,2]、最大65岁[3],结合文献笔者认为,本病可有2个好发年龄,平均年龄分别为18.4岁和50.7岁。本病好发于肋骨及四肢骨[1,2,3,4,5],本组3例,2例发生于肋骨;但1例发生于胸椎体,之前未见报道。本病男女均可发病,本组2例男性,1例女性。本病主要病理表现为:感染的组织中大量泡沫巨噬细胞浸润,有血肿和脓肿形成[5]。泡沫细胞的起源绝大多数可能来源于单核细胞或巨噬细胞。因为病变组织免疫组化染色显示,白细胞表面分化抗原(CD)68抗体、CD56单克隆抗体、CD11b和CD68均呈阳性[4]。黄色肉芽肿骨髓炎的病理过程为,初始阶段病变组织内含有粒状、嗜酸性、周期性的酸-裂体阳性组织细胞[5],随后被较多的泡沫巨噬细胞和活化浆细胞浸润,最后形成化脓性和出血性病灶及黄色肉芽肿。因此,黄色肉芽肿性骨髓炎的发病机制可能与细胞介导免疫的迟发型超敏反应有关[6]。
本病的影像特点:(1)溶骨性破坏:本组3例CT均呈溶骨性破坏,1例MR平扫T1WI、T2WI均呈低信号,T2WI压脂像呈高信号;3例PET-CT均显示18F-FDG代谢明显增高。(2)膨胀性生长并残留骨壳:病变呈膨胀性生长,并周围残留少许骨壳。(3)软组织肿块:随着病灶的进展,皮质破坏和骨膜反应可导致软组织肿块形成;由恶性肿瘤引起的骨质溶骨性病变周围的硬化是罕见的[2],因此这可以用来区分黄色肉芽肿性炎和恶性病变。本病需与下列疾病鉴别:(1)朗格汉斯细胞组织细胞增生症(Langerhans cell histiocytosis,LCH):单灶LCH表现为单一的溶骨性病变,通常累及长骨或扁平骨。多病灶LCH表现为颅骨、蝶鞍、下颌骨、椎骨和或上肢长骨的溶骨性病变;虽然病变典型表现为肉芽肿,伴有巨噬细胞、嗜酸性粒细胞、多核巨细胞和T细胞,但Birbeck颗粒是LCH特有。LCH典型的影像表现为类圆形或椭圆形骨质破坏,周围骨膜反应明显,伴周围软组织肿胀或肿块;MRI表现为T1WI等或等低信号、T2WI高信号,STIR序列示邻近髓腔内广泛高信号[7]。(2)Erdheim-Chester病(ECD):有多系统的黄色肉芽肿浸润,是一种多灶性疾病,病变最常累及股骨远端、胫骨近远端,表现为双侧对称的骨干或干骺端骨硬化,可伴溶骨性改变,但单纯溶骨性病变极其少见;病理表现为胆固醇结晶和泡沫样组织细胞浸润。(3)慢性复发多灶性骨髓炎(chronic recurrent multifocal osteomyelitis,CRMO):是一种罕见的儿童和青少年骨骼炎性和疼痛的疾病,可单发或多发溶骨性的改变,任何骨骼都可能受到累及;病理可见病变组织中大量纤维组织增生。
[1] Cozzutto C. Xanthogranulomatous osteomyelitis[J]. Arch Pathol Lab Med,1984,108(12):973-976.
[2] Cheema, A, Arkader A, Pawel B.Xanthogranulomatous osteomyelitis of the humerus in a pediatric patient with Alagille syndrome: a case report and literature review[J].Skeletal Radiol,2017(10),46:1447-1452.
[3] Singh S, Batra S, Maini L,et al.Xanthogranulomatous osteomyelitis of proximal femur masquerading as benign bone tumor[J]. Am J Orthop,2015,44(8):E272-274.
[4] Vankalakunti M, Saikia UN, Mathew M,et al.Xanthogranulomatous osteomyelitis of ulna mimicking neoplasm[J].World J Surg Oncol,2007,5(1):46.
[5] Borjian A, Rezaei F, Eshaghi MA,et al.Xanthogranulomatous osteomyelitis[J]. J Orthop Traumatol,2012,13(4):217-220.
[6] Nakashiro H, Haraoka S, Fujiwara K,et al.Xanthogranulomatous cholecystis. cell composition and a possible pathogenetic roleof cell-mediated immunity[J].Pathol Res Pract,1995,19(12):1078-1086.
[7] 陈桂玲,张晓军,张新荣,等.儿童四肢长骨郎格汉斯细胞组织细胞增生症影像表现与临床病理对照分析[J].中华放射学杂志,2016,50(2):110-113.
