托珠单抗治疗大动脉炎的有效性和安全性
2019年6月
中华放射学杂志,第58卷第6期 第444页-第448页
廖华,潘丽丽,杜娟,高娜,王天
大动脉炎是一种主要累及大血管的慢性、肉芽肿性系统性血管炎,影响主动脉及其主要分支,导致管壁狭窄、闭塞和动脉瘤形成[1,2]。该病呈长期慢性病程,需长期免疫抑制治疗。传统治疗主要依赖中、大剂量糖皮质激素(以下简称激素),但单用激素维持治疗,不但副作用大,疾病亦很难完全控制。联用免疫抑制剂对控制病情和帮助激素减量尤为重要。激素联合环磷酰胺是目前治疗大动脉炎比较有效且主要的治疗方案,但大动脉炎好发于40岁以下的生育期女性,环磷酰胺严重的毒副作用及其对生育的影响,尚不能成为治疗该病的理想方案。近年来有研究发现,大动脉炎患者血清白细胞介素(IL)-6水平与疾病活动度呈正相关[3]。托珠单抗是一种人源化的IL-6受体单克隆抗体,对类风湿关节炎治疗效果确切[4],尚未发现其对生育功能的损害[5]。但托珠单抗治疗大动脉炎的效果尚未明确,本研究旨在探讨托珠单抗治疗大动脉炎的有效性和安全性。
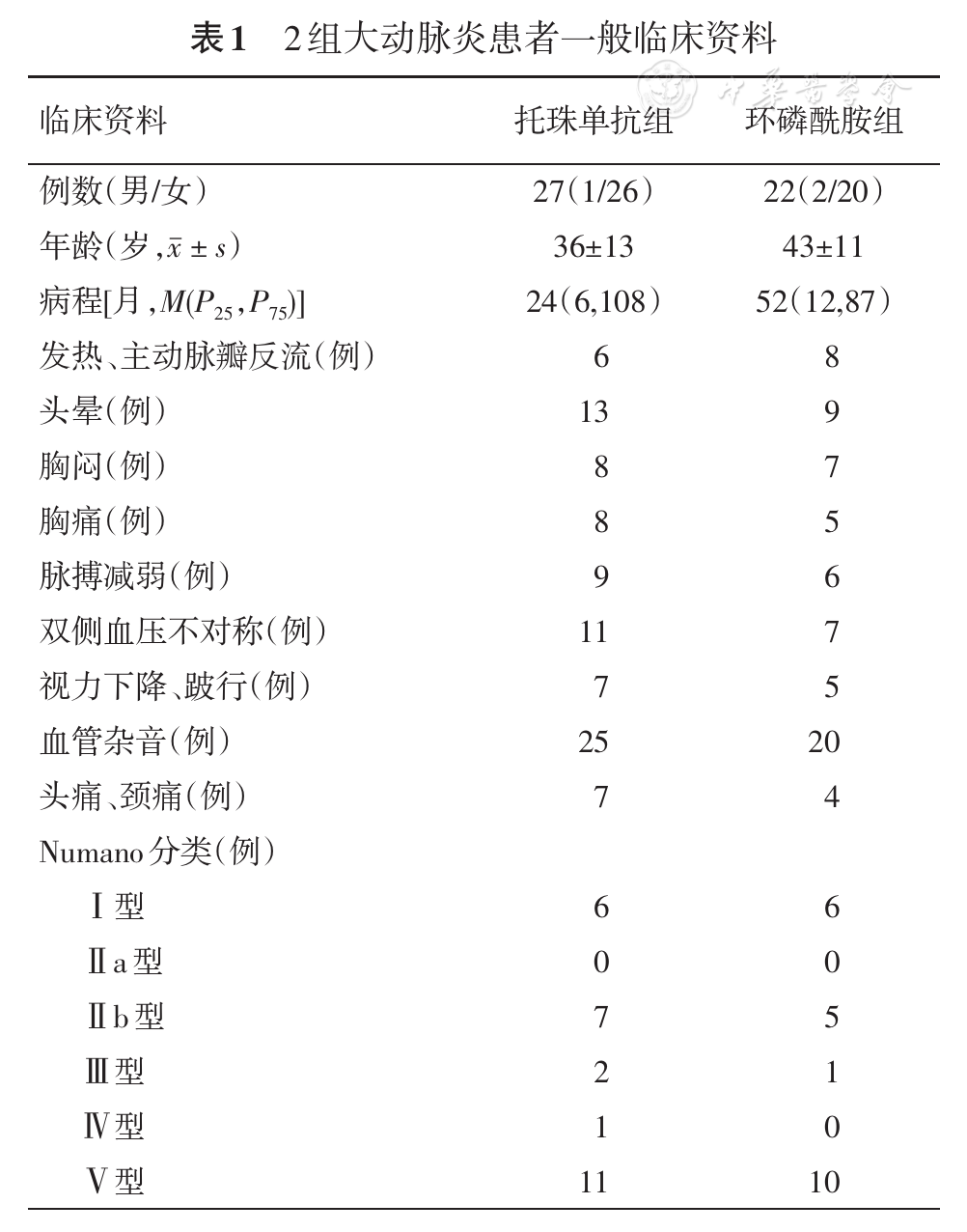
2015年1月至2018年6月首都医科大学附属北京安贞医院风湿免疫科住院确诊大动脉炎患者49例,其中27例患者应用激素联合托珠单抗治疗(托珠单抗组),托珠单抗8 mg/kg,每4周静脉输注1次,连续应用6个月;22例患者应用激素联合环磷酰胺治疗(环磷酰胺组),环磷酰胺每4周静脉输注1 g,连续应用6个月;激素使用依据病情给予起始量(泼尼松10~60 mg/d)。
确诊大动脉炎;疾病活动度评分为活动期,即美国国立卫生研究院大动脉炎评分(简称NIH评分)≥2分。大动脉炎的诊断符合1990年美国风湿病学会制定的大动脉炎分类标准[6]。大动脉炎疾病活动度判断依据NIH评分[2]、印度北方医学科学研究所2010年印度大动脉炎活动度评分(简称ITAS2010评分)、印度北方医学科学研究所印度大动脉炎活动度-A评分(简称ITAS-A评分)标准[7]。
(1)近5年接受大动脉炎相关治疗者;(2)合并其他风湿免疫系统疾病;(3)中性粒细胞计数<1.0×109/L,血小板计数<100×109/L;(4)丙氨酸转氨酶(ALT)或天冬氨酸转氨酶(AST)水平>正常上限的2倍,血清肌酐或尿素氮水平>正常上限的1.5倍;(5)有原发性或继发性免疫缺陷及恶性疾病史;(6)合并其他慢性疾病,如肝脏病、肾脏病、血液系统疾病、脑血管病、皮肤病及严重的胃肠道疾病;(7)合并感染、肿瘤、外伤等疾病。
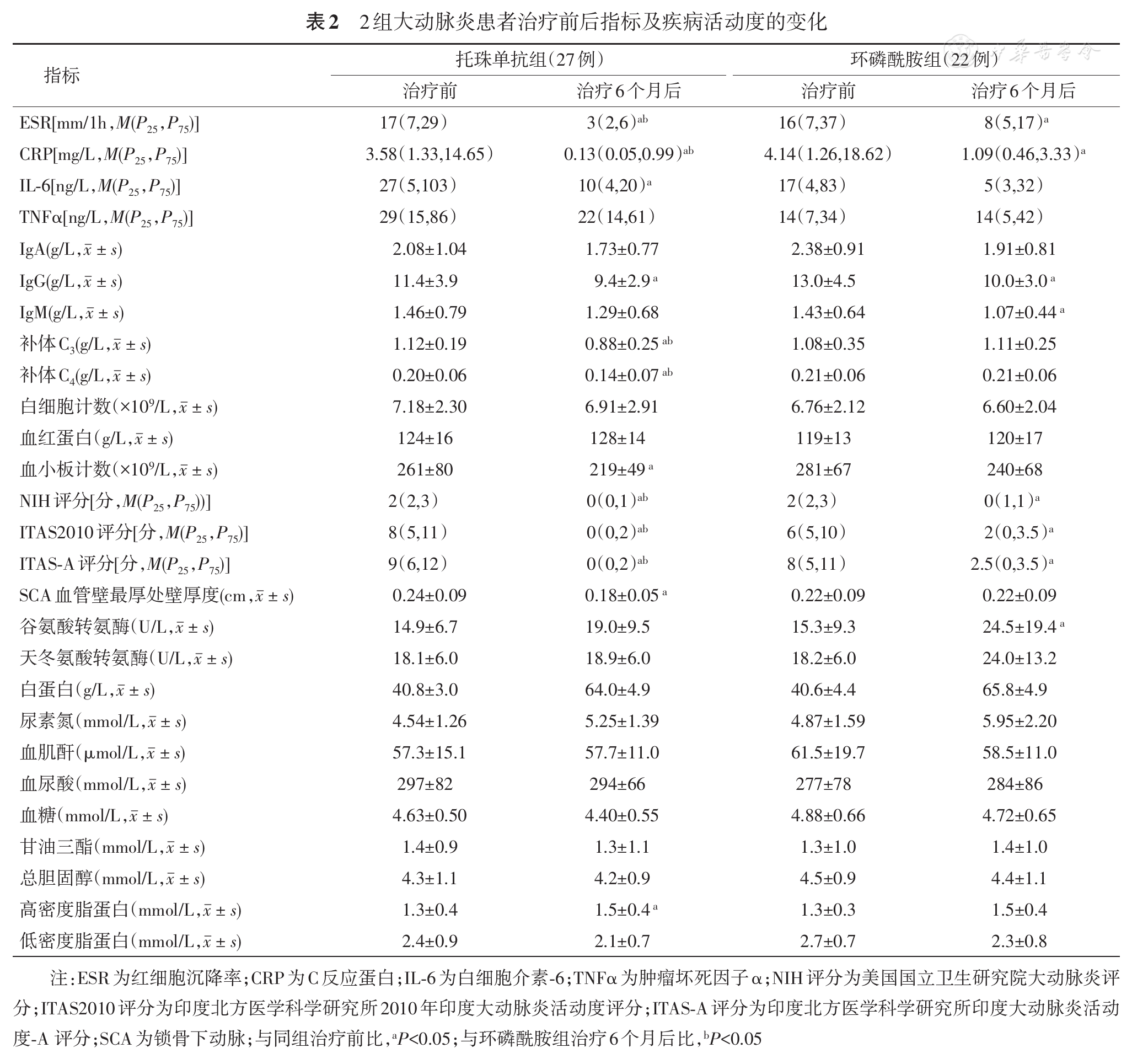
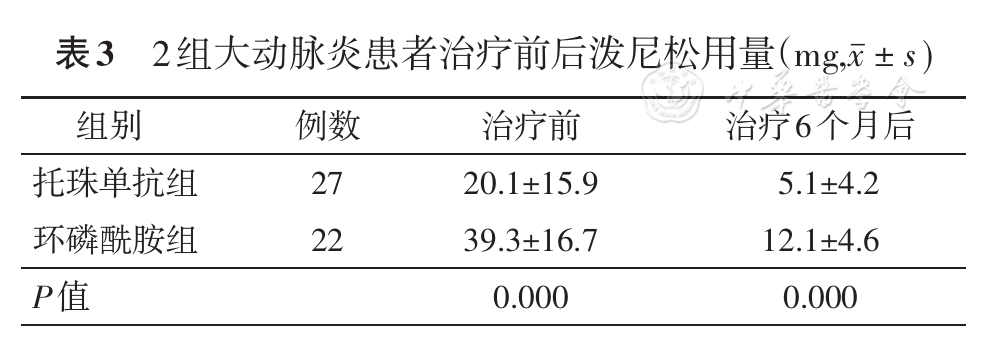
收集2组患者人口学资料(包括年龄、性别、病程),记录治疗前后的临床表现、实验室指标、NIH评分、ITAS2010评分和ITAS-A评分。依据影像学资料,采用Numano分类标准[8]对大动脉炎的血管受累进行分类。记录治疗6个月后激素的使用量、发生感染的情况。采用多普勒超声测量治疗前后锁骨下动脉(SCA)血管壁最厚处壁厚度,托珠单抗组22例患者进行了测量,环磷酰胺组17例患者进行了测量。2组患者空腹12 h后抽取肘静脉血4 ml,测ALT、AST、尿素氮、血肌酐、血尿酸、血糖、白细胞计数、中性粒细胞数、血红蛋白、血小板计数、红细胞沉降率(ESR)、C反应蛋白(CRP)、IgA、IgG、IgM、补体C3、补体C4、甘油三酯、总胆固醇、高密度脂蛋白、低密度脂蛋白、肿瘤坏死因子α(TNFα)和IL-6,所有检测步骤均按说明书进行操作。
采用SPSS 16.0统计软件进行统计分析。正态分布数据以
见
见
见
托珠单抗组患者6例出现药物相关副作用,1例肺结核,1例带状疱疹病毒感染,暂停托珠单抗治疗后好转;2例白细胞计数下降(3.12×109/L;3.25×109/L),1例中性粒细胞数下降(1.25×109/L),1例肝功能异常(ALT 44 U/L),无肾功能异常者。环磷酰胺组患者12例出现药物相关副作用,1例肺部感染者暂停环磷酰胺治疗好转;1例白细胞计数下降(3.25×109/L),2例中性粒细胞数下降(1.26×109/L;1.49×109/L),8例肝功能异常(ALT 45~78 U/L),无肾功能异常。托珠单抗组副作用发生率为22.2%(6/27),低于环磷酰胺组(54.5%,12/22),差异有统计学意义(P=0.020)。
大动脉炎是大血管炎,主要影响主动脉及其分支,是一种慢性疾病,不可避免地需要长期药物治疗。迄今为止,大动脉炎的治疗多依赖医生的临床经验,尚无统一的治疗方案。目前激素是最常用的药物,然而,只有不到一半的患者通过激素单药治疗获得持续缓解[9,10],而长期应用激素的同时,亦带来诸多严重副作用。20%~50%的患者出现与激素相关的副作用,包括白内障、外周水肿、肌病、骨折、感染和糖尿病[11]。高达50%~80%的患者在激素减量过程中出现复发[12]。因此为了提高持续缓解率,减少激素用量,免疫抑制剂的联合治疗显得尤为重要。激素联合环磷酰胺常被用于大动脉炎治疗,但环磷酰胺的生殖毒性,以及药物累积量依赖的副作用,限制了环磷酰胺的应用。
托珠单抗自上市以来,其有效性得到了世界各地10年使用的证据支持。目前托珠单抗在多种自身免疫病的治疗中均发挥很好的有效性和安全性。研究已证实,托珠单抗单药治疗类风湿关节炎优于甲氨蝶呤[4],对难治性类风湿关节炎,甚至对肿瘤坏死因子拮抗剂治疗效果差的类风湿关节炎患者亦有很好的疗效[13]。Samson等[14]观察了20例巨细胞动脉炎患者应用泼尼松联合托珠单抗治疗(8 mg/kg,每4周静脉输注1次)的前瞻性研究,随诊52周证实,托珠单抗治疗巨细胞动脉炎可减少激素用量。
多项研究发现,大动脉炎患者血清中IL-6水平明显高于健康人[15,16],且与疾病的活动性呈正相关[3]。免疫组化显示,大动脉炎患者血管壁IL-6表达强阳性[17]。大动脉炎患者IL-6大量分泌,不仅来源于免疫细胞,亦来自大动脉的组织如平滑肌细胞、内皮细胞均分泌IL-6[3,16,17]。IL-6可活化B细胞产生抗体,加强T细胞的细胞毒性,在免疫炎症过程中发挥重要作用[18]。由此可见,IL-6是大动脉炎激活免疫和炎症的关键因子。托珠单抗可抑制IL-6的生物学效应,能有效控制大动脉炎。
已有研究报道,托珠单抗在治疗难治性大动脉炎患者效果显著[12]。多中心回顾研究证实,托珠单抗治疗大动脉炎有效,且可以降低大动脉炎的复发率[19]。本研究结果显示,托珠单抗连续治疗大动脉炎患者6个月后疗效显著,ESR、CRP及疾病活动度评分明显低于环磷酰胺组。托珠单抗组治疗后多普勒超声测量SCA血管壁最厚处壁厚度较治疗前减少,与既往研究结论一致[20]。托珠单抗组治疗后大动脉炎患者补体C3、补体C4水平明显降低,但无不良反应增加。治疗6个月后2组激素使用量较治疗起始量均明显减少,而托珠单抗组的激素用量更少。提示托珠单抗组疗效优于环磷酰胺组。Nakaoka等[21]研究了对激素耐药的4例大动脉炎患者,每4周应用托珠单抗(8 mg/kg)治疗共24次,所有患者在托珠单抗治疗期间临床反应良好,CRP等急性炎性指标迅速降至正常。Ferfar等[22]回顾总结既往9项研究,24例大动脉炎患者接受托珠单抗治疗后,激素用量由11 mg/d减至3.5 mg/d,CRP水平显著下降,其中21例患者症状缓解,14例患者激素减量,5例患者停用激素。本研究对比药物副作用的发生率,托珠单抗组低于环磷酰胺组,治疗后环磷酰胺组ALT显著升高,但托珠单抗组无明显改变,提示托珠单抗对肝功能无显著损伤。一项托珠单抗治疗18例大动脉炎患者的随机双盲安慰剂对照的Ⅲ期临床研究显示,无严重感染及死亡发生,与安慰剂比未出现新发和更突出的安全问题[23]。Ferfar等[22]文献复习了应用托珠单抗治疗大动脉炎患者38例,其中肝损伤2例,感染2例,白细胞减少4例,发生率达21%,与本研究结果一致。
综上,托珠单抗治疗大动脉炎已有较好的疗效,但仍需多中心大样本研究进一步证实。
[1] Jennette JC, Falk RJ, Bacon PA, et al. 2012 revised International Chapel Hill Consensus Conference nomenclature of vasculitides[J]. Arthritis Rheum, 2013,65(1):1-11.
[2] Kerr GS, Hallahan CW, Giordano J, et al.Takayasu arteritis[J]. Ann Intern Med,1994,120(11):919-929.
[3] Tamura N, Maejima Y, Tezuka D, et al. Profiles of serum cytokine levels in Takayasu arteritis patients: potential utility as biomarkers for monitoring disease activity[J]. J Cardiol, 2017,70(3):278-285.
[4] 史群,赵岩,鲍春德,等.托珠单抗联合改善病情抗风湿药治疗类风湿关节炎的多中心、随机、双盲、安慰剂对照临床研究[J].中华内科杂志,2013,52(4):323-329.
[5] Ogata A, Kato Y, Higa S, et al. IL-6 inhibitor for the treatment of rheumatoid arthritis: a comprehensive review[J]. Mod Rheumatol,2019,29(2):258-267.
[6] Arend WP, Michel BA, Bloch DA, et al. The American College of Rheumatology 1990 criteria for the classification of Takayasu arteritis[J]. Arthritis Rheum, 1990,33(8):1129-1134.
[7] Misra R, Danda D, Rajappa SM, et al. Development and initial validation of the Indian Takayasu clinical activity score (ITAS2010)[J]. Rheumatology (Oxford), 2013,52(10):1795-1801.
[8] Hata A, Noda M, Moriwaki R, et al. Angiographic findings of Takayasu arteritis: new classification[J]. Int J Cardiol, 1996,54
[9] Mukhtyar C, Guillevin L, Cid MC, et al. EULAR recommendations for the management of large vessel vasculitis[J]. Ann Rheum Dis, 2009,68(3):318-323.
[10] Maksimowicz-McKinnon K, Clark TM, Hoffman GS. Limitations of therapy and a guarded prognosis in an American cohort of Takayasu arteritis patients[J]. Arthritis Rheum, 2007,56(3):1000-1009.
[11] Proven A, Gabriel SE, Orces C, et al. Glucocorticoid therapy in giant cell arteritis: duration and adverse outcomes[J]. Arthritis Rheum, 2003,49(5):703-708.
[12] Decker P, Olivier P, Risse J, et al. Tocilizumab and refractory Takayasu disease: four case reports and systematic review[J]. Autoimmun Rev, 2018,17(4):353-360.
[13] Farah Z, Ali S, Price-Kuehne F, et al. Tocilizumab in refractory rheumatoid arthritis: long-term efficacy, safety, and tolerability beyond 2 years[J]. Biologics, 2016,10:59-66.
[14] Samson M, Devilliers H, Ly KH, et al. Tocilizumab as an add-on therapy to glucocorticoids during the first 3?months of treatment of Giant cell arteritis: a prospective study[J]. Eur J Intern Med,2018,57:96-104.
[15] Savioli B, Abdulahad WH, Brouwer E, et al. Are cytokines and chemokines suitable biomarkers for Takayasu arteritis?[J]. Autoimmun Rev, 2017,16(10):1071-1078.
[16] Alibaz-Oner F, Yentür SP, Saruhan-Direskeneli G, et al. Serum cytokine profiles in Takayasu′s arteritis: search for biomarkers[J]. Clin Exp Rheumatol, 2015,33(2
[17] Kong X, Sun Y, Ma L, et al. The critical role of IL-6 in the pathogenesis of Takayasu arteritis[J]. Clin Exp Rheumatol, 2016,34(3
[18] Mesquida M, Molins B, Lloren? V, et al. Targeting interleukin-6 in autoimmune uveitis[J]. Autoimmun Rev, 2017,16(10):1079-1089.
[19] Mekinian A, Resche-Rigon M, Comarmond C, et al. Efficacy of tocilizumab in Takayasu arteritis: multicenter retrospective study of 46 patients[J]. J Autoimmun, 2018,91:55-60.
[20] Zhou J, Chen Z, Li J, et al. The efficacy of tocilizumab for the treatment of Chinese Takayasu′s arteritis[J]. Clin Exp Rheumatol, 2017,35
[21] Nakaoka Y, Higuchi K, Arita Y, et al. Tocilizumab for the treatment of patients with refractory Takayasu arteritis[J]. Int Heart J, 2013,54(6):405-411.
[22] Ferfar Y, Mirault T, Desbois AC, et al. Biotherapies in large vessel vasculitis[J]. Autoimmun Rev, 2016,15(6):544-551.
[23] Nakaoka Y, Isobe M, Takei S, et al. Efficacy and safety of tocilizumab in patients with refractory Takayasu arteritis: results from a randomised, double-blind, placebo-controlled, phase 3 trial in Japan (the TAKT study)[J]. Ann Rheum Dis, 2018,77(3):348-354.
