双侧非对称强直发作的症状学特点及临床应用价值
2019年8月
中华放射学杂志,第52卷第8期 第633页-第639页
王梦阳,王静,闫兆芬,王姮,徐飞飞,杨玉姣,邓琴琴,王洁,周健,关宇光,翟锋,栾国明
双侧非对称强直发作(bilateral asymmetrical tonic seizures, BATS)最早由Lüders和Noachtar[1]于2000年提出,他们将BATS定义为:以突然的肢体不对称强直姿势为特征,持续10~40 s,通常手臂外展同时肩膀上抬,伴随肘部不同程度屈曲,下肢可出现髋部外展、膝关节伸直或半屈,但上肢受累程度更明显。虽然BATS可由辅助感觉运动区(supplementary somatosensory motor area, SSMA)直接激活产生,但亦可为异常放电扩散至SSMA所致,两者相比,均以双侧上肢近端强直为显著特点,但对称性可有所不同[2]。
SSMA激活产生的BATS更符合原始定义,具有更强的不对称性,可称其为经典型BATS。我们将重点描述经典及非典型BATS症状学基本特征、症状学演变顺序,分析其在发作起始区(seizure onset zone, SOZ)定侧及定位中的价值,并探讨潜在功能神经解剖学机制及电扩散通路。此外,因字面意思接近,BATS常与双侧非对称强直性肢体姿势(asymmetric tonic limb posturing, ATLP)混淆[3,4],为此我们将剖析两者间差异,强调严格界定发作症状学定义对癫痫定位诊断具有重要意义。
本研究为回顾性系列病例分析。我们回顾了首都医科大学三博脑科医院癫痫中心2011年9月至2018年5月行立体定向电极植入的385例患者,只要监测中有1次癫痫临床发作出现BATS或ATLP,便归入对应组别。手术预后评价采用Engel′s分级标准,随访时间不少于6个月。如患者在一次发作中先后出现上述2种症状,或在不同次发作中分别出现上述2种症状,允许纳入不同组别内。排除标准:(1)立体定向脑电图(SEEG)无明确发作起始图型;(2)发作症状学诊断存在分歧且讨论后不能达成一致。症状学分析以视觉分析为主,四肢肌电分析为辅(三角肌、前臂伸屈肌、胫前肌常规加肌电电极)。
要求发作过程中出现双侧上肢近端为主的强直姿势,且三角肌出现强直肌电图型,分为3种类型:(1)经典型BATS(

要求双侧上肢远近端及双侧下肢均出现强直姿势,分为两种类型:(1)经典型ATLP:即"4"字征(
采用北京华科恒生医疗科技有限公司生产的电极,10~16个触点,或法国Alcis公司生产的电极(可用于热凝毁损),5~18个触点;立体定向电极规格均为:触点长度2 mm,直径:0.8 mm,间隔1.5 mm。
采用美国Nicolet公司Nicolet One脑电图仪(128和256导),采样频率1 024 Hz或512 Hz。
由2名有10年以上颅内脑电图阅图经验的医师独立回顾性分析SEEG,包括发作间歇期癫痫样放电、发作期起始及演变、发作症状学特征及演变,经讨论达成一致后方可入组。为避免麻醉和创伤影响,选择电极植入48 h后的临床发作进行分析[6]。对发作的描述根据Lüders和Noachtar[1]2000年提出的发作症状学分类及描述方法,用箭头将发作症状按照发生的时间先后顺序依次连接起来。
采用SPSS 22.0软件进行统计学分析。分类变量以频数(%)表示,组间比较采用χ2检验或Fisher精确检验。P ≤0.05被认为差异有统计学意义。
总计53例,其中男性30例,女性23例;SEEG监测时年龄5~54岁;癫痫术后Engel′sⅠ级38例,Engel′sⅡ~Ⅳ级12例,未行切除手术2例,失访1例;其中经典型共32例(60.4%)、双侧近端强直共18例(34.0%)、M2e共3例(5.6%)。发作基本特征见
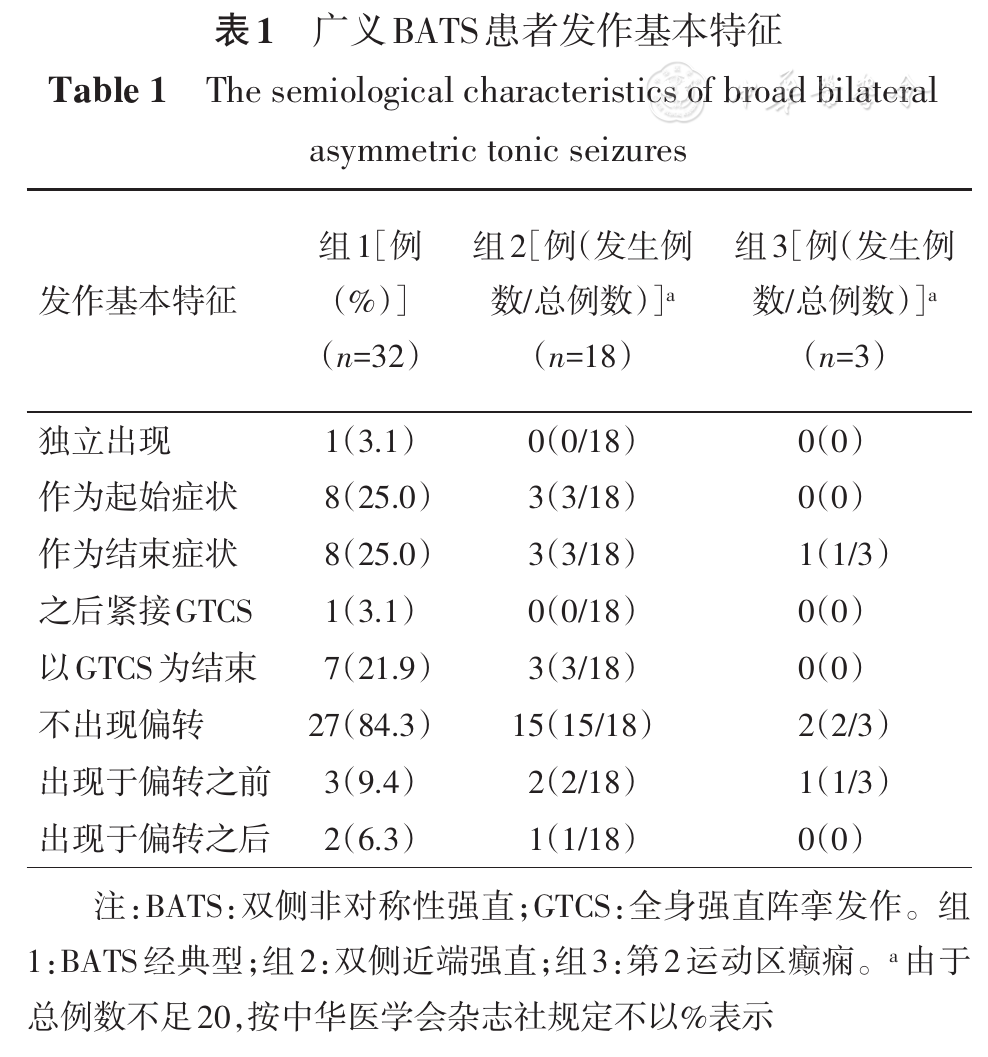
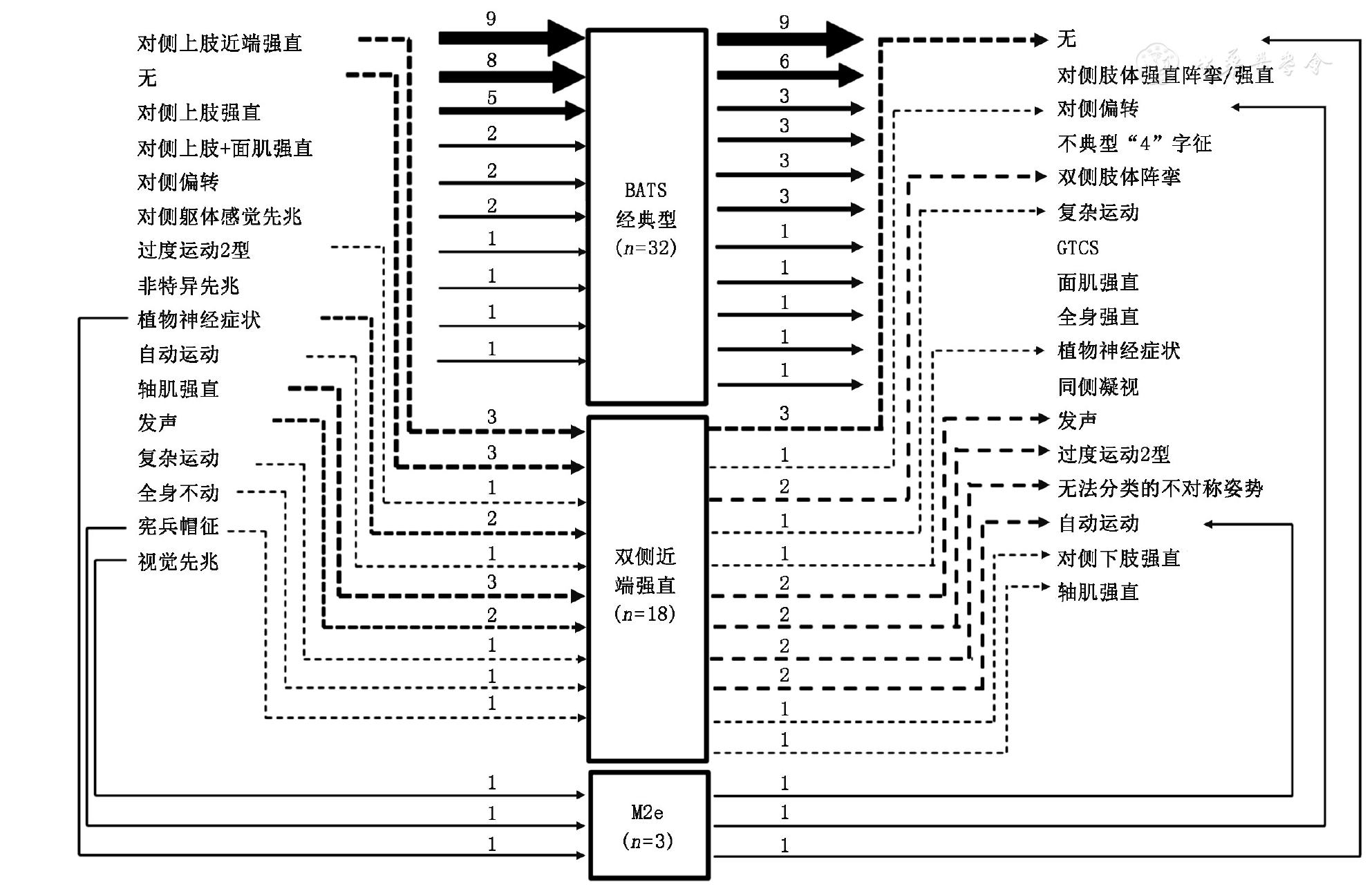
"对侧"指症状学侧别位于发作起始区对侧;GTCS:全身强直阵挛发作;M2e:第二运动区癫痫
总计42例,其中男性21例,女性21例;监测时年龄7~41岁;癫痫术后Engel′sⅠ级20例,Engel′sⅡ~Ⅳ级18例,1例未行切除性手术,失访3例;其中经典型ATLP 20例、不典型ATLP 22例。发作基本特征见
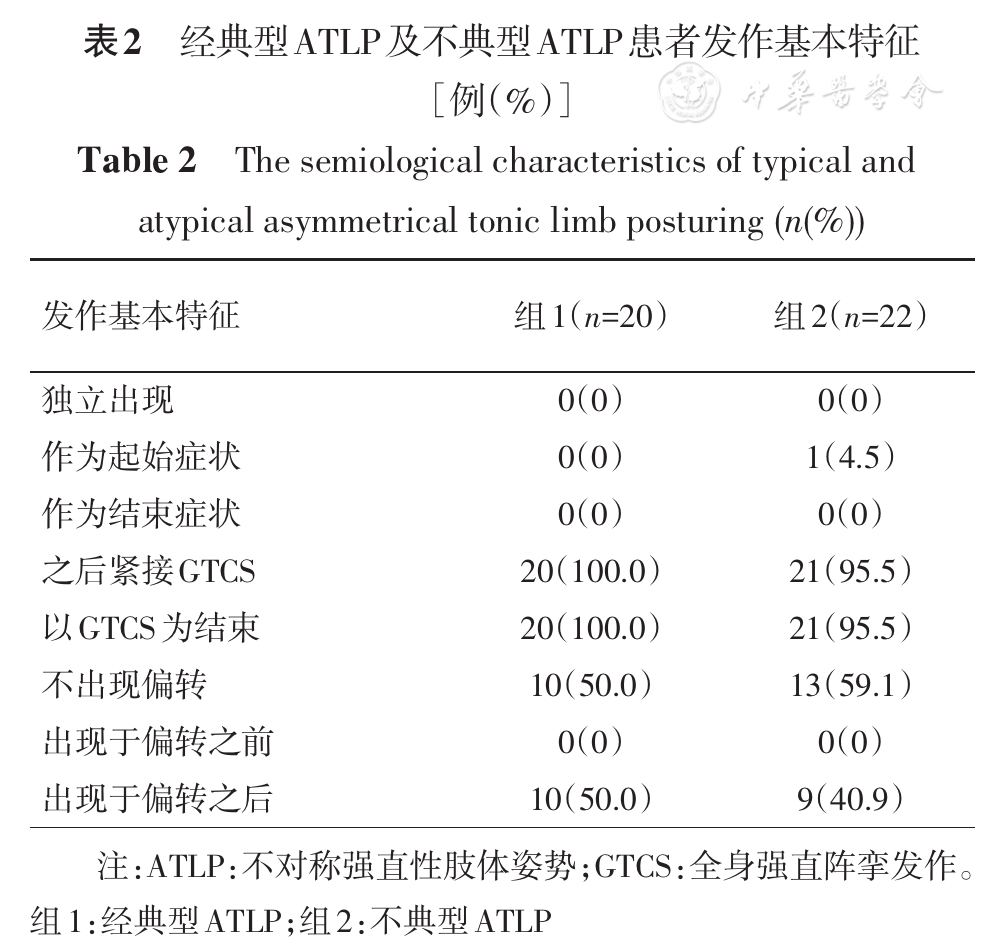
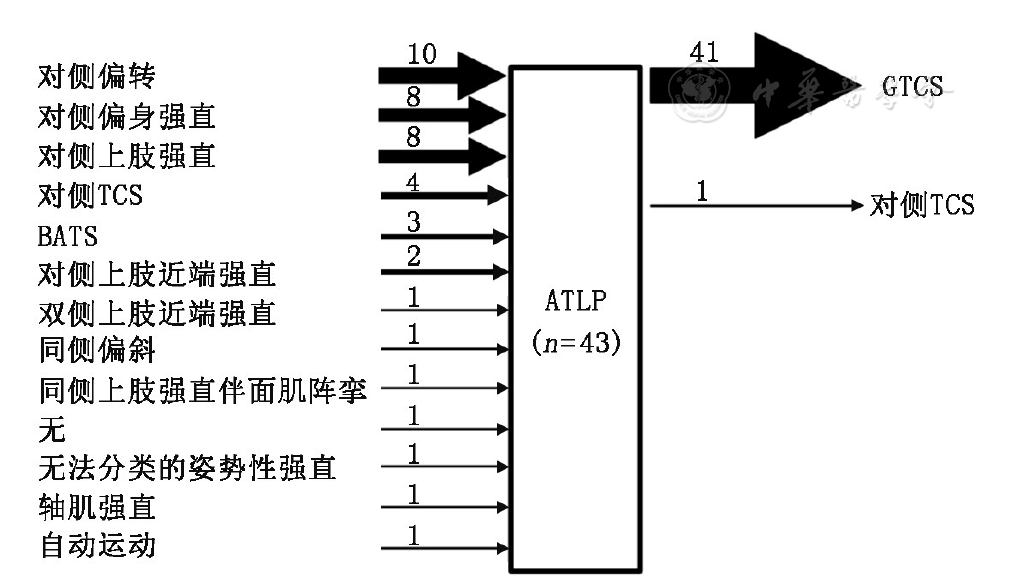
"对侧"指症状学侧别位于发作起始区对侧;TCS:强直阵挛发作;BATS:双侧非对称性强直;GTCS:全身强直阵挛发作
见
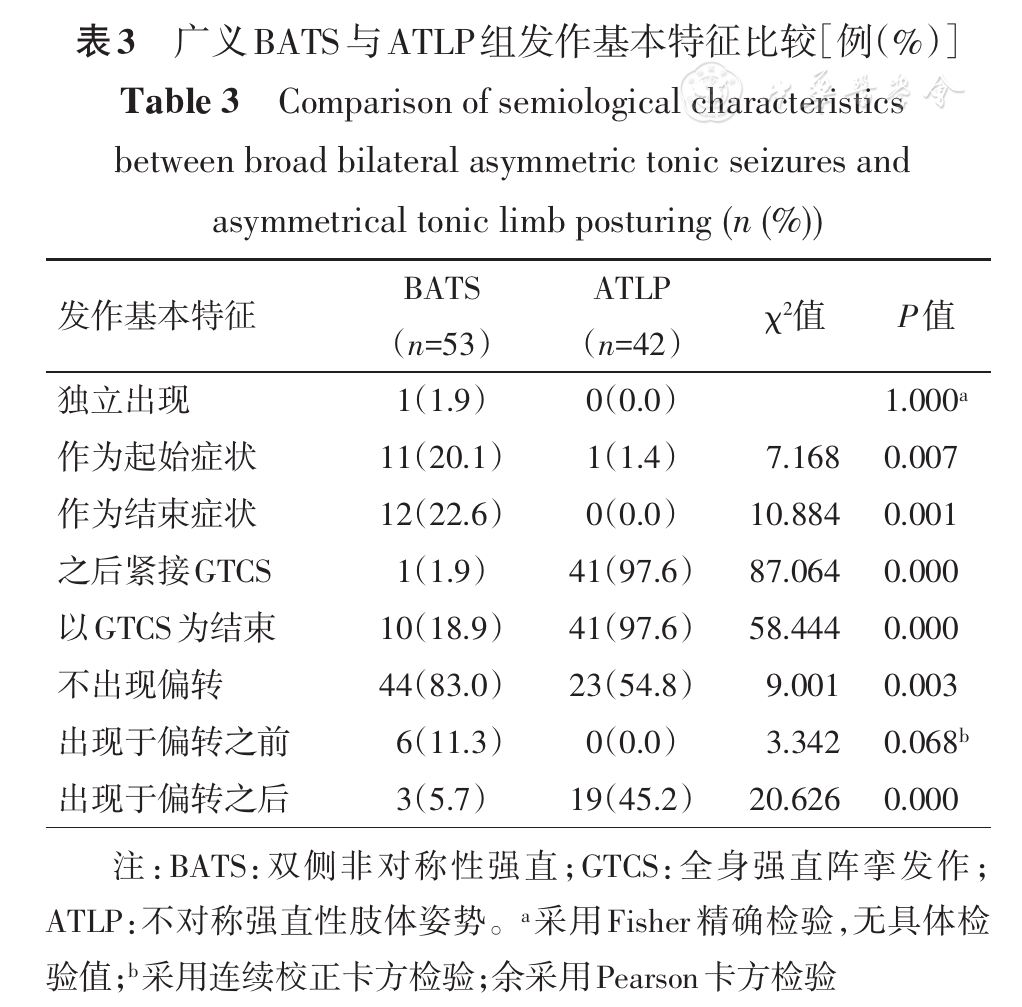
BATS经典型中32例(32/32,100.0%)上肢强直显著侧(肌电波幅高侧且提前出现)位于SOZ对侧;双侧近端强直中10例(10/18)上肢强直稍著侧(肌电波幅稍高侧)位于SOZ对侧;M2e中3例(3/3)上肢强直显著侧位于SOZ对侧。
经典型ATLP组中10例(10/20, 50.0%)为正"4"字,即上肢伸直强直显著侧位于SOZ对侧,10例(10/20, 50.0%)为反"4"字,即上肢伸直强直显著侧位于SOZ同侧;不典型组中15例(15/22,68.2%)上肢强直显著侧位于SOZ对侧,7例(7/22,31.8%)位于SOZ同侧。根据发作起始部位不同,ATLP总的定侧结果见
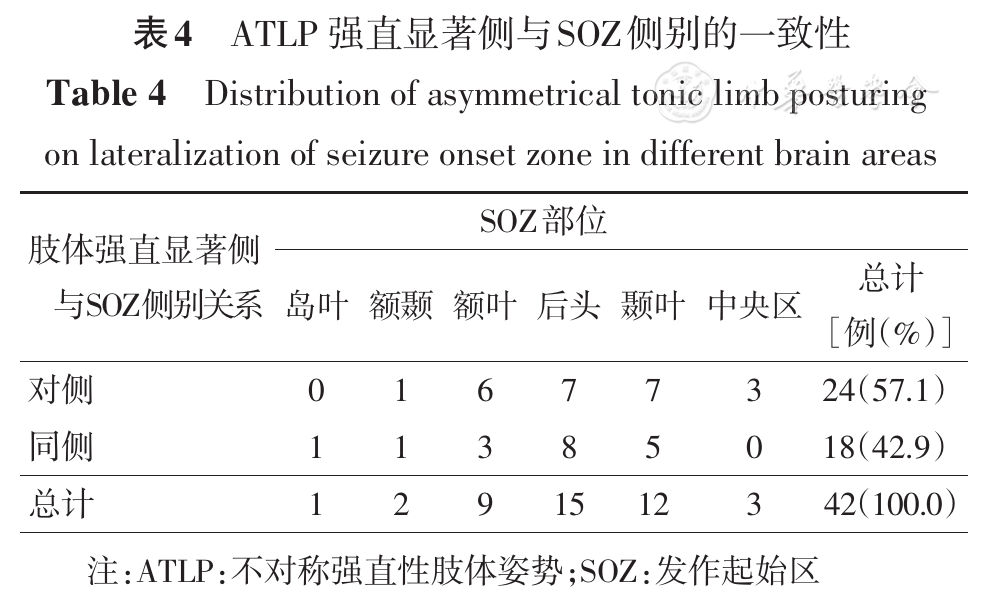
BATS与ATLP组相比,强直显著侧位于SOZ对侧的患者例数分别为45例(45/53,84.9%)和24例(24/42,57.1%),差异有统计学意义(χ2=9.086,P=0.003)。
根据SEEG分析结果,该症状学可见于额、岛、顶、枕、颞叶起始的癫痫发作(SOZ分布见
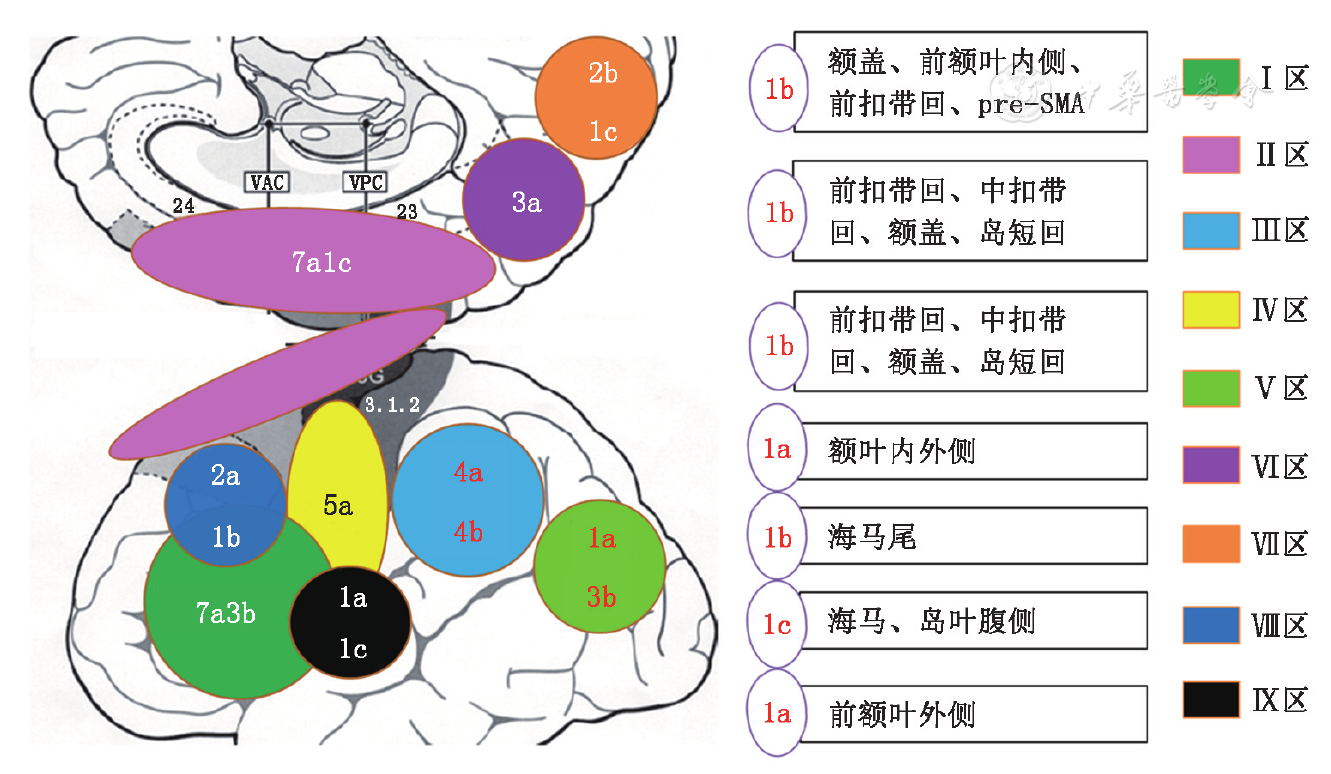
a:广义非对称性强直经典型;b:双侧近端强直;c:第2运动区癫痫;Ⅰ区:额下回、额下沟、额盖、岛短回;Ⅱ区:辅助感觉运动区、前辅助感觉运动区(pre-SSMA)、旁中央小叶、中扣带回、前扣带回后部、额上回、额上沟;Ⅲ区:缘上回、顶盖、岛长回;Ⅳ区:中央区下部、中央盖;Ⅴ区:颞顶枕交界;Ⅵ区:楔前叶、后扣带回;Ⅶ区:楔叶、舌回;Ⅷ区:额中回;Ⅸ区:颞上回、岛叶腹侧皮质。图中阿拉伯数字表示例数
根据SEEG分析结果,SOZ的分布如
广义BATS与ATLP组相比,内侧颞叶起始的患者较少[分别为3.9%(2/51)、23.8%(10/42),χ2=8.523,P=0.004]。
2017年,国际抗癫痫联盟发布了最新版癫痫发作分类。无论全面性还是局灶性发作,均按运动性和非运动性进行了二分[7]。运动性发作对致痫区定侧及定位均有重要价值[8],因此熟练掌握其分析方法对癫痫外科术前评估及抗癫痫药物选择均有裨益。然而,非标准化症状学描述常造成理解上的歧义,导致定侧、定位错误。譬如,BATS及ATLP字义相近,但定义不同,在上肢受累部位、不对称性姿势、发作前后症状等方面均存在明显差异。
BATS是局灶性运动发作的一种类型[2,7]。本研究中,我们提出了广义BATS概念,包括BATS经典型、双侧近端强直和M2e。虽然三种亚型在姿势上有所差别,但均以上肢近端强直为主要特征。本研究进一步证实,BATS经典型和双侧近端强直在发作基本特征方面并无显著差异,高度提示两者具有相似功能解剖学基础。由于M2e病例数较少,未进行统计学分析,将在后续研究中总结。
广义BATS和ATLP相比,大多数基本特征差异显著,提示两者的功能解剖学基础有所不同。经典型ATLP被认为是GTCS强直期的早期现象,提示电活动已扩散至双侧半球的广泛区域[4]。不典型ATLP是我们提出的概念,源于患者的双侧上肢并非总呈现出标准的"4"字。本研究结果显示,不典型ATLP与经典型在发作基本特征上无明显差异,仅1例患者在不典型ATLP后未继发GTCS,而以偏身强直阵挛发作结束,可能与形成强直姿势的双上肢未在"躯干之前"而在躯干两侧有关,因此ATLP原始定义中对"躯干之前"的强调非常必要。反观广义BATS,仅1例随后出现GTCS,说明此时仍以SSMA相关网络受激动为主。广义BATS偏转发生率不足20%,说明其相关网络与额眼区关系不密切。另外,本研究结果显示,偏转很少作为一次临床发作的结束,常以ATLP作为过渡,随后出现GTCS,且ATLP绝不出现于偏转之前。
本研究结果显示,BATS经典型和M2e对SOZ定侧价值高达100.0%。既往研究认为,M2e定侧准确率极高[5,8],但BATS经典型定侧价值报道较少。我们认为,M2e是一种不对称性增强的BATS,从视觉分析便能轻而易举识别强直显著侧,但经典BATS需进一步结合肌电,强直肌电波幅更高且提前出现的一侧视为强直显著侧。因对称性较强,双侧近端强直很难定侧,即使结合肌电亦较困难。
本研究结果显示,ATLP强直显著侧位于SOZ对侧病例占57.1%,其定侧价值低于既往文献报道的74%~100%[4,8,9],特别是后头部起始的癫痫发作出现反"ATLP"比例稍高,即强直显著侧的同侧为致痫区。一方面原因为SEEG入组患者常存在症状学侧向性与其他检查矛盾的情况,另一方面提示,ATLP出现时已处于发作后期,异常电活动不一定遵循同侧优先扩散的假想"原则",该特点在后头起始的癫痫发作中是否更为突出,需今后增加样本量进行统计学分析。BATS则是相对出现较早的症状,在癫痫放电向双侧广泛扩散之前出现,因此致痫区同侧受累更明显。
本研究结果显示,广义BATS在某些脑区不出现或非常少见,比如额眶回、额极、内侧颞叶。2例起始涉及海马,但不属于经典内侧颞叶型癫痫,其中1例与岛叶腹侧同时起始,另1例从海马尾部起始迅速向额叶内侧扩散,而经典内侧颞叶型癫痫则应独立起始于海马前部。
本研究结果提示,起始于SSMA及周边脑区的BATS不对称性更强,虽然差异未达统计学意义,但与文献报告一致[3]。如发作起始于其他脑区,BATS的对称性可以增强,可能与电活动激活双侧SSMA有关[2,3]。ATLP与BATS相比缺乏定位价值,各脑区均可出现,起始于颞叶亦不少见[8,9]。
本研究结果显示,在SSMA及pre-SSMA植入电极的病例中,96.9%在BATS出现前该电极存在异常放电的扩散,发作起始的部位可涉及额、顶、岛、枕等多个脑区。既往研究表明,电刺激SSMA可出现BATS经典型症状,而非其他BATS亚型,电刺激其他脑区三种亚型均不会出现[1]。因此我们认为,BATS经典型的症状产生区在SSMA,而双侧近端强直和M2e的产生可能也需要以SSMA为核心的随意运动网络共激活,是电活动扩散过程中依次激活该网络中重要节点的结果。
SSMA与pre-SSMA组成辅助感觉运动复合体,在随意运动的认知控制方面发挥重要作用[10,11],是随意运动网络的重要节点,接受顶叶自下而上和前额叶自上而下传入调控[12,13,14,15],且有白质纤维束相互联系[16,17,18]。这些传入脑区与本研究中BATS病例发作起始分布基本一致。以随意运动网络功能解剖学为基础分析BATS前后的症状学顺序有助于SOZ定位,比如过度运动Ⅱ型出现在经典BATS前后时,致痫区位于中线结构可能性较大[1,19]。
首先,约40%的BATS患者未在SSMA区植入电极,因此不能反映BATS与SSMA关系的全貌。其次,入组患者无发作率未达100%,部分患者的致痫区定侧定位可能欠准确。但根据文献报道和我们的经验,36%~76%手术失败的原因与切除范围不够有关,而非致痫区定位错误[20,21,22]。此外,我们排除了发作起始波型欠明确的病例,尽可能降低了致痫区定侧、定位的错误。
总之,我们提出了广义BATS概念,发现BATS经典型和双侧近端强直在发作基本特征方面有较高一致性,经典型及M2e对SOZ定侧有极高应用价值。出现BATS三种亚型的脑区分布存在一定规律,在结合发作演变顺序及功能解剖学的基础上,可进一步推测发作起始部位。ATLP与广义BATS在症状学核心表现、发作基本特征方面完全不同,且SOZ定侧价值弱于BATS,难以用于SOZ定位。
[1]
[2] Sitthinamsuwan B,Usui N,Tottori T, et al. Seizures with tonic posturing: semiologic difference between supplementary sensorimotor area (SSMA) origin and extra-SSMA origin[J]. Epilepsia, 2016, 57(2): e39-44.
[3] Kotagal P,Bleasel A,Geller E, et al. Lateralizing value of asymmetric tonic limb posturing observed in secondarily generalized tonic-clonic seizures[J]. Epilepsia, 2000, 41(4): 457-462.
[4] Bleasel A,Kotagal P,Kankirawatana P, et al. Lateralizing value and semiology of ictal limb posturing and version in temporal lobe and extratemporal epilepsy[J]. Epilepsia, 1997, 38(2): 168-174.
[5]
[6] 王梦阳,陈述花,王静,等. Ⅱ型局灶性皮质发育不良的立体定向脑电图特点[J].中华神经外科杂志, 2016, 32(8): 825-830.
[7] Scheffer IE,Berkovic S,Capovilla G, et al. ILAE classification of the epilepsies: position paper of the ILAE Commission for Classification and Terminology[J]. Epilepsia, 2017, 58(4): 512.
[8] Marashly A,Ewida A,Agarwal R, et al. Ictal motor sequences: lateralization and localization values[J]. Epilepsia, 2016, 57(3): 369-375.
[9] 金丽日,吴立文,井上有史."4"字征在颞叶内侧癫痫致痫源定侧中的应用价值[J].中华神经科杂志, 2008, 41(4): 247-249.
[10] Nachev P,Kennard C,Husain M. Functional role of the supplementary and pre-supplementary motor areas[J]. Nat Rev Neurosci, 2008, 9(11): 856-869.
[11] Ebbesen CL,Brecht M. Motor cortex-to act or not to act?[J]. Nat Rev Neurosci, 2017, 18(11): 694-705.
[12] Bartoli E,Aron AR,Tandon N. Topography and timing of activity in right inferior frontal cortex and anterior insula for stopping movement[J]. Hum Brain Mapp, 2018, 39(1): 189-203.
[13] Desmurget M,Sirigu A. Conscious motor intention emerges in the inferior parietal lobule[J]. Curr Opin Neurobiol, 2012, 22(6): 1004-1011.
[14] Fiori F,Chiappini E,Soriano M, et al. Long-latency modulation of motor cortex excitability by ipsilateral posterior inferior frontal gyrus and pre-supplementary motor area[J]. Sci Rep, 2016, 6: 38396.
[15] Rodrigo AH,Domenico SID,Ayaz H, et al. Differentiating functions of the lateral and medial prefrontal cortex in motor response inhibition[J]. Neuroimage, 2014, 85(2): 423-431.
[16] Cauda F,D′Agata F,Sacco K, et al. Functional connectivity of the insula in the resting brain[J]. Neuroimage, 2011, 55(1): 8-23.
[17] Catani M,Dell′acqua F,Vergani F, et al. Short frontal lobe connections of the human brain[J]. Cortex, 2012, 48(2): 0-291.
[18] Bozkurt B,Yagmurlu K,Middlebrooks EH, et al. Microsurgical and tractographic anatomy of the supplementary motor area complex in humans[J]. World Neurosurg, 2016, 95: 99-107.
[19] 郭韬,杜亚丽,康进生,等.中央区纵裂癫痫症状学和脑电图研究[J].中华神经科杂志, 2012, 45(1): 40-44.
[20] Grote A,Witt JA,Surges R, et al. A second chance-reoperation in patients with failed surgery for intractable epilepsy: long-term outcome, neuropsychology and complications[J]. J Neurol Neurosurg Psychiatry, 2016, 87(4): 379-385.
[21] Reed CM,Dewar S,Fried I. Failed epilepsy surgery deserves a second chance[J]. Clin Neurol Neurosurg, 2017, 163(12): 110-115.
[22] Krucoff MO,Chan AY,Harward SC, et al. Rates and predictors of success and failure in repeat epilepsy surgery: a meta-analysis and systematic review[J]. Epilepsia, 2017, 58(12): 2133-2142.
