单基因糖尿病的遗传学进展
2019年11月
中华放射学杂志,第11卷第11期 第716页-第719页
彭慧芳,姜宏卫
糖尿病以慢性血糖水平增高为主要临床特征,在发病机制和遗传特性上有很大的异质性,同时受环境因素和生活方式的影响,不同类型糖尿病遗传和环境的参与程度不同,精准的分型对不同类型糖尿病治疗有重要意义[1]。1999年WHO对糖尿病的分型虽广为接受,但临床上仍存在很多界限不清的类型、或者不同类型间重叠,给临床诊治带来一定困难。如果将生物标记、基因型、遗传风险等因素考虑进糖尿病的分型,会更有利于明确病因及指导治疗[2]。
医学及遗传学技术的快速发展使得人们对糖尿病遗传病因的分子机制有了越来越多的认识,随着糖尿病病因的不断被发现,分类成为一项具有挑战性的任务,近年来的讨论也越来越多。2015年的一篇报道从遗传环境、生活习惯等多个因素考虑糖尿病分型,对目前主流分型进一步细化,提出包含单基因糖尿病的分型[3],虽然这种分型仍然并非最优,但值得我们进一步讨论。
单基因糖尿病是由单一基因缺陷引起的一类分子病因明确的糖尿病,通常以常染色体显性或隐性方式遗传,部分母系遗传(线粒体糖尿病),发病率低、确诊率低、临床异质性高,绝大多数属于特殊类型糖尿病,且需要不同于1型糖尿病(T1DM)和2型糖尿病(T2DM)的特殊护理和治疗,必须进行明确诊断[4]。同时对单基因糖尿病的研究有利于了解胰岛β细胞功能缺陷及胰岛素抵抗的上游分子机制,有利于制定基于分子遗传学诊断的个体化治疗方案。单基因糖尿病在临床上主要包括:青少年的成年起病型糖尿病(MODY)、新生儿糖尿病(neonatal diabetes mellitus,NDM)(暂时性和永久性)、线粒体糖尿病、伴糖尿病的综合征[5]。在整个生命周期中的发生情况有差别,且与脂肪代谢障碍、胰岛素抵抗等多种病症难以区分,见
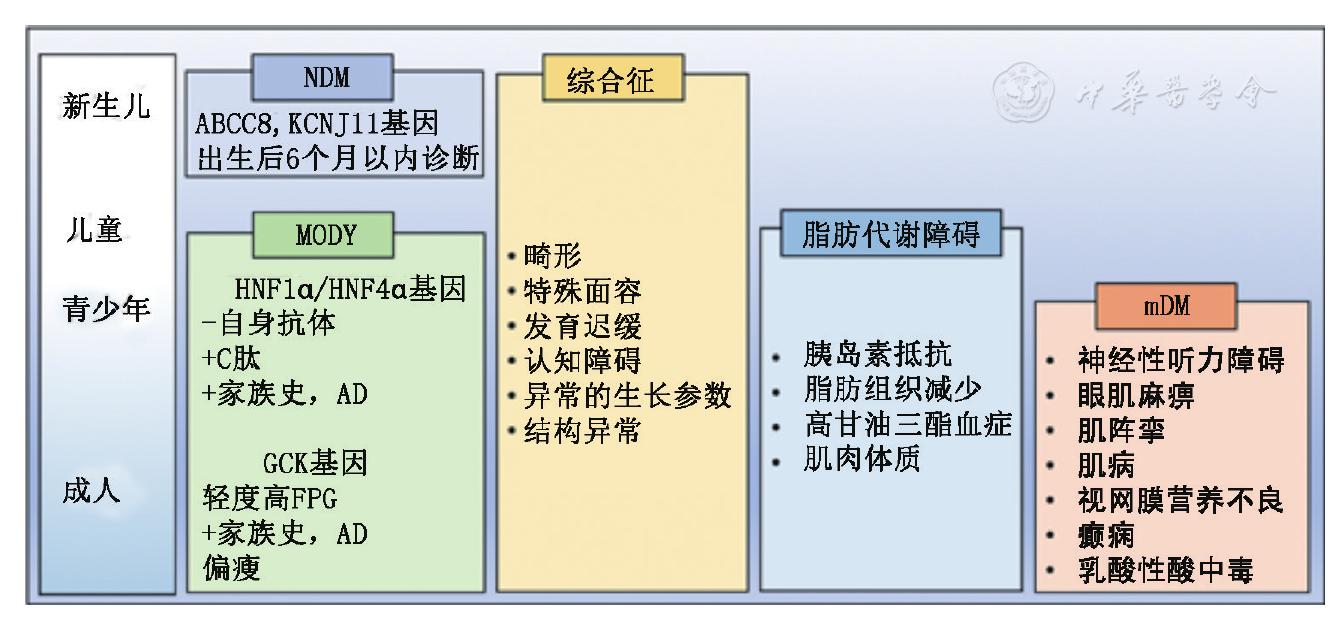
注:NDM:新生儿糖尿病;MODY:青少年的成人起病型糖尿病;mDM:线粒体糖尿病;FPG:空腹血糖;AD:常染色体显性遗传
MODY是最常见的单基因糖尿病,在英国占所有糖尿病病例的1%~2%,占30岁以下诊断的糖尿病患者1%~4%[6],常染色体显性方式遗传,以不同的突变基因来分,目前已知有14个亚型(MODY1~14),每个亚型由参与控制胰腺细胞发育、功能和调节的不同基因突变引起,导致葡萄糖感受和胰岛素分泌受损,少有胰岛素作用缺陷,临床表现为不同的特征[7](

目前研究最多的是MODY2(GCK基因)、MODY3(HNF-1α基因)和MODY1(HNF-4α基因)[9],在高加索人群中通过基因检测25岁以下诊断为MODY的患者,发现这三种亚型约占MODY的80%[10]。中国人群MODY患者不同亚型的发病情况尚缺少流行病学数据。
NDM一般指出生后6个月内发生的糖尿病,国外报道的发病率是1∶500 000~1∶300 000出生活婴[11],但各地发病率报道也有差别,国内尚缺乏数据报道。新生儿糖尿病的病因可归于胰腺发育缺失或紊乱、胰岛β细胞减少、β细胞功能紊乱或早期胰岛细胞破坏。对于有NDM史或家族性早发糖尿病史的患儿,无论其是否有T1DM或T2DM的表现,均应考虑单基因糖尿病的可能性。NDM中,50%~60%的患儿表现为暂时性糖尿病,在患儿几个月大时症状可消失,其余的为永久性NDM[12]。一些引起MODY的基因突变,也可以引起NDM,但在遗传方式上有所差别,其中的遗传学机制暂不清楚。已报道22种基因与NDM相关,详见

线粒体病是指线粒体基因组,或者核基因组中编码线粒体相关的基因异常所引起的疾病,人群中的患病率约为1∶4 300[14],临床差异大,遗传异质性高,又缺乏足够敏感和特异的生物标记物。各个年龄段发病均可发病,可以是母系遗传,也可以遵循常染色体显性、隐性或者X-连锁模式,在已知线粒体疾病谱系中大多数个体可以在评估时没有疾病迹象,其中30%的个体在未来5年内发展出疾病特征[15]。中华医学会糖尿病分会早在2005年发布的《线粒体基因突变糖尿病的现状及筛查与诊治建议》[16]中提出了线粒体糖尿病筛查对象、基因诊断、治疗等的建议。
综合征是指由于同一病因而可识别的一系列症状和体征,一些综合征伴随有糖尿病的发生。与糖尿病相关的综合征中,多数在儿童早期或者青少年时期发病,但糖尿病往往会在后期发生。许多包含糖尿病的综合征如Wolfram综合征,Wolcott-Rallison综合征,Werner综合征,Mitchell-Riley综合征,NDH综合征,Prader-Willi综合征等,很难逐一讨论[17]。血糖控制不佳会诱发一系列并发症,考虑到可能要遵循的相关健康问题以及确保向家庭成员提供适当的风险咨询,在此类综合征的诊治过程中,糖尿病仍然需要谨慎考虑。
有报道提出单基因自身免疫性糖尿病的概念,指单个基因缺陷引起对胰岛β细胞的自身免疫攻击而引发的糖尿病,主要表现在生命早期但不完全是新生儿时期,与典型的T1DM或其他单基因糖尿病综合征相交叠,较好的鉴别对治疗和预后意义重大[18]。AIRE、FOXP3、STAT3、CTLA4、STAT1、LRBA、IL2RA等免疫相关基因缺陷可引起自身免疫性糖尿病或者伴随自身免疫性糖尿病的综合征[19],也有报道应激反应和染色质沉默因子SIRT1基因突变可引起T1DM[20]。虽然部分单基因自身免疫性糖尿病可以归在伴糖尿病的综合征或者其他类型的单基因糖尿病,但由于单基因自身免疫性糖尿病的特殊性及在T1DM中被识别的难度较大,我们希望在考虑单基因糖尿病时能够对单基因自身免疫性糖尿病有更多的关注。
人类基因组计划的完成为基因组结构提供了新的见解,近十年来全基因组关联研究的兴起使得许多疾病的遗传研究取得了巨大进展,在糖尿病等一些代谢性疾病中也已开展了诸多研究。单基因糖尿病的精准诊断,可以给患者提供准确治疗和用药的机会,无症状的患者家属也可得到早期诊断,从而定期检测和适当治疗[21]。
单基因糖尿病诊断的金标准是基因检测,其特异性高、敏感性强。MODY、NDM、部分综合征中的基因突变包括错义突变、无义突变、剪接位点突变、移码突变、启动子突变和框内微小缺失、插入或重复等,目前最常用的检测方法是二代测序技术,全外显子测序是发现疾病未知变异的有效方案,也是验证罕见单基因疾病的新的遗传突变的方法,随着测序成本的降低,全外显子测序逐渐成为测序检测的首选方案。线粒体糖尿病的精准诊断首选需要线粒体基因组测序,虽然m.3243A>G突变占大多数[22],但m.3243A>G检测阴性的情况下,仍需要线粒体基因组测序,甚至进行受累靶器官组织线粒体基因组测序(考虑到线粒体遗体转异质性),所以可以推荐首先进行线粒体基因组测序,阴性情况下再进行全外显子测序。而对于种类复杂的伴糖尿病综合征,则需要谨慎判断,有些需要测序检测,一些则需要Ms-MLPA或者其他检测方法,但新突变的致病性分析及功能验证方面还存在巨大的空间。另外,对糖尿病基因检测的成本效益分析表明,单基因糖尿病的基因检测有利于准确及时的诊断,可以节省诊疗成本;对于临床诊断为T1DM的新生儿或儿童进行常规基因检测也是节省成本的,但不建议糖尿病基因检测作为成年患者的常规筛查[23]。
综上,糖尿病尤其单基因糖尿病的精准诊断十分必要,基因检测技术的飞速发展给遗传病的检测及诊断带来了新的契机,同时带来了解读、分析及新突变致病性验证等方面的挑战。未来还需要整合基因组学与其他组学(表观遗传组学、蛋白组学、代谢组学等)对基因结构/功能与疾病途径、表型的相关性。增强基因缺陷在糖尿病分型及诊治中所占的分量,有利于个体化的精准诊治。
[1] 翁建平,朱大龙,母义明,等.糖尿病的未来:精准预测,精准诊断,精准治疗[J].中华糖尿病杂志,2019,11(6):369-373.
[2] 裴晓蓓,郭立新.糖尿病分型的若干问题探讨[J].中华糖尿病杂志, 2019, 11(6): 379-383.
[3] Thomas CC, Philipson LH. Update on diabetes classification[J]. Med Clin North Am, 2015, 99(1): 1-16.
[4] Misra S, Owen KR. Genetics of monogenic diabetes: present clinical challenges[J]. Curr Diab Rep, 2018,18(12):141.
[5] Yeung RO, Hannah-Shmouni F, Niederhoffer K, et al. Not quite type 1 ortype 2, what now? Review of monogenic, mitochondrial, and syndromic diabetes[J]. Rev Endocr Metab Disord, 2018,19(1):35-52.
[6] Shields BM, Shepherd M, Hudson M, et al. Population-based assessment of a biomarker-based screening pathway to aid diagnosis of monogenic diabetes in young-onset patients[J]. Diabetes Care, 2017, 40(8): 1017-1025.
[7] Xie F, Chan JC, Ma RC. Precision medicine in diabetes prevention, classification and management[J]. J Diabetes Investig, 2018,9(5):998-1015.
[8] Bishay RH, Greenfield JR. A review of maturity onset diabetes of the young (MODY) and challenges in the management of glucokinase-MODY[J]. Med J Aust, 2016, 205(10): 480-485.
[9] Bansal V, Gassenhuber J, Phillips T, et al. Spectrum of mutations in monogenic diabetesgenes identified from high-throughput DNA sequencing of 6888 individuals[J]. BMC Med, 2017,15(1):213.
[10] Mc Carthy MI, Hattersley AT. Molecular diagnostics in monogenic and multifactorial forms of type 2 diabetes[J]. Expert Rev Mol Diagn, 2001,1(4):403-412.
[11] Polak M, Cavé H. Neonatal diabetes mellitus: a disease linked to multiple mechanisms[J]. Orphanet J Rare Dis, 2007, 2: 12.
[12] Grulich-Henn J, Wagner V, Thon A, et al. Entities and frequency ofneonatal diabetes: data from the diabetes documentation and quality managementsystem (DPV)[J]. Diabet Med, 2010, 27(6): 709-712.
[13] Pearson ER, Flechtner I, Nj?lstad PR, et al. Switching from insulin to oral sulfonylureasin patients with diabetes due to Kir6.2 mutations[J]. N Engl J Med, 2006, 355(5): 467-477.
[14] Gorman GS, Schaefer AM, Ng Y, et al. Prevalence of nuclear and mitochondrial DNA mutations related to adultmitochondrial disease[J]. Ann Neurol, 2015, 77(5): 753-759.
[15] Schaefer AM, Mc Farland R, Blakely EL, et al. Prevalence of mitochondrial DNA disease in adults[J]. Ann Neurol, 2008,63(1):35-39.
[16] 中华医学会糖尿病学分会.线粒体基因突变糖尿病的现状及筛查与诊治的建议[J].中华医学杂志, 2005, 85(28): 1951-1956.
[17] Hattersley A, Bruining J, Shield J, et al. The diagnosis and management of monogenic diabetes in children and adolescents[J]. Pediatr Diabetes, 2009, 10
[18] Johnson MB, Cerosaletti K, Flanagan SE, et al. Genetic mechanisms highlight shared pathways for the pathogenesis of polygenic type 1 diabetes and monogenic autoimmune diabetes[J]. Curr Diab Rep, 2019, 19(5): 20.
[19] Strakova V, Elblova L, Johnson MB, et al. Screening of monogenic autoimmune diabetes among children with type 1 diabetes and multiple autoimmune diseases: is it worth doing?[J]. J Pediatr Endocrinol Metab, 2019, 32(10): 1147-1153.
[20] Biason-Lauber A, B?ni-Schnetzler M, Hubbard BP, et al. Identification of a SIRT1 mutation in a family with type 1 diabetes[J]. Cell Metab, 2013,17(3):448-455.
[21] 王晓艳,陈临琪,孙辉,等.儿童糖尿病基因检测研究进展[J].中国实用儿科杂志, 2019, 34(6):523-526.
[22] Karaa A, Goldstein A. The spectrum of clinical presentation, diagnosis, andmanagement of mitochondrial forms of diabetes[J]. Pediatr Diabetes, 2015, 16(1): 1-9.
[23] Naylor R. Economics of genetic testing for diabetes[J]. Curr Diab Rep, 2019, 19(5):23.
