自身免疫性脑炎的影像诊断与鉴别诊断
2020年3月
中华放射学杂志,第54卷第3期 第256页-第260页
向雅芸,曾春,李咏梅
自身免疫性脑炎(autoimmune encephalitis, AE)泛指一类机体免疫系统对神经元抗原成分产生异常免疫反应所致的中枢神经系统炎性疾病,占脑炎发病率的10%~20%[1]。各个年龄均可发病,年轻患者中AE的患病率甚至超过了病毒性脑炎。随着AE生物标志物的检测,越来越多的AE被发现与神经元抗体有关,目前AE已成为神经病学临床与基础研究的热点之一。笔者对AE的影像学特征及其鉴别诊断进行归纳总结,以期进一步提高广大医师对该病的认识。
AE常急性或亚急性起病,典型的临床表现包括癫痫、认知障碍和精神异常等[2]。目前AE的分类尚不完全一致。根据抗神经细胞抗体的不同,可大致分为两大类,即抗细胞内抗原抗体相关AE和抗细胞表面抗原抗体相关AE[3](
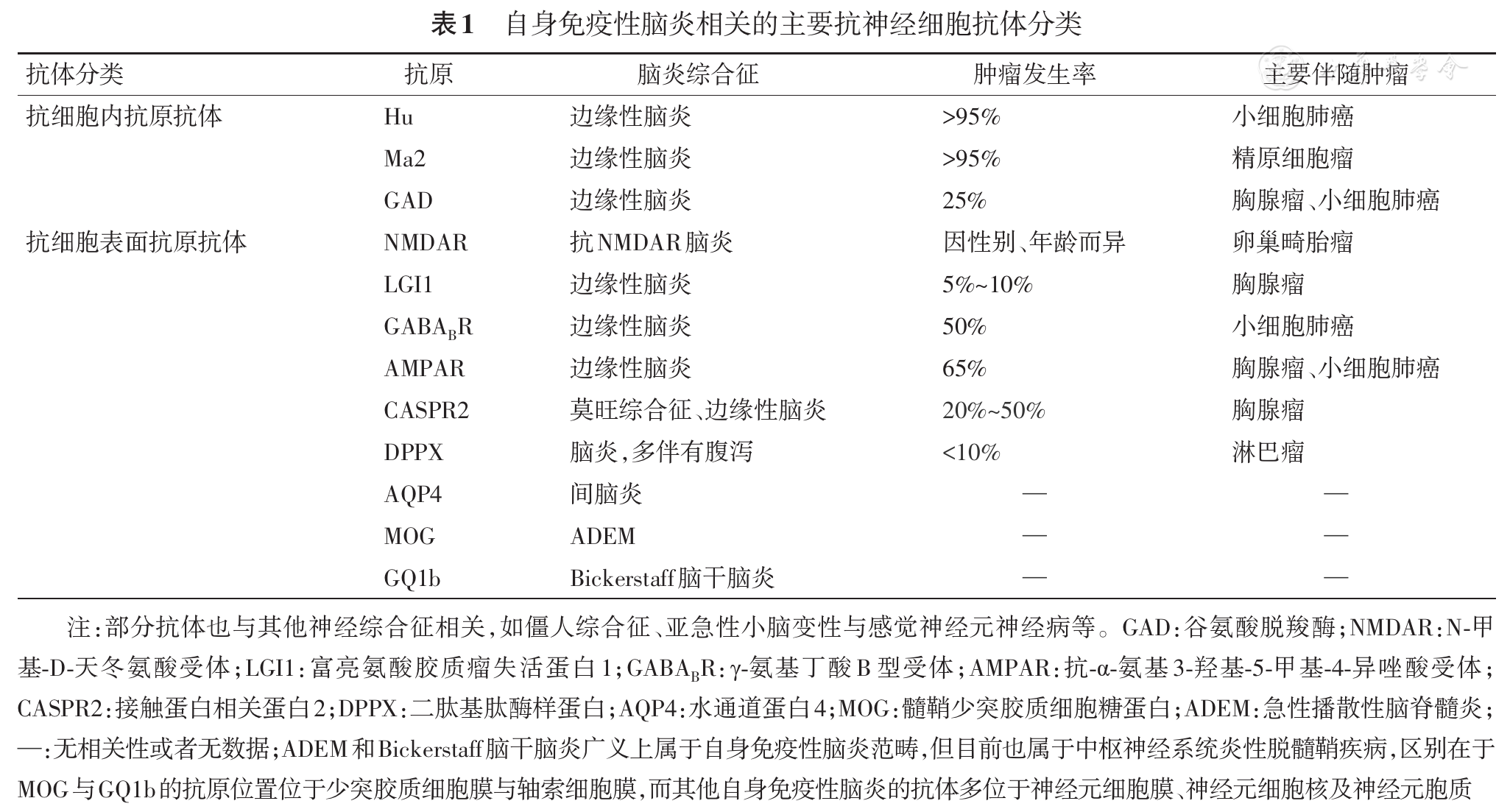
AE的诊断需要结合患者的临床症状和体征,包括边缘系统症状、脑炎综合征、基底节和(或)间脑/下丘脑等受累的临床特征;辅助检查包括脑脊液(cerebrospinal fluid, CSF)、脑电图、神经影像学。确诊依赖于CSF和血清AE相关抗体的检测[4]。常见的AE相关抗体脑炎包括抗NMDAR抗体、抗富亮氨酸胶质瘤失活蛋白1 (leucine-rich glioma-inactivated protein-1, LGI1)抗体、抗γ-氨基丁酸B(gamma-aminobutyric acid B receptor, GABABR)抗体、抗-α-氨基3-羟基-5-甲基-4-异唑酸受体(a-amino-3-hydroxy-5-methyl-4-isoxazol-propionic acid receptor,AMPAR)抗体和抗接触蛋白相关蛋白2受体(contacting-associated protein-2 receptor,CASPR2)抗体等细胞表面抗原抗体脑炎和副肿瘤性边缘性脑炎抗体脑炎。脑电图特异性低,但抗NMDAR脑炎中的异常"δ"刷具有特征性。2016年国际AE专家还提出了自身抗体阴性但拟诊为AE的诊断标准[3],提高了AE早期诊断的灵敏度,但应避免诊断过度,AE的治疗以切除肿瘤和免疫调节为主。
AE常累及边缘系统,表现为一侧或双侧颞叶内侧异常信号或多发性病灶(需除外非特异性白质改变和卒中),可同时累及幕上下脑灰质、白质或者符合炎症脱髓鞘改变,液体衰减反转恢复序列T2WI是显示病灶最敏感的序列。笔者就最常见的抗NMDAR脑炎和边缘性脑炎为例对其影像学特征进行阐述。
抗NMDAR脑炎是最常见的AE,其患病率在全部脑炎中占4%,在免疫介导的脑炎中占第2位,仅次于急性播散性脑脊髓炎[5]。年轻女性多发,40%~60%患者合并卵巢畸胎瘤,特征性临床表现为弥漫型脑炎受损表现[6]。在疾病的早期阶段行免疫治疗和肿瘤切除后,约80%患者病情可缓解。此外,抗NMDAR脑炎可与脱髓鞘疾病或病毒性脑炎合并存在或先后出现[7,8],可同时检测到抗NMDAR抗体、抗水通道蛋白4(aquaporin 4, AQP4)及髓鞘少突胶质细胞糖蛋白(myelin oligodendrocyte glycoprotein, MOG)抗体等,须要考虑重叠综合征的可能[9]。在抗NMDAR脑炎中发现广泛的白质损伤,提示该病的发病机制可能与少突胶质细胞NMDA受体参与有关,部分患者有复发。
抗NMDAR脑炎仅有23%~50%患者存在常规MRI异常,表现为弥漫性脑炎、皮质或皮质下非特异性信号异常,可累及边缘系统、脑灰质、白质,大脑、小脑以及脑干(
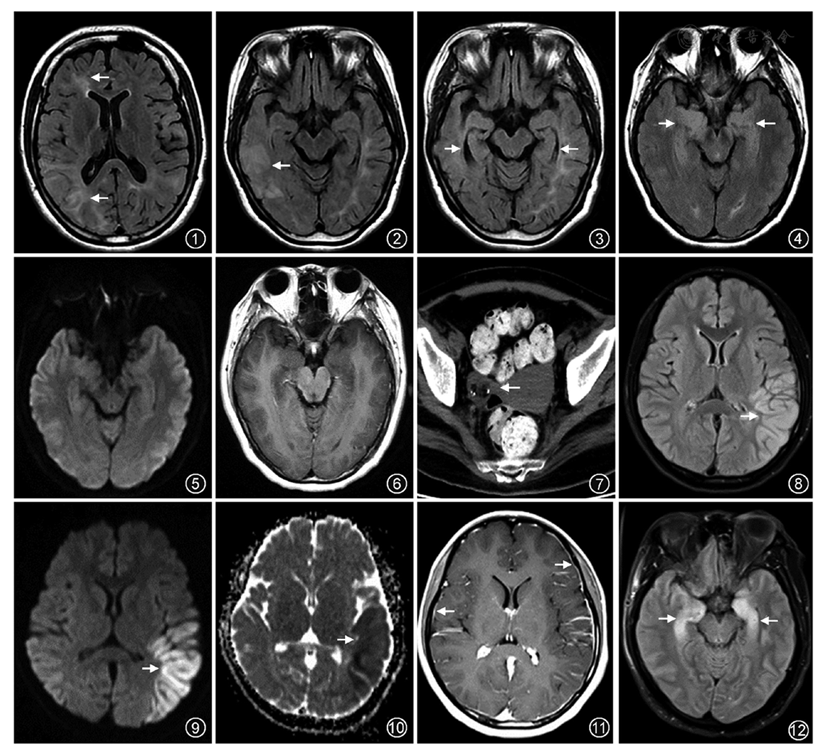
部分患者常规MRI表现为阴性[11],功能MRI可发现更多的隐匿性异常,有助于解释其临床-放射相互矛盾的现象。扩散张量成像可发现更多隐匿的大脑白质损害,与疾病的严重程度有关。静息态功能MRI研究显示患者双侧海马功能连接明显降低,并与记忆受损相关[12]。影像学检查指标与患者的认知能力、严重程度和病程密切相关,提示其可作为评估临床预后的有效指标。
研究显示脱氧葡萄糖(18F-FDG) PET可发现MRI阴性的患者存在葡萄糖代谢异常增高或减低[3],PET可提高影像学诊断的灵敏度。与经典的边缘性脑炎相反,抗NMDAR脑炎可表现为弥漫型脑部的低代谢或高代谢,与临床和MRI表现一致,包括额叶、颞叶和枕叶以及基底节区、小脑和脑干,且与患者的疾病严重程度和临床预后有关。
总之,抗NMDAR脑炎的诊断依赖于血清和脑脊液中NMDA受体阳性的检测,后者的特异度更高。常规MRI表现为弥漫性脑炎、边缘系统脑炎、皮质或皮质下非特异性信号异常、脑膜增厚和强化以及FDG-PET显示特征性的代谢异常。
边缘性脑炎是指主要累及颞叶内侧、海马、下丘脑、杏仁核和扣带回等边缘结构导致的脑部炎症[11],根据2017年中国AE专家共识,边缘性脑炎包括抗细胞表面抗原抗体相关抗体边缘性脑炎(如抗GABAB相关脑炎、抗LGI1相关脑炎和抗AMPAR相关脑炎等)和抗细胞内抗原抗体相关AE(即副肿瘤性边缘性脑炎)[1]。临床表现以急性或亚急性起病,为快速进展的意识障碍,常有癫痫发作、进展型短期记忆丧失等症状。
由于GABAB受体在海马、丘脑及小脑中高表达,因此抗GABABR抗体脑炎通常表现为边缘性脑炎(

抗LGI1抗体脑炎患者多见于40岁以上中老年人,男性多于女性,多在亚急性起病癫痫发作,面-臂肌张力障碍发作是该病特征性症状[15]。该病与肿瘤相关性不大,预后良好,复发罕见。影像表现为单侧或双侧颞叶内侧异常信号,同时伴基底节信号改变。脑功能成像通过容积分析发现常规MRI无阳性患者伴有海马和全脑萎缩。FDG-PET可有更多的阳性发现,Fidzinski等[16]报道了MRI表现为阴性,但双侧纹状体FDG-PET代谢增高。总之,抗LGI1抗体脑炎表现典型的边缘性脑炎。联合MRI和FDG-PET成像可观察到患者基底节、皮层及椎体外系受累,其中皮层和锥体外系异常可能是该病和运动障碍重叠的原因之一[17]。
副肿瘤边缘性脑炎属于抗细胞内抗原抗体AE,其抗体主要包括抗Hu抗体(3/4患者合并小细胞肺癌)、抗Ma2抗体(睾丸肿瘤多见)、抗Yo抗体、抗Ri抗体和抗GAD抗体等,可合并精原细胞瘤、乳腺癌和胸腺瘤等[18]。常规MRI表现以包括海马在内的边缘系统受累为主,表现为一侧或双侧颞叶内侧的异常信号,也可累及大脑皮层、下丘脑和脑干,后期伴有脑萎缩,部分DWI扩散受限,少部分患者表现为弥漫性小脑半球异常信号或脑膜强化;PET可表现为代谢增高。随访过程中MRI可表现为小脑或全脑萎缩,PET轻度代谢异常。
AE的影像学需要鉴别和排除的疾病比较多,包括感染性疾病(例如病毒性脑炎、神经梅毒)、桥本脑炎(Hashimoto′s encephalitis,HE)、脱髓鞘疾病(例如急性播散性脑脊髓炎)、代谢性脑病、药物中毒、风湿疾病神经系统累及脑血管病、线粒体病等。下面就单纯疱疹病毒性脑炎(herpes simplex encephalitis,HSE)、HE和神经梅毒进行鉴别。
此类脑炎是最常见的病毒性脑炎,以年轻人和老年人多见[19],其发热症状、癫痫首发的比例要高于AE,临床多在1周左右达高峰,其特异性诊断为血清和CSF的HSV的病原学检测。MRI是首选影像学检查方法,约90%的患者MRI表现异常,典型MRI表现为单侧的不对称性内侧颞叶异常信号(
神经梅毒为苍白密螺旋体感染神经系统所引起的疾病,影像学表现多样[22],称为"超级模仿者" (
总之,由于AE抗体谱系的检测,新的神经元自身抗体不断被发现,一些疾病也被重新分类和命名,其诊断标准也在不停地更新中,越来越多的AE患者获得及时和精准的诊断,从而可能获得特异性的治疗。虽然影像学表现多样化,但多为一侧或双侧颞叶内侧异常信号或累及边缘系统,灰白质均可受累的弥漫性脑炎,也可累及脑干和脊髓。诊断需结合CSF和血清相关抗体及病原学检测、临床症状及体征。未来的影像学研究应更多的使用定量且独立于视觉观察的方法,与纵向研究设计相结合,为AE的早期诊断及预后的评估提供更可靠且有效的影像学依据。
[1] 中华医学会神经病学分会.中国自身免疫性脑炎诊治专家共识[J].中华神经科杂志,2017,50(2):91-98.
[2] Liu CY, Zhu J, Zheng XY, et al. Anti-N-Methyl-D-aspartate receptor encephalitis: a severe, potentially reversible autoimmune encephalitis[J]. Mediators Inflamm, 2017,2017:6361479.
[3] Kelley BP, Patel SC, Marin HL, et al. Autoimmune encephalitis: pathophysiology and imaging review of an overlooked diagnosis[J]. AJNR Am J Neuroradiol, 2017,38(6):1070-1078.
[4] Graus F, Titulaer MJ, BaluR, et al. A clinical approach to diagnosis of autoimmune encephalitis[J]. Lancet Neurol, 2016,15(4):391-404.
[5] Granerod J, Ambrose HE, Davies NW, et al. Causes of encephalitis and differences in their clinical presentations in England: a multicenter, population-based prospective study[J]. Lancet Infect Dis, 2010,10(12):835-844.
[6] Gurrera RJ. Frequency and temporal sequence of clinical features in adults with anti-NMDA receptor encephalitis presenting with psychiatric symptoms[J]. Psychol Med, 2018,18:1-8.
[7] Zhou L, ZhangBao J, Li H, et al. Cerebral cortical encephalitis followed by recurrent CNS demyelination in a patient with concomitant anti-MOG and anti-NMDA receptor antibodies[J]. MultSclerRelatDisord, 2017,18:90-92.
[8] Kaneko K, Sato DK, Misu T, et al. Anti-N-methyl-D-aspartate receptor encephalitis with multiphasic demyelination. Ann Neurol, 2014, 76(3):462-464.
[9] Titulaer MJ, H?ftberger R, Iizuka T, et al. Overlapping demyelinating syndromes and anti-N-methyl-D-aspartate receptor encephalitis[J]. Ann Neurol, 2014,75(3):411-428.
[10] 曹笃,张丽娟,郭秀明,等.自身免疫性脑炎临床表现与MRI特征分析[J].中国神经精神疾病杂志,2017,43(6):341-345.
[11] Aguiar de Sousa D, Lobo PP, Caldas AC, et al. Pure ataxia associated with N-methyl-D-aspartate receptor antibodies[J]. Parkinsonism Relat Disord, 2014, 20(5):568-589.
[12] Constantinides VC, Kasselimis DS, Paraskevas GP, et al. Anti-NMDA receptor encephalitis presenting as isolated aphasia in an adult[J]. Neurocase, 2018,24(4):188-194.
[13] Li H, Zhang A, Hao Y, et al. Coexistence of Lambert-Eaton myasthenic syndrome and autoimmune encephalitis with anti-CRMP5/CV2 and anti-GABAB receptor antibodies in small cell lung cancer: a case report[J]. Medicine, 2018, 97(19):e0696.
[14] H?ftberger R, Titulaer MJ, Sabater L, et al. Encephalitis and GABAB receptor antibodies: novel findings in a new case series of 20 patients[J]. Neurology, 2013,81(17):1500-1506.
[15] d′Orsi G, Martino T, Lalla A, et al. Faciobrachial dystonic seizures expressed as epileptic spasms, followed by focal seizures in anti-LGI1 encephalitis: a video-polygraphic study[J]. Epileptic Disord, 2018,20(6):525-529.
[16] Fidzinski P, Jarius S, Gaebler C, et al.Faciobrachial dystonic seizures and antibodies to Lgi1 in a 92-year-old patient: a case report[J].J Neurol Sci, 2014,347(1-2):404-405.
[17] Boesebeck F, Schwarz O, Dohmen B, et al. Faciobrachial dystonic seizures arise from cortico-subcortical abnormal brain areas[J]. J Neurol, 2013, 260(6):1684-1646.
[18] Dalmau J, Rosenfeld MR. Paraneoplastic syndromes of the CNS[J]. Lancet Neurol, 2008, 7(4):327-40.
[19] Solomon T, Michael BD, Smith PE, et al. Management of suspected viral encephalitis in adults--Association of British Neurologists and British Infection Association National Guidelies[J]. J Infect, 2012,64(4):347-73.
[20] Xiang T1, Li G, Xiao L, et al. Neuroimaging of six neurosyphilis cases mimicking viral encephalitis[J]. J Neurol Sci, 2013,15;334(1-2):164-6.
[21] 陈楠,秦文,齐志刚,等.桥本脑病的MRI特点[J].中华放射学杂志,2010,44(8):789-793.
[22] 向涛,李国良,肖岚,等.伴颞叶病变的神经梅毒的MRI特点[J].中华放射学杂志,2014,48(3): 248-249.
