大鼠杏仁核内Sirt1信号通路调控海洛因成瘾行为
2019年4月
中华精神科杂志,第52卷第4期 第267页-第274页
张茜,王云鹏,芦晓红,党伟
海洛因成瘾是一种慢性复发性脑病,主要表现为强迫性觅药、海洛因渴求和耐受,以及中断后出现戒断症状,导致长久乃至终身的躯体和精神依赖,对家庭和社会造成巨大负担。研究表明,大脑杏仁核不仅调控恐惧[1]、抑郁[2]、记忆[3]等认知功能,还参与药物成瘾的形成[4],可能是海洛因觅药行为和情感性记忆的关键脑区,对治疗海洛因复吸行为产生有重要意义。
越来越多的证据表明,表观遗传调控机制异常是导致药物成瘾病理反应的重要因素之一,并可能介导了成瘾行为的长久存在[5]。通过表观遗传调控机制,环境刺激被快速整合为染色体结构的稳定改变,而组蛋白乙酰化修饰是这种调控机制的一种重要途径。组蛋白N端特定赖氨酸残基的乙酰化可促进特定基因转录并与药物成瘾行为密切相关[6]。Sirtuins(Sirts)蛋白家族是一类Ⅲ型烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide)依赖的组蛋白去乙酰酶(histone deacetylases),成员包括Sirt1~7。此外,Sirt家族成员被发现可以催化一些非组蛋白类的反应,以及许多重要的转录因子如核因子κB(NF-κB)、FOXO蛋白、组蛋白乙酰化酶p300/CBP相关因子等[7]。在一些动物实验中,Sirt家族成员可调控神经元的分化并阻止神经退行性病变[8]。
既往多数对Sirt家族调控机制的研究集中于外周组织器官,对大脑内Sirts家族调控蛋白表达及神经功能的研究仍较有限,其在海洛因成瘾大鼠杏仁核中的表达调控仍不清楚。我们首先采用慢性海洛因给药检测大鼠杏仁核中Sirt家族表达,继而干预杏仁核中Sirt1表达并利用海洛因条件位置偏爱(CPP)模型研究其对海洛因成瘾行为的调控机制。
本实验所用8周龄雄性SD大鼠,体重200~220 g,由西安交通大学动物实验中心提供。大鼠每笼饲养4只,共76只。人工控制饲养环境,每天12 h光照/黑暗循环(光照时间7:00~19:00),温度(22±3)℃,湿度(55±5)%,自由进食。
海洛因标准品(国家药监局制,纯度99.98%),RNA提取试剂盒、反转录试剂盒和SYBR Green染料(日本TaKaRa公司),蛋白酶抑制剂Cocktail(美国Topscience公司,RIPA裂解液和BCA蛋白定量试剂盒(北京普利莱技术基因有限公司),抗SIRT1抗体(美国Cell Signaling Technology公司),抗乙酰化组蛋白aceH3K4、aceH3K9抗体和抗脑源性神经营养因子(BDNF)抗体(美国Abcam公司),抗β-actin抗体和HRP标记山羊抗兔二抗(美国Santa Cruz公司),高滴度的绿色荧光蛋白(GFP)慢病毒颗粒(2×109 TU/mL)及高滴度Sirt1沉默慢病毒颗粒(2×109 TU/mL)(上海吉凯基因化学技术有限公司),二甲基亚砜(DMSO)及选择性Sirt1抑制剂EX527(美国Selleck公司)。
(1)实验一:筛选慢性海洛因作用下杏仁核内差异表达的Sirt分子。SD大鼠分为慢性海洛因组及盐水对照组,每组7只。给药流程及给药剂量参照文献[9]并依照我们的预实验结果优化。慢性海洛因组每天腹腔注射5 mg/kg海洛因溶液,对照组注射等体积生理盐水,连续7 d。最后一天注射结束1 h后,立刻处死大鼠,依照大鼠脑立体定位图谱分离杏仁核组织,提取mRNA及组织总蛋白,逆转录-聚合酶链反应检测Sirt家族表达变化,并筛选出表达有统计学意义的目标Sirt分子。(2)实验二:目标Sirt分子在海洛因给药后不同时间的表达变化及对杏仁核组蛋白乙酰化的调控。将一批新的SD大鼠分为慢性海洛因组及盐水对照组,每组7只,依照实验一步骤进行7 d的慢性海洛因给药,于最后一次给药后的1 h、6 h、24 h、3 d、7 d、14 d后处死,分离杏仁核组织,提取mRNA及组织总蛋白,RT-PCR检测目标分子Sirt1和Sirt2的mRNA表达变化。蛋白质印迹法检测具有显著表达差异的时间点(24 h和7 d)的Sirt1、乙酰化组蛋白aceH3K4、aceH3K9表达,ChIP检测成瘾相关分子ΔFosB结合于Sirt1启动子区的水平,从而确定海洛因组大鼠杏仁核Sirt1对组蛋白乙酰化的调控作用。(3)实验三:上调杏仁核内Sirt1对大鼠海洛因成瘾行为的影响。将SD大鼠分为4组:Sirt1过表达+海洛因条件位置偏爱(CPP)组、Sirt1过表达+盐水CPP组、绿色荧光蛋白(GFP)对照病毒+海洛因CPP组、GFP对照病毒+盐水CPP组,每组6只。通过脑立体定位手术于杏仁核内分别注射Sirt1过表达慢病毒(OE-Sirt1)或GFP对照病毒。手术后28 d开始,每天腹腔注射5 mg/kg海洛因溶液或等体积生理盐水,通过海洛因CPP实验检测各组大鼠成瘾行为改变。(4)实验四:抑制杏仁核内Sirt1对大鼠海洛因成瘾行为的影响。将SD大鼠分为Sirt1抑制剂组和二甲基亚砜(DMSO)对照组,每组6只。通过脑立体定位手术于杏仁核内埋置微量注射套管,术后大鼠恢复7 d,各组大鼠无死亡。于8 d开始每天杏仁核内注射Sirt1抑制剂EX527(1.0 μg/0.5 μL,通过微量注射泵于2 min内缓慢注射完毕[9])或1% DMSO,15 min后腹腔注射5 mg/kg海洛因溶液或等体积生理盐水,通过海洛因CPP实验检测各组大鼠成瘾行为改变。
CPP实验为检测动物成瘾行为的经典实验,具体步骤依照我们先前的报道进行[9]。实验箱由2个相连的小箱体组成。一侧小箱壁为黑白网格,另一侧小箱壁为黑白条纹,两箱中间有小门可供大鼠自由穿梭。其原理为:选定一侧箱体为海洛因伴药箱后,将大鼠置于此箱并给海洛因,另一侧箱则固定给予盐水。经过数循环训练后,观察大鼠在伴药箱和非伴药箱的自由活动情况,动物在药物奖赏效应的作用下对伴药箱产生位置偏好即为海洛因成瘾行为,其程度与海洛因精神依赖性相关。CPP实验包括3个阶段:(1)CPP预测试阶段各组均不给药。每组大鼠在打开实验箱中间隔板后,进行一次两侧的自由活动15 min,使其适应箱内环境。第2天测试大鼠在箱两侧的停留时间,获得CPP基线值。自然偏爱箱为停留时间长的一侧,海洛因伴药箱则为时间停留短的一侧。(2)CPP训练阶段。将CPP实验箱中间的隔板关闭,大鼠注射海洛因(对照组注射生理盐水)后放入伴药箱45 min,隔天给予同体积生理盐水后放入自然偏爱侧45 min。(3)CPP测试阶段。测试当天各组大鼠均不给药,打开CPP箱中间隔板,大鼠在箱两侧自由活动15 min后记录各箱停留时间。CPP测试值=伴药箱时间-自然偏爱箱时间。CPP训练与测试共进行4个循环。
水合氯醛0.5~1.0 mL/100 g腹腔注射麻醉大鼠。剪去表层皮肤暴露颅骨,在脑立体定向仪上固定大鼠。参照大鼠脑立体定位图谱确立杏仁核坐标为:前囟前-2.76 mm,中线侧旁开4.8 mm,硬膜下8.4 mm。调整游标卡尺对应其坐标点钻孔,微量注射泵每侧缓慢注射0.5 μL GFP慢病毒或Sirt1沉默慢病毒颗粒,注射速度0.2 μL/min,注射完毕停留15 min。对于Sirt1抑制剂注射组,脑内植入不锈钢套管,牙科水泥固定。碘伏消毒,缝皮,置于动物手术复苏室苏醒。术中和术后各组大鼠无死亡。
试剂盒提取杏仁核总RNA,琼脂糖凝胶电泳评价总RNA质量。进行反转录反应合成cDNA后,SYBR Green染料进行RT-PCR反应。反转录反应为20 μL体系,反应条件为37 ℃ 15 min,85 ℃ 5 s。PCR反应为10 μL体系,反应条件为预变性95 ℃ 30 s,变性95 ℃ 30 s,退火60 ℃ 10 s,共40个循环。引物序列如下:Sirt1 F:5′-CAGCCGTCT CTGTGTCACAAA-3′,R:5′-GCACCGAGGAACTAC CTGAT-3′;Sirt2 F:5′-GCCTGGGTTCCCAAAAGG AG-3′,R:5′-GCACCGAGGAACTACCTGAT-3′;Sirt3F:5′-ATCCCGGACTTCAGATCCCC-3′,R:5′-CAA CATGAAAAAGGGCTTGGG-3′;Sirt4 F:5′-GAT TGACTTTCAGGCCGACAA-3′,R:5′-GCGGCACAA ATAACCCCGA-3′;Sirt5 F:5′-CTCCGGGCCGAT TCATTTCC-3′,R:5′-GCGTTCGCAAAACACTT CCG-3′;Sirt6 F:5′-ATGTCGGTGAATTATGCA GCA-3′,R:5′-GCTGGAGGACTGCCACATTA-3′;Sirt7 F:5′-AGCATCACCCGTTTGCATGA-3′,R:5′-GGCAGTACGCTCAGTCACAT-3′;GAPDH F:5′-ATGGGACGATGCTGGTACTGA-3′,R:5′-TGC TGACAACCTTGAGTGAAAT-3′。GAPDH为内参基因。Bio-Rad iQ5软件采集数据,并根据2-ΔΔCT法计算mRNA相对表达量。
取蛋白酶抑制剂Cocktail一片,溶解于10 mL RIPA裂解液中。向装有大鼠杏仁核组织的离心管中各加入200 μL蛋白裂解液,静置5 min后使用超声组织裂解仪于冰上将待测样本完全裂解。4℃ 14 000 rpm离心30 min后小心吸取75 μL含组织总蛋白的上清液于新的1.5 mL离心管中,BCA蛋白定量试剂盒检测蛋白浓度。12%的聚丙烯酰胺凝胶电泳分离蛋白,湿转法转印于聚偏二氟乙烯膜,5%的牛血清蛋白室温封闭3 h。抗SIRT1抗体(1∶1 000)、抗乙酰化组蛋白H3K4、H3K9抗体(1∶1 000)、抗BNDF抗体(1∶500)、抗β-actin抗体(1∶2 000)孵育4℃摇床过夜,二抗(1∶10 000)室温摇床孵育60 min,化学发光显色。QuantityOne软件分析条带结果,计算目的蛋白与内参β-actin条带相对灰度。
参照美国Upstate公司Chromatin Immunoprecipitation Kit说明书,杏仁核组织分别在1%甲醛、2 mol/L甘氨酸溶液固定10 min。超声低频匀浆,预冷PBS缓冲液(含蛋白酶抑制剂)重悬。4℃,2 500 r/min离心5 min,去掉上清。用1 mL SDS裂解缓冲液(含5 μL蛋白酶抑制剂)重悬。超声波处理将DNA剪切成200~1 000 bp片段,ChIP缓冲液稀释并用蛋白G琼脂糖清洁,以降低非特异性背景。样品用相应的抗体进行免疫沉淀反应,4 ℃摇动过夜。复合物用蛋白G琼脂糖悬浮液收集,用试剂盒提供的低盐、高盐、氯化锂洗脱缓冲液冲洗。沉淀的染色质用新配制的洗脱缓冲液洗去蛋白G。蛋白质和DNA的交联复合物解交联,蛋白酶K消化DNA中蛋白质,纯化柱纯化DNA。取80 μL纯化DNA样品(组蛋白ChIPs、ΔFosB或非组蛋白ChIPs)作为模板,进行PCR定量检测。PCR反应产物用2%琼脂糖凝胶电泳验证结果。
采用GraphPad Prism 6.0软件进行数据分析。结果表示为均数±标准差。CPP实验结果采用双因素方差分析,当两因素交互作用显著时采用Turkey多重检验分析组间差异。RT-PCR、Western blot及qChIP结果中海洛因组mRNA和蛋白表达量均表示为相对于盐水组的倍数,非配对t检验分析组间差异。以P<0.05表示差异有统计学意义。
经过连续7 d的慢性海洛因给药后,慢性海洛因组大鼠杏仁核内Sirt1(t14=8.127,P<0.01)mRNA表达水平显著高于盐水对照组,Sirt2(t14=4.598,P<0.05)mRNA表达则低于盐水对照组,差异有统计学意义,Sirt3-7表达无显著变化(
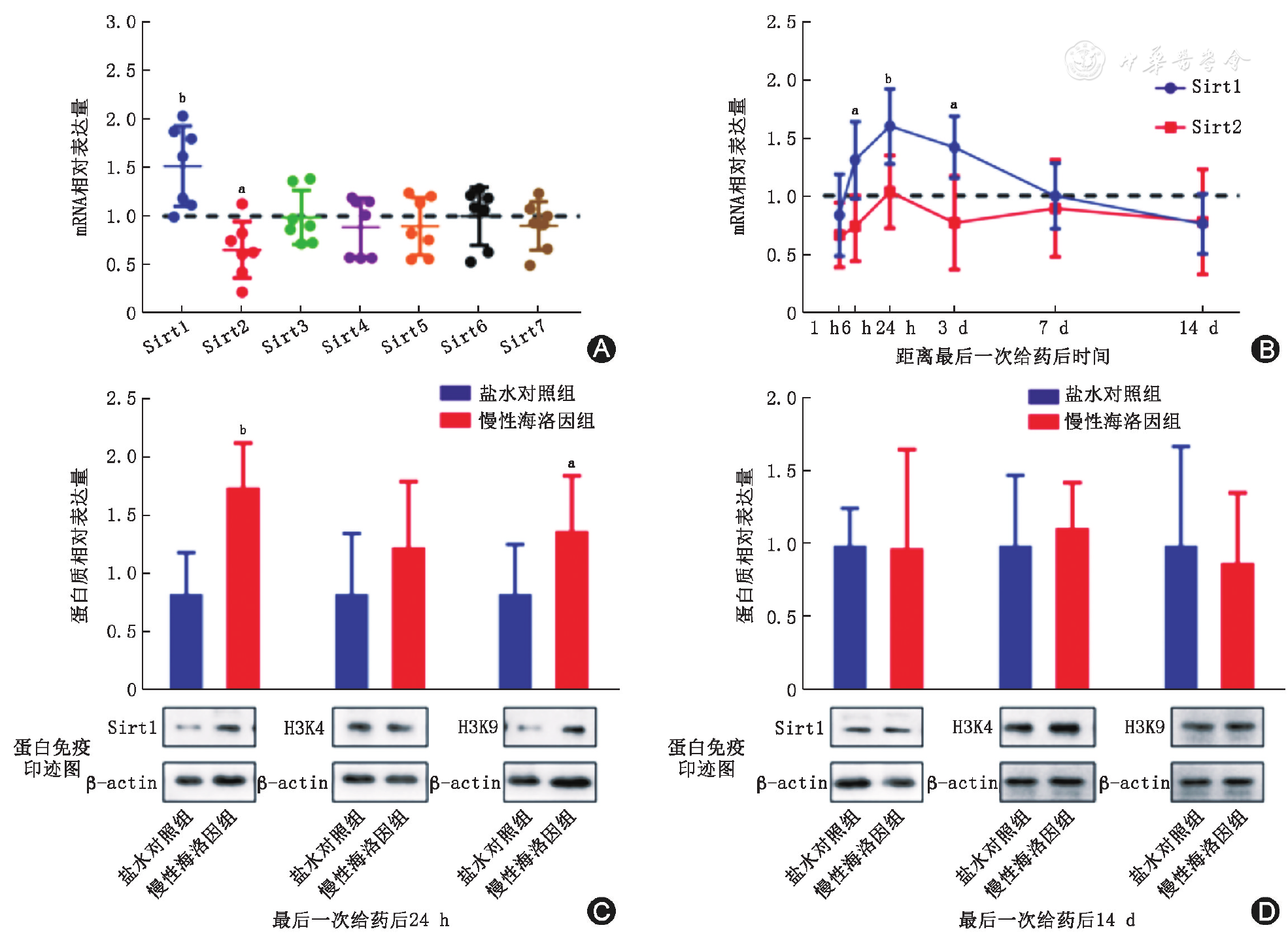
A:慢性海洛因给药后杏仁核内Sirt家族分子mRNA表达水平;B:海洛因给药后杏仁核内Sirt1和Sirt2的mRNA表达水平。A、B图中结果为慢性海洛因组相对于盐水对照组mRNA的改变倍数,虚线表示归一化后的盐水对照组mRNA表达水平;C:海洛因给药24 h后杏仁核内Sirt1、乙酰化组蛋白H3K4、H3K9表达水平及蛋白免疫印迹图;D:海洛因给药14 d后杏仁核内Sirt1、乙酰化组蛋白H3K4、H3K9表达水平及蛋白免疫印迹图;盐水对照组与慢性海洛因组均n=7;与盐水对照组相比,aP<0.05,bP<0.01
慢性海洛因组大鼠杏仁核中,结合于Sirt1启动子区的转录因子ΔFosB水平显著高于盐水对照组(t14=7.301,P<0.01),差异有统计学意义(
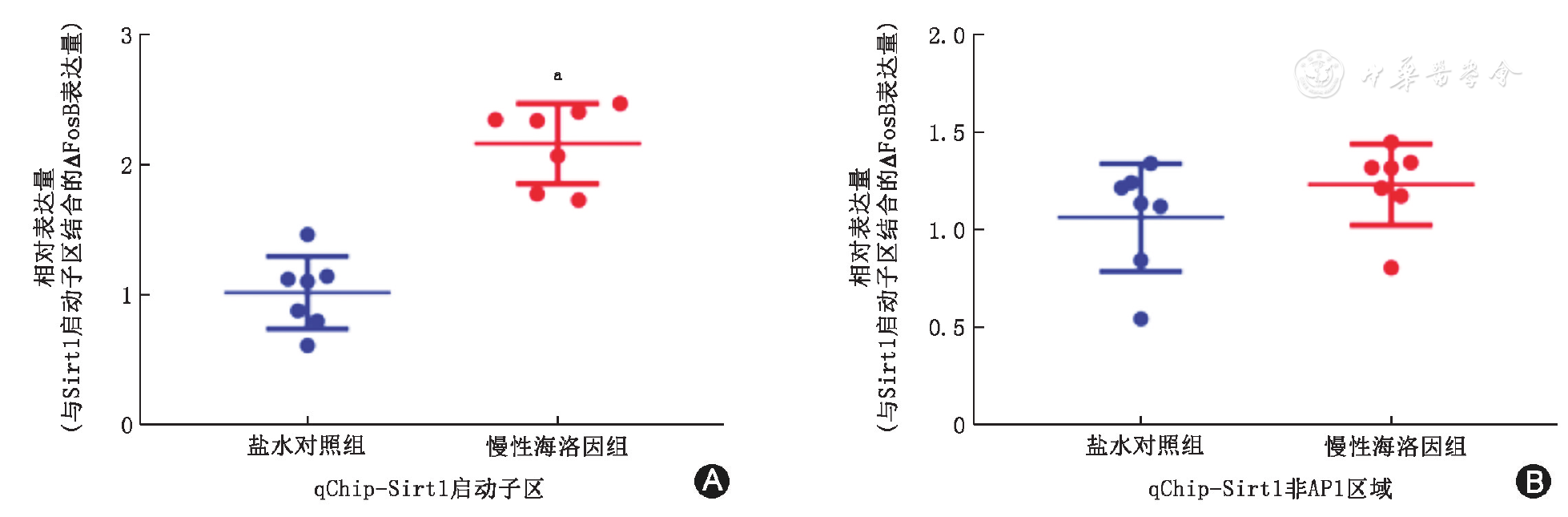
A:结合于Sirt1启动子区的ΔFosB表达水平;B:结合于Sirt1非激活子蛋白1区ΔFosB表达水平;盐水对照组与慢性海洛因组均n=7;与盐水对照组相比,aP<0.01
在预测试阶段,OE-Sirt1+海洛因组、OE-Sirt1+盐水组、GFP对照病毒+海洛因组、GFP+盐水组的CPP测试值差异无统计学意义(
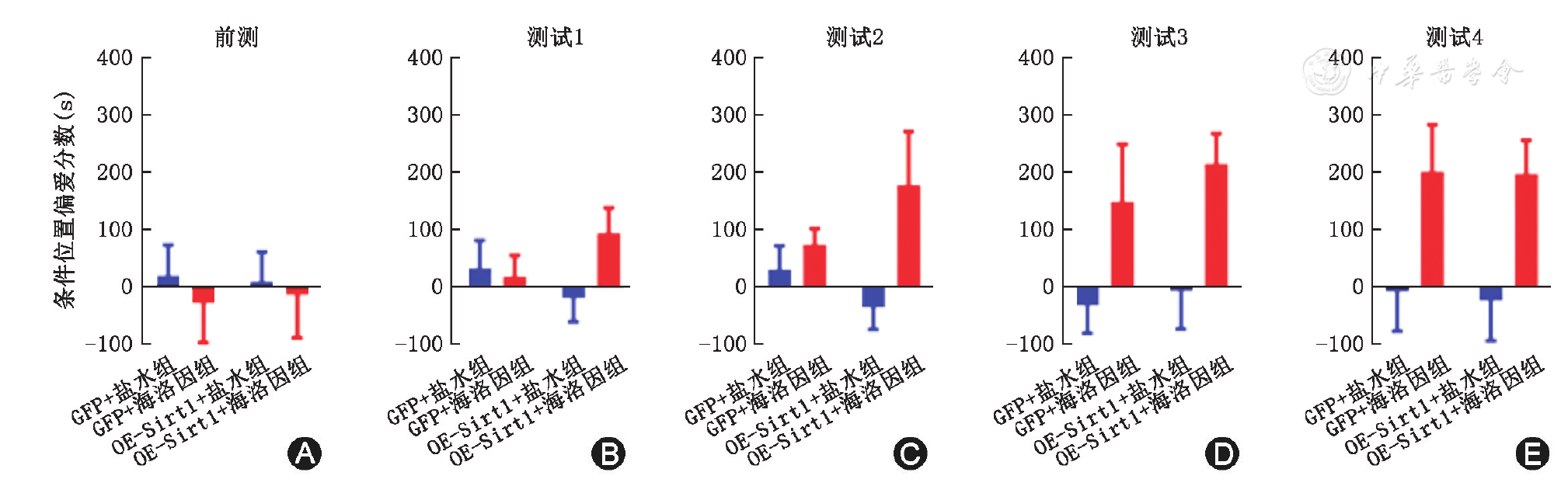
A~E:不同测试阶段的海洛因条件位置偏爱评分;GFP:绿色荧光蛋白对照病毒。OE-Sirt1:Sirt1过表达慢病毒;OE-Sirt1+海洛因组、OE-Sirt1+盐水组、GFP+海洛因组、GFP+盐水组均n=6;与各自对应盐水组相比,aP<0.01
在预测试阶段(
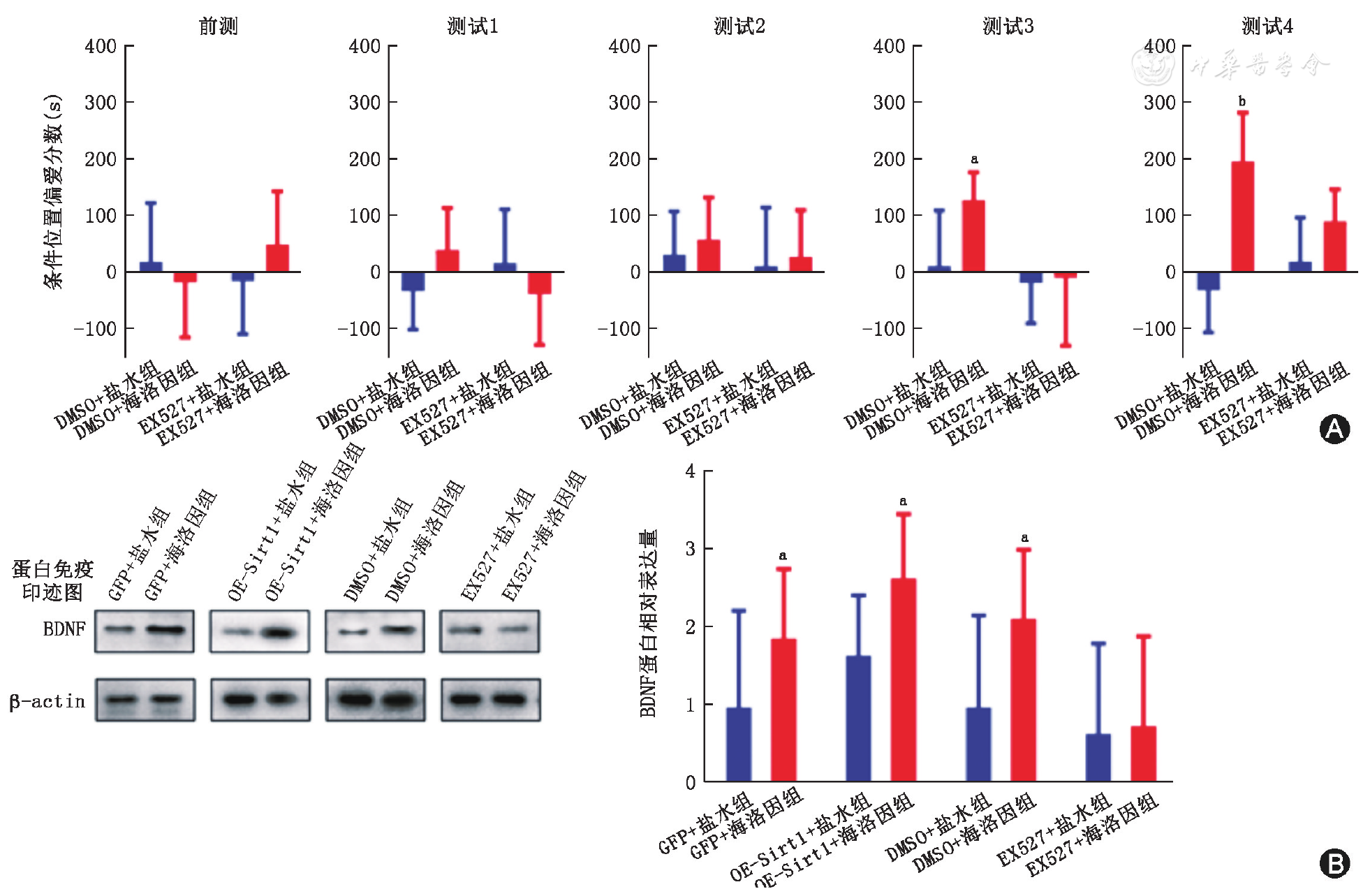
A:EX527组和DMSO对照组大鼠海洛因条件位置偏爱评分;B:测试后大鼠杏仁核内BDNF蛋白相对表达水平;EX527:Sirt1特异抑制剂;DMSO:对照溶剂二甲基亚砜;GFP:绿色荧光蛋白对照病毒;OE-Sirt1:Sirt1过表达慢病毒;BDNF:脑源性神经营养因子;OE-Sirt1+海洛因组、OE-Sirt1+盐水组、GFP+海洛因组、GFP+盐水组均n=6;与各自对应盐水组相比,aP<0.05,bP<0.01
如
海洛因成瘾是一种复杂性慢性脑疾病,长期滥用海洛因可引起大脑内部持久的神经环路功能异常、突触可塑性改变及信号转导通路变化。本研究结果显示,大鼠慢性注射海洛因7 d后杏仁核内Sirt1 mRNA表达上调、Sirt2 mRNA表达下调,而Sirt3~Sirt7无改变。大鼠接触海洛因后,Sirt1的表达上调主要发生在6 h至3 d内,于24 h到达高峰。这表明海洛因对杏仁核神经元内Sirt1的表达调控具有时间特异性。同时对慢性海洛因模型大鼠杏仁核内乙酰化组蛋白的分析表明,Sirt1高表达与组蛋白H3K9高乙酰化的时间相一致,表明Sirt1上调与组蛋白H3K9乙酰化程度显著相关。这与既往报道中Sirt1主要催化组蛋白H3K9和H3K14位点的去乙酰化反应相符[10]。我们推测,Sirt1的上调也许改变了杏仁核神经元内染色体结构和下游重要基因启动子区的转录活性。
本研究对慢性海洛因诱导的杏仁核内Sirt1上调的上游机制进行了初步探索。ΔFosB为Fos转录因子家族之一,可与激活子蛋白1(AP1)形成复合体共同结合于目的基因启动子区,调控基因转录活性[11]。研究表明,ΔFosB一旦表达便具有高度稳定性,可在腹侧被盖区内稳定存在数周之久,在药物成瘾中具有重要作用[12]。本研究发现,慢性海洛因大鼠Sirt1启动子区结合的ΔFosB显著高于盐水对照组,表明ΔFosB通过结合于Sirt1启动子区促进Sirt1转录,很可能是海洛因诱导的杏仁核内Sirt1表达的上游调控关键分子;同时,慢性海洛因大鼠Sirt1启动子区未与AP1结合的ΔFosB水平与盐水对照组无差异,表明ΔFosB对Sirt1转录调控具有高度特异性。
本研究分别使用了Sirt1过表达慢病毒和特异性抑制剂EX527,对杏仁核内Sirt1活性进行上调/下调,并观察了其对海洛因成瘾行为的影响。结果表明过表达杏仁核内Sirt1可显著促进海洛因CPP的形成,而抑制杏仁核内Sirt1活性可显著抑制海洛因所诱导的CPP。这一结果与先前报道的伏隔核内病毒敲减Sirt1可抑制可卡因成瘾行为相一致[9]。目前的理论认为,反复暴露于成瘾性药物可与用药环境相结合,使大脑神经环路产生适应性改变,继而形成稳固的成瘾记忆和觅药行为[13]。
有证据表明,Sirt1是成瘾药物如可卡因所诱导的突出可塑性改变的关键调控分子。伏隔核内过表达Sirt1可以诱导伏隔核神经元突触棘显著增多,而敲除Sirt1则导致海马神经元突触间隙变宽、密度降低[9]。我们随后检测了各组大鼠杏仁核内BDNF的表达。结果显示,BDNF的表达水平与Sirt1的表达改变存在显著关联。根据既往研究及我们的结果,可以推测海洛因可能通过上调杏仁核内ΔFosB调控Sirt1表达,继而改变神经元染色质组蛋白乙酰化水平,影响BDNF等下游基因表达,从而引起海洛因成瘾行为变化。本研究对杏仁核内Sirt1参与调控海洛因成瘾提供了实验证据。然而应当注意,本研究尚未能深入解释Sirt1的下游调控机制,Sirt1对神经可塑性的具体调控机制还需进一步研究。

