伴儿茶酚胺心肌病的嗜铬细胞瘤/副神经节瘤的围手术期处理经验
2018年5期
中华泌尿外科杂志,第39卷第5期 第333页-第337页
樊华,李汉忠,纪志刚,张学斌,张玉石
儿茶酚胺心肌病是超生理剂量的儿茶酚胺释放入血后引起心肌收缩功能下降,从而导致心脏结构与功能异常的一类特殊心肌病[1,2]。超生理剂量的儿茶酚胺可由来源于交感或副交感神经系统的嗜铬细胞瘤/副神经节瘤(pheochromocytoma/paraganglioma,PHEO/PGL)分泌[3]。儿茶酚胺心肌病是PHEO/PGL引起的一类严重并发症,如诊断、治疗不及时或误诊,可能导致患者死亡。本研究回顾性分析2008年1月至2018年3月我院收治的15例经手术治疗的PHEO/PGL伴儿茶酚胺心肌病患者的临床资料,总结此类患者的临床表现、儿茶酚胺心肌病诊治方法,以及手术前后心功能变化情况。
本组15例,男8例,女7例。年龄13~64岁,平均32.8岁。左侧PHEO 4例,右侧PHEO 4例,双侧PHEO 3例(其中VHL病2例),颈静脉体PGL 1例,左腹膜后PGL 2例,右腹膜后PGL 1例。肿瘤直径2.3~7.2 cm。增强CT检查示腹膜后肾上腺区或肾上腺外大小不一、明显不均匀强化的肿物,内部可见缺血坏死区,部分瘤体血运极为丰富,可见肿瘤周边呈蔓状分布的不规则血管网(
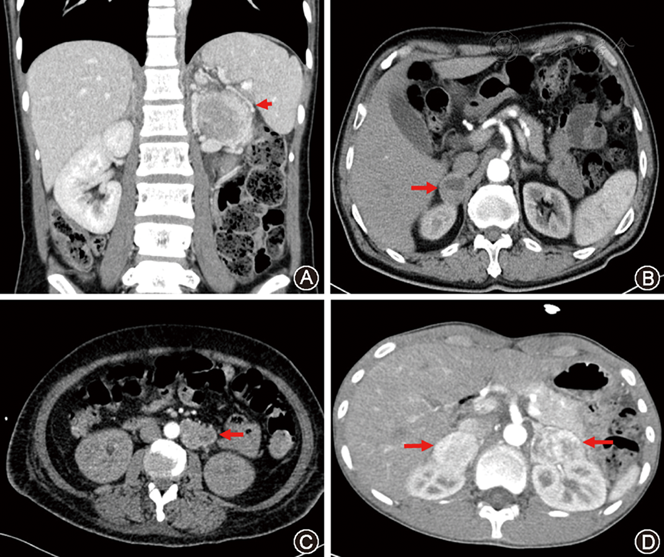
14例术前PHEO/PGL定性定位诊断明确,有头痛、心悸、大汗等典型PHEO/PGL临床表现。24 h尿儿茶酚胺检查:肾上腺素1.75~268.75μg/24 h,平均24.87 μg/24 h(正常值1.74~6.42 μg/24 h);去甲肾上腺素(norepinephrine,NE)21.09~1 177.27 μg/24 h,平均551.70 μg/24 h(正常值16.69~40.65 μg/24 h);多巴胺72.58~1 121.05 μg/24 h,平均395.41 μg/24 h(正常值120.93~330.59 μg/24 h)。7例奥曲肽检查及131I-间碘苄胍(131I-metaiodobenzylguanidine,131I-MIBG)显像均阳性,6例奥曲肽检查阳性,1例131I-MIBG显像阳性。超声心动图检查示儿茶酚胺心肌病发作时左室射血分数(left ventricular ejection fraction,LVEF)为(42.0±7.1)%(32%~54%),其中轻度异常(LVEF 45%~54%)5例,中度异常(LVEF 30%~44%)9例;左心室肥厚,左室后壁厚度(posterior wall thickness,PWT)为6~17 mm;伴心肌回声增强、左心扩大、心肌运动减弱等儿茶酚胺心肌病表现。9例严重心功能不全患者伴急性左心衰,表现为肺水肿、咳大量粉红色泡沫痰。此14例予规律α受体阻滞剂(酚苄明5~10 mg,每8小时1次)、β受体阻滞剂(酒石酸美托洛尔12.5~25.0 mg,1~2次/日)及钙离子拮抗剂(硝苯地平10~30 mg,1次/日)治疗1~3个月。怀疑肺部感染者加用敏感抗生素,并予强心、利尿等治疗,待血压、心率平稳,外周循环增加,体重增加,并行超声心动图评估心功能显著改善后手术。
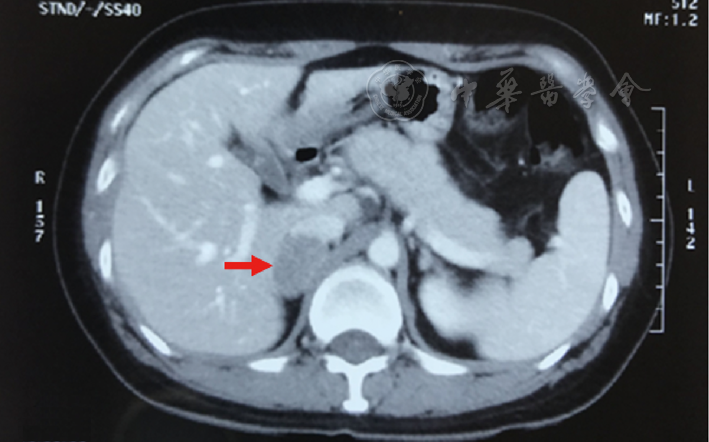
1例为隐匿型PHEO,女,36岁,术前6个月诊断为病毒性心肌炎,既往无发作性高血压、心悸、大汗等临床表现。影像学检查无特殊改变,术前增强CT检查动脉期未见肿瘤明显强化(
本组15例,行腹腔镜手术13例,其中1例中转开放手术;开放手术2例(均为PGL患者)。
采用SPSS 22.0统计学软件处理数据,正态分布的定量资料采用
本组15例手术均完整切除肿瘤。14例术前确诊病例,药物治疗后PWT为6~15 mm,LVEF为(55.9±7.6)%(44%~72%),与药物治疗前比较差异有统计学意义(P=0.041);术后PWT为6~12 mm,LVEF为(66.1±8.5)%(42%~75%),与药物治疗后比较差异有统计学意义(P=0.013)。
1例隐匿型PHEO患者术中触碰瘤体时出现血压剧烈波动,血压190/130~80/50 mmHg(1 mmHg=0.133 kPa),心率150次/分,术后于ICU病房出现儿茶酚胺心肌病表现,超声心动图检查示LVEF为37%(中度异常),PWT为6 mm,左心扩大且心肌普遍收缩不良;纤维支气管镜检查示双肺粉红色泡沫痰;胸部X线片检查示双侧肺水肿、左侧为著。确诊为儿茶酚胺心肌病。经治疗后心功能恢复,复查超声心动图示LVEF为50%,PWT为7 mm。
本组15例术后病理诊断为PHEO或PGL。术后随访1个月~10年,15例均存活,无肿瘤复发。
PHEO/PGL是起源于胚胎神经嵴副神经节细胞的神经内分泌肿瘤,位于肾上腺的称为PHEO,位于肾上腺外的称为PGL。PHEO/PGL多沿主动脉旁交感神经链分布,瘤体形态规则、有包膜、切面实性、多见出血及囊性变[4]。PHEO/PGL可分泌儿茶酚胺,多以NE为主,高儿茶酚胺血症可引起高血压、心悸、大汗等临床症状。儿茶酚胺心肌病是PHEO/PGL的严重并发症,甚至可导致死亡,但临床上常被忽视或误诊,因此识别并准确诊断儿茶酚胺心肌病是十分必要的[1]。
儿茶酚胺可通过钙超载、氧化应激、诱导凋亡、促纤维化和激活肾素-血管紧张素-醛固酮系统等作用产生直接的心肌损害[2],还可以通过增加心肌耗氧量、诱导冠状动脉痉挛和内皮损伤导致微循环功能障碍,造成心肌缺血,加重心肌损伤。儿茶酚胺心肌病的实际发生率可能高于普遍认知,根据尸检研究报道,50%~60%死于PHEO的患者有心肌炎表现,典型表现为局灶变性、心肌细胞收缩带坏死、炎性细胞浸润,后期以纤维化更为突出[5]。Meune等[6]也发现部分PHEO/PGL患者虽然超声心动图检查结果正常,但亚临床左心室收缩功能异常却普遍存在,并与术中出现循环衰竭的风险有相关性。儿茶酚胺心肌病常见的心脏结构与功能异常为对称性左心室肥大和左心收缩功能下降,严重时引起急性左心衰,还可表现为扩张型[7]、肥厚梗阻型[8]、心室肥大、Tako-tsubo型[9]、反Tako-tsubo型、弥漫性或与冠状动脉分布不一致的节段性室壁运动障碍等[10]。本组15例的LVEF均<55%,其中轻度异常5例,中度异常10例,9例伴粉红色泡沫痰等急性左心衰表现。但此类左心功能障碍多为可逆性,积极药物治疗后左心功能可部分恢复,本组患者儿茶酚胺心肌病时、药物治疗后的LVEF分别为(42.0±7.1)%、(55.9±7.6)%,差异有统计学意义,术后LVEF进一步改善为(66.1±8.5)%,与药物治疗后比较差异有统计学意义,提示心脏功能可逐步恢复。Paur等[11]认为高儿茶酚胺激活心肌β2肾上腺素受体后,细胞内信号传导通路中Gs转换为Gi,导致该部位心肌产生负性肌力作用。而术后心功能恢复的原因可能主要是β2AR-Gi对心肌具有保护和抗凋亡作用[12]。
10%~20%的VHL病患者有PHEO/PGL,VHL病是发生在实质及神经嵴起源器官的高度血管化的肿瘤,如PHEO、肾细胞癌、附睾囊肿、胰岛细胞肿瘤、内淋巴管肿瘤以及中枢神经系统血管母细胞瘤[13]。本组中2例经基因检测确诊的VHL病,均为双侧PHEO,均行后腹腔镜手术先切除一侧肿瘤,再改变体位切除对侧肿瘤,疗效满意。
隐匿型PHEO患者无典型的内分泌功能异常表现,影像学检查也不提示肿瘤有丰富血运,故多未行术前药物准备,但术中易于麻醉诱导阶段或触碰瘤体时出现PHEO危象。气管插管本身和麻醉诱导时使用的阿片类镇静药、多巴胺受体拮抗剂类止吐药和增加交感张力的肌松药、拟交感胺类血管活性物质可诱发儿茶酚胺大量释放[14]。本组1例隐匿型PHEO患者,回顾病史,其既往诊断的病毒性心肌炎可能即为儿茶酚胺心肌病,因误诊导致术中术后出现PHEO危象,提示对于任何可疑PHEO/PGL患者均需完善内分泌及核医学检查,并行积极药物准备后再行手术治疗,尽可能避免严重儿茶酚胺心肌病发生。
儿茶酚胺心肌病的严重程度与内分泌检查无相关性。既往研究报道了15例PHEO患者,6例表现为左心室肥大,但血浆NE或肾上腺素水平均与左心室结构的测量值无相关性[15]。本组15例中,24 h尿儿茶酚胺水平升高与LVEF下降也无明显相关性,提示儿茶酚胺心肌病的易感因素仍需进一步研究。
综上所述,儿茶酚胺心肌病是PHEO/PGL的严重并发症。PHEO/PGL伴儿茶酚胺心肌病患者如诊断明确,需行充分药物准备,发生心功能异常时需积极对症治疗,心功能异常可在肿瘤切除后有效改善。隐匿型PHEO围手术期风险大,对于疑似隐匿型PHEO患者需积极药物准备后再行手术治疗。
[1] 丁莉,方理刚,朱文玲.嗜铬细胞瘤的心血管表现[J].中国心血管杂志,2013,18:136-138.
[2] Otusanya O, Goraya H, Lyer P,et al. A vicious cycle of acute catecholamine cardiomyopathy and circulatory collapse secondary to pheochromocytoma[J].Oxf Med Case Reports,2015,10:343-345.
[3] Richard C. Stress-related cardiomyopathies[J].Ann Intensive Care,2011,1: 39.
[4] 文进,李汉忠,纪志刚,等.3D腹腔镜手术治疗肾上腺嗜铬细胞瘤/副神经节瘤的临床研究[J].中华泌尿外科杂志,2015,36: 511-513.
[5] Miura M, Kawano H, Yoshida T,et al. The histological features of a myocardial biopsy specimen in a patient in the acute phase of reversible catecholamine-induced cardiomyopathy due to pheochromocytoma[J].Intern Med,2017,56:665-671.
[6] Meune C, Bertherat J, Dousset B,et al. Reduced myocardial contractility assessed by tissue Doppler echocardiography is associated with increased risk during adrenal surgery of patients with increased risk during adrenal surgery of patients with pheochromocytoma:report of a preliminary study[J].J Am Soc Echocardiogr,2006,19:1466-1470.
[7] Park M, Hryniewicz K, Setaro JF. Pheochromocytoma presenting with myocardial infarction,cardiomyopathy,renal failure,pulmonary hemorrhage,and cyclic hypotension: case report and review of unusual presentations of pheochromocytoma[J]. J Clin Hypertens (Greenwich), 2009,11:74-80.
[8] Jategaonkar SR, Butz T, Burchert W,et al. Echocardiac features simulating hypertrophic obstructive cardiomyopathy in a patient with pheochromocytoma[J]. Clin Res Cardiol,2009,98:195-198.
[9] Tanriver Y, Betz MJ, Nibbe L,et al. Sepsis and cardiomyopathy as rare clinical manifestations of pheochromocytoma-two case report studies[J]. Exp Clin Endocrinol Diabetes,2010,118:747-753.
[10] 连鹏鹄,丁莉,张学斌,等.嗜铬细胞瘤伴严重儿茶酚胺心肌病5例围手术期治疗[J].北京大学学报(医学版),2013,45:605-608.
[11] Paur H, Wright PT, Sikkel MB,et al. High levels of circulating epinephrine trigger apical cardiodepression in a beta2-adrenoceptor/Gi-dependent manner:a new model of takot-subo cardiomyopathy[J]. Circulation,2012,126:697-706.
[12] Tong H, Bernstein D, Murphy E,et al. The rols of beta-adrenergic receptor singaling in cardioprotection[J].FASEB J,2005,19:983-995.
[13] 邓建华,李汉忠. 嗜铬细胞瘤/副神经节瘤遗传基因研究进展[J].中华医学杂志,2015,95:1193-1195.
[14] Mannelli M, Dralle H, Lenders JW. Perioperative management of pheochromocytoma/paraganglioma: is there a state of the art? [J].Horm Metab Res,2012,44:373-378.
[15] Galetta F, Franzoni F, Bernini G,et al. Cardiovascular complications in patients with pheochromocytoma: a mini-review [J].Biomed Pharmacother, 2010,64:505-509.