SCN2A基因突变导致的癫痫表型特点
2018年7期
中华泌尿外科杂志,第56卷第7期 第518页-第523页
曾琦,张月华,杨小玲,张静,刘爱杰,刘晓燕,姜玉武,吴希如
癫痫是常见的神经系统疾病之一。世界卫生组织的调查数据显示,世界范围内的癫痫患病率为0.4%~0.7%[1],且癫痫在儿童中的发病率高于成人。癫痫的病因包括:遗传性、结构性、代谢性、免疫性、感染性和原因不明性[2]。目前认为半数以上的儿童癫痫为遗传性病因导致[1,3]。国外研究发现,编码钠离子通道的SCN2A基因突变导致的癫痫表型谱较广,不但可表现为良性预后的癫痫,还可表现为癫痫性脑病,遗传方式为常染色体显性遗传[4,5,6]。本研究对北京大学第一医院儿科收集的SCN2A基因突变的癫痫患儿的表型特点及基因突变特点进行总结。
本研究为回顾性病例总结。收集2006年9月至2017年10月在北京大学第一医院儿科神经专业门诊及病房诊治的癫痫患儿,且基因检测发现SCN2A突变者,对每例入选的患儿及其家系成员建立详细的临床资料登记表(内容包括姓名、性别、出生日期、民族、发病年龄、发作表现、围产期情况、既往史、智力及运动发育情况、家族史、用药史及辅助检查结果),通过门诊复诊及电话随访患儿的病情发展,包括临床表现、视频脑电图(VEEG)、头颅磁共振成像(MRI)、治疗及预后情况,回顾性分析随访资料齐全患儿的临床特点。每例患儿由监护人签署知情同意书,收集患儿及其家系成员的临床资料和外周血DNA。该研究已通过北京大学第一医院伦理委员会的批准,编号:2012[453]。
SCN2A基因突变检测采用Miller改良盐析法提取外周血白细胞基因组DNA。采用靶向捕获二代测序癫痫基因检测包筛查患儿的基因突变,对发现SCN2A基因突变的患儿,采用一代测序的方法验证患儿及其家系成员相关突变位点。
抗癫痫药物的疗效分为4种:控制(至少3个月无发作)、减少(发作次数减少≥25%)、无效(发作次数减少<25%)和加重,用药后控制或发作次数减少为有效,药物尝试到最大有效量发作无明显减少为无效。
癫痫患儿临床特征中各表型发病率为计数资料,用例(%)表示。
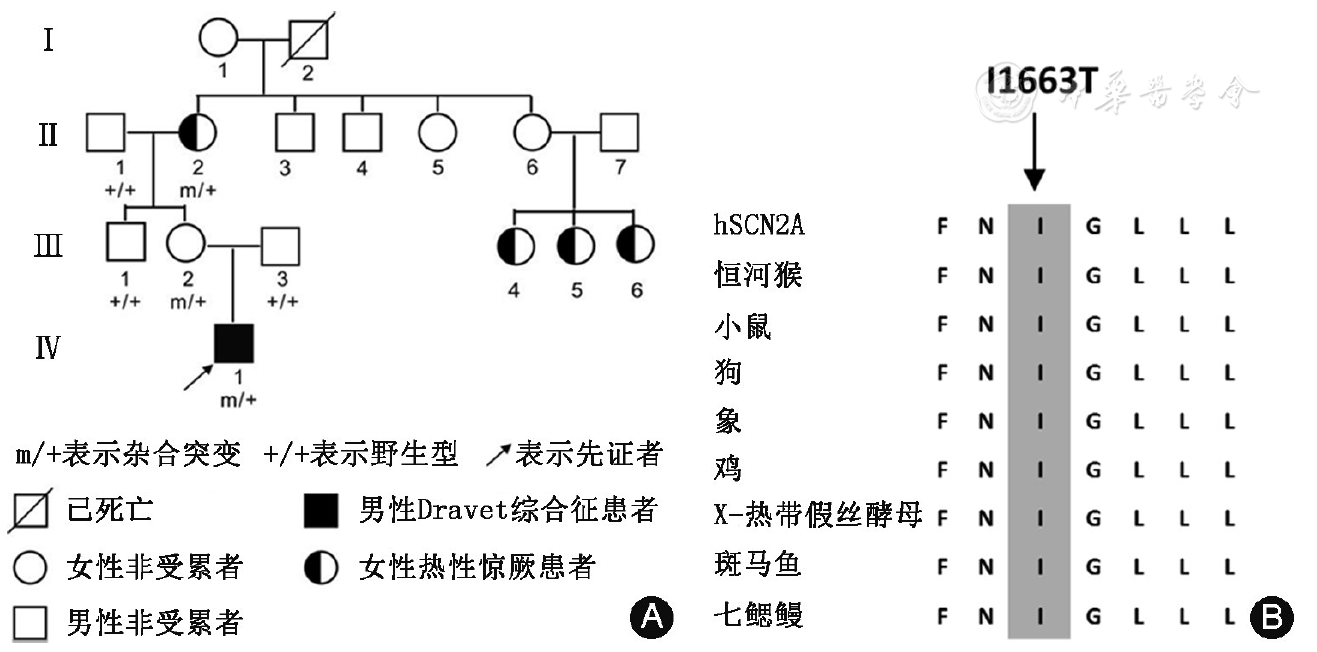
共收集到21例SCN2A基因突变癫痫患儿,其中男16例、女5例。共检测到21种不同类型的SCN2A基因杂合突变(Genbank序列号为NM_001040142.1),其中错义突变17种,框内缺失突变2种,移码突变1种,无义突变1种。3种为已报道的致病突变,其余18种为新发现的突变。18种新发现的突变在100例正常对照中均未发现。21例患儿中,10例携带遗传性突变,其余11例为新生突变(
21例患儿的癫痫起病年龄为2日龄~2岁6月龄,其中新生儿期起病6例(29%),1~3月龄起病6例(29%),4~6月龄起病3例,7月龄~1岁起病2例,1岁后起病4例。21例患儿病程中表现为多种发作类型,其中18例有局灶性发作(86%),6例有痉挛发作(29%),3例有强直痉挛发作,2例有全面强直-阵挛发作,2例有强直发作,2例有肌阵挛发作,1例有失张力发作(
10例携带SCN2A基因遗传性突变的患儿均有癫痫或热性惊厥家族史,其中9例先证者及其家系受累者智力、运动发育均正常,其余1例(例10)伴智力、运动发育落后。11例携带SCN2A基因新生突变的患儿均有不同程度智力、运动发育落后,其中例19在癫痫发作前已有落后,2岁3月龄首次出现癫痫发作。例20在癫痫发作前已有孤独症样表现,2岁6月龄首次出现癫痫发作。
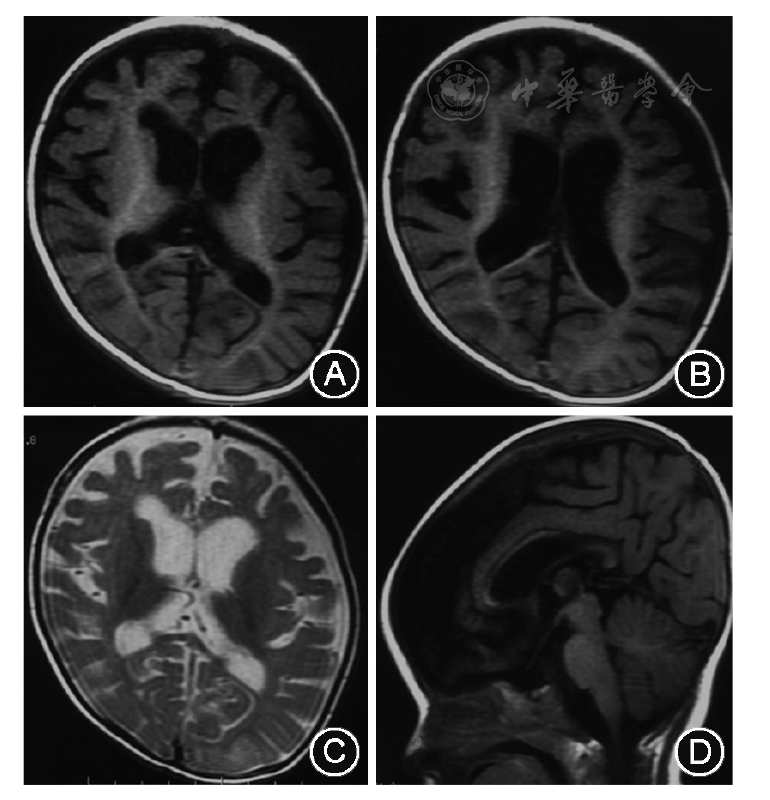
21例患儿发作缓解前至少进行过1次VEEG检查。脑电图背景活动慢4例,其余17例患儿脑电图背景正常;13例发作间期脑电图监测到异常放电,其中8例有局灶性或多灶性放电(放电可位于一侧或双侧的额、颞、中央和后头部),3例有爆发-抑制,3例有高峰失律,5例有广泛性痫样放电(其中3例放电表现为棘波、多棘波或棘慢波,另2例为尖波和尖慢波);10例监测到临床发作,其中肌阵挛发作2例,痉挛发作5例,局灶性发作7例,强直发作1例。8例患儿VEEG正常。21例患儿均行头颅MRI检查,1例左侧侧脑室扩大;1例双内囊后肢T1WI高信号;1例双侧侧脑室扩大,胼胝体发育不良,脑沟增深(例21,
21例SCN2A基因突变的患儿具有多种癫痫表型,其中良性家族性新生儿-婴儿癫痫(benign familial neonatal-infantile epilepsy, BFNIE)3例(14%);良性家族性婴儿癫痫(benign familial infantile epilepsy, BFIE)5例(24%);热性惊厥附加症1例,见于遗传性癫痫伴热性惊厥附加症家系(generalized epilepsies with febrile seizures plus, GEFS+),其他3例家系受累者的表型为热性惊厥,家系中所有受累者智力、运动发育均正常;大田原综合征3例(14%);婴儿痉挛症3例(14%);Dravet综合征1例;不能分类的早发癫痫性脑病2例;儿童期起病的癫痫性脑病1例(于2岁起病,在癫痫起病后开始出现发育落后);发育落后共患癫痫1例;孤独症共患癫痫1例,见
本组21例患儿末次随访年龄为8月龄~10岁,其中14例(67%)在4月龄~4岁3月龄发作缓解,7例仍未缓解(末次随访年龄为8月龄~3岁6月龄)。14例已缓解的患儿中,2例未用药自行缓解;6例口服单药治疗缓解,其中丙戊酸4例,奥卡西平和苯巴比妥各1例;6例发作缓解时联合口服2~3种抗癫痫药物,其中2例联合丙戊酸和左乙拉西坦,1例联合丙戊酸和托吡酯,1例联合左乙拉西坦和托吡酯,1例联合氨己烯酸和托吡酯,1例联合丙戊酸、左乙拉西坦和托吡酯。7例发作尚未缓解的患儿均尝试至少3种抗癫痫药物进行治疗。
有患儿曾使用钠离子通道阻滞剂奥卡西平、苯妥英钠或拉莫三嗪。7例使用奥卡西平,其中5例有效,1例无效,1例加重;3例使用苯妥英钠,其中1例有效,2例无效;2例使用拉莫三嗪,其中1例无效,1例加重。除钠离子通道阻滞剂外,至少有5例患儿使用过的抗癫痫药物有丙戊酸、左乙拉西坦和托吡酯。16例使用丙戊酸,其中10例有效,6例无效。8例使用左乙拉西坦,其中4例有效,4例无效。12例使用托吡酯,其中6例有效,6例无效。有3例有痉挛发作的患儿曾使用促肾上腺皮质激素(ACTH),其中1例痉挛发作减少,2例无效。1例患儿曾尝试生酮饮食治疗无效。
SCN2A基因位于染色体2q24.3,包含26个外显子,编码2 005个氨基酸。SCN2A基因编码电压门控钠离子通道α2亚基(Nav1.2)。Nav1.2主要分布在兴奋性神经元轴突起始段、未髓鞘化轴突部位,在大脑中分布广泛,且在皮质、海马、纹状体、中脑中呈高表达[7,8,9]。SCN2A基因与神经系统的发育相关,该基因突变不仅可以导致癫痫发作,还可导致发育落后、孤独症、精神分裂症以及周期性共济失调等[6,10,11,12],以常染色体显性方式遗传。近年来有关SCN2A基因突变的文献报道逐渐增多,已报道多种SCN2A基因突变类型,包括错义突变、框内碱基缺失或插入突变、无义突变、移码突变、剪切位点突变,其中错义突变最常见[6]。本组21例患儿携带的SCN2A基因突变均不相同,分布在整个基因上,无热点突变,其中约80%为错义突变,其他少见的突变类型有框内碱基缺失或插入突变、无义突变和移码突变。
SCN2A基因突变导致的癫痫表型谱广,2001年Sugawara等[13]首次在日本GEFS+家系发现了SCN2A基因错义突变R187W,携带该突变的先证者同时具有热性惊厥和局灶性癫痫。2002年文献报道,SCN2A基因是BFNIE的致病基因[4]。2009年文献报道,SCN2A基因也是Dravet综合征的致病基因[14]。随后研究发现SCN2A基因是多种癫痫综合征的致病基因,包括预后较好癫痫如良性家族性新生儿癫痫(BFNE)、BFIE[15,16]以及发育性癫痫性脑病如大田原综合征、婴儿癫痫伴游走性局灶性发作、婴儿痉挛症、Doose综合征、Lennox-Gastaut综合征和不能分类的早发癫痫性脑病等[6,17,18,19,20,21]。2017年,Wolff等[6]对欧美6个国家的74个临床或研究中心参与并收集的66个SCN2A基因突变家系或散发病例的表型进行了研究,发现较常见的表型为良性(家族性)新生儿和(或)婴儿癫痫(13%)、大田原综合征(11%)、不能分类的早发癫痫性脑病(21%)、婴儿痉挛症(13%)、婴儿期或儿童期起病的癫痫性脑病(22%),其他较少见的表型有婴儿癫痫伴游走性局灶性发作、Doose综合征、Lennox-Gastaut综合征以及不伴癫痫的发育落后和孤独症。本组较多见的为BFNIE(14%)、BFIE(24%)、大田原综合征(14%)和婴儿痉挛症(14%),其他少见的表型有GEFS+、不能分类的早发癫痫性脑病、Dravet综合征、儿童期起病的癫痫性脑病、孤独症或发育落后共患癫痫,与Wolff等[6]的报道不完全一致,可能与单中心研究有关。
SCN2A基因突变可为遗传性突变或新生突变。文献报道,遗传性突变常见于BFNE、BFNIE、BFIE和GEFS+家系,大多预后良好[13, 15];而新生突变多见于癫痫性脑病散发患者,预后不良[6, 17,18,19,20,21]。本组中10例遗传性突变患儿中仅1例伴智力、运动发育落后,其余9例诊断为BFNIE、BFIE或热性惊厥附加症,智力、运动发育正常,而11例携带新生突变患儿均伴发育落后,与文献报道一致。相同SCN2A基因突变导致的表型轻重程度可有差异[6]。本组例10诊断为Dravet综合征,其母表型为热性惊厥,其外祖母无抽搐史,说明SCN2A基因突变导致的表型在同一家系内部也可存在差异,并可出现外显率不全。
SCN2A基因突变导致的癫痫患儿中,新生儿期起病者约占一半[6]。本组21例SCN2A基因突变的患儿中,3月龄前起病的患儿占一半以上,说明SCN2A基因突变导致的癫痫起病年龄早,主要在新生儿期或婴儿早期起病。文献报道,SCN2A基因突变相关癫痫可表现为多种发作类型[6, 17, 21]。本组患儿发作类型有局灶性发作、痉挛发作、强直痉挛发作、全面强直-阵挛发作、强直发作、肌阵挛发作和失张力发作,其中局灶性发作和痉挛发作分别见于86%和29%的患儿,其他发作类型相对少见。SCN2A基因突变导致的癫痫可呈丛集性发作,但在婴儿期起病的良性癫痫更常见,而在癫痫性脑病患者相对少见[6, 18];本组91%的患儿发作呈丛集性,其中包括大部分伴智力、运动发育落后患儿,说明SCN2A基因突变相关癫痫的发作有丛集性特点。文献报道,少数SCN2A基因突变癫痫患儿可出现癫痫持续状态和热性惊厥[6];本组患儿无癫痫持续状态,仅3例出现过发热诱发的发作,说明SCN2A基因突变导致的癫痫发作较少出现热敏感。
文献报道,SCN2A基因突变的婴儿期起病的良性癫痫患者脑电图大多正常,少数发作间期可出现多灶性棘波或睡眠期癫痫性电持续状态样放电[6, 15];本组8例BFNIE和BFIE患儿的VEEG均正常,其余患儿脑电图均监测到异常放电,包括爆发-抑制、高峰失律、局灶性、多灶性或广泛性痫样放电,未发现睡眠期癫痫性电持续状态样放电。SCN2A基因突变导致的大田原综合征、婴儿痉挛症和早发癫痫性脑病患儿可伴大脑萎缩、小脑萎缩、胼胝体发育不良及髓鞘化不良等[22,23];本组患儿MRI检查仅3例存在异常,其中1例双侧侧脑室扩大,胼胝体发育不良,脑沟增深。
本组患儿67%在4月龄~4岁3月龄发作缓解,仍有7例未缓解,其中未缓解者末次随访年龄最大者为3岁6月龄。在癫痫发作已缓解的患儿中,有2例表型为BFIE的患儿未用药自行缓解,说明SCN2A基因突变导致的良性癫痫可为自限性。有研究对不同发育时期的小鼠海马神经元的海马CA1区Nav1.2表达量进行检测发现,Nav1.2于5~15日龄在神经元的轴突起始段区域高表达,之后逐渐被SCN8A基因编码的电压门控钠离子通道α8亚基取代,推测这可能是SCN2A基因突变导致婴儿良性癫痫且随着年龄增长癫痫发作可自行缓解的原因[24]。本组口服单药缓解患儿的表型为BFNIE、BFIE或热性惊厥附加症,预后较好,而7例发作尚未缓解患儿的表型为大田原综合征、婴儿痉挛症、早发癫痫性脑病或Dravet综合征,均尝试至少3种抗癫痫药物进行治疗,说明SCN2A基因突变导致的癫痫性脑病多呈难治性。钠离子通道阻滞剂如奥卡西平、卡马西平、苯妥英钠、拉莫三嗪等能使SCN2A基因突变导致的癫痫发作缓解或减少,但部分无效,少数还可使发作加重[6];本组7例患儿使用奥卡西平5例有效,说明SCN2A基因突变导致的癫痫可能对奥卡西平反应好。仅少数患儿使用过苯妥英钠和拉莫三嗪,各有1例患儿在使用奥卡西平和拉莫三嗪后出现了发作加重,因此,SCN2A基因突变癫痫患者使用钠离子通道阻滞剂后应注意观察发作情况,一旦出现发作加重应该尽早停药。本组除钠离子通道阻滞剂外,临床使用较多的抗癫痫药物有丙戊酸、左乙拉西坦和托吡酯,其中丙戊酸的有效率最高,且无患儿用药后出现发作加重。文献报道1例SCN2A基因突变导致的难治性痉挛发作癫痫患儿,使用改良阿特金斯饮食后单用丙戊酸维持1年无发作[25]。本研究中仅1例SCN2A基因突变患儿曾尝试过生酮饮食,发作无明显减少。文献报道,7例SCN2A基因突变癫痫患儿使用了ACTH进行治疗,其中3例痉挛发作控制,2例发作减少,2例无效[6];本组3例有痉挛发作的患儿曾用ACTH治疗,其中1例痉挛发作减少,2例无效。
SCN2A基因突变包括新生突变和遗传性突变,该基因导致的癫痫多在新生儿期或婴儿早期起病,发作类型以局灶性发作和痉挛发作为主,癫痫表型谱广,既可以表现为良性预后的癫痫,也可表现为癫痫性脑病。
[1] Pal DK,Pong AW,Chung WK. Genetic evaluation and counseling for epilepsy[J]. Nat Rev Neurol, 2010,6(8):445-453.
[2] Scheffer IE,Berkovic S,Capovilla G, et al. ILAE classification of the epilepsies: Position paper of the ILAE Commission for Classification and Terminology[J]. Epilepsia, 2017,58(4):512-521.
[3] Scheffer IE. Genetic testing in epilepsy: what should you be doing?[J]. Epilepsy Curr, 2011,11(4):107-111.
[4] Heron SE,Crossland KM,Andermann E, et al. Sodium-channel defects in benign familial neonatal-infantile seizures[J]. Lancet, 2002,360(9336):851-852.
[5] Baumer FM,Peters JM,EI Achkar CM, et al. SCN2A-Related Early-Onset Epileptic Encephalopathy Responsive to Phenobarbital[J]. J Pediatr Epilepsy, 2016,5(1):42-46.
[6] Wolff M,Johannesen KM,UBS H, et al. Genetic and phenotypic heterogeneity suggest therapeutic implications in SCN2A-related disorders[J]. Brain, 2017,140(5):1316-1336.
[7] Whitaker WR,Faull RL,Waldvogel HJ, et al. Comparative distribution of voltage-gated sodium channel proteins in human brain[J]. Brain Res Mol Brain Res, 2001,88(1-2):37-53.
[8] Westenbroek RE,Merrick DK,Catterall WA. Differential subcellular localization of the RI and RII Na+ channel subtypes in central neurons[J]. Neuron, 1989,3(6):695-704.
[9] Oliva M,Berkovic SF,Petrou S. Sodium channels and the neurobiology of epilepsy[J]. Epilepsia, 2012,53(11):1849-1859.
[10] Carroll LS,Woolf R,Ibrahim Y, et al. Mutation screening of SCN2A in schizophrenia and identification of a novel loss-of-function mutation[J]. Psychiatr Genet, 2016,26(2):60-65.
[11] Li J,Cai T,Jiang Y, et al. Genes with de novo mutations are shared by four neuropsychiatric disorders discovered from NPdenovo database[J]. Mol Psychiatry, 2016,21(2):290-297.
[12] Schwarz N,Hahn A,Bast T, et al. Mutations in the sodium channel gene SCN2A cause neonatal epilepsy with late-onset episodic ataxia[J]. J Neurol, 2016,263(2):334-343.
[13] Sugawara T,Tsurubuchi Y,Agarwala KL, et al. A missense mutation of the Na+ channel alpha II subunit gene Na(v)1.2 in a patient with febrile and afebrile seizures causes channel dysfunction[J]. Proc Natl Acad Sci U S A, 2001,98(11):6384-6389.
[14] Shi X,Yasumoto S,Nakagawa E, et al. Missense mutation of the sodium channel gene SCN2A causes Dravet syndrome[J]. Brain Dev, 2009,31(10):758-762.
[15] Zara F,Specchio N,Striano P, et al. Genetic testing in benign familial epilepsies of the first year of life: clinical and diagnostic significance[J]. Epilepsia, 2013,54(3):425-436.
[16] Grinton BE,Heron SE,Pelekanos JT, et al. Familial neonatal seizures in 36 families: Clinical and genetic features correlate with outcome[J]. Epilepsia, 2015,56(7):1071-1080.
[17] Zerem A,Lev D,Blumkin L, et al. Paternal germline mosaicism of a SCN2A mutation results in Ohtahara syndrome in half siblings[J]. Eur J Paediatr Neurol, 2014,18(5):567-571.
[18] Howell KB,McMahon JM,Carvill GL, et al. SCN2A encephalopathy: A major cause of epilepsy of infancy with migrating focal seizures[J]. Neurology, 2015,85(11):958-966.
[19] Allen AS,Berkovic SF,Cossette P, et al. De novo mutations in epileptic encephalopathies[J]. Nature, 2013,501(7466):217-221.
[20] Samanta D,Ramakrishnaiah R. De novo R853Q mutation of SCN2A gene and West syndrome[J]. Acta Neurol Belg, 2015,115(4):773-776.
[21] Shi X,Yasumoto S,Kurahashi H, et al. Clinical spectrum of SCN2A mutations[J]. Brain Dev, 2012,34(7):541-545.
[22] Syrbe S,Zhorov BS,Bertsche A, et al. Phenotypic Variability from Benign Infantile Epilepsy to Ohtahara Syndrome Associated with a Novel Mutation inSCN2A[J]. Mol Syndromol, 2016,7(4):182-188.
[23] Nakamura K,Kato M,Osaka H, et al. Clinical spectrum of SCN2A mutations expanding to Ohtahara syndrome[J]. Neurology, 2013,81(11):992-998.
[24] Liao Y,Deprez L,Maljevic S, et al. Molecular correlates of age-dependent seizures in an inherited neonatal-infantile epilepsy[J]. Brain, 2010,133(
[25] Wong VC,Fung CW,Kwong AK. SCN2A mutation in a Chinese boy with infantile spasm-response to Modified Atkins Diet[J]. Brain Dev, 2015,37(7):729-732.