周期性发热-阿弗他口炎-咽炎-淋巴结炎11例临床表型及基因特点分析
2018年7期
中华泌尿外科杂志,第56卷第7期 第524页-第528页
杨芝,何庭艳,赵晓东,杨军
自身炎症性疾病(AIDs)是一种罕见的原发性免疫缺陷病,由固有免疫基因缺陷导致固有免疫失调及促炎症因子过度释放所致,一般不伴特异性抗原、致敏T淋巴细胞和高滴度自身抗体产生[1]。周期性发热-阿弗他口炎-咽炎-淋巴结炎(PFAPA)是儿童期最常见的AIDs,主要表现为周期性发热、阿弗他口炎、咽炎、淋巴结炎,具体发病机制尚不明确,可能与感染、固有免疫失调及遗传背景相关。PFAPA多于幼年期发病,成年期后缓解,有一定的自限性,预后良好。国内缺乏大样本系统性PFAPA的相关报道,现对深圳市儿童医院收治的11例PFAPA患儿的临床特征、实验室检查、基因突变特点、治疗及预后进行回顾性分析,以提高临床医师对该病的认识。
2015年6月至2017年5月深圳市儿童医院诊断的11例PFAPA患儿,符合PFAPA诊断标准并排除感染性疾病、自身免疫性疾病、恶性肿瘤性疾病、其他遗传性或明确病因的周期性发热相关疾病(HPF)。健康对照组来源于我院15名体检的健康儿童。所有研究对象的监护人或代理监护人签署知情同意书。本研究已获深圳市儿童医院伦理委员会批准(2013-07-24函;2016-021函)。
采集患儿发热期、发热间歇期、健康对照组儿童乙二胺四乙酸(EDTA)抗凝外周血1 ml以行血浆细胞因子检测,患儿及父母EDTA抗凝外周血1 ml分离淋巴细胞用于基因测序。
回顾性收集并分析11例PFAPA患儿的临床资料,包括年龄、性别、临床特征、辅助检查[白细胞计数(WBC)、C反应蛋白(CRP)、血浆淀粉样蛋白(SAA)、降钙素原、骨髓涂片等]、治疗及预后。比较患儿发热期、发热间歇期外周血炎症指标(WBC、CRP、SAA)。
收集数据完整的6例患儿发热期、发热间歇期及15名健康对照组儿童外周静脉血1 ml,参照Milliplex HCYTOMAG-60K试剂盒说明书操作步骤,检测外周血血浆中白细胞介素(IL)1β、IL-6、IL-17、肿瘤坏死因子α (TNF-α)、γ干扰素(IFN-γ)、粒细胞集落刺激因子(G-CSF)水平。4 ℃冰箱中取出试剂盒,平衡至室温,取出样本,微珠稀释液定容,准备标准品、质控品及血清基质,预洗96孔板,加样,避光室温震荡2 h后,洗板2次,每孔加入25 μl检测抗体。继续孵育1 h后,每孔加入25 μl链霉亲和素藻红蛋白孵育30 min,洗板2次,每孔加入150 μl鞘液,室温避光震荡5 min后,上机检测、数据导出及分析。患儿发热期细胞因子分别与发热间歇期、健康对照组儿童比较。
PFAPA患儿及其父母外周血分离的淋巴细胞送第三方检验机构(北京迈基诺基因检测公司)行免疫基因组外显子检测(包含MEFV、NLRP3、TNFRSF1A、MVK等基因),并结合患儿临床特征、突变预测、突变位点正常人频率、突变类型等,采用Sanger测序方法验证所有患儿及父母相关的基因变异位点。
应用SPSS 17.0统计学软件进行数据处理,符合正态分布的计量资料以
11例PFAPA患儿中男7例,女4例,有阳性家族史者1例(其父有反复发热伴MEFV基因纯合突变),均无近亲婚配史。11例患儿精神运动发育均正常。
11例PFAPA患儿中位起病年龄24(3~60)月龄,中位诊断年龄69(11~151)月龄,中位发热时长4(1~8)d,发热间歇期1~8周。11例患儿均有周期性发热,发热时均有咽炎或扁桃体炎(明显扁桃体肿大3例),淋巴结炎7例,口腔溃疡5例,畏寒1例,寒战1例,腹痛4例,腹泻1例,关节痛4例,头痛3例,头晕2例,皮疹1例。患儿一般临床资料见
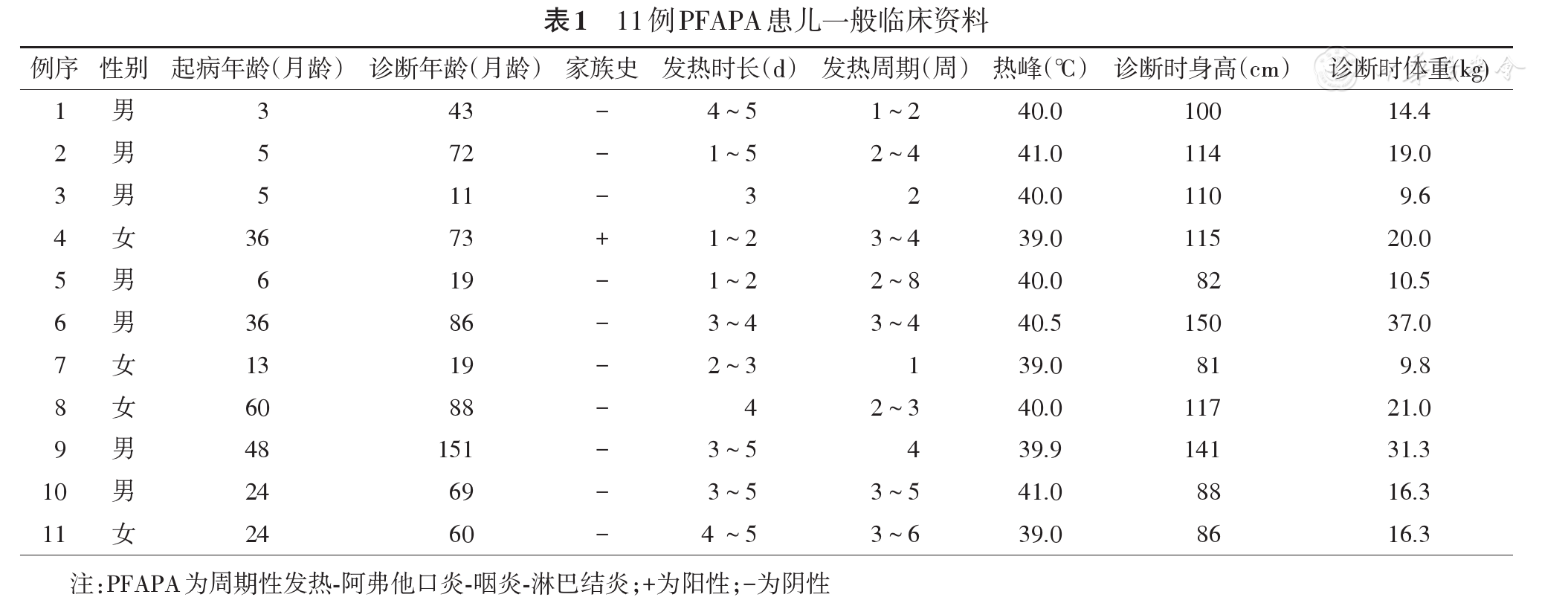
11例PFAPA患儿体液免疫及淋巴细胞免疫分析未见明显异常,发热时降钙素原正常(0.08±0.05) μg/L。发热期与间歇期比较,WBC[(14.7±4.1)×109/L比(8.4±1.9)×109/L,t=4.645,P<0.01],CRP[(24.2±21.1)比(3.3±2.1)mg/L,t=3.286,P=0.040],SAA[(136.4±47.7)比(7.1±1.1)mg/L,t=7.172,P<0.01],差异均有统计学意义。所有患儿EB病毒、结核、血培养等相关病原学检查均为阴性,胸部CT或胸X线片检查及骨髓细胞学检查未见异常。
PFAPA患儿发热期IL-6、IFN-γ、G-CSF高于健康对照组,差异有统计学意义(P均>0.05);IL-1β、IL-17、TNF-α组间差异无统计学意义(P均>0.05),见
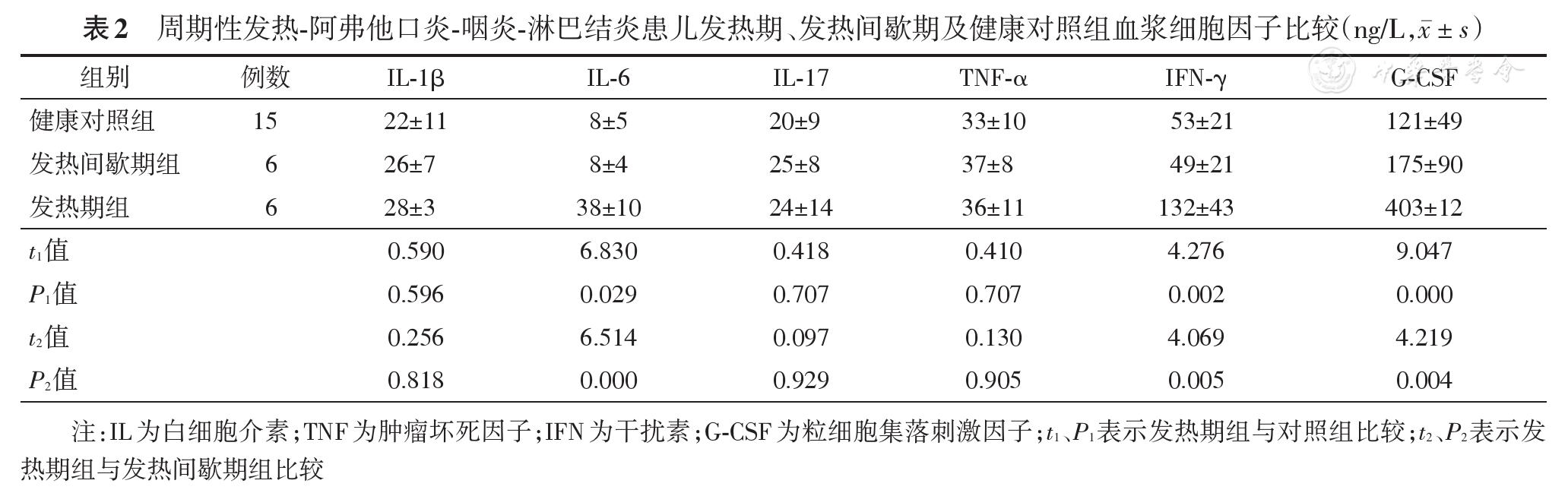
PFAPA患儿发热期IL-6、IFN-γ、G-CSF高于间歇期,差异有统计学意义(P均<0.05);IL-1β、IL-17、TNF-α组间差异均无统计学意义(P均>0.05),见
11例PFAPA患儿中,8例发现MEFV基因杂合变异,其中6例为exon2 c.442G>C杂合错义变异,1例同时有exon2 c.442G>C和exon2 c.329T>C两个位点杂合错义变异,1例为exon2 c.605G>A杂合错义变异。11例患儿中均未发现NLRP3、TNFRSF1A、MVK等基因杂合或纯合变异。
所有PFAPA患儿在疑诊AIDs之前均无重症感染病史,多次因"发热"于普通门诊就诊,易诊断为反复呼吸道感染,反复予抗菌药治疗。疑诊或确诊PFAPA后于免疫专科门诊随访,发热时均慎用抗菌药,其中6例患儿发热时单次或2次小剂量泼尼松[0.5 mg/(kg·次)]口服后可快速缓解发热等临床症状;1例患儿更换居住环境后发热间歇期延长;1例患儿口服匹多莫德后发热间歇期延长;1例患儿发热时均伴有明显扁桃体肿大,既往反复抗菌药治疗,诊断PFAPA后在未使用抗菌药情况下,发热症状亦可自行缓解,4个月前扁桃体及腺样体切除术,至今未再发热;1例患儿年满12岁后未再出现周期性发热,期间未予特殊治疗;1例患儿外院就诊后失访。
PFAPA首次报道于1987年,挪威报道发病率0.23%[2],女性发病率略高于男性,无种族特异性,我国暂无相关数据统计。其主要症状有周期性发热伴阿弗他口炎、咽炎、淋巴结炎,偶伴皮疹、关节痛、恶心、呕吐、腹痛、寒战、肌肉疼痛、头痛等。
PFAPA发病机制复杂,基因及遗传背景不清。AIDs相关基因例如MEFV、NLRP3、TNFRSF1A、MVK等基因杂合变异可能与其高度相关。MEFV、NLRP3、TNFRSF1A、MVK被认为是家族性地中海热(FMF)、Cryopyrin相关性周期热综合征(CAPS)、肿瘤坏死因子相关周期热综合征(TRAPS)、高IgD综合征(HIDS)的致病基因,部分PFAPA患儿检测出上述基因的杂合变异[3]。亚洲人群最常见的是MEFV基因变异,11例患儿中8例存在MEFV基因杂合变异。MEFV是FMF的致病基因,PFAPA患儿存在较高频率的MEFV基因杂合突变。有专家认为,MEFV基因突变是一种增功能变异,可能存在基因剂量效应[4],MEFV纯合突变导致FMF,MEFV杂合突变表现为PFAPA,这也可以解释PFAPA和FMF临床表型的诸多相似之处。部分MEFV携带者并无周期性发热,调查发现挪威正常人群约20%有MEFV基因变异,PFAPA发病率仅为0.23%,MEFV基因与PFAPA的相关性有待进一步研究。
目前认为PFAPA主要与固有免疫失调,导致炎症因子及趋化因子过度释放有关。既往文献报道炎症因子如IL-6、IFN-γ、G-CSF在发热期会增高[5,6],本组数据测定与文献报道基本一致。既往文献报道IL-1β在发热期多增高[6,7],本数据显示IL-1β在疾病急性期无增高,可能与例数少和采血时间未在急性期高峰有关。虽然PFAPA非感染因素直接导致,但其发病也可能与扁桃体微生物有关,本组11例患儿发热时均伴有咽炎/扁桃体炎,扁桃体微生物可触发患儿体内失调的炎症反应,产生过多的细胞因子及趋化因子,在趋化因子募集作用下,大量的淋巴细胞和中性粒细胞从外周血募集至扁桃体,引起扁桃体炎症[8,9]。
PFAPA诊断标准为:(1)周期性发热,起病年龄<5岁;(2)发热时伴有口腔溃疡、咽炎或淋巴结炎;(3)排除周期性中性粒细胞缺乏症;(4)发热间歇期无不适;(5)精神、运动、生长发育正常[10]。PFAPA鉴别诊断主要包括:(1)感染性疾病包括反复呼吸道感染、EB病毒感染等,但PFAPA病原学检测阴性,发热期降钙素原正常,抗感染治疗无效;(2)周期性中性粒细胞缺乏症:PFAPA无粒细胞缺乏;(3)自身免疫性疾病如幼年特发性关节炎(全身型)、系统性红斑狼疮等:PFAPA发热间歇期炎症指标正常,自身抗体阴性,多系统损害不明显;(4)恶性肿瘤性疾病如白血病、淋巴瘤等:PFAPA发热间歇期无不适,监测血常规三系无明显改变,骨髓细胞学、淋巴结活检、胸腹部CT等检查均正常;(5)其他明确病因的HPF:某些单基因HPF早期易误诊为PFAPA。Gaslini评分系统有助于鉴别,高分患儿提示单基因HPF可能性更大。Gaslini评分的临床和流行病学参数包括早期发病、阳性家族史、胸痛、腹痛、腹泻、口腔溃疡等[11,12]。PFAPA与FMF鉴别要点包括:(1)FMF呈短期复发性发热,热程多<3 d,伴有浆膜炎、关节痛、丹毒样红斑等;(2)PFAPA对于单剂量或者双次糖皮质激素治疗的有效率可达90%,而多数FMF对于糖皮质激素治疗反应欠佳,多需长期使用秋水仙碱治疗;(3)PFAPA发热间歇期SAA多正常;(4)FMF多为MEFV基因的纯合突变或复合杂合突变,而PFAPA多为MEFV杂合突变;(5)PFAPA有自限性,而FMF预后不良。大约30%的FMF患者表现为MEFV基因的杂合突变,轻型FMF基本无法与PFAPA鉴别,早期可诊断PFAPA,但需密切随访,警惕脉管炎、炎症性肠病、肾脏淀粉样变等FMF严重并发症。
PFAPA治疗目标主要是控制急性期发作和减轻临床症状。一线治疗药物为糖皮质激素。患儿发热第1天单次给予泼尼松0.5~2.0 mg/kg或者倍他米松0.1~0.2 mg/kg可快速缓解发热,若单次给药无效,可再次给药。Vanoni等[13]在一项纳入301例PFAPA患儿的大样本研究中发现,63%患儿接受单剂量泼尼松1~2 mg/kg后发热快速缓解,32%患儿部分缓解,仅有5%患儿对泼尼松治疗无反应。观察本组8例使用小剂量泼尼松[0.5 mg/(kg·次)],亦能有效缓解症状。PFAPA的二线治疗包括西咪替丁、秋水仙碱[0.5~1.0 mg/(kg·次)]等。对于发热时均伴扁桃体炎,特别是明显扁桃体肿大的患儿,扁桃体切除术是长期缓解手段。中国儿童PFAPA的最主要表现是反复扁桃体炎。Garavello等[14]在一项纳入102例PFAPA的前瞻性研究结果显示,99例患儿(97%)在接受扁桃体切除术或扁桃体-腺样体切除术后发热于1~6个月内缓解,仅2例患儿(2%)仍有周期性发热,另1例(1%)进一步研究纠正诊断为HIDS。有专家认为,扁桃体、腺样体是PFAPA患儿自身炎症反应的主要靶器官,靶器官的摘除可减少自身炎症反应的激活。若患儿对糖皮质激素、西咪替丁、秋水仙碱、扁桃体切除术等治疗无反应,IL-1受体阻滞剂如阿那白滞素也可用于PFAPA,但缺乏大样本临床数据[6]。本组PFAPA患儿常规治疗有效,均未使用IL-1受体阻滞剂。结合我院临床诊治经验,对诊断PFAPA的患儿,可使用小剂量糖皮质激素[0.5 mg/(kg·次)]缓解急性期症状;若患儿伴明显扁桃体肿大,可考虑行扁桃体或扁桃体-腺样体切除术。上述治疗能否改善PFAPA患儿的远期预后尚需大样本多中心的临床数据验证,但急性期缓解症状能有效提高患儿及其家庭的生活质量,减轻家庭经济负担。
[1] Hausmann JS,Dedeoglu F. Autoinflammatory diseases in pediatrics[J]. Dermatol Clin, 2013,31(3):481-494.
[2] Marshall GS,Edwards KM,Butler J, et al. Syndrome of periodic fever, pharyngitis, and aphthous stomatitis[J]. J Pediatr, 1987,110(1):43-46.
[3] Theodoropoulou K,Vanoni F,Hofer M. Periodic fever, aphthous stomatitis, pharyngitis, and cervical adenitis (PFAPA) syndrome: a review of the pathogenesis[J]. Curr Rheumatol Rep, 2016,18(4):18.
[4] Debeljak M,Toplak N,Abazi N, et al. The carrier rate and spectrum of MEFV gene mutations in central and southeastern European populations[J]. Clin Exp Rheumatol, 2015,33(6
[5] Stojanov S,Hoffmann F,Kéry A, et al. Cytokine profile in PFAPA syndrome suggests continuous inflammation and reduced anti-inflammatory response[J]. Eur Cytokine Netw, 2006,17(2):90-97.
[6] Stojanov S,Lapidus S,Chitkara P, et al. Periodic fever, aphthous stomatitis, pharyngitis, and adenitis (PFAPA) is a disorder of innate immunity and Th1 activation responsive to IL-1 blockade[J]. Proc Natl Acad Sci U S A, 2011,108(17):7148-7153.
[7] F?rsvoll J,Kristoffersen EK,Oymar K. Elevated levels of CXCL10 in the periodic fever, aphthous stomatitis, pharyngitis and cervical adenitis syndrome (PFAPA) during and between febrile episodes;an indication of a persistent activation of the innate immune system[J]. Pediatr Rheumatol Online J, 2013,11(1):38.
[8] Cattalini M,Soliani M,Rigante D, et al. Basic characteristics of adults with periodic fever, aphthous stomatitis, pharyngitis, and adenopathy syndrome in comparison with the typical pediatric expression of disease[J]. Mediators Inflamm, 2015,2015:570418.
[9] Tejesvi MV,Uhari M,Tapiainen T, et al. Tonsillar microbiota in children with PFAPA (periodic fever, aphthous stomatitis, pharyngitis, and adenitis) syndrome[J]. Eur J Clin Microbiol Infect Dis, 2016,35(6):963-970.
[10] Thomas KT,Feder HM,Lawton AR, et al. Periodic fever syndrome in children[J]. J Pediatr, 1999,135(1):15-21.
[11] Batu ED,Kara EF,Tsoukas P, et al. Periodic fever, aphthosis, pharyngitis, and adenitis syndrome: analysis of patients from two geographic areas[J]. Arthritis Care Res (Hoboken), 2016,68(12):1859-1865.
[12] Gattorno M,Caorsi R,Meini A, et al. Differentiating PFAPA syndrome from monogenic periodic fevers[J]. Pediatrics, 2009,124(4):e721-728.
[13] Vanoni F,Theodoropoulou K,Hofer M. PFAPA syndrome: a review on treatment and outcome[J]. Pediatr Rheumatol Online J, 2016,14(1):38.
[14] Garavello W,Romagnoli M,Gaini RM. Effectiveness of adenotonsillectomy in PFAPA syndrome: a randomized study[J]. J Pediatr, 2009,155(2):250-253.