儿童伴钙化与囊变的脑白质病四例临床特征及诊断
2018年7期
中华泌尿外科杂志,第56卷第7期 第539页-第544页
金洪,吴沪生,丁昌红,金真,黄昱,周春菊,张炜华,吕俊兰,代丽芳,任晓暾,葛明,方方
伴钙化与囊变的脑白质病(leukoencephalopathy with cerebral calcifications and cysts, LCC)由Labrune等[1]于1996年首次报道,以影像学出现多发颅内钙化、囊变及脑白质病变三联征为主要特点,又称之为Labrune综合征,是一种罕见疾患,文献报道不足100例[2,3],国内学者报道了不足10例成人病例[4,5,6,7],其中仅个别病例于儿童期发病[4]。为提高对本病的认识,现将首都医科大学附属北京儿童医院2012年5月至2017年12月诊治的4例儿童LCC患者的病例资料回顾性总结如下。
例1为早饭后蹲位玩耍半小时后站起时突发一过性左侧肢体无力,10 min后即自行缓解;例2为坠床1 d致左颞部出现头皮血肿伴头痛、头晕及非喷射性呕吐2次;例3为2个月来发作性右手发麻伴活动不利2次;例4为左下肢跛行2个月。
主要表现见
4例患儿行血常规,血生化(包括钙、磷、碱性磷酸酶)、心肌酶、肝肾功能,血氨、血乳酸、同型半胱氨酸检测,结果均阴性;例1~3行血维生素B12、叶酸检测(-);例1、例2行血甲状旁腺素检测(-),血、尿代谢病筛查(-);例3、例4行血甲胎蛋白(AFP)、人绒毛膜促性腺激素(HCG)、癌胚抗原(CEA)、神经元特异性烯醇化酶(NSE)检测(-);例3还行血CD系列、Ig系列(-),抗核抗体、双链DNA(ds-DNA)、抗心磷脂抗体、抗中性粒细胞胞质抗体(ANCA)(-),血抗链"O"、肺炎支原体抗体、TORCH-IgM、EB病毒-DNA、EB抗体四项(-),血涂片未见寄生虫,血曼氏裂头蚴IgG、囊虫IgG(-),脑脊液细胞学分析(-),脑脊液常规、生化、病原学(细菌、病毒、支原体、真菌)检测(-),血及脑脊液免疫抗体检测(-)。
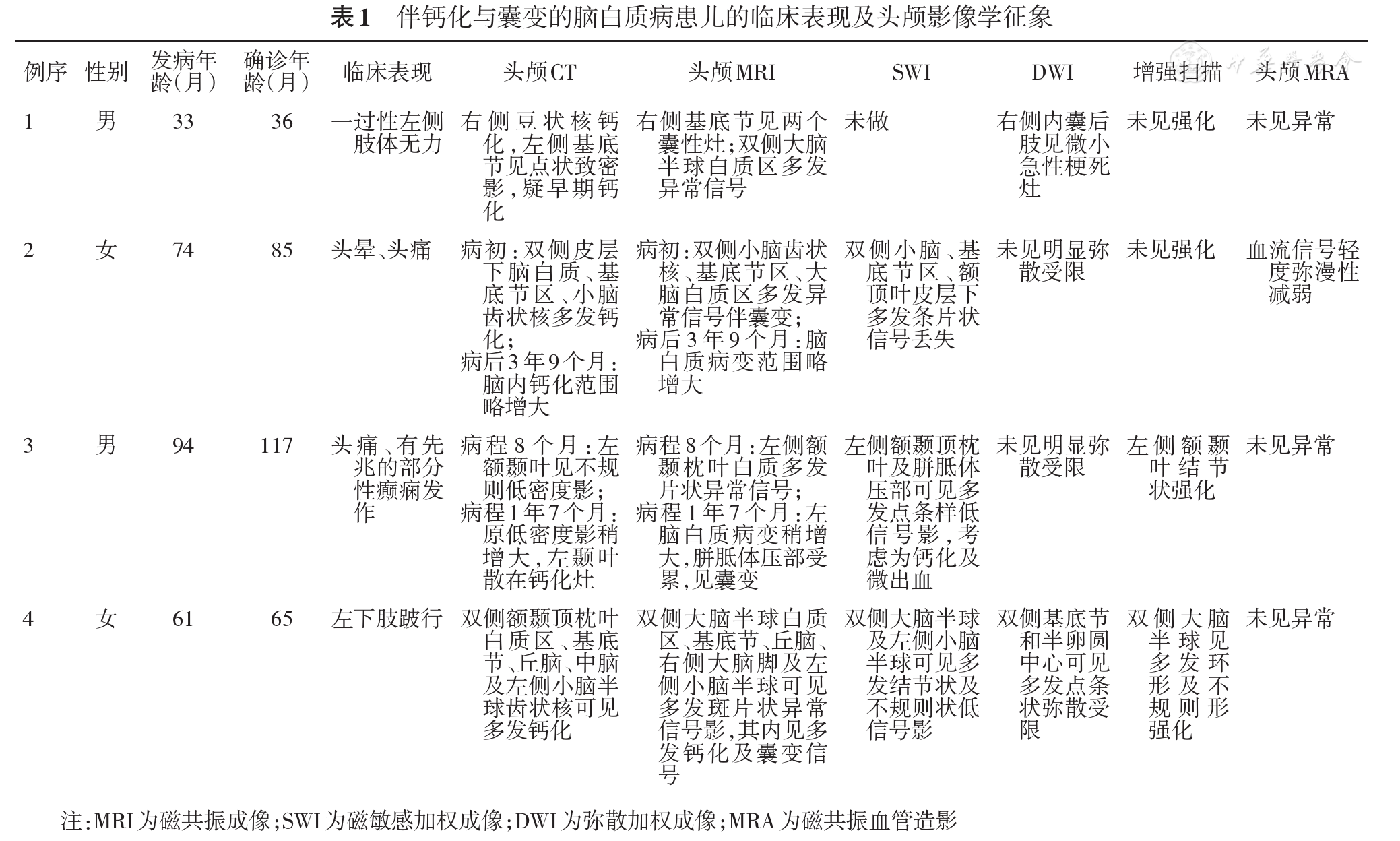
4例患儿均存在颅内多发钙化、囊变及脑白质病变。例1及例2起病当日、例4病程2个月行头颅影像学检查发现患儿已存在上述影像学三联征,例3于病程8个月首次行头颅CT及磁共振成像(MRI)时仅发现脑白质病变,病程1年7个月复查时发现脑内出现多发钙化及囊变(
4例患儿行眼底及心脏彩超检查均正常;3例行脑电图检查,例2、例4正常,例3示背景活动正常,醒睡各期左侧前、中颞区尖波散发。
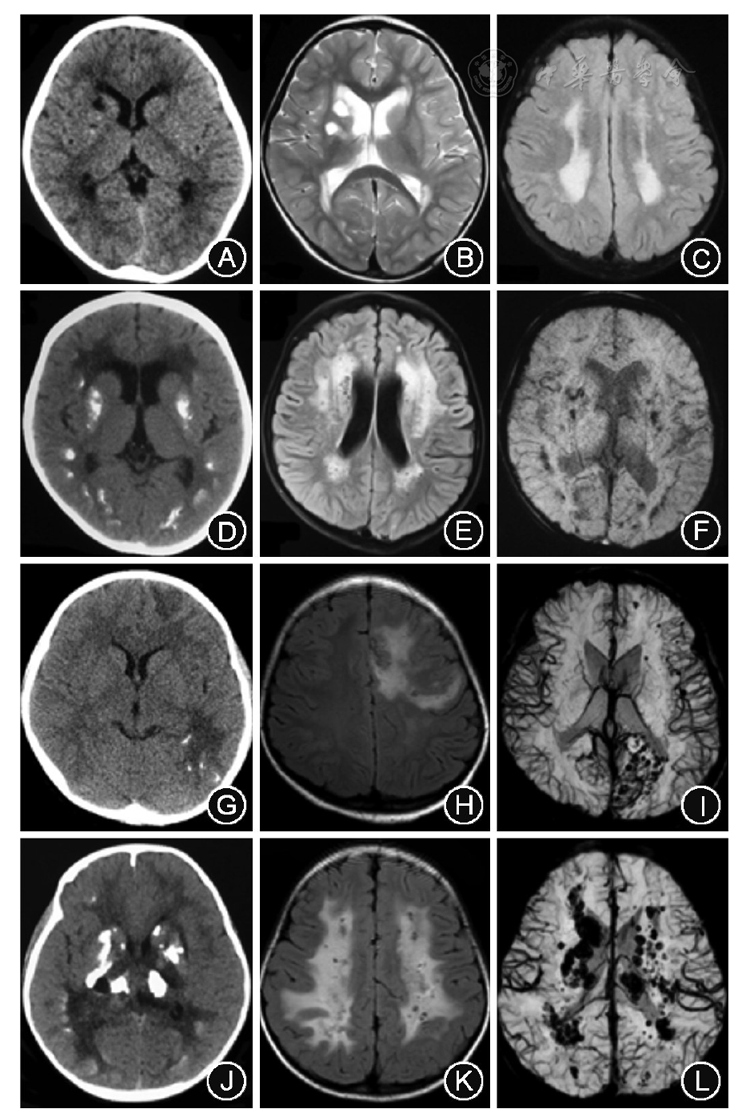
例3在取得家长的知情同意后于病程1年8个月(9岁6月龄)时在全身麻醉下行左颞叶脑组织活检,病理示皮层神经元减少,局部白质结构疏松,见多灶性淋巴细胞浸润、新鲜出血及胶质细胞增生;部分血管呈血管瘤样改变,管壁增厚、玻璃样变性、钙化,局灶管腔狭窄或闭塞;未见明确肿瘤性病变(
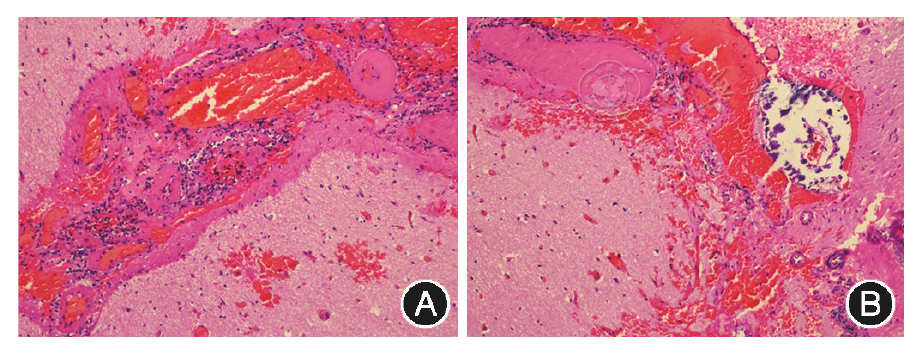
例1、2、4在获得家属知情同意后,采集患儿及父母外周血各2 ml行基因检测。例1、2提取基因组DNA,针对CTC1基因编码区及内含子与外显子交界区设计引物,应用PCR-Sanger测序法进行CTC1基因检测,均未发现明确致病变异。例4提取基因组DNA后,应用目标基因捕获二代测序技术(委托北京迈基诺医学检验所)进行医学全外显子检测,测序结果运用BWA软件与人类基因组hg19参考序列进行比对、过滤,并参照人类基因组变异数据库(HGMD)及变异位点致病性预测软件(SIFT、Polyphen2、CADD、Mutation Taster)筛选变异位点;采用Sanger测序法确定变异来源。结果发现该患儿SNORD118基因存在n.*10G>A及n.82A>G两个复合杂合变异。其中n.*10G>A来自父亲,是未见文献报道的新变异,有文献报道n.*10G>T是LCC的致病变异[8],本例在相同位置的碱基变化为G>A,结合该位点在不同物种具有保守性,CADD_PHRED分值13.89,考虑为致病性变异;n.82A>G来自母亲,为文献已报道的致病变异,可以导致LCC(
箭头为变异位点
例1曾口服银杏叶提取物片1个月,病后5年9个月电话随访,患儿未再出现神经系统症状,现上小学三年级,成绩中等。例2初诊后曾口服艾地苯醌半年,仅于感冒时有轻微头晕,2~4次/年,病后5年3个月时偶因大哭致头胀痛2次,不伴呕吐,再次予艾地苯醌口服至今,近半年余未再出现神经系统症状,现正常上学,成绩优秀。例3仅予左乙拉西坦及奥卡西平口服抗癫痫治疗,病程2年4个月随访,仍有癫痫发作,程度略减轻,未再出现头痛,复查头颅MRI示左额颞顶枕叶及胼胝体压部多发病灶的范围较前略有减小。例4除康复训练外未行特殊治疗,初诊后4个月(病程半年)随访,跛行已减轻。
LCC是神经系统的罕见疾病,文献报道发病年龄自1月龄至70岁不等,无明显性别差异,临床症状与颅内病变的部位和程度有关,主要包括肌张力障碍、肢体瘫痪、癫痫发作、共济失调和认知障碍等,脑内有大囊变者可出现视乳头水肿等颅高压征象[1,2,3,4,5,6,7, 9,10,11,12,13]。本组4例男女各半,起病年龄2岁9月龄~7岁10月龄,例1以一过性左侧肢体无力起病,但考虑这与其头颅MRI提示的右侧内囊后肢微小急性梗死有关,而其颅内钙化、囊变及脑白质病变是偶然间发现的既有病变,很可能并非本次症状的直接原因;例2的头颅影像学三联征亦为在坠床当日行头颅CT和MRI时偶然发现,此前并无任何神经系统症状,提示了其起病的隐匿性;例3为亚急性起病;例4起病相对较慢。经随访5年9个月,例1一直未再出现临床症状;例2仅于上呼吸道感染时有轻微头晕,大哭后头痛2次,近半年已无明显神经系统症状,表明LCC患儿可以有较长时间的临床稳定期;例3于病程2年4个月时随访,除曾偶有头痛外,主要表现以右手发麻及活动不利为先兆的部分性癫痫发作,与其头颅影像学显示病灶主要集中在左脑相符;例4主要表现左下肢跛行,初诊后4个月(病程半年)随访跛行暂减轻。本组患儿眼底检查均正常,无颅压高征象,亦无认知障碍,临床表现相对较轻,考虑与患儿的病程尚短、颅内病变尚未发展到一定程度有关。
颅内钙化、囊变及脑白质病变三联征为LCC头颅影像学的突出特点[1,2,3, 9]。钙化分布多不对称,少数可相对对称,常见于基底节、丘脑、皮层下白质,亦可见于小脑齿状核、脑干、脑室旁白质及囊壁等部位,形态往往不规则。囊变可见于脑实质的任何部位,以幕上居多;大小不等,可随病程延长而缓慢或迅速增大增多,少数亦可缩小;囊壁可有完整或不完整的环形增强,其内可有附壁结节(有病理证实为血肿合并机化[4])或出血信号。脑白质异常主要见于脑室周围及深部白质,皮层下白质亦可受累,可以对称,亦可非对称,甚至可仅限于单侧脑区[2]。SWI可见脑内有多发微出血和钙化[2, 5];正电子发射断层成像(PET)和单光子发射计算机断层扫描(SPECT)可显示病变脑组织呈低灌注与低代谢[2];脊髓一般不受累[3]。本组4例患儿均具有上述影像学三联征:例1和例3的钙化较局限,其余2例则分布较广,其中例2的钙化分布左右基本对称;4例患儿的囊变均在幕上;例1、2、4的脑白质病变相对对称,例3的脑部病变仅局限于左脑,且胼胝体亦有受累,这在LCC病例中不多见,病变是否会波及右脑还有待长期随访;例3左侧额颞叶病灶内见数个结节状强化,例4部分囊壁见环形强化,均符合LCC特点。另外,例2头颅磁共振血管造影(MRA)显示血流信号轻度弥漫性减弱,符合LCC病变脑组织低灌注的特点;例2~4的SWI均可见脑内多发条片状、点条状或结节状低信号,提示存在微出血及钙化,均支持本病是一种脑微血管病。由本组病例还可以看出,LCC的临床症状可明显轻于其影像学表现。特别值得注意的是,例3在病程早期行头颅CT及MRI时均未见明确脑内钙化及囊变,11个月后复查,则发现了左颞叶散在钙化灶及左额颞叶多发囊变,故临床上对以颅内感染、脱髓鞘脑病、脑肿瘤、代谢性脑病、脑白质营养不良等一般疾患难以解释的脑白质病变,应长期随访观察有无钙化及囊变等新发病灶,并加做SWI观察有无微出血,以观察有无LCC等脑微血管病的可能性。
脑组织活检及尸检显示LCC的病理主要包括病变区域脑组织的小血管扩张,部分呈血管瘤样改变,管壁增厚,玻璃样变性,可有钙化;周围脑组织变性,髓鞘苍白样变或脱失,伴胶质增生、Rosenthal纤维形成、营养不良性钙化和含铁血黄素沉积,亦可见新鲜微出血[1,2,3,4,5, 9,11,12]。亦有小血管纤维素样变性伴腔内血栓形成、管腔狭窄等小血管炎样改变的报道[4, 12,13]。尽管LCC的确切发病机制尚不清楚,多数学者根据临床和病理结果推测本病是一种慢性闭塞性脑微血管病,弥漫性血管瘤样发育异常可引起脑组织慢性缺氧,导致脑组织变性、胶质增生、钙盐沉积和脑实质囊变[1,2, 4, 12]。囊性病灶的形成很可能归因于脑血管及脑组织局限性变性坏死所致的渗透性液体的逐渐积聚;而小血管破裂、血脑屏障破坏导致的出血很可能也参与了囊变的形成并可促使其迅速膨大,这就很好地解释了囊性病灶周围的环状强化[1, 4]。而LCC影像学上显示的脑白质病变则很可能是小血管破裂引起的血管源性水肿和缺氧缺血造成的髓鞘苍白样变性和脱髓鞘共同作用的结果[4, 11]。本组例3脑组织活检病理显示皮层神经元减少,局部白质结构疏松,见多灶性新鲜出血及胶质细胞增生;部分血管呈血管瘤样增生,管壁增厚、玻璃样变性、钙化,局灶管腔狭窄或闭塞,均符合LCC的病理表现,其未见典型的Rosenthal纤维形成,考虑与患儿病程尚短可能有关。
LCC的临床表现缺乏特异性,病理资料又难以早期获得,且为有创检查,不宜作为确诊的必需条件,故影像学三联征就成了诊断本病的主要依据,但还要做鉴别诊断。首先是Coats plus综合征或称伴钙化与囊变的脑视网膜微血管病(CRMCC),它们与LCC的影像学及病理表现极相似,很难鉴别,二者实际上是由CTC1基因变异导致的同一种病,除均具有与LCC同样的影像学三联征外,还有视网膜毛细血管扩张和渗出、出生前后发育迟缓、皮肤牛奶咖啡斑、毛发稀疏、指甲营养不良、骨质疏松、肝硬化、胃肠出血、骨髓抑制等多系统表现[14,15],而LCC仅有神经系统受累,无CTC1基因变异,故是不同于Coats plus和CRMCC的独立疾病[16]。囊虫等寄生虫或巨细胞病毒(CMV)等病毒感染时亦可出现脑钙化、囊变及脑白质病,患者的暴露史、病情、影像学演变过程、血与脑脊液寄生虫或病毒抗体检测可资鉴别[9,17]。Aicardi-Goutières综合征(AGS)常表现颅内钙化伴脑白质病变,部分病例亦可有脑内囊性灶,但AGS患者往往还有智力、运动发育落后、小头畸形、脑萎缩等表现,且TREX1等7种致病基因检测往往阳性,可资鉴别[18]。某些星形细胞瘤亦可出现上述影像学三联征,但其磁共振波谱(MRS)一般显示cho峰增高,与LCC脑白质病变区cho峰多降低不同[9]。另外,线粒体脑肌病、Cockayne综合征等亦可表现脑白质病变合并颅内钙化,但它们多无囊变,且结合各自的其他临床特点及基因检测结果,比较容易鉴别。
LCC病因未明,既往文献报道的病例大多为临床影像学诊断,部分有病理诊断。2016年,Jenkinson等[8]总结33个家系共计40例LCC患者的遗传学资料,发现SNORD118基因变异是LCC的致病原因,指出LCC是一种呈常染色体隐性遗传方式的核糖体病。Iwama等[19]也通过对7个LCC家系的研究证实了这一观点。小核仁RNAs(snoRNAs)是一类位于细胞核内的中等长度的非编码RNA,主要包含box H/ACA和box C/D snoRNAs两个家族,能与蛋白结合形成小核仁核糖核蛋白(snoRNPs)复合物。位于染色体17p13.1的SNORD118基因编码box C/D snoRNA U8,这是核糖体RNA生物发生、修饰和加工的必需组分。SNORD118基因变异可影响U8的表达、结构稳定,并破坏box C/D与LSm (like-Sm)蛋白的结合位点,从而引起下游调控功能异常,导致LCC。虽其确切的发病机制还有待进一步研究,但基因诊断已成为LCC确诊的有效手段。本组例4检出了SNORD118基因的复合杂合变异,分别遗传自其杂合子的父母,符合常染色体隐性遗传方式,LCC诊断明确;该例发现了一个新发变异n.*10G>A,扩充了LCC的变异基因谱。
多年来,LCC的治疗以对症为主,口服抗癫痫药对本病症状性癫痫的疗效往往欠佳[20];脑内囊变迅速膨大导致的颅高压是本病的手术指征,单纯囊变切除后可能复发,脑室-囊变-腹腔引流术可能效果更好[21]。本组例1、2试验性给予银杏叶提取物片和艾地苯醌治疗,是否有效尚需长期随访及深入研究。Fay等[22]报道了1个用血管内皮生长因子抑制剂贝伐珠单抗治疗1年余的LCC病例,临床表现和头颅MRI所示囊变及脑白质病变均明显好转,为本病的治疗带来了希望,但该药尚无儿科适应证,其疗效与安全性也还有待更多的研究来证实。
[1] Labrune P,Lacroix C,Goutières F, et al. Extensive brain calcifications, leukodystrophy, and formation of parenchymal cysts: a new progressive disorder due to diffuse cerebral microangiopathy[J]. Neurology, 1996, 46(5):1297-1301.
[2] Stephani C,Pfeifenbring S,Mohr A, et al. Late-onset leukoencephalopathy with cerebral calcifications and cysts: case report and review of the literature[J/OL]. BMC Neurol, 2016, 16:19. (
[3] Tamura R,Ohira T,Emoto K, et al. Leukoencephalopathy, cerebral calcifications, and cysts: A clinical case involving a long-term follow-up and literature review[J/OL]. J Neurol Sci, 2017, 373:60-65. (
[4] 刘学军,刘红光,王建红,等.伴钙化与囊变的脑白质病二例临床、影像学表现及相关病理学分析[J].中华神经科杂志,2009, 42(10):664-668.
[5] 钱海蓉,孟宇宏,桂秋萍,等.伴钙化及囊变的脑白质病一例报道并文献复习[J].中华内科杂志,2013, 52(5):403-406.
[6] 巩俪,林华,詹淑琴,等.伴钙化和囊变的脑视网膜微血管病二例[J].中华神经科杂志,2015, 48(3):212-214.
[7] 李永丽.伴钙化与囊变的脑白质病MRI影像学表现[J].中华实用诊断与治疗杂志,2017, 31(9):833-835.
[8] Jenkinson EM,Rodero MP,Kasher PR, et al. Mutations in SNORD118 cause the cerebral microangiopathy leukoencephalopathy with calcifications and cysts[J]. Nat Genet, 2016, 48(10):1185-1192.
[9] Wang M,Zhang M,Wu L, et al. Leukoencephalopathy with cerebral calcification and cysts: cases report and literature review[J/OL]. J Neurol Sci, 2016, 370:173-179. (
[10] Brenner C,Del Negro MC,Borigato EM, et al. Leukoencephalopathy with cerebral calcifications and cysts[J].Neurology, 2006, 66(9):E32.
[11] Kaffenberger T,Valko PO,von Meyenburg J, et al. A case of late onset leukoencephalopathy with cerebral calcifications and cysts in a 59-year-old woman[J]. Eur J Neurol, 2009, 16(2):278-281.
[12] Kleinschmidt-Demasters BK,Cummings TJ,Hulette CM, et al. Adult cases of leukoencephalopathy, cerebral calcifications, and cysts: expanding the spectrum of the disorder[J]. J Neuropathol Exp Neurol, 2009, 68(4):432-439.
[13] Wang Y,Cheng G,Dong C, et al. Adult-onset leukoencephalopathy, brain calcifications and cysts: a case report[J/OL]. J Med Case Rep, 2013, 7:151. (
[14] Anderson BH,Kasher PR,Mayer J, et al. Mutations in CTC1, encoding conserved telomere maintenance component 1, cause Coats plus[J]. Nat Genet, 2012, 44(3):338-342.
[15] Polvi A,Linnankivi T,Kivel? T, et al. Mutations in CTC1, encoding the CTS telomere maintenance complex component 1, cause cerebroretinal microangiopathy with calcifications and cysts[J]. Am J Hum Genet, 2012, 90(3):540-549.
[16] Livingston JH,Mayer J,Jenkinson E, et al. Leukoencephalopathy with calcifications and cysts: a purely neurological disorder distinct from coats plus[J]. Neuropediatrics, 2014, 45(3):175-182.
[17] Rangankar V,Dongre A,Hadgaonkar M, et al. Subcortical cysts in anterior temporal regions: Unusual imaging finding in congenital cytomegalovirus infection[J]. Med J Armed Forces India, 2015, 71
[18] La Piana R,Uggetti C,Roncarolo F, et al. Neuroradiologic patterns and novel imaging findings in Aicardi-Goutières syndrome[J]. Neurology, 2016, 86(1):28-35.
[19] Iwama K,Mizuguchi T,Takanashi JI, et al. Identification of novel SNORD118 mutations in seven patients with leukoencephalopathy with brain calcifications and cysts[J]. Clin Genet, 2017, 92(2):180-187.
[20] Ogles RL,Joshi CL,Miller DC, et al. Leukoencephalopathy, cerebral calcifications, and cysts in two sisters[J]. Pediatr Neurol, 2014, 51(4):576-579.
[21] Berry-Candelario J,Kasper E,Eskandar E, et al. Neurosurgical management of leukoencephalopathy, cerebral calcifications, and cysts: A case report and review of literature[J/OL]. Surg Neurol Int, 2011, 2:160.(
[22] Fay AJ,King AA,Shimony JS, et al. Treatment of Leukoencephalopathy With Calcifications and Cysts With Bevacizumab[J/OL]. Pediatr Neurol, 2017, 71:56-59. (