人参皂苷Rb2通过抑制自噬促进肥胖小鼠白色脂肪棕色化
2020年12月
中华内分泌代谢杂志,第36卷第12期 第1055页-第1061页
杨丽娟,洪逸莲,林怡,顾雪疆
肥胖是机体长期能量摄入超过能量消耗,导致能量以三酰甘油的形式在白色脂肪或其他器官过度堆积的结果,其与糖尿病、高血压、血脂异常等慢性疾病的发生密切相关,对人类健康构成巨大威胁[1]。研究发现,人参皂苷作为人参的主要有效成分之一,具有改善胰岛素抵抗和调节糖脂代谢的作用[2,3,4]。人参皂苷Rb2(ginsenoside Rb2, Rb2)属于人参二醇型皂苷,在改善糖脂代谢中的作用亦多有研究[4,5,6]。本课题组的前期研究发现,Rb2能改善肿瘤坏死因子-α诱导的3T3-L1脂肪细胞的胰岛素抵抗[7];通过促进白色脂肪组织棕色化减轻高脂饮食诱导肥胖小鼠的体重,改善糖耐量异常和胰岛素抵抗[8]。
自噬是细胞内的一种分解代谢过程,应激条件下通过溶酶体降解多余的细胞结构,维持细胞内稳态,在代谢调节中发挥重要作用[9]。然而,尚缺乏Rb2是否调节自噬信号通路,并促进棕色化的研究。本研究通过高脂饮食肥胖小鼠模型和3T3-L1脂肪细胞,观察Rb2干预后自噬信号通路和棕色化表型的变化,探讨Rb2对自噬信号通路的影响及自噬在Rb2促进肥胖小鼠白色脂肪棕色化中的作用,以期进一步探讨Rb2改善肥胖的作用机制。
24只6周龄雄性C57BL/6J小鼠购自上海斯莱克实验动物有限责任公司[许可证号:SCXK(沪)2007-0005],饲养于温州医科大学附属第一医院实验动物中心清洁级动物房,自由摄食与饮水,温度(22±3)℃,湿度50%±5%,每天光照与黑夜时间各为12 h。
Rb2购自上海源叶生物有限公司,10% kcal对照饲料和60% kcal高脂饲料购自江苏美迪森公司,β-actin抗体购自英国Abcam公司,p62、Beclin-1、微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3, LC3)抗体购自美国CST公司,反转录试剂盒购自立陶宛MBI公司,荧光定量PCR试剂盒、荧光定量PCR仪(IQ5)均购自美国BIO-RAD公司。雷帕霉素(rapamycin)购于美国MCE公司。
C57BL/6J雄性小鼠随机分成正常喂养组、正常喂养Rb2干预组、高脂喂养组和高脂喂养Rb2干预组,普通饲料适应2周,正常喂养组予10%kcal对照饲料喂养、高脂喂养组予60% kcal高脂饲料喂食9周,监测体重。造模结束后,正常喂养Rb2干预组和高脂喂养Rb2干预组予40 mg·kg-1·d-1 Rb2腹腔注射,时间为早晨9:00~10:00,连续注射10 d,正常喂养组和高脂喂养组予等量磷酸缓冲盐溶液(PBS)相应处理。
小鼠脊髓脱臼处死,75%的乙醇浸泡3~5 min无菌分离小鼠皮下(腹股沟)和内脏(附睾)白色脂肪组织,DMEM/F12冲洗组织,转移入培养皿中,剪成糊状;移入含消化液离心管中(10 mL PBS+100 μL Hespes缓冲液+20 mg Ⅱ型胶原酶+200 mg牛血清白蛋白),37℃、300转/min摇床晃动30 min,继而2 400转/min离心10 min,液体分3层,弃去上2层,加入DMEM/F12重悬,40 μmol/L滤网过滤细胞悬液,2 400转/min离心10 min,弃上清,加入培养基(DMEM/F12+10% FBS+1%双抗+0.1% Fgf)培养4~6 h,细胞贴壁,可见亮点状脂肪细胞下层灰色细胞,PBS反复洗涤,尽量去除上层成熟脂肪细胞,加入上述培养基培养接触抑制2 d,进行诱导分化。
在37℃,5% CO2,10% FBS细胞培养液条件下,培养至接触抑制2 d后,经鸡尾酒诱导法诱导方案[3-异丁基-1-甲基黄嘌呤(IBMX)、地塞米松、胰岛素]向白色脂肪细胞分化成熟,予以10 μmol/L的Rb2处理2 h。
检测利用Trizol法提取RNA;取2 μg RNA,按Revertra First Strand cDNA Synthesis kit说明书进行反转录,合成cDNA,然后以其为模板加入引物和SYBR,按说明书进行实时荧光定量PCR分析;实验所用引物均由上海生工生物工程股份有限公司合成。
实验动物禁食12 h后,用水合氯醛麻醉处死小鼠,取附睾旁和腹股沟皮下白色脂肪组织、肩胛部棕色脂肪组织及肝组织称重,部分组织以4%多聚甲醛溶液固定,用于普通病理染色;其余组织液氮速冻,-80℃保存。
取20 mg组织样本,加入200 μL蛋白裂解液(蛋白裂解液∶PMSF为100∶1),匀浆机研磨均匀。低温离心15 000转/min 20 min,将无色透明上清液移至新的EP管中,BCA法测蛋白浓度,后加入适量上样缓冲液,100℃变性5 min后-20℃低温保存。聚丙烯酰胺凝胶电泳(SDS-PAGE)胶制备10%的分离胶和5%的浓缩胶。电泳槽内加入一定量的电泳液,SDS-PAGE胶固定好后放入电泳槽,每孔加入等量蛋白;80 V恒压30 min后,加压至100~120 V恒压,待目的蛋白至电泳夹底部中下时,停止电泳,低温220 mA恒流转膜1 h,5%牛奶封闭液4℃封闭过夜;将抗体与一抗稀释液1∶1 000配制成工作液,4℃水平摇床中孵育过夜,TBST洗涤3次,每次10 min,山羊抗兔二抗室温水平摇床中孵育2 h,TBST洗涤3次,每次10 min;曝光。
应用SPSS 20.0统计软件进行数据处理。计量资料用Mean±SD表示,3组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
各组实验小鼠体重、附睾旁和腹股沟皮下白色脂肪组织、肩胛部棕色脂肪组织质量及肝质量(
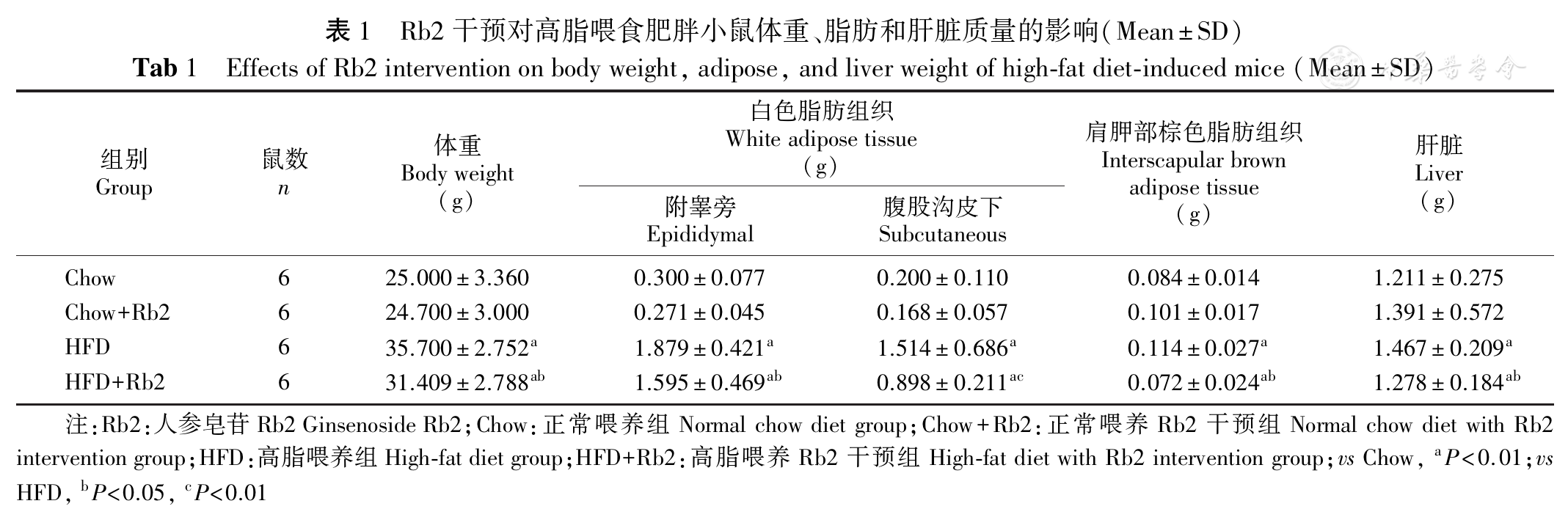
光学显微镜下观察,可见脂滴呈圆形,高脂喂养组较正常喂养组附睾旁和腹股沟皮下白色脂肪组织、肩胛部棕色脂肪组织脂滴明显增大,高脂喂养Rb2干预组较高脂喂养组腹股沟皮下白色脂肪脂滴体积减小,数目减少,附睾旁白色脂肪组织和肩胛部棕色脂肪无明显变化;正常喂养组肝细胞排列呈索状,结构正常;高脂喂养组小鼠肝组织可见细胞质中出现大小不等的脂肪空泡,呈脂肪变性,高脂喂养Rb2干预组与高脂喂养组相比,脂肪空泡数目和体积明显减少,脂肪变性程度减轻(

注:Rb2:人参皂苷Rb2 Ginsenoside Rb2;iWAT:腹股沟皮下白色脂肪组织Inguinal white adipose tissue;eWAT:附睾旁白色脂肪组织Epididymal white adipose tissue;BAT:肩胛部棕色脂肪组织Interscapular brown adipose tissue; Liver:肝脏;Chow:正常喂养组Normal chow diet group;Chow+Rb2:正常喂养Rb2干预组Normal chow diet with Rb2 intervention group;HFD:高脂喂养组High-fat diet group;HFD+Rb2:高脂喂养Rb2干预组High-fat diet with Rb2 intervention group
高脂喂养组较正常喂养组附睾旁、腹股沟白色脂肪组织和肩胛部棕色脂肪组织自噬相关基因(autophagy related gene, Atg)5、Atg7、Beclin-1明显增加,自噬蛋白Beclin-1、LC3-Ⅱ/LC3-Ⅰ增加,p62减少,提示高脂饮食激活了小鼠自噬信号通路;高脂喂养Rb2干预组较高脂喂养组Atg5、Atg7、Beclin-1基因表达下调,自噬蛋白Beclin-1、LC3-Ⅱ/LC3-Ⅰ表达下降,p62表达增加(
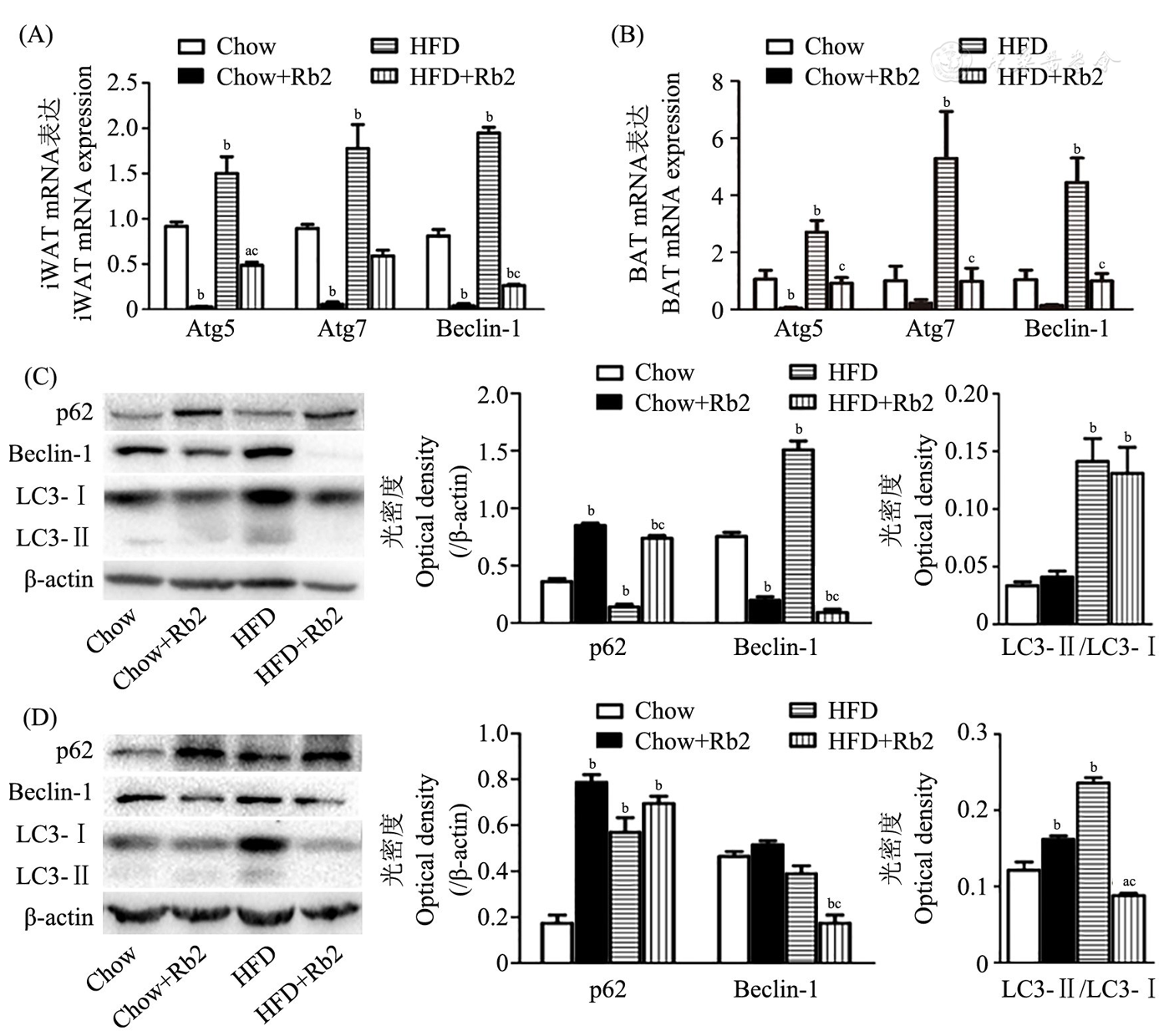
注:(A)(C)iWAT;(B)(D)BAT;Rb2:人参皂苷Rb2 Ginsenoside Rb2;Chow:正常喂养组Normal chow diet group;Chow+Rb2:正常喂养Rb2干预组Normal chow diet with Rb2 intervention group;HFD:高脂喂养组High-fat diet group;HFD+Rb2:高脂喂养Rb2干预组High-fat diet with Rb2 intervention group;iWAT:腹股沟皮下白色脂肪组织Inguinal white adipose tissue;Atg:自噬相关基因Autophagy related gene;BAT:肩胛部棕色脂肪组织Interscapular brown adipose tissue;LC3:微管相关蛋白1轻链3 Microtubule-associated protein 1 light chain 3;vs Chow, aP<0.05, bP<0.01;vs HFD, cP<0.01
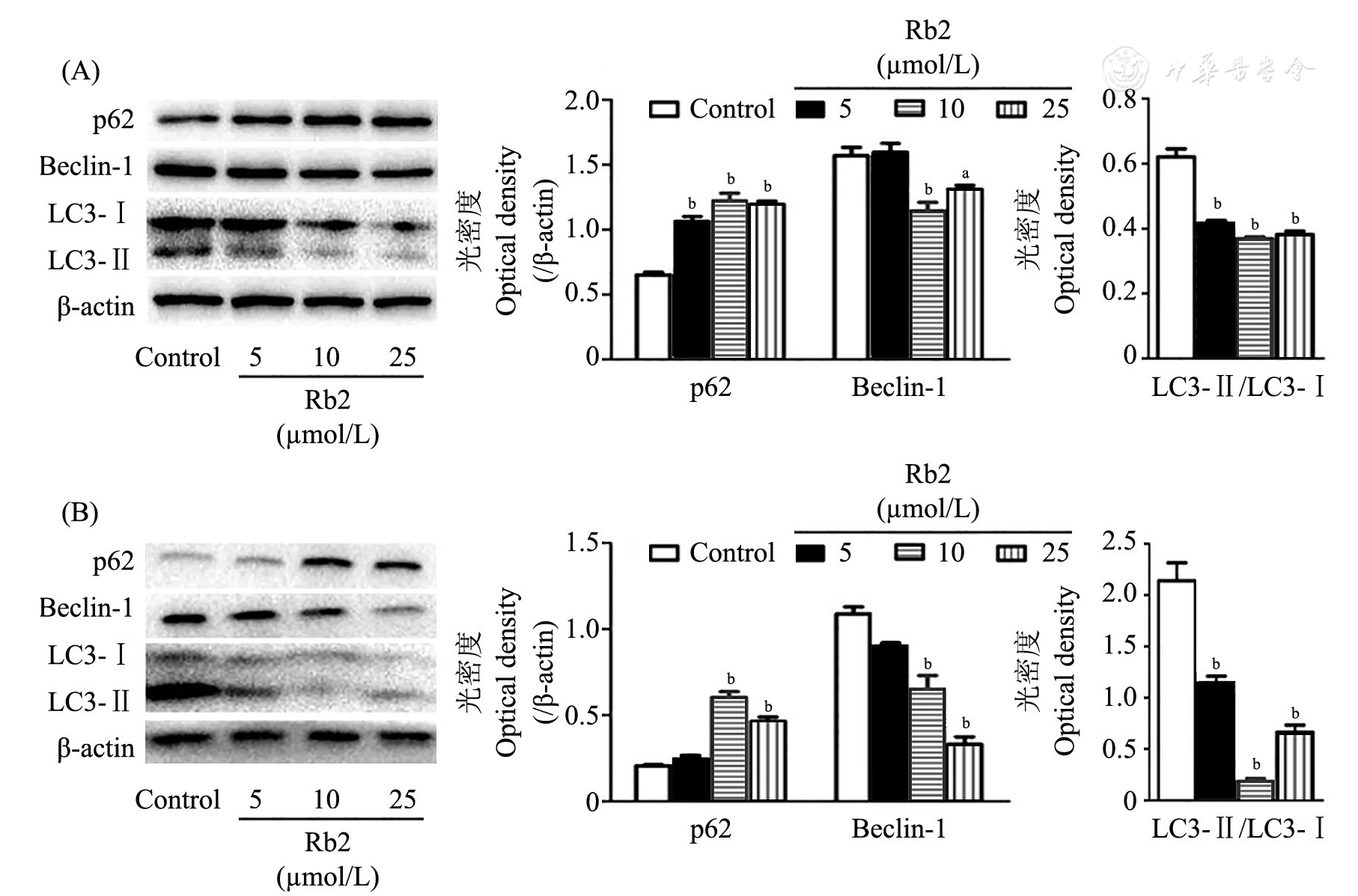
注:(A)3T3-L1;(B)SVF;Rb2:人参皂苷Rb2 Ginsenoside Rb2;SVF:基质血管组分Stromal vascular action;LC3:微管相关蛋白1轻链3 Microtubule-associated protein 1 light chain 3;Control:对照组;vs Control, aP<0.05, bP<0.01
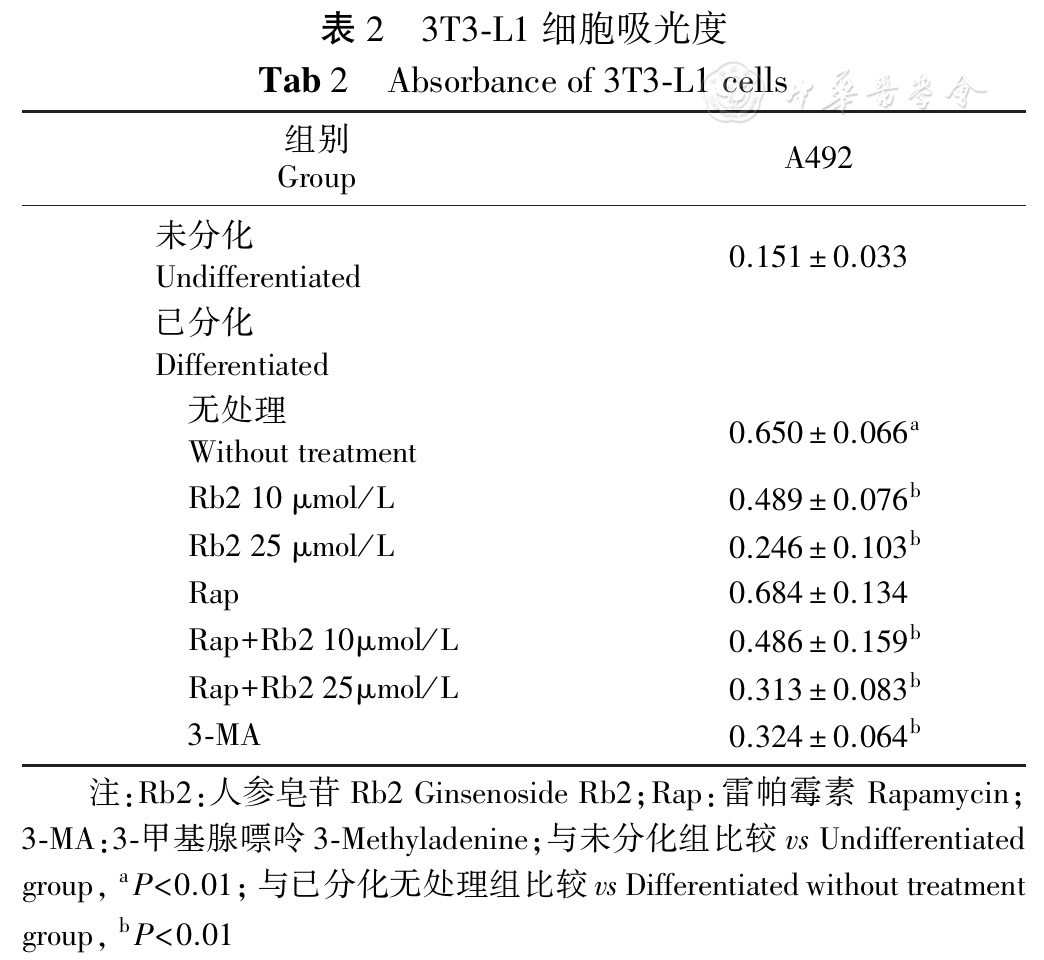
在3T3-L1脂肪前体细胞诱导分化后,分别予Rb2(10、25 μmol/L)、雷帕霉素(100 nmol/L)、雷帕霉素+Rb2、3-甲基腺嘌呤(10 mmol/L)干预,空白组予等量二甲基亚砜(DMSO)干预,油红O染色,检测3T3-L1脂肪前体细胞在A492的吸光度,结果显示分化成熟的脂肪细胞较未分化的脂肪细胞吸光度明显增加,Rb2可以降低3T3-L1细胞的吸光度(
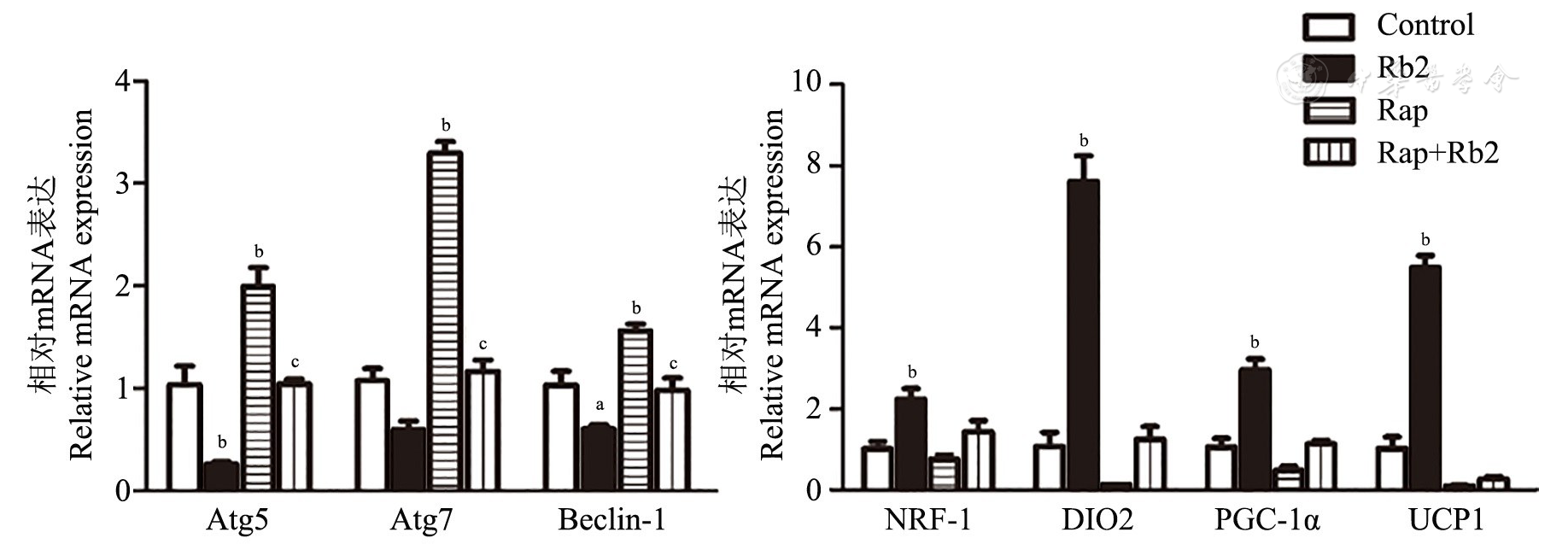
注:Rb2:人参皂苷Rb2 Ginsenoside Rb2;Control:对照组;Rap:雷帕霉素Rapamycin;Atg:自噬相关基因Autophagy related gene;NRF-1:核呼吸因子1 Nuclear respiratory factor 1;DIO2:碘甲腺原氨酸脱碘酶2 Iodothyronine deiodinase 2;PGC-1α:过氧化物酶体增殖物激活受体γ共激活因子-1α Peroxisome proliferator-activated receptor γ coactivator-1α;UCP1:解偶联蛋白1 Uncoupling protein 1;vs Control, aP<0.05, bP<0.01;vs HFD, cP<0.01
脂肪组织是人体的主要组成成分之一,其在机体的能量代谢中发挥着重要的作用。脂肪组织作为脂质的主要储存部位,主要由白色和棕色脂肪细胞组成。白色脂肪组织(white adipose tissue)起着维持体温、能量稳态和保护内脏器官等作用;棕色脂肪组织(brown adipose tissue)线粒体含量丰富,其线粒体内膜表面含有大量UCP1,可将化学能转化为热能,提高机体代谢率,维持体温,同时可减轻肥胖和改善代谢异常[10,11]。在白色脂肪细胞的经典部位,存在着一种形态和功能更接近于棕色脂肪细胞的白色脂肪细胞,称为米色脂肪细胞[12]。在某些药物、环境或饮食刺激下,白色脂肪组织前体细胞可以向棕色脂肪组织或米色脂肪转化,这一转化过程称为"白色脂肪棕色化"。白色脂肪组织棕色化后具备了部分棕色脂肪组织的功能,将化学能转化为热能,提高机体代谢率,无疑将有助于改善肥胖及2型糖尿病等代谢异常,从而使其成为寻求治疗方法的一个热点。本课题组前期研究显示,Rb2腹腔注射的高脂饮食小鼠出现体重减轻、体脂/体重比下降、糖代谢和胰岛素抵抗得到改善,小鼠腹股沟皮下和附睾旁白色脂肪细胞出现棕色样改变,同时棕色脂肪组织棕色化相关基因和蛋白表达水平亦有所升高[8]。与动物模型实验结果一致,在经典白色脂肪诱导方案刺激下,Rb2促进棕色脂肪特异性表达基因(如UCP1、PGC-1α、DIO 2、NRF-1)在3T3-L1脂肪细胞和SVF中的表达增加,提示Rb2能促进白色脂肪细胞的棕色化[8]。
自噬是一种依赖溶酶体途径对胞质蛋白和细胞器进行降解的过程。当细胞接受饥饿等诱导自噬的信号后,胞质某处会形成小的类似脂质体样膜结构,继而扩张形成扁平的脂双层吞噬泡结构,胞质中细胞器等物质被包裹起来形成密闭的双层膜自噬体;期间,自噬体的内膜被溶酶体酶降解,产物被输送到胞质中,供细胞重新利用[9]。因此,在维持细胞能量代谢稳态中发挥着重要作用。近年研究表明,自噬通过溶酶体降解途径也参与了脂肪细胞合成分化的调节过程。肥胖患者脂肪组织自噬水平升高,表现为Atg5在皮下和大网膜脂肪组织中过表达[13];肥胖或超重糖尿病患者的脂肪组织自噬水平也明显上调[14,15]。特异性敲除自噬相关基因Atg5的小鼠,其体重较野生型小鼠轻,胰岛素敏感性增加,对高脂饮食诱导的肥胖具有更强的抵抗力[16];特异性敲除自噬相关基因Atg7的小鼠,白色脂肪细胞的生成减少[17]。相似地,沉默3T3-L1脂肪前体细胞中Atg5、Atg7基因或利用药物抑制自噬将减少脂滴的形成[18];敲除小鼠胚胎成纤维(mouse embryo fibroblasts)细胞的Atg5基因,其向白色脂肪诱导分化受到抑制[16]。进一步研究发现,寒冷等外部刺激会引起米色脂肪细胞的分化生成,当撤除外部刺激之后,米色脂肪细胞会逐步失去形态学和分子特征,重新获得白色脂肪细胞样特征。这个过程中,线粒体自噬被激活,线粒体数目出现下降。当特异性删除脂肪细胞的Atg5或Atg12,抑制线粒体自噬,将减少线粒体的清除,从而阻止外部刺激撤除之后米色脂肪细胞丧失,使其维持高产热能力,抵抗饮食诱导的肥胖,改善胰岛素抵抗[19]。这些结果提示,自噬在脂肪细胞合成分化过程中起着不可或缺的作用,米色脂肪生成和维持需要抑制自噬过程。本研究显示,Rb2可以促进白色脂肪棕色化,同时伴随着自噬相关基因Atg5、Atg7和Beclin-1的表达下调,自噬信号通路的抑制;在雷帕霉素干预促进自噬激活的情况下,Rb2可以在一定程度上抑制雷帕霉素对自噬信号通路的激活作用,减轻雷帕霉素对白色脂肪棕色化的抑制作用。
综上所述,Rb2可以通过抑制自噬信号通路,促进白色脂肪棕色化,进而改善肥胖。
[1] Jung UJ, Choi MS. Obesity and its metabolic complications: the role of adipokines and the relationship between obesity, inflammation, insulin resistance, dyslipidemia and nonalcoholic fatty liver disease[J]. Int J Mol Sci, 2014,15(4): 6184-6223.
[2] Lee JB, Yoon SJ, Lee SH, et al. Ginsenoside Rg3 ameliorated HFD-induced hepatic steatosis through downregulation of STAT5-PPARγ[J]. J Endocrinol, 2017,235(3): 223-235.
[3] Chen W, Wang J, Luo Y, et al. Ginsenoside Rb1 and compound K improve insulin signaling and inhibit ER stress-associated NLRP3 inflammasome activation in adipose tissue[J]. J Ginseng Res, 2016,40(4): 351-358.
[4] Huang Q, Wang T, Yang L, et al. Ginsenoside Rb2 alleviates hepatic lipid accumulation by restoring autophagy via induction of Sirt1 and activation of AMPK[J]. Int J Mol Sci, 2017,18(5): 1063.
[5] Lee KT, Jung TW, Lee HJ, et al. The antidiabetic effect of ginsenoside Rb2 via activation of AMPK[J]. Arch Pharm Res, 2011,34(7): 1201-1208.
[6] Kim EJ, Lee HI, Chung KJ, et al. The ginsenoside-Rb2 lowers cholesterol and triacylglycerol levels in 3T3-L1 adipocytes cultured under high cholesterol or fatty acids conditions[J]. BMB Rep, 2009,42(4): 194-199.
[7] Dai S, Hong Y, Xu J, et al. Ginsenoside Rb2 promotes glucose metabolism and attenuates fat accumulation via AKT-dependent mechanisms[J]. Biomed Pharmacother, 2018,100: 93-100.
[8] Hong Y, Lin Y, Si Q, et al. Ginsenoside Rb2 alleviates obesity by activation of brown Fat and induction of browning of white fat[J]. Front Endocrinol (Lausanne), 2019,10: 153.
[9] Kume S, Uzu T, Horiike K, et al. Calorie restriction enhances cell adaptation to hypoxia through Sirt1-dependent mitochondrial autophagy in mouse aged kidney[J]. J Clin Invest, 2010,120(4): 1043-1055.
[10] Virtanen KA, Lidell ME, Orava J, et al. Functional brown adipose tissue in healthy adults[J]. N Engl J Med, 2009,360(15): 1518-1525.
[11] Cannon B, Nedergaard J. Brown adipose tissue: function and physiological significance[J]. Physiol Rev, 2004,84(1): 277-359.
[12] Tran KV, Gealekman O, Frontini A, et al. The vascular endothelium of the adipose tissue gives rise to both white and brown fat cells[J]. Cell Metab, 2012,15(2): 222-229.
[13] Kovsan J, Bashan N, Greenberg AS, et al. Potential role of autophagy in modulation of lipid metabolism[J]. Am J Physiol Endocrinol Metab, 2010,298(1): E1-E7.
[14] Ost A, Svensson K, Ruishalme I, et al. Attenuated mTOR signaling and enhanced autophagy in adipocytes from obese patients with type 2 diabetes[J]. Mol Med, 2010,16(7-8): 235-246.
[15] Kovsan J, Blüher M, Tarnovscki T, et al. Altered autophagy in human adipose tissues in obesity[J]. J Clin Endocrinol Metab, 2011,96(2): E268-E277.
[16] Baerga R, Zhang Y, Chen PH, et al. Targeted deletion of autophagy-related 5 (atg5) impairs adipogenesis in a cellular model and in mice[J]. Autophagy, 2009,5(8): 1118-1130.
[17] Zhang Y, Goldman S, Baerga R, et al. Adipose-specific deletion of autophagy-related gene 7 (atg7) in mice reveals a role in adipogenesis[J]. Proc Natl Acad Sci USA, 2009,106(47): 19860-19865.
[18] Singh R, Xiang Y, Wang Y, et al. Autophagy regulates adipose mass and differentiation in mice[J]. J Clin Invest, 2009,119(11): 3329-3339.
[19] Altshuler-Keylin S, Shinoda K, Hasegawa Y, et al. Beige adipocyte maintenance is regulated by autophagy-induced mitochondrial Clearance[J]. Cell Metab, 2016,24(3): 402-419.
