Ad36诱导分化的脂肪细胞中LncRNA00602的作用初探
2021年6月
中华内分泌代谢杂志,第37卷第6期 第558页-第566页
高佳乐,张晓峥,焦谊,努尔比耶·努尔麦麦提,孟轩羽,徐尤宗胜,王冰丽,刘迪晖,关亚群
肥胖是引起2型糖尿病、高血压、非酒精性脂肪肝等代谢性疾病的重要原因之一,是遗传、环境等多种因素相互作用的结果[1]。肥胖引起的临床问题主要与脂肪组织的分布和种类密切相关,人体内主要有白色和棕色两种脂肪组织[2]。大量研究发现,白色脂肪组织(white adipose tissue)既是一个储能器官,也是全身最大的内分泌器官,通过分泌脂肪细胞因子参与机体糖脂代谢,引起代谢综合征的发生[2,3]。棕色脂肪组织(brown adipose tissue)通过分泌解偶联蛋白1(uncoupling protein 1, UCP1)使线粒体氧化和磷酸化解偶联,将储存的能量以热能形式释放[3]。因此,研究棕色脂肪成脂发育及白色脂肪棕色化的作用将进一步拓展肥胖诊治的有效策略。
研究发现,病毒的感染也可引起肥胖,其中腺病毒36型(adenovirus type 36, Ad36)与人类及动物肥胖的关系已被许多国内外研究所证实[4,5]。虽然Ad36引起了机体肥胖,但是感染Ad36的肥胖患者表现出血糖、血脂良性改善等特点,提示Ad36可能在机体中具有保护作用[6]。本课题组前期研究显示,在Ad36诱导人脂肪源性干细胞(human adipose-derived stem cells, hADSC)及3T3-L1前脂肪细胞分化过程中,Ad36能正向调控UCP1、PR结构域蛋白16(PR domain containing 16, PRDM16)等一系列棕色脂肪细胞标志基因、线粒体氧化磷酸化的酶基因表达和脂滴的代谢变化,从而促进脂肪细胞棕色化[7,8]。但Ad36促进脂肪细胞棕色化的具体作用机制尚不清楚。本课题组前期测序结果发现,在Ad36诱导hADSC分化过程中,长链非编码RNA(long non-coding RNA, LncRNA)00602表达水平显著上调,且与UCP1、PRDM16基因表达趋势相一致,推测LncRNA00602对上述基因表达水平的变化可能具有调节作用。基于此,本研究首先在组织水平,分析LncRNA00602的表达变化与临床生化指标的相关性,通过网膜脂肪组织中脂肪细胞形态变化和棕色脂肪标记基因表达水平的差异,探讨LncRNA00602在Ad36感染患者脂肪组织能量代谢变化中的作用。再以Ad36诱导的脂肪细胞为研究对象,从形态学和分子水平的变化中探讨LncRNA00602在Ad36诱导脂肪细胞棕色化中的可能作用。这将为脂肪细胞棕色化拓展新的研究思路,也将进一步为肥胖诊治提供新的靶点。
主要试剂与仪器Ad36购自ATCC公司(美国);氟硼二吡咯(fluoroboron dipyrrole, BODIPY)染料购自索莱宝公司(中国);Mito-Tracker Red染料购自碧云天公司(中国);TRIzol RNA提取试剂购自Invitrogen公司(美国);SYBR Green Real time PCR试剂盒购自QIAGEN公司(德国);Revert Aid First Strand cDNA Synthesis Kit反转录试剂盒购自TAKARA公司(日本);DMEM低糖培养基购自Hyclone公司(美国);胎牛血清、青霉素-链霉素溶液购自BI公司(以色列);PRDM16抗体购自R&D Systems公司(美国);UCP1抗体购自Santa Cruz公司(美国);过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor γ,PPARγ)、热休克蛋白90(heat shock protein 90, HSP90)抗体购自CST公司(美国);小干扰RNA(Small interfering RNA,siRNA)购自上海吉玛公司(中国);核酸微量检测仪(NanoDrop)、电热恒温培养箱购自Thermo公司(美国);荧光倒置显微镜购自Leica公司(德国)。
根据成人体重指数≥28 kg/m2为肥胖,选取年龄20~55岁、胆囊结石或腹股沟疝择期手术的男性单纯性肥胖患者38例,术中留取网膜脂肪组织。按照血清中是否携带Ad36抗体分为Ad36感染组和Ad36阴性组各19例。本研究均经医院伦理委员会批准,患者均签署知情同意书。
为避免来自年龄、性别或肥胖程度的差异,以随机数字表法从2组总样本中各选取6例(28 kg/m2≤体重指数≤33 kg/m2)、年龄在25~45岁的男性单纯性肥胖患者。用3 mL的4%多聚甲醛分别固定网膜脂肪组织24 h,常规梯度乙醇脱水、二甲苯脱蜡、石蜡包埋及切片(厚度8 μm)。常规HE染色、中性树胶封片。Leica光学显微镜下观察切片,Image J软件进行脂肪细胞平均面积分析。
为避免来自年龄、性别或肥胖程度的差异,选取Ad36阴性组中28 kg/m2≤体重指数≤33 kg/m2、年龄在25~45岁的男性单纯性肥胖患者。将网膜脂肪组织用生理盐水清洗后,剔除可见的血块和血管,用眼科剪在无菌条件下,将组织剪成糊状后与2 mL浓度为1 mg/mL的Ⅰ型胶原酶混匀,加入15 mL离心管,在37℃水浴箱,振荡25 min。加入4 mL DMEM低糖完全培养基,终止消化,将组织悬液以1 000转/min,离心5 min。吸去上层清液后将沉淀重悬。将细胞接种在6 cm细胞培养皿,置入培养箱培养;2 d换1次液,细胞汇合达到80%时,用胰酶消化传代。传代后收集细胞悬液,分为阴性对照及同型对照,分别加单克隆抗体CD44-FITC、CD105-PE,在4℃冰箱避光孵育30 min;用预冷的磷酸盐缓冲液(PBS)清洗2次,洗掉多余抗体后,加入400 μL的PBS制成单细胞悬液,通过流式细胞仪检测细胞表面抗原。间充质干细胞标记抗原CD44、CD105呈阳性,表明分离的细胞为hADSC。
将4×105个细胞接种于3.5 cm培养皿,细胞汇合达80%时,弃去皿内液体,加入2 mL DMEM低糖培养基,饥饿2 h,再加入感染复数(multiplicity of infection,MOI)为5的Ad36病毒悬液,置于37℃培养箱感染1 h,弃去皿内Ad36诱导悬液,加入2 mL DMEM低糖完全培养基,2 d换1次液。
将4×105个细胞接种于3.5 cm皿,细胞汇合达80%时,弃去皿内液体,加入2 mL DMEM低糖培养基,饥饿2 h。转染液的配制:5 μL的脂质体3000(lipofectamine 3000),用250 μL减血清培养基进行稀释,室温孵育5 min;5 μL siRNA用250 μL减血清培养基进行稀释,室温孵育5 min;将脂质体3000稀释液与siRNA稀释液混合,室温孵育20 min。将500 μL转染液加入培养皿,置于37℃培养箱孵育4 h后,再加入Ad36病毒悬液诱导。siRNA由上海吉玛公司设计并合成,序列见

在细胞接种前在培养皿内放入爬片,细胞汇合达80%时,爬片用PBS清洗3次,加入4%多聚甲醛,固定细胞20 min,取出爬片,PBS清洗3次,将BODIPY用PBS按1∶200稀释,并取50 μL BODIPY染液覆盖爬片,室温避光30 min,PBS清洗3次。将DAPI用PBS按1∶100稀释,并取50 μL覆盖爬片,室温避光30 min,PBS清洗3次,略微晾干后倒扣在含封片剂的玻璃板上,用激光共聚焦显微镜观察。采用Image J软件进行细胞脂滴面积分析。
将细胞接种在3.5 cm玻底培养皿,细胞汇合达80%时,弃去皿内液体,PBS清洗3次,加入2 mL经过37℃预温的Mito-Tracker Red染液(按照1∶2 000的浓度稀释)后,放入37℃培养箱,避光孵育30 min。弃去染液,PBS清洗3次,加入2 mL 37℃预温的Hoechst染液(按照1∶5 000的浓度稀释)后,放入37℃培养箱,避光孵育15 min,弃去染液,PBS清洗3次,加入2 mL预温的DMEM低糖完全培养基,立即用激光共聚焦显微镜观察。采用Image J软件进行平均荧光强度分析。
细胞汇合达80%时,弃去皿内液体,PBS清洗3次(脂肪组织浸泡液氮用研钵碾成粉末置入1.5 mL EP管),管内加入1 mL预冷的TRIzol,匀浆仪将细胞或组织在冰上匀浆;采用异丙醇、氯仿方法提取细胞及组织RNA,分光光度法测量细胞及组织内RNA浓度及A260/A280。使用Revert Aid First Strand cDNA Synthesis试剂盒将RNA反转录为cDNA后,在ABI 7500系统下,使用SYBR Green Real time PCR试剂进行PCR扩增。用2-ΔΔCt计算目的基因相对表达量。引物由上海生工设计并合成,序列见

当hADSC汇合达80%时,弃去液体,PBS清洗3次(脂肪组织浸泡液氮用研钵研磨成粉末置入1.5 mL EP管),加入100~300 μL RIPA裂解液,冰上裂解30 min后,用双软骨酸(BCA)工作液对蛋白质进行定量;在10%的丙烯酰胺凝胶上样,电泳后转移至NC膜,NC膜置于5%的脱脂奶,室温摇床,封闭1 h,将一抗按照UCP1(1∶1 000)、PPARγ(1∶1 000)、PRDM16(1∶1 000)、HSP90(1∶3 000)用5%脱脂奶稀释,NC膜置于一抗,4℃摇床上,孵育12 h。5 mL Tris-Hcl清洗缓冲液(TBST)清洗3次,每次10 min;室温摇床,二抗孵育1 h,5 mL TBST清洗3次,每次10 min。用ECL发光法进行显色,Image J软件进行光密度分析。
实验结果以Mean±SD表示,采用SPSS 26.0统计软件。多组计量资料采用方差分析;相关关系使用Pearson相关系数分析,P<0.05为差异有统计学意义。
qRT-PCR结果显示,LncRNA00602在Ad36感染组中表达水平显著高于阴性组,且差异有统计学意义(P<0.05,

注:(A)LncRNA00602 mRNA表达水平LncRNA00602 mRNA expression; (B)Ad36感染组LncRNA00602 mRNA表达水平与空腹血糖相关性分析Analysis of the correlation between LncRNA00602 mRNA expression level and fasting blood glucose in Ad36 infection group; (C)Ad36感染组LncRNA00602 mRNA表达水平与三酰甘油相关性分析Analysis of the correlation between LncRNA00602 mRNA expression level and triglyceride in Ad36 infection group; LncRNA:长链非编码RNA Long non-coding RNA;Ad36:腺病毒36型Adenovirus type 36; Ad36(-):Ad36阴性组Ad36 negative group; Ad36(+):Ad36感染组Ad36 infection group; vs Ad36(-), aP<0.05
2组网膜脂肪组织HE染色结果显示,Ad36感染组脂肪细胞平均面积显著小于Ad36阴性组,且差异有统计学意义(P<0.05,

注:(A)HE染色HE staining (×20);(B)平均细胞面积Average cell area;Ad36:腺病毒36型Adenovirus type 36; Ad36(-):Ad36阴性组Ad36 negative group; Ad36(+):Ad36感染组Ad36 infection group; vs Ad36(-), aP<0.05
qRT-PCR结果显示,Ad36感染组网膜脂肪组织中PRDM16、UCP1 mRNA表达水平均高于阴性组,且差异有统计学意义(均P<0.05,
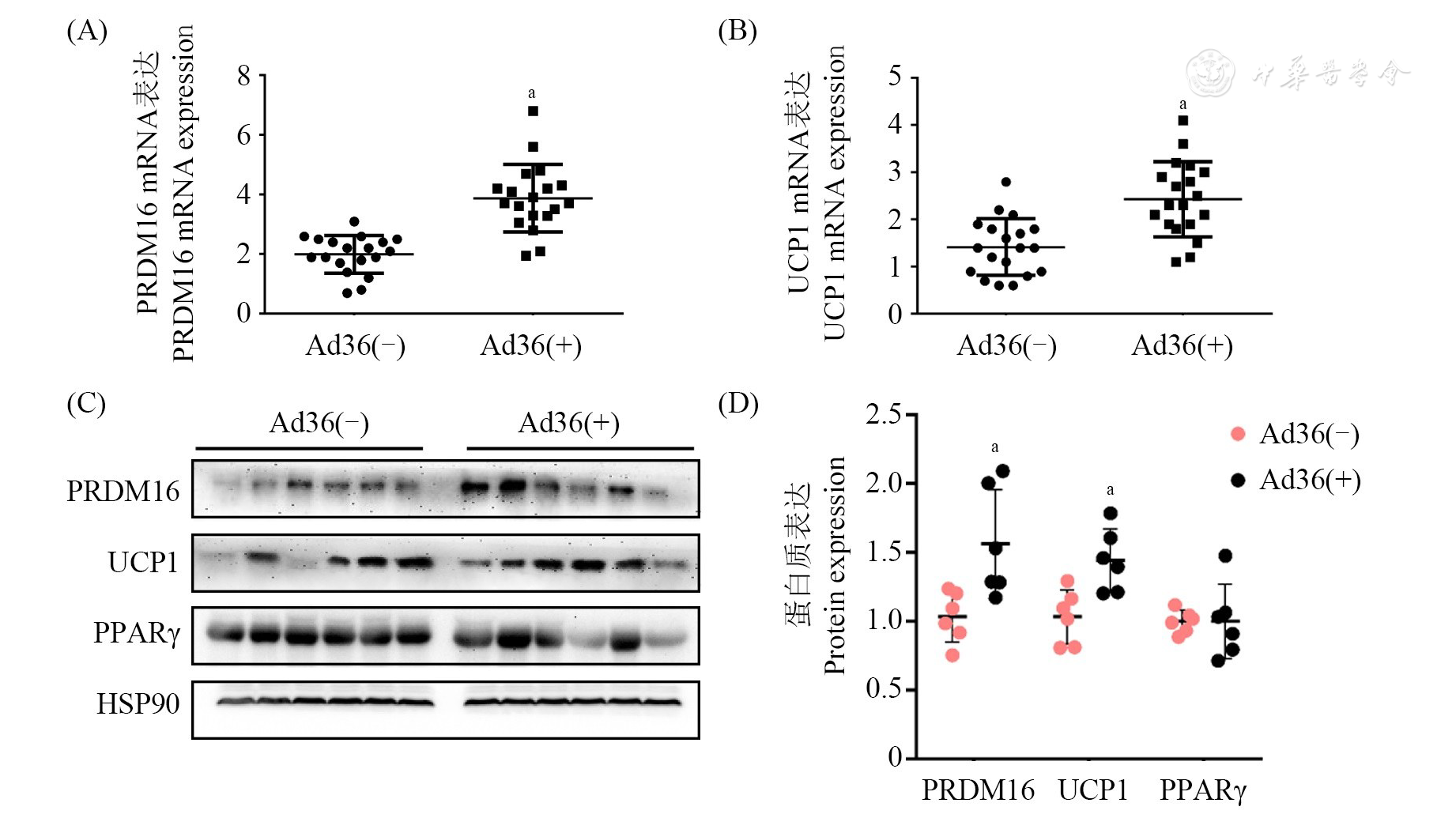
注:(A)PRDM16 mRNA表达水平PRDM16 mRNA expression; (B)UCP1 mRNA表达水平UCP1 mRNA expression; (C)PRDM16、UCP1、PPARγ、HSP90蛋白质表达水平PRDM16, UCP1, PPARγ,HSP90 protein expression; (D)蛋白质表达定量结果Protein expression quantitative results; Ad36:腺病毒36型Adenovirus type 36; Ad36(-):Ad36阴性组Ad36 negative group; Ad36(+):Ad36感染组Ad36 infection group; PRDM16:PR结构域蛋白16 PR domain containing 16; UCP1:解偶联蛋白1 Uncoupling protein 1; PPARγ:过氧化物酶体增殖物激活受体γ Peroxisome proliferator-activated receptor γ;HSP90:热休克蛋白90 Heat shock protein 90; vs Ad36(-), aP<0.05
Ad36诱导2组脂肪细胞分化,第2、4天的BODIPY细胞染色结果显示,LncRNA00602敲低组脂滴形状较圆且较大,而对照组呈现细沙状颗粒样小脂滴(
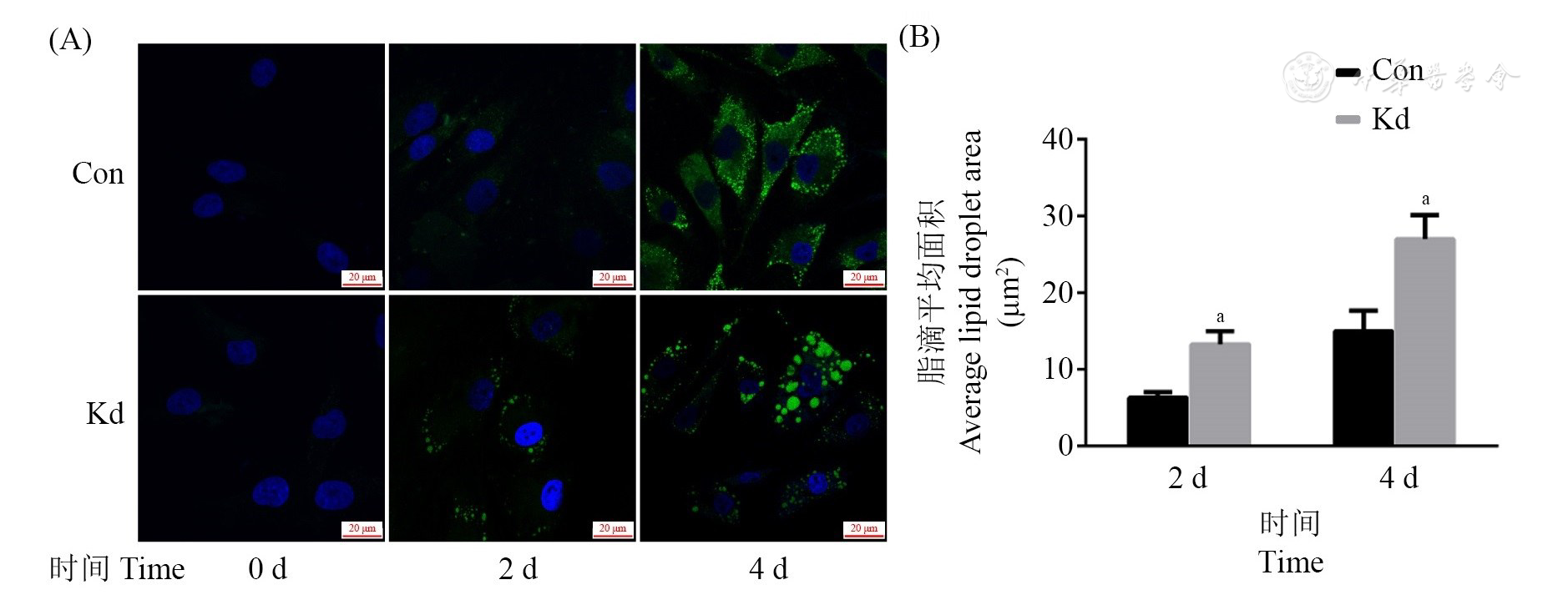
注:(A)BODIPY染色BODIPY staining (×100); (B)脂滴平均面积Average lipid droplet area; Ad36:腺病毒36型Adenovirus type 36; LncRNA:长链非编码RNA Long non-coding RNA; BODIPY:氟硼二吡咯Fluoroboron dipyrrole; Con:对照组Control group; Kd:敲低组Knockdown group; vs Con, aP<0.05
用激光共聚焦显微镜观察,Ad36诱导对照组及LncRNA00602敲低组第0、2、4天细胞,其中敲低组线粒体数量较对照组逐渐减少(
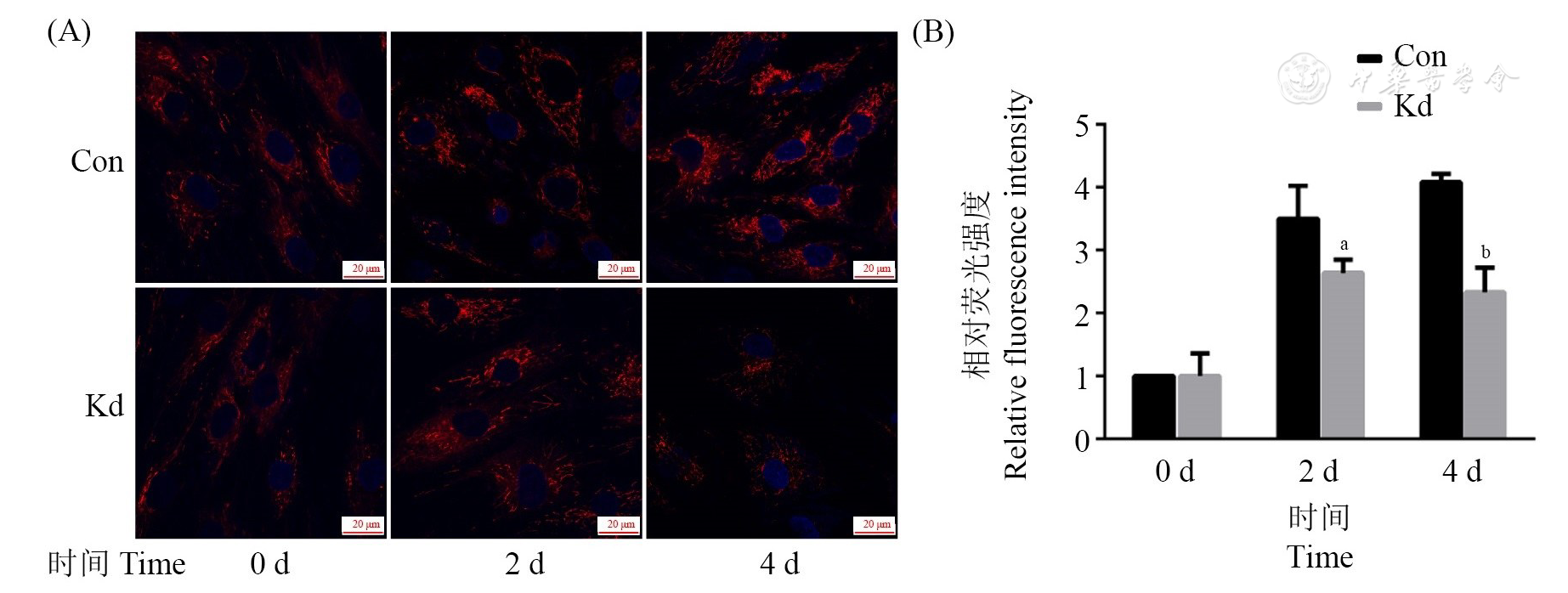
注:(A)线粒体红色荧光染色Mitochondrial red fluorescence staining (×100); (B)平均荧光强度Average fluorescence intensity; Ad36:腺病毒36型Adenovirus type 36; LncRNA:长链非编码RNA Long non-coding RNA; Con:对照组Control group;Kd:敲低组Knockdown group; vs Con, aP<0.05, bP<0.01
qRT-PCR结果显示,在Ad36诱导的脂肪细胞分化中,LncRNA00602、UCP1、PRDM16 mRNA表达水平随诱导时间增加而逐渐升高(

注:(A)LncRNA00602 mRNA表达水平LncRNA00602 mRNA expression; (B)LncRNA00602 mRNA表达水平敲低效率的结果Result of knockdown efficiency of LncRNA00602 mRNA expression; (C)E1a mRNA表达水平E1a mRNA expression; (D)UCP1 mRNA表达水平UCP1 mRNA expression; (E)PRDM16 mRNA表达水平PRDM16 mRNA expression; (F)PRDM16、UCP1、PPARγ、HSP90蛋白质表达水平PRDM16, UCP1, PPARγ,HSP90 protein expression levels; (G)~(I)PRDM16、UCP1、PPARγ蛋白质表达定量结果PRDM16, UCP1, PPARγ protein expression quantitative results; Ad36:腺病毒36型Adenovirus type 36; LncRNA:长链非编码RNA Long non-coding RNA; Con:对照组Control group;Kd:敲低组Knockdown group; E1a:腺病毒36型E1a基因Adenovirus type 36-E1a gene; UCP1:解偶联蛋白1 Uncoupling protein 1; PRDM16:PR结构域蛋白16 PR domain containing 16; PPARγ:过氧化物酶体增殖物激活受体γ Peroxisome proliferator-activated receptor γ;HSP90:热休克蛋白90 Heat shock protein 90; vs Con, aP<0.05, bP<0.01
随着社会发展及人们生活方式的改变,肥胖症的发病率在全球范围内迅速上升,肥胖已经成为严峻的公共卫生问题,受到人们越来越多的关注[1]。肥胖引起的多种代谢性疾病,主要与脂肪组织的分布和种类密切相关[2]。人体内主要有白色脂肪组织和棕色脂肪组织这两种脂肪组织,其中引起代谢性疾病的主要是白色脂肪组织,相较于白色脂肪组织,棕色脂肪组织主要将多余的脂肪氧化、提供能量并以热能形式释放[2,3]。因此,白色脂肪细胞的棕色化调控机制可能成为治疗肥胖的有效策略,受到越来越多研究者青睐,成为目前较热门的研究领域之一。
肥胖是由遗传、环境等多种因素相互作用产生的结果。大量国内外文献报道,病毒感染也可引起肥胖[4,5,6]。其中,Ad36能够引起人类肥胖的发生,人感染Ad36后出现体重、体脂增加,但血脂相对较低、血糖容易控制、对脂肪组织的炎症应答较低等代谢表型改变[4]。研究发现,Ad36通过激活磷酸肌醇3激酶(PI3K)/蛋白激酶B(AKT)途径上调葡萄糖转运蛋白4(GLUT4)表达,增加了脂肪组织、骨骼肌、肝脏对葡萄糖的摄取和利用,最终改善糖代谢[5]。同时,本课题组前期研究发现,Ad36感染的肥胖患者表现出血糖、血脂指标良性改善的特点,表明Ad36对其感染的肥胖个体代谢具有保护作用[6]。
LncRNA是一类长度大于200 nt的非编码RNA,可以与蛋白质、DNA和RNA相互作用,主要通过其信号、诱饵、海绵和支架等功能参与对脂肪细胞的成脂、发育、棕色化及能量代谢的调节[9,10,11]。因此,本研究将网膜组织中LncRNA00602的表达变化结合患者临床生化指标行相关性分析发现,Ad36感染组中LncRNA00602表达水平显著高于Ad36阴性组,且LncRNA00602表达水平与Ad36感染组患者的血糖、血脂指标呈负相关,提示LncRNA00602可能参与了Ad36感染引起的对血糖、血脂代谢的调节作用。本研究对肥胖患者网膜脂肪组织HE染色发现,Ad36感染组脂肪细胞平均面积小于阴性组,且Ad36感染组LncRNA00602、PRDM16、UCP1基因表达水平均显著高于阴性组。PRDM16是锌指蛋白家族的成员之一,作为棕色脂肪细胞中重要的转录因子参与棕色脂肪细胞脂滴的形成[12,13]。并且,有研究发现,PRDM16能够激活包括棕色脂肪细胞基因UCP1、过氧化物酶体增殖物激活受体γ辅助激活因子-1α(peroxisome proliferator-activated receptor γ coactivator-1α,PGC-1α)和许多线粒体基因的表达[14]。UCP1位于棕色脂肪细胞线粒体内膜,通过增加线粒体内膜的渗透性加快质子返回线粒体基质,发挥线粒体氧化呼吸解偶联作用,最终使脂肪细胞中储存的能量以热能形式消耗从而对代谢产生影响[14,15]。同时,Choi等[16]发现Gelidium elegans能够通过腺苷酸激活蛋白激酶(AMPK)/PRDM16/UCP1途径,上调PRDM16表达,并促进UCP1的表达,加速小鼠脂肪细胞的脂质代谢,降低小鼠血清中葡萄糖和三酰甘油,最终抑制高脂饲料饲养的ICR小鼠体重的增加。这提示在Ad36感染患者的网膜脂肪组织中,上调的PRDM16、UCP1可能对Ad36感染引起血糖、血脂的代谢具有调节作用。
本课题组前期研究发现,Ad36能够诱导hADSC分化,在分化过程中UCP1、PRDM16等脂肪细胞棕色化标志基因表达水平均显著升高[7]。并且,在3T3-L1细胞中,Ad36能够正向调控UCP1、细胞色素C氧化酶亚基5b(COX5b)等基因的表达水平,加速脂肪细胞的氧化呼吸以及能量消耗,这表明Ad36具有促进脂肪细胞棕色化的作用,但其关于Ad36引起的脂肪细胞棕色化的具体作用机制尚不清楚[8]。在Ad36诱导hADSC分化为脂肪细胞中发现,LncRNA00602表达水平显著升高且和脂肪细胞棕色化标记基因PRDM16、UCP1表达水平趋势一致。同时,有研究报道LncRNA GM13133通过增加线粒体活性并上调PRDM16、UCP1的表达水平,最终使小鼠的脂肪细胞棕色化[17]。LncBATE10能将CUGBP Elav类家族成员1(CELF1)从PGC-1α特定区域招募出来,干扰CELF1对PGC-1α的抑制作用,从而上调UCP1基因的表达,最终促进脂肪细胞棕色化,提示LncRNA00602可能参与Ad36对脂肪细胞棕色化的调节作用[18]。本研究发现,在敲低LncRNA00602后,PRDM16、UCP1 mRNA及蛋白质表达水平均较对照组显著下降,差异有统计学意义。上述结果提示LncRNA00602可能在Ad36诱导的脂肪细胞分化中对PRDM16、UCP1的表达具有调节作用。本研究发现,敲低组脂肪细胞脂滴平均面积在第2、4天显著大于Ad36诱导对照组,线粒体荧光强度也较对照组显著降低,且差异有统计学意义。有研究显示,脂肪细胞脂滴作为机体能量存储的场所,与白色脂肪细胞相比,棕色脂肪细胞中线粒体数量更多,氧化磷酸化能力更强,脂滴更小[14,15,19,20]。在Ad36感染的脂肪细胞中,LncRNA00602可能正向调控了PRDM16、UCP1的表达和细胞脂滴代谢变化使脂肪细胞棕色化,避免了在Ad36感染肥胖患者中出现的高三酰甘油、高血糖和胰岛素抵抗等临床特征。
本研究在Ad36诱导的脂肪细胞中,发现LncRNA00602对PRDM16、UCP1的表达具有调节作用,并证明了LncRNA00602在Ad36诱导脂肪细胞棕色化中的作用。PPARγ是脂肪细胞分化的重要转录因子,在Ad36诱导的脂肪细胞中,Ad36能够上调PPARγ的表达水平[21]。本研究在敲低LncRNA00602后,脂肪细胞仍然处于分化过程中,PPARγ的表达呈上升趋势;敲低LncRNA00602后,未影响脂肪细胞分化及成脂能力,并且LncRNA00602可能不参与对PPARγ表达的调控,因此敲低组与对照组PPARγ的蛋白质表达水平无明显差异。LncRNA00602调节PRDM16、UCP1表达的分子机制较为复杂,调节过程中还有其他分子参与,具体的分子机制还有待进一步研究。
[1] Macia E, Cohen E, Gueye L, et al. Prevalence of obesity and body size perceptions in urban and rural Senegal: new insight on the epidemiological transition in West Africa[J]. Cardiovasc J Afr, 2017, 28(5): 324-330.
[2] Hyv?nen MT, Spalding KL. Maintenance of white adipose tissue in man[J]. Int J Biochem Cell Biol, 2014, 56: 123-132.
[3] Lo KA, Sun L. Turning WAT into BAT: a review on regulators controlling the browning of white adipocytes[J]. Biosci Rep, 2013, 33(5): e00065.
[4] Park S, Kim J, Shin HJ, et al. Tracking study about adenovirus 36 infection: increase of adiposity[J]. J Microbiol Biotechnol, 2015, 25(12): 2169-2172.
[5] Na HN, Hong YM, Ye MB, et al. Adenovirus 36 attenuates weight loss from exercise but improves glycemic control by increasing mitochondrial activity in the liver[J]. PLoS One, 2014, 9(12): e114534.
[6] Jiao Y, Mao X, Chang X, et al. Adenovirus36 infection expresses cellular APMI and Visfatin genes in overweight Uygur individuals[J]. Diagn Pathol, 2014, 9: 83.
[7] Jiao Y, Liu L, Gu H, et al. Ad36 promotes differentiation of hADSCs into brown adipocytes by up-regulating LncRNA ROR[J]. Life Sci, 2021, 265: 118762.
[8] 刘杰,梁小弟,焦谊,等. Ad36诱导3T3-L1细胞棕色化的作用研究[J]. 中华内分泌代谢杂志,2019,35(10):867-873.
[9] Chen Z. Progress and prospects of long noncoding RNAs in lipid homeostasis[J]. Mol Metab, 2016, 5(3): 164-170.
[10] Bai Z, Chai XR, Yoon MJ, et al. Dynamic transcriptome changes during adipose tissue energy expenditure reveal critical roles for Long noncoding RNA regulators[J]. PLoS Biol, 2017, 15(8): e2002176.
[11] Zhao XY, Li S, Wang GX, et al. A Long noncoding RNA transcriptional regulatory circuit drives thermogenic adipocyte differentiation[J]. Mol Cell, 2014, 55(3): 372-382.
[12] Jeremic N, Chaturvedi P, Tyagi SC. Browning of white fat: Novel insight into factors, mechanisms, and therapeutics[J]. J Cell Physiol, 2017, 232(1): 61-68.
[13] Zafrir B. Brown adipose tissue: research milestones of a potential player in human energy balance and obesity[J]. Horm Metab Res, 2013, 45(11): 774-785.
[14] Roman S, Agil A, Peran M, et al. Brown adipose tissue and novel therapeutic approaches to treat metabolic disorders[J]. Transl Res, 2015, 165(4): 464-479.
[15] Srivastava S, Veech RL. Brown and brite: the fat soldiers in the anti-obesity fight[J]. Front Physiol, 2019, 10: 38.
[16] Choi J, Kim KJ, Koh EJ, et al. Gelidium elegans regulates the AMPK-PRDM16-UCP-1 pathway and has a synergistic effect with orlistat on obesity-associated features in mice fed a high-fat diet[J]. Nutrients, 2017, 9(4): 342.
[17] You L, Zhou Y, Cui X, et al. GM13133 is a negative regulator in mouse white adipocytes differentiation and drives the characteristics of brown adipocytes[J]. J Cell Physiol, 2018, 233(1): 313-324.
[18] Bai Z, Chai XR, Yoon MJ, et al. Dynamic transcriptome changes during adipose tissue energy expenditure reveal critical roles for long noncoding RNA regulators[J]. PLoS Biol, 2017, 15(8): e2002176.
[19] Alvarez-Dominguez JR, Bai Z, Xu D, et al. De novo reconstruction of adipose tissue transcriptomes reveals long non-coding RNA regulators of brown adipocyte development[J]. Cell Metab, 2015, 21(5): 764-776.
[20] Li S, Mi L, Yu L, et al. Zbtb7b engages the long noncoding RNA Blnc1 to drive brown and beige fat development and thermogenesis[J]. Proc Natl Acad Sci USA, 2017, 114(34): E7111-E7120.
[21] Jiao Y, Aisa Y, Liang X, et al. Regulation of PPARγ and CIDEC expression by adenovirus 36 in adipocyte differentiation[J]. Mol Cell Biochem, 2017, 428(1-2): 1-8.
