转胶蛋白通过阻断丝裂原活化蛋白激酶/细胞外信号调节激酶信号通路抑制人甲状腺癌细胞的增殖和侵袭
2021年6月
中华内分泌代谢杂志,第37卷第6期 第567页-第573页
于佳睿,赵燕芸,李脉超,迟静薇,车奎,王颜刚,孙文海,胡建霞,赵世华
甲状腺癌(thyroid carcinoma)是最常见的内分泌系统恶性肿瘤之一,据报道其发生与丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)/细胞外信号调节激酶(extracellular-signal regulating kinase, ERK)信号通路激活有关,且发病率在近年来呈上升趋势[1,2]。其中,以恶性度较低、预后较好的甲状腺乳头状癌(papillary thyroid carcinoma, PTC)最为多见[3]。PTC起源于甲状腺滤泡上皮细胞,虽预后较好,但易复发和转移[4]。因此,探索甲状腺癌尤其是PTC的发病机制,找到针对其发生和发展的分子标志物,对于提高该疾病的诊治水平和预后具有重要意义。
转胶蛋白(transgelin, TAGLN)是一种肌动蛋白结合蛋白,几乎在所有细胞和组织中都有表达,其在平滑肌细胞和成纤维细胞中表达最高[5]。其作为一种通过稳定肌动蛋白细丝来影响肌动蛋白细胞骨架动力学的蛋白质,主要参与与肌动蛋白细胞骨架重塑的相关过程[6]。由于细胞骨架结构和功能的改变是导致肿瘤发生和发展的一个重要因素,故其直接或间接地参与了许多与肿瘤相关的过程,如增殖、侵袭、迁移和凋亡[6,7]。已有研究报道,TAGLN通过阻断GTP结合蛋白(Ras)-ERK1/2途径来抑制血管平滑肌细胞增殖[8]。因此,推测TAGLN可能是甲状腺癌发生和发展的重要分子标志物。
本研究通过分别采用实时荧光定量PCR (realtime quantitative PCR, RT-qPCR)、免疫印迹(Western印迹)以及免疫组织化学(immunohistochemistry)检测了TAGLN在PTC组织和对应癌旁正常甲状腺组织中mRNA和蛋白水平上的表达情况,并在细胞水平上通过上调和下调TAGLN的表达,分析了其在PTC细胞增殖、侵袭和转移中的作用及对MAPK/ERK信号通路的影响,旨在为PTC的分子靶向治疗寻找新的靶点。
收集2018年9月至2019年6月在青岛大学附属医院行手术治疗的100例初发PTC患者样本(包括甲状腺癌组织及距离其0.5 cm的配对癌旁正常甲状腺组织),所有样本在手术中收集并立即冷冻储存,术后均经病理学确诊,且术前未接受手术和放化疗。本研究所纳入病例均签署知情同意书,并经本院伦理委员会批准。
使用TRIzol(Sigma,美国)法分别提取细胞和新鲜冷冻PTC组织及其配对癌旁正常甲状腺组织RNA,使用PrimeScript? RT reagent Kit(TAKARA,日本)反转录试剂盒将RNA反转录成cDNA,并放置于-80℃冰箱保存。
人PTC的BCPAP细胞购自中国科学院细胞库,并长期保存于本实验室。培养基为含10%胎牛血清(Gibco,美国)的RPMI-1640(Hyclone,美国),培养条件为5% CO2,温度为37℃,贴壁生长,当细胞融合至80%以上时,进行常规传代培养。
使用TB Green Premix EX TaqⅡ(TAKARA,日本),反应体系为25 μL,TAGLN引物序列如下:上游引物为5′-GTTCCAGACTGTTGACCTCTTT-3′,下游引物为5′-CTGCGCTTTCTTCATAAACC-3′;以GAPDH为内参,上游引物为5′-TGCACCACCAACTGC-TTAGC-3′,下游引物为5′-GGCATGGACTGTGGTCAT-GAG-3′。反应条件:95℃预变性30 s,95℃变性5 s,60℃退火30 s,进行40个循环。用real-time PCR仪(Roche cobas z480,美国)进行RT-qPCR检测,实验重复3次,以2-ΔΔCt计算mRNA的相对表达量。
加裂解液(裂解液∶蛋白酶磷酸酶抑制剂为100∶1)提取组织或细胞蛋白,用BCA蛋白检测试剂盒(Thermo Fisher Scientific,美国)测定蛋白浓度,经15%十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离后电转移至聚偏二氟乙烯(PVDF)膜上,5%脱脂奶粉封闭2 h,按1∶1 000加入TAGLN多克隆抗体(Abcam,美国)4℃孵育过夜,加入二抗室温下孵育1 h。采用ECL化学发光法显色、定影,设α-Tubulin(Proteintech,中国)为内参蛋白。应用Image J 1.52a软件分析蛋白的相对表达水平。
组织标本经4%甲醛固定、石蜡包埋,5 μm连续切片,置于载玻片上风干。切片脱蜡至水,将其置于柠檬酸抗原修复缓冲液(pH 6.0)中进行抗原修复,然后将切片放入3%双氧水溶液,室温避光孵育25 min,磷酸盐缓冲液(PBS)洗3次。加3%牛血清白蛋白(BSA)均匀覆盖组织,室温封闭30 min。加入TAGLN抗体(1∶200),4℃孵育过夜。加入二抗[辣根过氧化物酶(HRP)标记,1∶500],室温孵育1 h。二氨基联苯胺(DAB)法显色,苏木精复染,脱水封片。
根据Lipofectamine 3000(Invitrogen,美国)说明书转染细胞,分别将TAGLN过表达质粒和shRNA慢病毒载体以及各自对应的阴性对照(上海吉凯基因科技股份有限公司)转染至BCPAP细胞,并用合适浓度的嘌呤霉素筛选出稳定表达株,用RT-qPCR和Western印迹进行mRNA和蛋白水平的验证。
用细胞增殖实验(cell counting kit-8, CCK-8)细胞增殖试剂盒(MCE,中国)检测。将各组细胞消化后制成单细胞悬液,以3×103个/孔的密度接种于96孔板,每组设6个复孔,分别于培养1、2、3、4 d时进行CCK-8实验,每孔加入10 μL CCK-8试剂,继续培养2 h后,使用酶标仪测定450 nm处的吸光度(A450)。实验重复3次。利用GraphPad Prism 8.0软件绘制生长曲线。
选择带基质胶和不带有基质胶的孔径为0.8 μm的24孔Transwell小室(Croning,北京)。各组细胞用无血清培养基制成1×106/mL的细胞悬液,取200 μL分别接种到预铺基质胶(BD Matrigel?,上海)和无基质胶的上室,下室加入500 μL含5%胎牛血清的培养基,常规培养24 h,用棉签刮去基质胶和未穿膜细胞,甲醇固定30 min,0.1%结晶紫溶液染色30 min,显微镜下随机选取5个视野拍照并计数。每组实验均重复3次。
运用SPSS 23.0进行统计学分析。计量资料以Mean±SD表示,两组间比较采用t检验,多组间比较采用单因素方差分析,P<0.05为差异有统计学意义。用GraphPad Prism 8.0进行绘图。
为了解TAGLN在PTC组织与配对癌旁正常甲状腺组织的表达差异,收集100例PTC组织及其配对癌旁正常甲状腺组织进行RT-qPCR检测。结果显示,PTC组织中的TAGLN mRNA相对表达量和配对癌旁正常甲状腺组织中的TAGLN mRNA相对表达量分别为(1.126 0±1.177 03)和(1.199 8±1.438 8),差异无统计学意义(t=0.539,P>0.05,
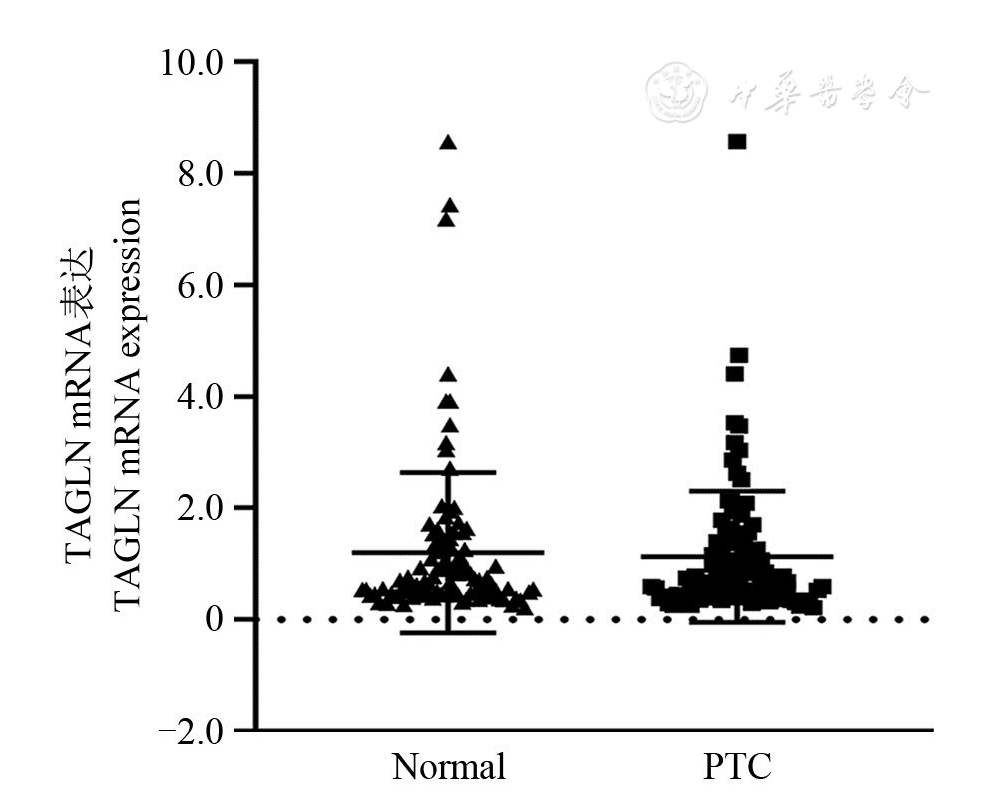
注:TAGLN:转胶蛋白Transgelin; Normal:配对癌旁正常甲状腺组织Corresponding paracancerous normal thyroid tissues; PTC:甲状腺乳头状癌Papillary thyroid carcinoma
为进一步探究TAGLN基因在PTC组织与癌旁正常甲状腺组织的蛋白水平表达情况,提取组织中的蛋白,采用Western印迹法检测TAGLN蛋白相对表达量。结果显示,PTC组织和配对癌旁正常甲状腺组织中TAGLN蛋白水平表达分别为(0.420 4±0.349 1)和(1.250 4±0.664 4),TAGLN在PTC组织中的蛋白表达量明显低于癌旁正常甲状腺组织,差异有统计学意义(t =5.516,P<0.05,
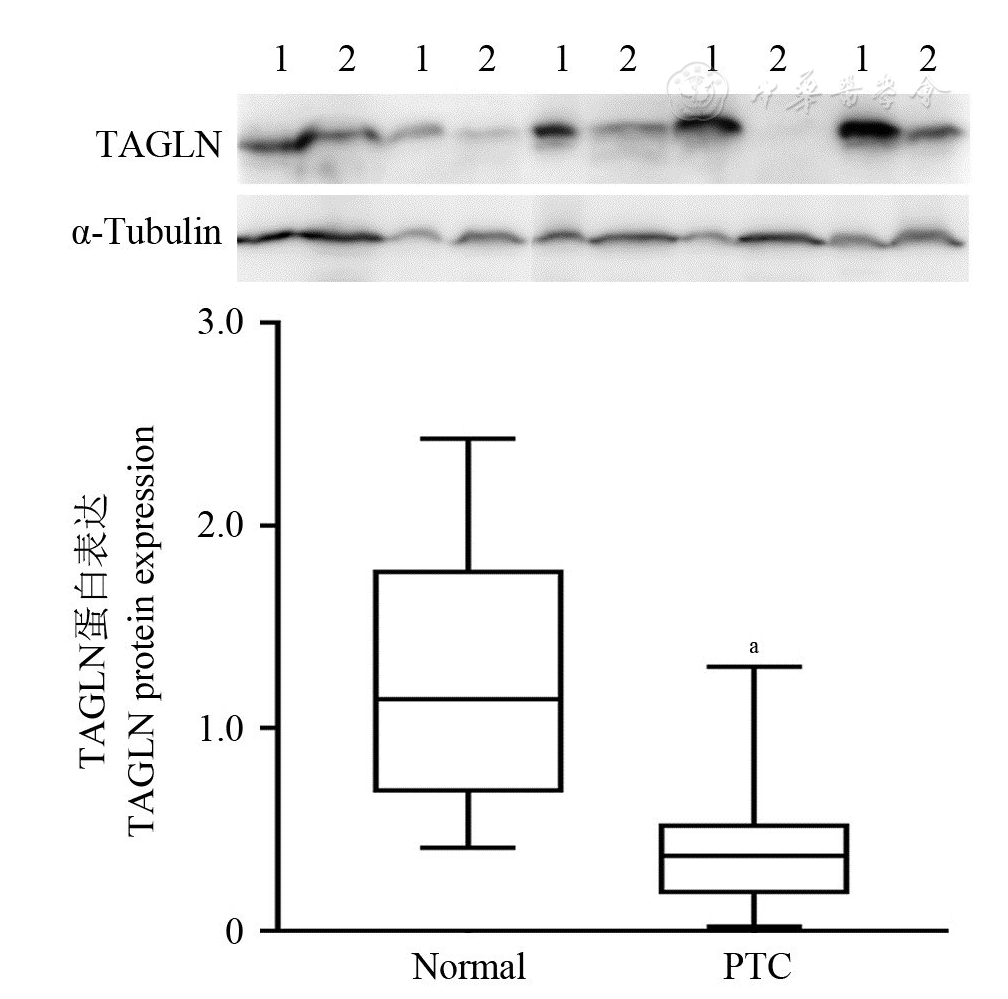
注:TAGLN:转胶蛋白Transgelin;1:Normal; 2:PTC; Normal:配对癌旁正常甲状腺组织Corresponding paracancerous normal thyroid tissues; PTC:甲状腺乳头状癌Papillary thyroid carcinoma; vs Normal, aP<0.01
为更进一步探索TAGLN在PTC组织和癌旁正常甲状腺组织中的表达情况,采用免疫组织化学方法进行验证。结果显示,TAGLN在癌旁正常甲状腺组织滤泡上皮细胞胞质中的表达明显高于在PTC细胞中的表达(
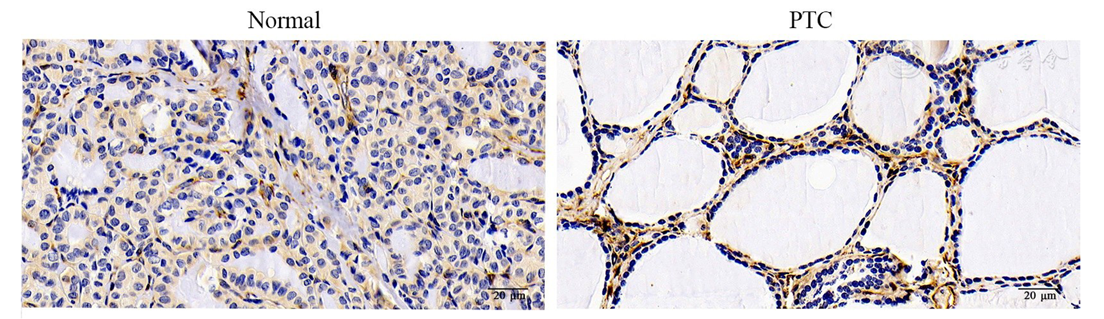
注:TAGLN:转胶蛋白Transgelin; Normal:配对癌旁正常甲状腺组织Corresponding paracancerous normal thyroid tissues; PTC:甲状腺乳头状癌Papillary thyroid carcinoma
通过CCK-8细胞增殖实验检测过表达和RNA干扰TAGLN后BCPAP细胞1~4 d内细胞增殖能力的变化情况。结果显示,过表达TAGLN后,细胞增殖能力显著减弱(P<0.01,
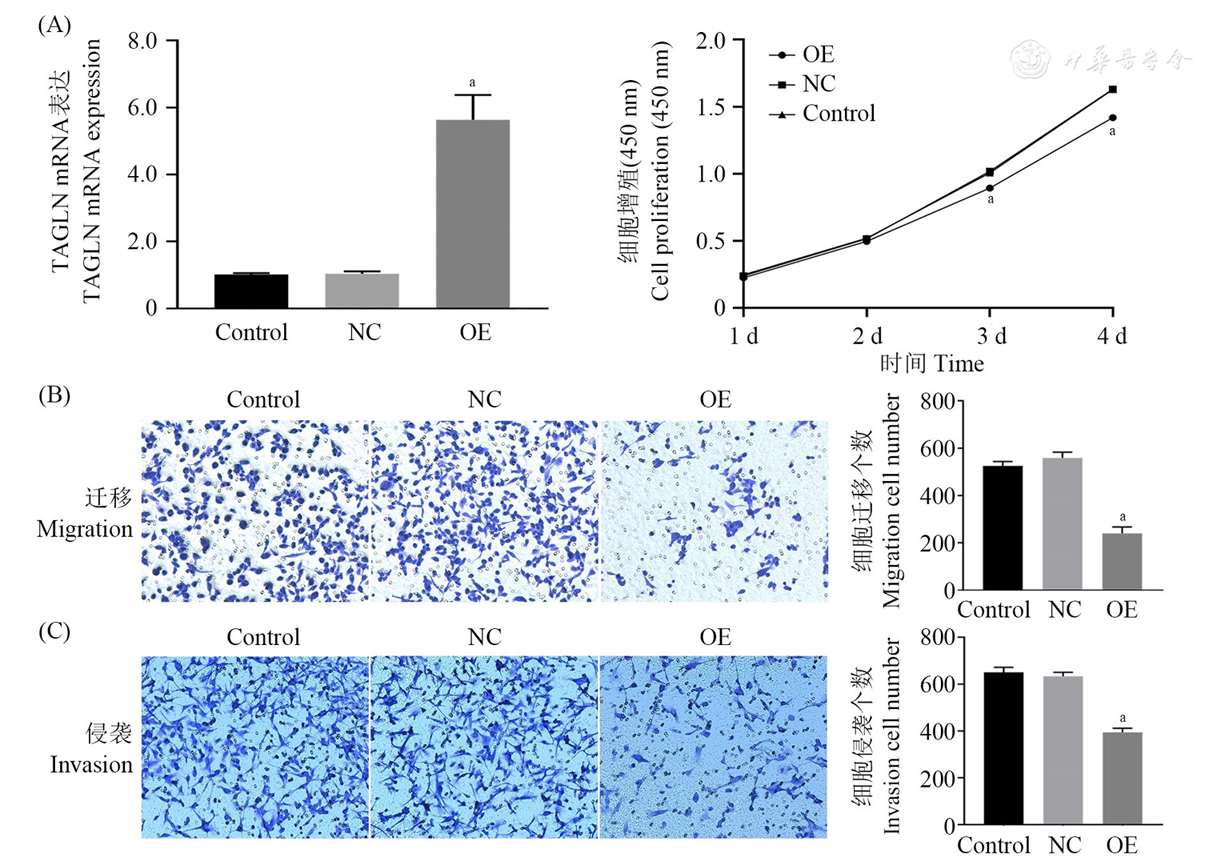
注:(A)BCPAP细胞增殖BCPAP cell proliferation; (B)BCPAP细胞迁移BCPAP cell migration; (C)BCPAP细胞侵袭BCPAP cell invasion; TAGLN:转胶蛋白Transgelin; Control:正常细胞组Normal cell group; NC:阴性对照组Negative control group; OE:过表达TAGLN组Overexpression TAGLN group; vs NC, aP<0.01
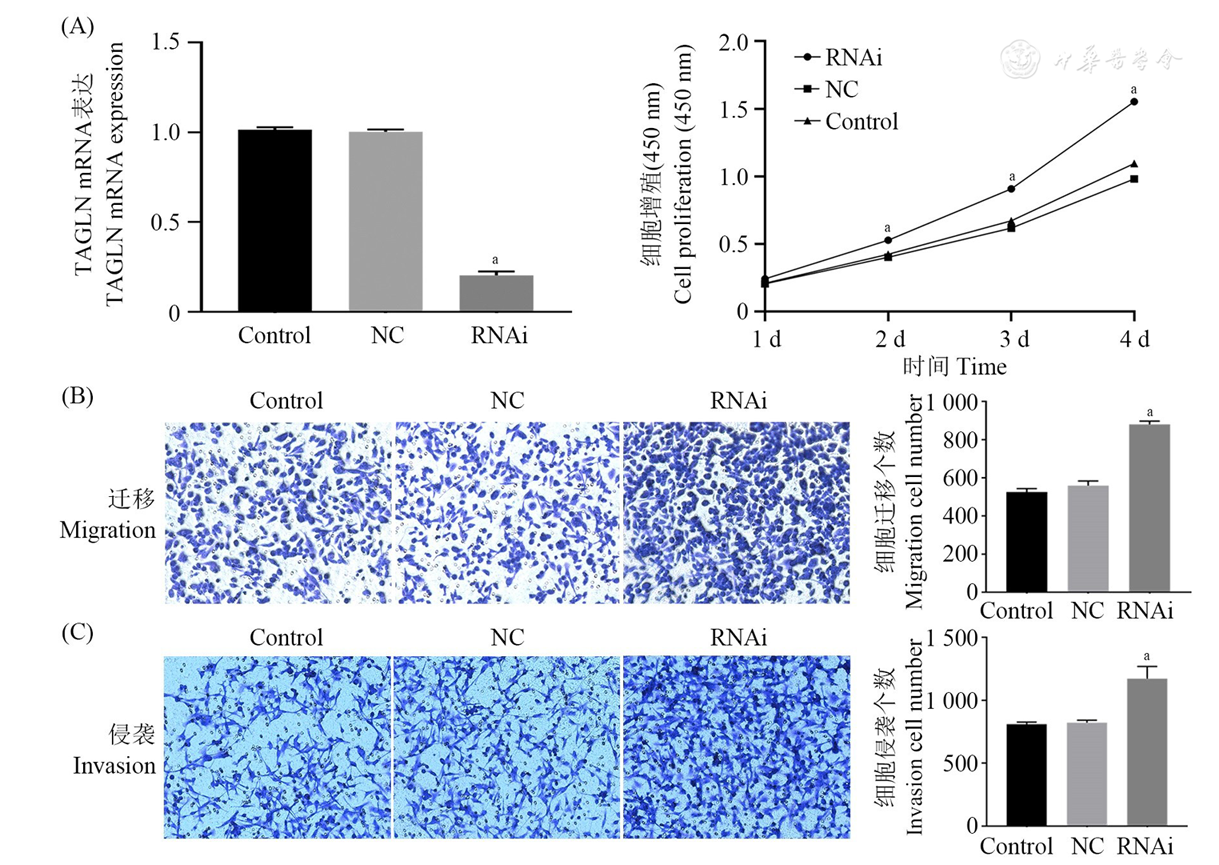
注:(A)BCPAP细胞增殖BCPAP cell proliferation; (B)BCPAP细胞迁移BCPAP cell migration; (C)BCPAP细胞侵袭BCPAP cell invasion; TAGLN:转胶蛋白Transgelin; Control:正常细胞组Normal cell group; NC:阴性对照组Negative control group; RNAi:敲减TAGLN组Knockdown TAGLN group; vs NC, aP<0.01
通过Transwell细胞迁移和侵袭实验,检测过表达和RNA干扰TAGLN基因后BCPAP细胞迁移和侵袭能力的变化。结果显示,过表达TAGLN后,BCPAP细胞的迁移能力显著下降(P<0.01,
为进一步了解与之相关的作用机制,通过Western印迹法分别检测过表达和RNA干扰TAGLN基因的PTC细胞对MAPK/ERK信号通路活性的影响。结果显示,过表达TAGLN显著降低了磷酸化ERK的蛋白表达量(P<0.05,
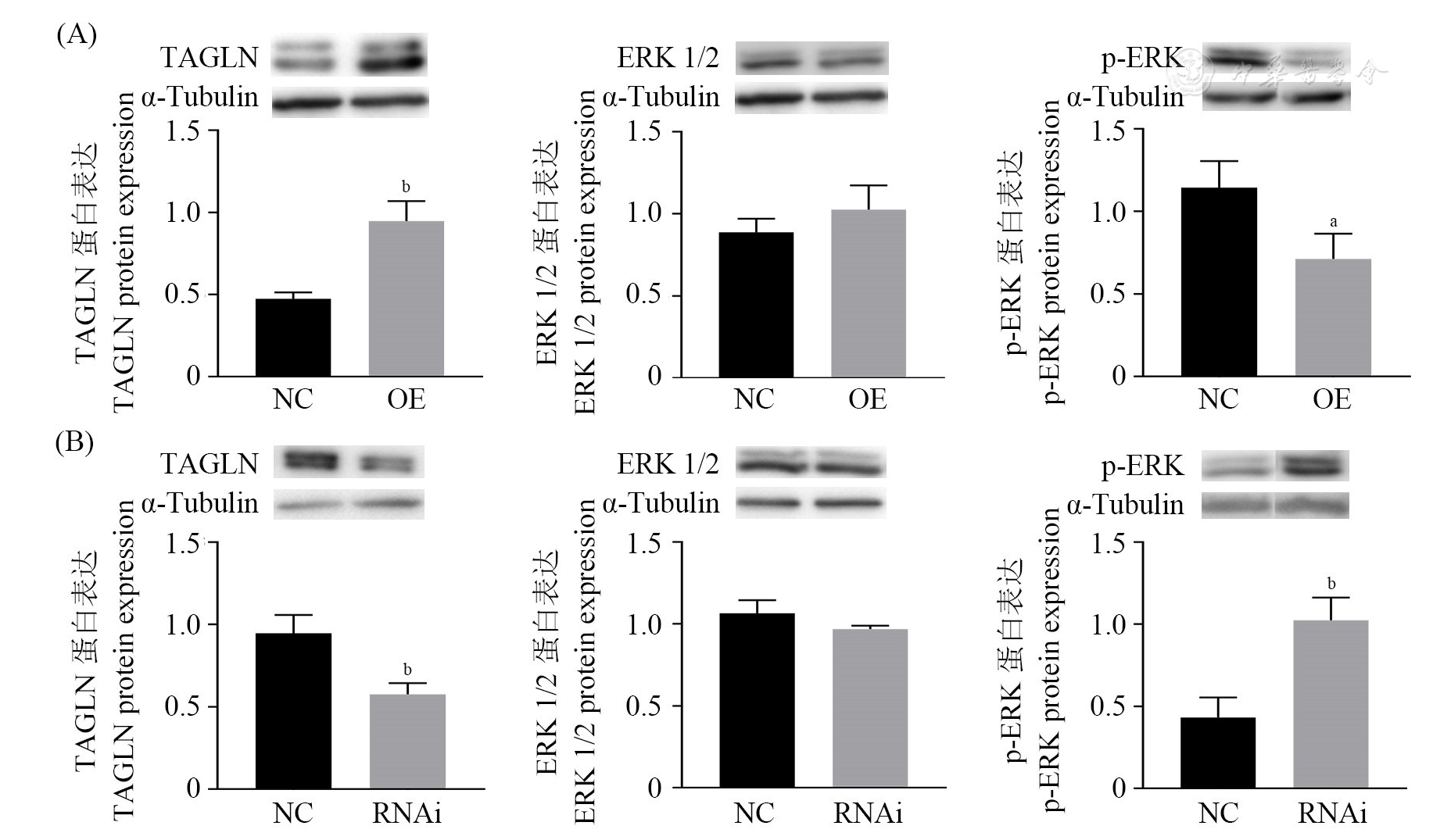
注:(A)过表达TAGLN Overexpression TAGLN; (B)敲减TAGLN Knockdown TAGLN; TAGLN:转胶蛋白Transgelin; MAPK:丝裂原活化蛋白激酶Mitogen-activated protein kinase; ERK:细胞外信号调节激酶Extracellular-signal regulating kinase; NC:阴性对照组Negative control group; OE:过表达TAGLN组Overexpression TAGLN group; RNAi:敲减TAGLN组Knockdown TAGLN group; vs NC, aP<0.05, bP<0.01
随着诊断技术和治疗水平的提高,甲状腺癌发病率开始趋于稳定,但仍然呈上升趋势[9,10]。PTC是发病率最高的病理类型,恶性程度低,但易复发和转移,影响着患者的预后及生存质量。PTC的分子发病机制涉及MAPK信号通路的激活,导制该通路激活的最常见原因是丝氨酸/苏氨酸蛋白激酶(BRAF)和Ras基因的点突变[11]。但具体的分子机制尚未阐明,因此有必要探究与其发生、发展、侵袭及转移相关的分子标志物,即在细胞恶性转化过程中起重要作用的蛋白质。TAGLN是一种肌动蛋白结合蛋白,其特征是具有钙蛋白同源结构域和类钙蛋白重复结构域,钙蛋白同源结构域与ERK相互作用,ERK也可以直接与肌动蛋白结合,为肌肉和非肌肉细胞中的ERK信号复合物提供支架[12]。ERK与肌动蛋白的细胞骨架相关联,诱导特定的细胞反应,并且肌动蛋白细胞骨架中产生的张力是驱动ERK信号转导的关键机制[13]。近年来,随着蛋白质组学的发展,越来越多的研究描述了TAGLN在肿瘤样本中不同的表达变化,如在膀胱癌、结直肠癌和食管癌中下调,在肺腺癌、前列腺癌和卵巢癌中上调[14,15,16,17,18,19]。这表明TAGLN在肿瘤调控中具有一定的复杂性,其去调控导致了许多类型癌症的发生。既往研究发现,TAGLN通过Ras与丝氨酸/苏氨酸特异性蛋白激酶1(Raf-1)分离,抑制Raf-1-丝裂原活化蛋白激酶激酶(MEK)1/2-ERK1/2信号转导通路,上调TAGLN明显抑制细胞增殖和迁移,诱导细胞周期阻滞,并且促进细胞凋亡[8]。综上,推测TAGLN很有可能与PTC的发生和发展有关。
本研究发现,TAGLN在PTC组织中表达降低,进而又探讨了其在BCPAP细胞中的作用。结果显示,过表达TAGLN可以抑制BCPAP细胞增殖、迁移和侵袭,而敲减TAGLN则促进BCPAP细胞增殖、迁移和侵袭。这些发现表明,TAGLN可能通过多种机制,在调节甲状腺癌的恶性生物学行为中起关键作用。据报道,MAPK/ERK途径也是甲状腺癌有希望的治疗靶点[20,21]。ERK1/2作为MAPK家族主要成员,通过激活细胞内信号转导过程,参与调节细胞增殖、凋亡、分化等多种重要的生物过程[22]。而本研究进一步探索了TAGLN与MAPK/ERK信号通路的关系。结果表明,TAGLN抑制磷酸化ERK的表达。由此,本研究推测TAGLN可能通过增强对MAPK/ERK信号通路的抑制作用,从而阻止了PTC的发生与发展,可能成为治疗甲状腺癌的潜在靶点。
目前,尚缺乏TAGLN在甲状腺癌方面的研究。本研究证明,TAGLN作为抑癌基因在PTC的发生和发展中起着重要作用,但其具体的分子机制尚未阐明。后续将深入探讨TAGLN与MAPK/ERK信号通路相互作用的机制,并从模式生物水平研究其对PTC发生与转归的影响,进一步提供靶向TAGLN和MAPK/ERK信号通路失调可能对甲状腺癌治疗具有直接临床意义的有力证据。
[1] Xing M. Molecular pathogenesis and mechanisms of thyroid cancer[J]. Nat Rev Cancer, 2013, 13(3): 184-199.
[2] Roman BR, Morris LG, Davies L. The thyroid cancer epidemic, 2017 perspective[J]. CurrOpin Endocrinol Diabetes Obes, 2017, 24(5): 332-336.
[3] Cabanillas ME, McFadden DG, Durante C. Thyroid cancer[J]. Lancet, 2016, 388(10061): 2783-2795.
[4] Ambrosi F, Righi A, Ricci C, et al. Hobnail variant of papillary thyroid carcinoma: a literature review[J]. Endocr Pathol, 2017, 28(4): 293-301.
[5] Chakraborty R, Saddouk FZ, Carrao AC, et al. Promoters to study vascular smooth muscle[J]. Arterioscler Thromb Vasc Biol, 2019, 39(4): 603-612.
[6] Dvorakova M, Nenutil R, Bouchal P. Transgelins, cytoskeletal proteins implicated in different aspects of cancer development[J]. Expert Rev Proteomics, 2014, 11(2): 149-165.
[7] Pawlak G, Helfman DM. Cytoskeletal changes in cell transformation and tumorigenesis[J]. CurrOpin Genet Dev, 2001, 11(1): 41-47.
[8] Dong LH, Wen JK, Liu G, et al. Blockade of the Ras-extracellular signal-regulated kinase 1/2 pathway is involved in smooth muscle 22 alpha-mediated suppression of vascular smooth muscle cell proliferation and neointima hyperplasia[J]. Arterioscler Thromb Vasc Biol, 2010, 30(4): 683-691.
[9] Siegel RL, Miller KD, Jemal A. Cancer statistics, 2019[J]. CA Cancer J Clin, 2019, 69(1): 7-34.
[10] Morris LG, Tuttle RM, Davies L. Changing trends in the incidence of thyroid cancer in the United States[J]. JAMA Otolaryngol Head Neck Surg, 2016, 142(7): 709-711.
[11] Borrelli N, Panebianco F, Condello V, et al. Characterization of activ-ating mutations of the MEK1 gene in papillary thyroid carcinomas[J]. Thyroid, 2019, 29(9): 1279-1285.
[12] Li M, Li S, Lou Z, et al. Crystal structure of human transgelin[J]. J Struct Biol, 2008, 162(2): 229-236.
[13] Hirata H, Gupta M, Vedula SR, et al. Quantifying tensile force and ERK phosphorylation on actin stress fibers[J]. Methods Mol Biol, 2017, 1487: 223-234.
[14] Tsui KH, Lin YH, Chang KS, et al. Transgelin, a p53 and PTEN-upregulated gene, inhibits the cell proliferation and invasion of human bladder carcinoma cells in vitro and in vivo[J]. Int J Mol Sci, 2019, 20(19): 4946.
[15] Yeo M, Park HJ, Kim DK, et al. Loss of SM22 is a characteristic signature of colon carcinogenesis and its restoration suppresses colon tumorigenicity in vivo and in vitro[J]. Cancer, 2010, 116(11): 2581-2589.
[16] Zhang J, Wang K, Zhang J, et al. Using proteomic approach to identify tumor-associated proteins as biomarkers in human esophageal squamous cell carcinoma[J]. J Proteome Res, 2011, 10(6): 2863-2872.
[17] Wu X, Dong L, Zhang R, et al. Transgelin overexpression in lung adenocarcinoma is associated with tumor progression[J]. Int J Mol Med, 2014, 34(2): 585-591.
[18] Mahal BA, Alshalalfa M, Zhao SG, et al. Genomic and clinical charac-terization of stromal infiltration markers in prostate cancer[J]. Cancer, 2020, 126(7): 1407-1412.
[19] Zadeh Fakhar HB, Zali H, Rezaie-Tavirani M, et al. Proteome profiling of low grade serous ovarian cancer[J]. J Ovarian Res, 2019, 12(1): 64.
[20] Petrulea MS, Plantinga TS, Smit JW, et al. PI3K/Akt/mTOR: A promising therapeutic target for non-medullary thyroid carcinoma[J]. Cancer Treat Rev, 2015, 41(8): 707-713.
[21] Milosevic Z, Pesic M, Stankovic T, et al. Targeting RAS-MAPK-ERK and PI3K-AKT-mTOR signal transduction pathways to chemosensitize anaplastic thyroid carcinoma[J]. Transl Res, 2014, 164(5): 411-423.
[22] Zou X, Blank M. Targeting p38 MAP kinase signaling in cancer through post-translational modifications[J]. Cancer Lett, 2017, 384: 19-26.
