白藜芦醇对阿尔茨海默病动物模型miRNA-106b的影响
2016年11月
中华神经科杂志,第49卷第11期 第846页-第851页
孔丹莉,赵祖国,何玉清,丁元林,罗燕鸿,梁碧玉,王瑾,于海兵
阿尔茨海默病( Alzheimer's disease,AD )是一种起病隐匿的进行性发展的神经系统退行性疾病[1],以进行性认知功能障碍和记忆损害为特征,是导致老年人痴呆的主要原因,其特征性的病理改变是大脑皮质和海马区域神经元数量减少、老年斑沉积或神经原纤维缠结[2]。在临床上以记忆障碍、失语、失用、失认、视空间技能损害、执行功能障碍以及人格和行为改变等全面性痴呆表现为特征,病因迄今未明。
循环微小RNA(miRNA)是一类由内源基因编码的长度约为22个核苷酸的非编码单链RNA分子,其表达水平在多种神经退行性疾病中存在特异变化[3]。由于miRNA敏感度及特异度较高,检测快速、简单、重复性好,故以miRNA作为标志物快速诊断AD正成为新的研究热点[4]。目前有关AD研究最多的miRNA有很多,比如:miRNA-9、miRNA-29、miRNA-101、miRNA-106、miRNA-107、miRNA-146家族、miRNA-153等。P62/SQSTM1蛋白(sequestosome 1)是自噬选择性底物,也是miRNA-106b的靶基因之一[5]。研究表明自噬是细胞的基本功能,自噬功能紊乱与许多疾病相关,已发现P62存在于AD脑组织中的神经原纤维缠结处,是AD和许多慢性退行性疾病的标志物[6]。
最近的研究表明,AD的发生发展与脂代谢紧密相关,尤其是三磷酸腺苷结合盒转运子A1(ATP binding cassette transport protein A1,ABCA1)调节转运胆固醇与β淀粉样蛋白(β amyloid protein,Aβ)沉积有着密切联系[7]。载脂蛋白A1(apolipoprotein A1,ApoA1)是一种主要的高密度脂蛋白,其基因变异也可影响蛋白质功能及脑内胆固醇代谢,进而增加AD的发病风险[8]。
白藜芦醇(resveratrol)是多酚类化合物,主要来源于虎杖、花生、葡萄、桑椹等植物。研究发现白藜芦醇具有广泛的生物学活性,是一种天然的抗氧化剂[9]。已有较多研究发现白藜芦醇可在一定程度上改善AD动物模型的学习记忆能力[10],同时减少脑组织中海马神经元的丢失,但目前关于白藜芦醇对AD中miRNA表达影响的报道很少。故我们通过建立小鼠AD模型,初步研究白藜芦醇对AD小鼠脑组织中miRNA-106b表达的影响,希望能为抗AD新药开发及临床治疗提供理论基础及依据。
无特定病原体级昆明小鼠50只,雄性,体重(22±3) g,由广东省医学实验动物中心提供,合格证号:SCXK(粤)2013-0002,使用标准饲料,自由饮水。
白藜芦醇(湖南洪江华光生物有限责任公司,纯度≥98 %,批号:080130);D-半乳糖(Sigma公司,美国,批号:106K0045);结晶氯化铝分析纯(广州化学制剂厂,批号:20060501);抗-淀粉样前体蛋白(amyloid precursor protein,APP)抗体(Abcam公司,英国,货号ab32136);鼠抗β肌动蛋白抗体(杭州联科生物公司,货号mab1445);抗鼠IgG,辣根过氧化物酶(HRP)标记抗体(Cell Signaling公司,美国);ReverTra Ace Qpcr逆转录试剂盒、SYBR Green荧光定量Master Mix(TOYOBO公司,日本,货号FSQ101、SCQ101);Qiagen 205311逆转录试剂盒(北京诺博莱德科技有限公司)。
Centrifuge 5810R型台式高速冷冻离心机(Eppendorf公司,德国);Synergy HT型多功能酶标仪(Bio Tek公司,美国);7500型PCR仪(ABI公司,美国);DYY-6C型电泳仪(北京六一仪器厂);BIO- RAD电泳、转膜及成像系统(BIO- RAD公司,美国)。
将实验小鼠适应性饲养1周,对动物进行称重,20~22 g的分在一组, 23~25 g的分一组,再从这些分好组的动物中按完全随机区组的抽样原则[11]分为5组:正常对照组、AD模型组、白藜芦醇高、中、低剂量组,每组10只。参照文献[12]造模:对正常对照组每天腹腔注射生理盐水,AD模型组和干预组每天腹腔注射D-半乳糖(120 mg/kg)及氯化铝灌胃(10 mg/kg),连续30 d。从第31天起在前述基础上白藜芦醇组分别灌胃20、40、80 mg/kg,连续60 d。
于末次给药2 h后进行小鼠跳台实验。开启DT-200小鼠跳台测试箱(成都泰盟科技有限公司),测试箱的底面铺有铜栅栏,内置有一个绝缘台作为实验对象回避电击的安全区。正式实验开始前将各组实验小鼠放在实验箱内自由活动,以适应环境5 min,然后开始测试:将铜栅栏通电到32 V,小鼠受到电击后,正常反应是跳上跳台回到安全区,躲避电击,如此学习5 min,记录学习成绩(小鼠遭受电击次数)。24 h后进行记忆能力测试,将小鼠直接放在跳台上,记录小鼠跳台错误次数,并以此评价小鼠的记忆能力。每次测试时都要求测试的各种环境因素如灯光、实验员站位等各种参照物要保持一致,而且要保持安静,水温恒定。
采用Trizol法[13]提取总RNA,检测所提RNA纯度及完整性。RNA样品经逆转录反应合成cDNA模板,然后进行PCR扩增,观察miRNA-106b、ABCA1表达情况。miRNA-106b的上游引物:5'-TAAAGTGCTGACAGTGCA-GAT-3',下游引物为Qiagen逆转录试剂盒中提供的通用引物。U6的上游引物:5'-GCTTCGGCAGCAC-ATATACTAAAAT-3';U6下游引物:5'-CGCTTCACG-AATTTGCGTGTCAT-3'。按照SYBR Green qPCR Master Mix试剂盒说明书进行PCR反应,95 ℃预变性15 min;95 ℃变性15 s,60 ℃退火30 s,72 ℃延伸30 s,40个循环,每次扩增设置U6为内参。ABCA1引物序列:上游5'-GATTGGCTTCAGGATG-TCCATGTTGGAA-3',下游5'-GTATTTTTGCAAGGC-TACCAGTTACATTTGACAA-3',PCR扩增产物长度为177 bp;β-肌动蛋白的引物序列:上游5'-GGGAAATCGTGCGTGACATT-3',下游5'- GCGGCA-GTGGCCATCTC-3',PCR扩增产物长度为144 bp。反应条件为:94 ℃预变性5 min,94 ℃变性30 s,60 ℃复性30 s,72 ℃延伸45 s,35个循环,72 ℃延伸10 min。根据标准曲线扩增效率的一致性,选用2-ΔΔCt法分析样本中miRNA-106b的相对表达量。
末次给药结束后将各组小鼠脱颈椎处死取脑,解剖显微镜下分离海马组织,按照比例每100 mg组织加入500 μl的细胞裂解液,10 μl蛋白酶抑制剂苯甲基磺酰氟,混合研磨后4 ℃离心(12 000 r/min,15 min),取上清液用BCA法测定蛋白质浓度,每孔上样50 μg,10%聚丙烯酰胺凝胶电泳分离样品,将蛋白转至聚偏二氟乙烯膜,用5%牛血清白蛋白室温封闭2 h,分别加入一抗(APP、P62、ApoA1和β-肌动蛋白抗体),4 ℃摇床过夜,加入二抗室温孵育2 h,然后加入增强化学发光液显色曝光。检测结果用吸光度法(quantity one)定量,分析各组间海马组织APP、P62、ApoA1的表达水平。
利用PCR法扩增APP的3' UTR序列,所使用的引物为5'-ACCCCCG-CCACAGCAGCCU-3'和5'-CAGCAGCGCACUCGGU-3'。然后将这序列克隆到pGL3荧光素酶的基本载体上,所生成的质粒命名为P3' UTR-APP。我们将P3' UTR-APP与miRNA-106b表达载体或阴性对照质粒共同转染至293T细胞内,转染48 h后收集细胞检测荧光酶素的活性。
采用SPSS13.0统计软件进行统计学处理。所有正态分布计量数据用均数±标准差(
与正常对照组相比,AD模型组小鼠的学习记忆能力明显下降(P<0.05)。与AD模型组相比,白藜芦醇干预高、中剂量组小鼠的潜伏期延长,错误次数也明显减少(均P<0.05;
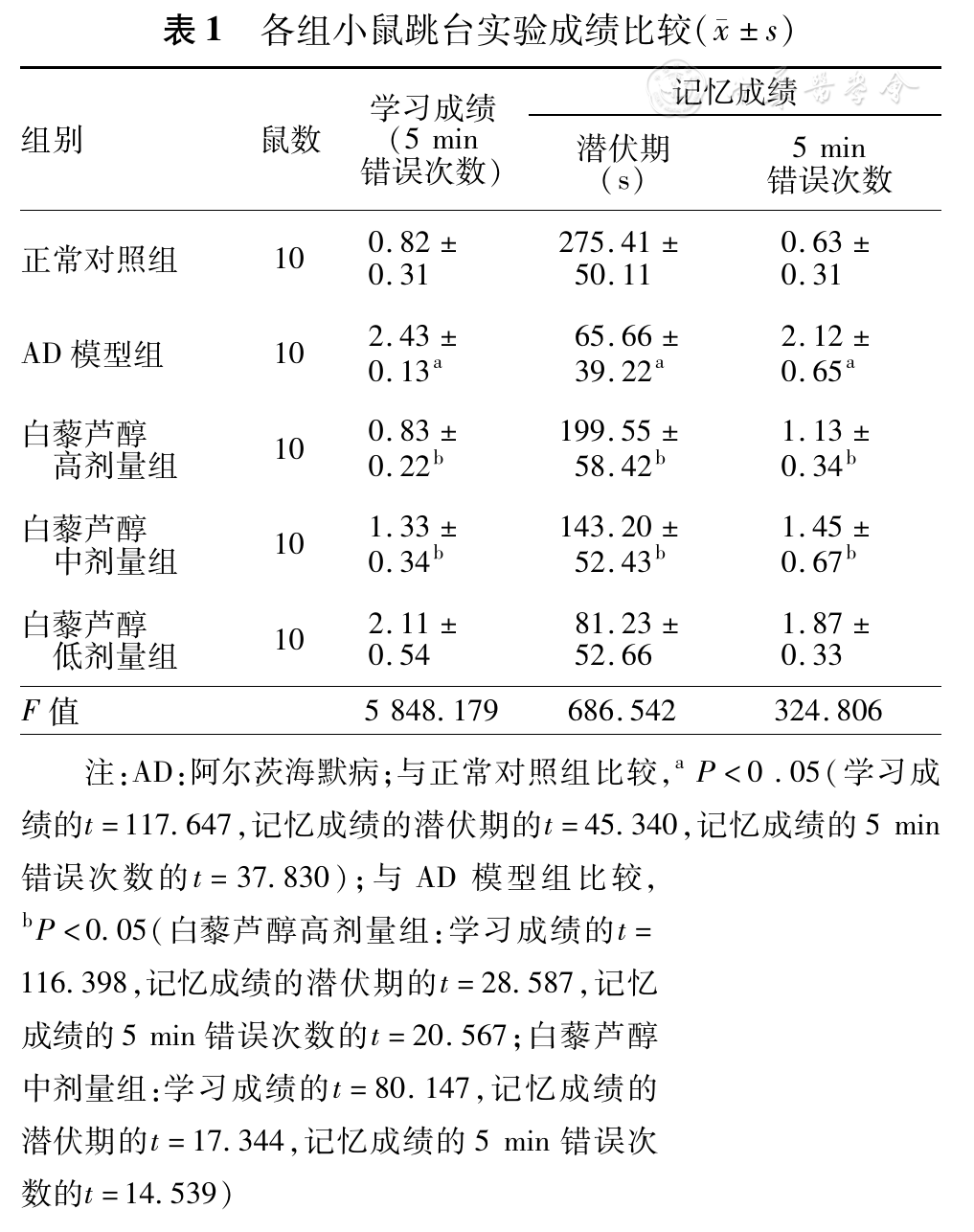
通过实验发现,AD模型组小鼠大脑miRNA-106b及ABCA1相对表达量较对照组明显降低,而白藜芦醇高、中剂量组处理后均可不同程度上调miRNA-106b及ABCA1水平(
1:正常对照组,2:阿尔茨海默病(AD)模型组,3、4、5:白藜芦醇低、中、高剂量组;图2同。与正常对照组相比,aP<0.05(miRNA-106b相对表达量:t=25.189;ABCA1相对表达量:t=24.033);与AD模型组相比,bP<0.05(miRNA-106b相对表达量:白藜芦醇中剂量组t=19.900,白藜芦醇高剂量组t=8.895;ABCA1相对表达量:白藜芦醇中剂量组t=7.791,白藜芦醇高剂量组t=4.973)
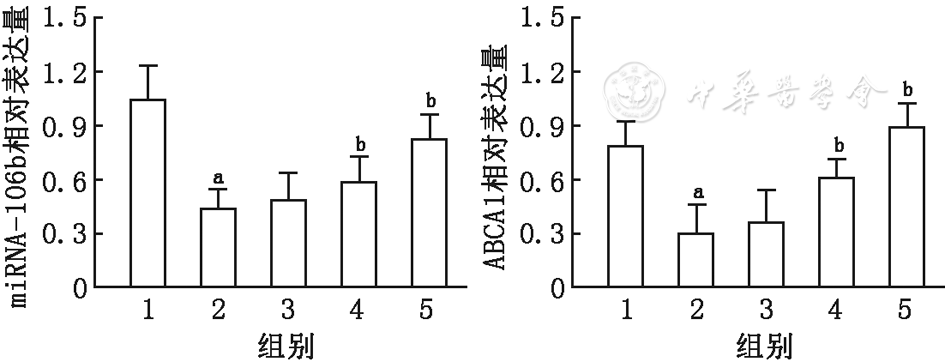
通过Western印迹法检测各组海马中APP、P62、ApoA1蛋白表达情况发现,与正常对照组相比,AD模型组APP表达明显增加,而P62及ApoA1表达水平较低;与AD模型组相比,白藜芦醇处理后各剂量组均可不同程度下调APP蛋白表达,同时可上调P62、ApoA1的水平,但低剂量组差异没有统计学意义(
与正常对照组相比, aP<0.05(APP相对灰度值:t=22.853,P62相对灰度值:t=24.491,ApoA1相对灰度值:t=23.900);与AD模型组相比,bP<0.05(APP相对灰度值:白藜芦醇中剂量组t=13.100,白藜芦醇高剂量组t=4.367;P62相对灰度值:白藜芦醇中剂量组t=10.378,白藜芦醇高剂量组t=10.241;ApoA1相对灰度值:白藜芦醇中剂量组t=12.300,白藜芦醇高剂量组t=2.935)
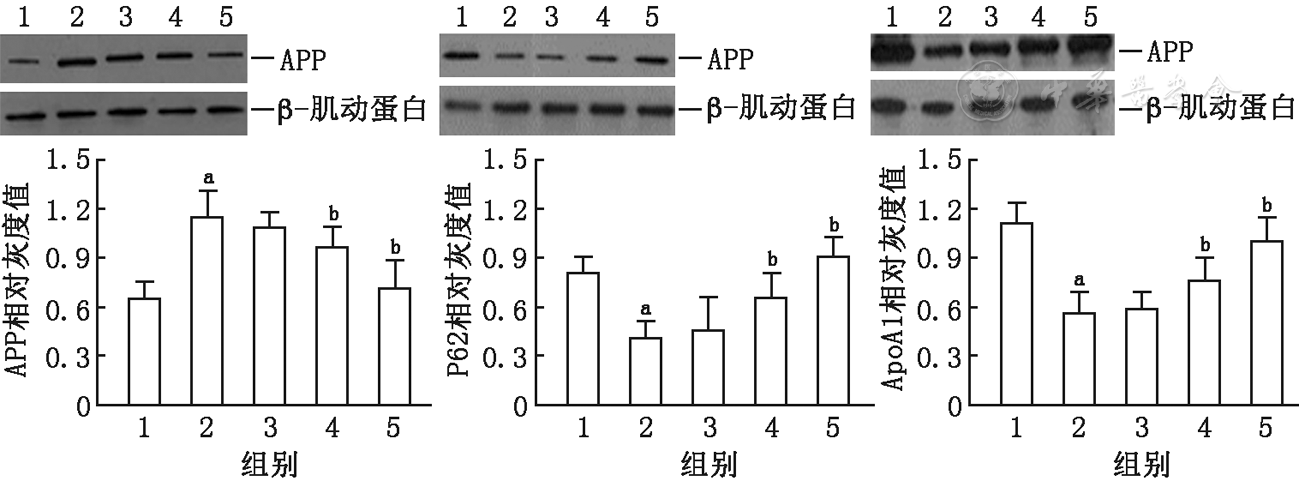
实验结果显示与对照组相比,miRNA-106b的过表达可明显抑制荧光素酶的活性(
P3' UTR-APP:APP的3' UTR序列,P3' UTRmut-APP:含有突变的APP 3' UTR序列
目前,有大量研究表明miRNAs参与了AD的发病过程并有可能起着关键作用[14]。虽然AD的具体发病机制仍不十分明确,但Aβ的产生和聚集被认为是重要因素之一[15]。Aβ来源于APP的蛋白水解,APP是一种膜蛋白,其生理功能尚未完全阐明,研究表明miRNA可调节APP的水平[16]。但是淀粉样蛋白假说认为APP的代谢紊乱是AD发病的始动因素,它可以导致Aβ的沉积,尤其是Aβ42。APP及其代谢产物除了发挥正常生理作用外,在AD的发病过程中也起到关键作用。研究发现,APP降解后产生的Aβ,在细胞外聚集形成老年斑影响AD发展进程[17]。以往的研究及本次研究都验证了miRNA-106b在APP的3'UTR有结合位点,而降低miRNA-106b的表达可能会导致APP蛋白水平的增加,从而影响Aβ的沉积。本次实验结果表明AD模型中miRNA-106b水平是降低的,而APP水平是升高的,进一步验证了miRNA-106b及其靶基因在AD发展中的作用。
研究发现P62作为自噬受体参与蛋白质降解的作用,在部分神经退行性疾病中起作用[18],例如,P62参与将AD相关tau蛋白转移到蛋白酶体降解,对AD患者具有保护作用;P62-/-鼠研究也发现,缺乏P62可引起脑组织多种改变,包括衰老相关的蛋白积聚、神经元死亡等。P62存在于AD脑组织神经原纤维缠结中[6],在AD脑组织中,自噬水平升高很可能促进Aβ生成。但关于自噬对神经元的影响研究结果存在争议。有些学者发现敲除小鼠自噬相关基因可引起进行性神经变性,而相反也有学者发现自噬增强可引起神经元死亡[19]。而实验发现AD模型中P62表达水平较低,而P62是miRNA-106的靶基因之一,这提示我们P62及miRNA-106很有可能与AD发病有关。
miRNA-106能够调节ABCA1[19],一种与ApoE脂化和Aβ生产相关的脂质转运体,从而影响Aβ形成。研究发现在AD转基因小鼠体内增加ABCA1的表达可以降低Aβ的沉积,缓解了AD的进展[20]。这些研究说明了ABCA1在AD发生发展中的重要地位,提示ABCA1很可能是AD进展过程中的一个重要的保护因子。本研究中我们也发现了AD模型中ABCA1的表达水平有所降低,提示ABCA1很可能参与AD进程,进一步验证了之前的研究结果。
由于AD的发生发展与脂代谢紧密相关,而ABCA1又被认为是形成高密度脂蛋白的关键蛋白,正常情况下,经ABCA1转运出细胞的胆固醇与ApoA1共同形成β-高密度脂蛋白,进而形成成熟的高密度脂蛋白[7]。Lewis等[21]发现,同时表达APP、PS1、ApoA1的转基因小鼠血清高密度脂蛋白水平明显高于只表达APP和PS1的转基因小鼠高密度脂蛋白水平,同时前者在行为学实验中的表现更接近正常老年鼠的表现,而后者则有空间和学习障碍的表现。所以我们有理由推断ApoA1在AD的进程中作用不可忽视,且很可能是与ABCA1相结合而共同发挥作用。
目前关于miRNAs在AD发病机制中的作用的研究已取得了一定的进展,但仍存在一定的局限性和挑战: (1)每种miRNA可作用于多个靶基因,只研究一种靶基因很有可能忽视了miRNAs的总体反应及各种靶蛋白的相互作用。(2)每个靶基因又很可能受多种miRNAs调控,仅集中于一种miRNA的影响,可能无法反映生物效应的真实性。(3)动物模型对研究疾病的发病机制很重要,但是人体特别复杂,这种结果很难应用到人体上。所以miRNAs对疾病的机制还需要深入探讨。
[1] 惠珊,王哲. MicroRNAs与阿尔茨海默病的研究进展[J]. 中风与神经疾病杂志, 2015, 32(7):664-666.
[2] 梁春联,秦川. MicroRNA在阿尔茨海默病发病机制中的作用[J]. 中国比较医学杂志, 2011, 21(6):75-79.
[3] 何祥,王涛,杜晓光, 等. MicroRNA在阿尔兹海默病中的作用研究[J]. 生命科学, 2015, 27(5):569-573.
[4] 艾海新,邓芳博,刘宏生. 与阿尔茨海默病发病机制相关的microRNA的研究现状及进展[J]. 辽宁大学学报(自然科学版), 2015, 42(3):263-269.
[5] 段冉冉,李燕飞,贾延劼. 与阿尔茨海默病发病机制相关的microRNA的研究进展[J]. 中国神经精神疾病杂志, 2013, 39(9):569-573.
[6] 张坤西,张洁,郭艳苏. P62蛋白的研究[J]. 脑与神经疾病杂志, 2016, 24(1):59-61.
[7] 滕志朋,王晨,张雄,等. 姜黄素对APP/PS1双转基因鼠海马ABCA1、apoA1的表达和血清TC、HDL含量的影响[J]. 重庆医科大学学报, 2014, 39(2):146-149.
[8] Vollbach H, Heun R, Morris CM, 等. APOA1基因多态性影响早发非家族性阿尔茨海默病的风险[J]. 世界核心医学期刊文摘(神经病学分册), 2005, 58(3):436-441.
[9] 韩晶晶,刘炜,毕玉平. 白藜芦醇的研究进展[J]. 生物工程学报, 2008, 24(11):1851-1859.
[10] 李娜,程雪娇,王茜, 等. 白藜芦醇抑制海马β-APP表达改善大鼠学习记忆[J]. 中国公共卫生, 2015, 31(03):327-329.
[11] 赵伟,孙国志. 常用实验动物随机分组方法[J]. 畜牧兽医科技信息, 2009, (4):61-62.
[12] 林茂,万章,王春梅. 白藜芦醇对阿尔茨海默病小鼠记忆和抗氧化能力的影响[J]. 现代中西医结合杂志, 2009, 18(5):484-486.
[13] 易浪,方斌,陈鹏,等. 桃红四物汤对巨噬细胞TGF-β1和TNF-α mRNA转录的影响[J]. 中国实验方剂学杂志, 2013, 19(2):178-182.
[14] 牛静亚,张睿,许顺江. MicroRNAs在阿尔茨海默病发病中的作用[J]. 中国老年学杂志, 2014, 34(4):1127-1129.
[15] Hébert SS, Horré K, Nicola? L, et al. MicroRNA regulation of Alzheimer's Amyloid precursor protein expression[J]. Neurobiol Dis, 2009, 33(3):422-428.
[16] 隋小龙,梁良,张玲, 等. 中药1号方对APP/PS1双转基因模型小鼠APP代谢的影响[J]. 中国实验动物学报, 2014, 22(6):49-53.
[17] Patel N, Hoang D, Miller N, et al. MiRNAs can regulate human APP levels[J]. Mol Neurodegener, 2008, 3(1):8138-8143.
[18] 刘诗濛,董越娟,刘彬. P62与蛋白降解途径的研究进展[J]. 生理学报, 2015, 67(1):48-58.
[19] Kim J, Yoon H, Ramirez CM, et al. MiR-106b impairs cholesterol efflux and increases Abeta levels by repressing ABCA1 expression[J]. Exp Neurol, 2012, 235(2):476-483.
[20] 孙洁芸,李丹,王晨,等. 姜黄素对APPswe/PSEN1dE9双转基因小鼠学习记忆能力及大脑中Aβ42表达的影响[J]. 中国药理学通报, 2013, 29(8):1084-1088.
[21] Lewis TL, Cao D, Lu H, et al. Overexpression of human apolipoprotein A-I preserves cognitive function and attenuates neuroinflammation and cerebral amyloid angiopathy in a mouse model of Alzheimer disease[J]. J Biol Chem, 2010, 285(47):36958-36968.
