急性脑梗死卒中病灶特点与卒中后抑郁的相关性分析
2016年12月
中华神经科杂志,第49卷第12期 第936页-第941页
李雪斌,杨彩梅,王洁,黄建敏,蒙兰青,李保生,陆皓,吴为民
卒中后抑郁(post-stroke depression,PSD)是脑卒中后常见的神经精神并发症。在临床上,PSD的主要症状包括情绪低落、体重改变、失眠、疲劳、无价值感和快感缺乏,其中以情绪低落和体重改变为核心症状。PSD不仅对脑卒中患者神经功能康复产生负面的影响,而且是导致卒中患者生活质量降低及增加发病率的一个危险因素[1,2]。研究表明,首次脑卒中患者有发生PSD的倾向之前若给予一定的干预治疗,能降低PSD的患病率,并能促进患者康复[3]。但目前PSD诊断率低,发病机制尚未明确,影响因素较多,而关于PSD与病灶部位之间关系的研究存在较大争议,特别是PSD与脑梗死体积是否具有相关性仍不得而知。因此,我们旨在探讨PSD与病灶部位及脑梗死体积之间的关系,期望进一步了解其相关危险因素,为提高PSD早期诊断提供一定的临床参考价值。
185例患者均为2015年1月至2016年1月在广西壮族自治区百色市右江民族医学院附属医院神经内科住院治疗的急性缺血性脑卒中病例。入选标准:所有患者诊断均符合2014年中国急性缺血性脑卒中诊治指南标准,并通过头颅CT或MRI检查证实;均为成年人急性缺血性脑卒中,入选时间均为发病2周之内;意识清楚,无严重失语。排除标准:脑卒中前有抑郁症、痴呆、认知功能障碍及智能障碍、其他精神障碍、遗传精神病家族史等;其他中枢神经系统疾病,如颅内创伤、中枢神经系统感染等;患有严重躯体疾病,如休克或恶性肿瘤等。本研究经右江民族医学院附属医院医学伦理委员会审查批准,所有受试者均对研究知情并签署知情同意书。
符合研究入组的缺血性脑卒中患者共185例(男性116例,女性69例),年龄33~84岁,平均(61.15±10.84)岁。根据是否合并有抑郁,分为卒中后无抑郁(non-PSD)组和PSD组,其中non-PSD组患者110例(男性74例,女性36例),年龄34~82岁,平均(60.17±11.04)岁;PSD组患者75例(男性42例,女性33例),年龄33~84岁,平均(62.57±10.43)岁。non-PSD组和PSD组患者在性别、年龄、民族、文化程度等分布方面差异无统计学意义。
本研究中抑郁的诊断按照美国精神病学会精神障碍诊断和统计手册第5版(diagnostic and statistical manual of mental disorder-Ⅴ,DSM-Ⅴ)标准[4]。采用24项汉密尔顿抑郁量表(HAMD)对入组患者在发病2周内进行抑郁程度评价。HAMD评分得分<8分为无抑郁,8~19分为轻度抑郁,20~34分为中度抑郁,≥35分为重度抑郁;根据抑郁的诊断标准再进行诊断,排除未达到抑郁标准者,最终得到结果:185例患者中共75例发病,总的抑郁发生率为40.54%,其中轻度抑郁51例,占27.57%,中度抑郁20例,占10.81%,重度抑郁4例,占2.16%。
PSD组中轻度抑郁者51例(男性25例,女性26例),平均(63.27±10.04)岁;中度抑郁者20例(男性14例,女性6例),平均(61.35±11.91)岁;重度抑郁者4例(男性3例,女性1例),平均(59.75±8.67)岁。
入组患者均在发病2周内完成头颅MRI(1.5 T SIEMENS,MAGNETOM Essenza磁共振扫描仪,西门子公司,德国)检查,所有患者全部完成横断面和矢状面T1、T2及FLAIR加权像的MRI扫描,层厚5 mm。(1)根据患者的病史、临床症状及MRI结果,将入组患者分为:左右额叶、颞叶、顶叶、枕叶、岛叶、基底节、小脑及脑干卒中;(2)单纯左半球卒中与非单纯左半球卒中(包括右侧大脑半球、双侧大脑半球及小脑、脑干);(3)采用牛津郡社区卒中规划(Oxfordshire Community Stroke Project,OCSP)将所有入组患者分别分为:全前循环梗死(total anterior circulation infarct,TACI)、部分前循环梗死(part anterior circulation infarct,PACI)、后循环梗死(posterior circulation infarct,POCI)和腔隙性梗死(lacunar infarct,LACI)4型;(4)根据卒中患者MRI结果计算病灶数目,并根据病灶数分为:单病灶和多病灶(病灶数目≥2个);(5)采用改良的椭圆体法[5]计算脑梗死体积:脑梗死体积=A×B×C×0.5/2 ml(A、B为FLAIR加权像上最大脑梗死横断面的最大垂直径线,C为层数,层厚为5 mm)。以上内容均由两名受过培训的神经影像科医生完成,并取其平均值。
采用SPSS 16.0统计软件进行统计学处理。正态分布的计量资料以均数±标准差表示,组间比较采用两独立样本t检验或近似t检验或单因素方差分析(One-Way ANOVA)或方差分析近似检验。计数资料以率(%)或相对数构成比(%)表示,进行χ2检验或连续校正法,样本量较小时用Fisher精确概率法。双变量间的相关关系行Pearson相关分析和偏相关分析。多因素分析用Logistic逐步回归分析。均以P<0.05为差异有统计学意义。
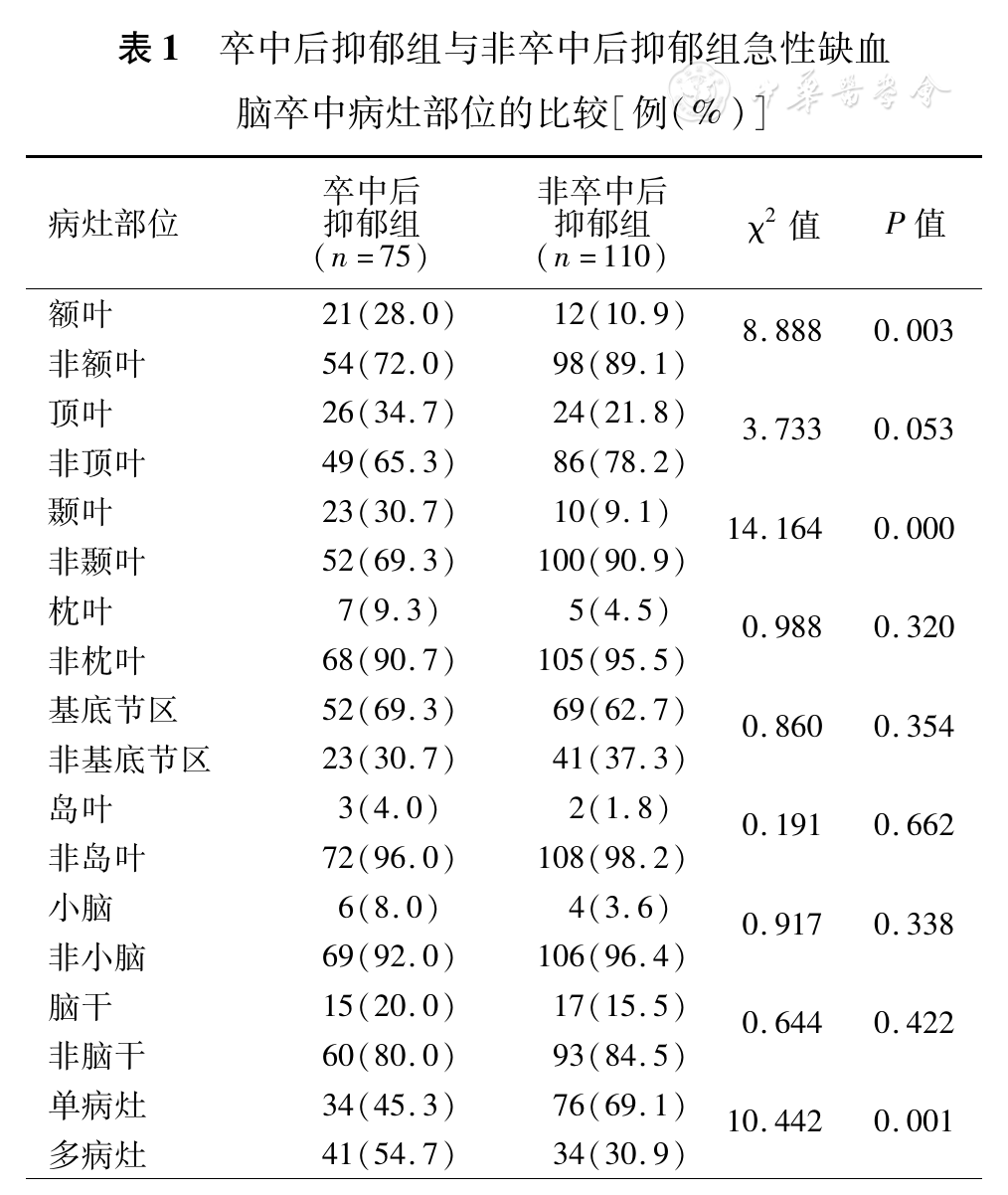
额叶卒中在两组患者中抑郁的发生率分别为28.0%(21/75)和10.9%(12/110),组间比较差异有统计学意义;颞叶卒中在两组患者中抑郁的发生率分别为30.7%(23/75)和9.1%(10/110),组间比较差异有统计学意义;多病灶卒中在两组患者中抑郁的发生率分别为54.7%(41/75)和30.9%(34/110),组间比较差异有统计学意义。
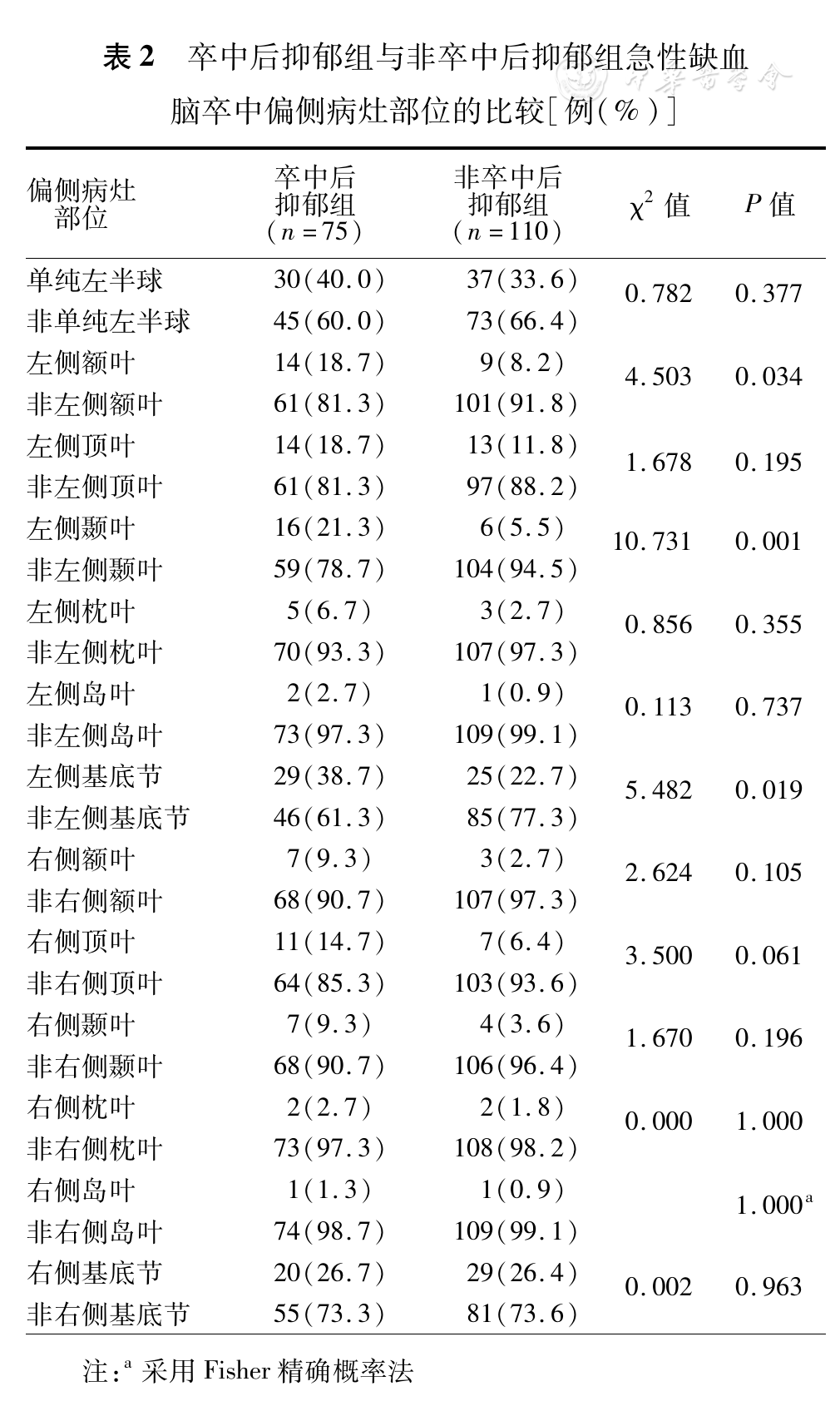
左额叶卒中在两组患者中PSD发生率分别为18.7%(14/75)和8.2%(9/110),组间比较差异有统计学意义;左颞叶卒中在两组患者中PSD发生率分别为21.3%(16/75)和5.5%(6/110),组间比较差异有统计学意义;左基底节卒中在两组患者中PSD发生率分别为38.7%(29/75)和22.7%(25/110),组间比较差异有统计学意义。
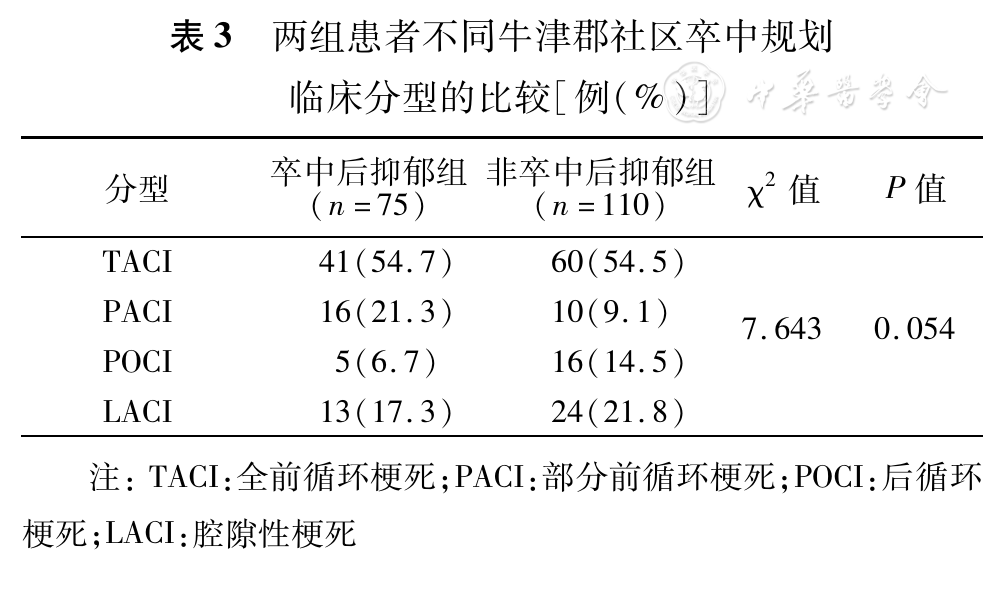
采用OCSP将患者分别分为TACI、PACI、POCI和LACI 4型,4种不同OCSP临床分型在PSD组和non-PSD组患者间比较差异无统计学意义(
两组患者的脑梗死平均体积分别为(3.35±1.51) ml和(2.78±1.18) ml,组间比较差异有统计学意义(t=2.758,P<0.05);两组患者的平均病灶数目分别为1.95±1.10和1.45±0.76,组间比较差异有统计学意义(t=3.360,P<0.05)。
无抑郁组有110例,轻度抑郁组有51例,中重度抑郁组有24例,三组脑梗死平均体积分别为(2.78±1.18)、(3.10±1.40)和(3.87±1.64) ml,三组间比较差异有统计学意义(F=7.090,P<0.05);三组平均病灶数目分别为1.45±0.76、1.76±1.05和2.33±1.13,中重度抑郁组平均病灶数目高于轻度抑郁组和无抑郁组患者,差异有统计学意义(F=7.497, P<0.05)。
Pearson相关分析结果显示,急性缺血性卒中患者的脑梗死体积(r=0.208,P=0.005)、病灶数目(r=0.298,P=0.000)与HAMD评分呈正相关。为控制其他因素的影响,进一步行偏相关分析,结果与前一致(脑梗死体积r=0.189,P=0.010,病灶数目r=0.286,P=0.000)。
以急性缺血性卒中患者是否抑郁作为因变量,脑梗死体积和病灶数目作为自变量,进行急性缺血性PSD的二分类Logistic逐步回归分析。分析结果显示,排查混杂因素的影响后,脑梗死体积和病灶数目可能是急性缺血性PSD的独立危险因素。脑梗死体积越大的卒中患者患PSD风险是脑梗死体积小的1.348倍,病灶数目多的卒中患者患PSD风险是病灶数目少的1.722倍(

有研究报道,PSD发生率存在广泛的差异,平均发生率30%~35%,其中卒中后2周时抑郁发病率为6%~41%[6,7]。卒中后1~2个月PSD发生率仍继续上升,3~4个月达到高峰,长达7年随访仍存在抑郁症状。目前有研究显示,约33%卒中幸存者存在抑郁症状[8]。因此,PSD普遍存在于卒中幸存者中,持续时间长,严重地影响卒中患者的预后,增加病死率。本研究结果显示,185例患者中共75例患有抑郁,总的发生率为40.54%,其中轻度抑郁占27.57%,中度抑郁占10.81%,重度抑郁占2.16%,提示急性缺血性卒中后抑郁主要以轻、中度抑郁为主,与国内外大部分文献报道基本一致。
左侧大脑半球是大多数人的优势半球,尤其是左侧额叶或额极,在情感处理、注意力、记忆力、语言、逻辑思维和综合分析能力等方面起关键性的作用,因此该侧大脑病变则易引起精神障碍。目前,多数研究者认为卒中病灶累及额叶-皮质下(FSC)环路或边缘系统-皮质-纹状体-苍白球-丘脑(LCSPT)神经环路,导致5-羟色胺能和去甲肾上腺素(norepinephrine,NE)能神经轴突中断,使5-羟色胺、NE等神经递质水平下降而发生PSD。
关于PSD与卒中病灶的关系研究甚多,但结果众说纷纭。早期Robinson等[9]提出重度PSD与特定卒中部位相关,尤其靠近额极的病变是PSD发病的重要危险因素[10]。Terroni等[11]的MRI研究显示,病灶部位累及左侧的LCSPT神经环路,尤其是前额叶内侧和腹侧皮质、杏仁核等部位易导致PSD。近年来的研究也表明,PSD的发病与左侧大脑损伤,特别是左侧皮质和皮质下损伤有关,且左侧病变较右侧更易导致抑郁[12,13,14]。本研究结果显示,PSD组患者病灶部位以额叶、颞叶,特别是以左额叶、左颞叶及左基底节区卒中PSD发生率明显升高,均高于non-PSD组,提示卒中急性期左额叶、左颞叶与左基底节区的损伤易导致PSD,也说明左侧大脑半球的损伤易导致PSD,此结果不同于Wei等[15]研究,但与中国人群Zhang等[16]观点相似。推测可能原因是:(1)这些病灶损害或累及调节情感的LCSPT神经环路,引起5-羟色胺、NE等神经递质水平下降而发生PSD;(2)5-羟色胺和NE能神经元主要位于脑干,其神经轴突向上辐射通过下丘脑、基底节和放射冠,最终到达皮质,纤维束由前向后排列,当卒中病变部位在左额叶、左颞叶及基底节区可能更容易损伤这些神经元而导致抑郁症;(3)左侧大脑半球卒中患者的右侧大脑半球5-羟色胺受体敏感性增高,导致5-羟色胺神经递质水平降低而诱发PSD,这能解释PSD发病的偏侧性[17];(4)左额叶和基底节区脑卒中破坏5-羟色胺能和NE能神经元较右侧大脑半球轻,其相对较少的5-羟色胺和NE两种神经递质水平下降不足,引起代偿性5-羟色胺受体水平上调,最终导致5-羟色胺和NE两种神经递质减少而诱发PSD[18]。但最近的一项系统评价显示,卒中亚急性期PSD的发生与右侧大脑半球损伤密切相关,而左侧大脑半球损伤则不然[19]。造成与本研究结果不同的原因可能是方案设计、样本来源、抑郁评定标准和评估时间以及对试验结果理解等方面的差异所致。
我们还发现,多病灶卒中比单病灶卒中患者更易导致PSD,随着脑梗死体积增大和病灶数目增多,抑郁严重程度有加重的趋势,病灶数目和脑梗死体积可能是急性缺血性卒中后抑郁发生的独立危险因素,多病灶卒中患者患PSD的风险是单病灶卒中的1.72倍,脑梗死体积越大的患者患PSD的风险是脑梗死体积小的1.35倍。Nys等[20]研究表明,在卒中后第1周时,卒中损伤体积与PSD密切相关。另一项研究也发现,PSD组患者的脑梗死体积及病灶数目显著高于非PSD组患者[16]。推测可能的原因是:(1)卒中患者病灶数目越多,脑梗死体积范围越大,更加容易累及调节情绪的FSC或LCSPT神经环路,5-羟色胺、NE能神经元损害概率更大,进而易导致PSD的发生。(2)脑梗死体积越大,损害肢体功能的责任灶区域风险越大,神经功能缺损越重,使患者的社会和经济地位显著下降,给患者造成更大的心理负担,加重患者神经内分泌和神经免疫功能紊乱,一定程度上促进了PSD的发生和加重。
综上所述,PSD是目前卒中常见的并发症之一,发病率较高,普遍存在于脑梗死幸存者中。卒中病灶部位、病灶数目、脑梗死体积与PSD的发生密切相关,病灶数目、脑梗死体积可能是急性缺血性卒中后抑郁发生的独立危险因素。本研究的不足之处在于,以急性缺血性卒中患者为研究对象,排除了亚急性期及慢性期的卒中患者,样本量较小,其他因素未考虑列入本研究,同时量表评价及影响学诊断也存在偏倚,这些均可能会造成PSD患者的遗漏或误诊,从而使得研究结果受到影响。下一步需扩大样本含量,延长研究的时间跨度和增加时间点,临床和动物研究相结合,有必要构建多中心合作研究模式,进一步深化研究,以提供更可靠的PSD病因学证据。总的来说,早期发现、早期诊断、早期干预及治疗PSD,能改善卒中患者的预后,促进其躯体功能早期康复,减轻患者的家庭及心理负担。
[1] Loubinoux I, Kronenberg G, Endres M, et al. Post-stroke depression: mechanisms, translation and therapy[J]. J Cell Mol Med, 2012, 16(9): 1961-1969.
[2] Quaranta D, Marra C, Gainotti G. Post-stroke depression: Main phenomenological clusters and their relationships with clinical measures[J]. Behav Neurol, 2012, 25(4): 303-310.
[3] 卢瑞春,苗丹,王昊,等. 早期应用小剂量阿米替林干预首发脑卒中患者脑卒中后抑郁[J].中华神经科杂志,2010, 43(5): 355-357.
[4] 美国精神医学学会. 精神障碍诊断与统计手册(案头参考书):第五版[M].(美)张道龙等,
[5] Kissela B, Broderick J, Woo D, et al. Greater Cincinnati/Northern Kentucky Stroke Study: volume of first-Ever ischemic stroke among blacks in a population-based study[J]. Stroke, 2001, 32(6): 1285-1290.
[6] Whyte EM, Mulsant BH. Post stroke depression: epidemiology, pathophysiology, and biological treatment[J]. Biol Psychiatry, 2002, 52(3): 253-264.
[7] Townend BS, Whyte S, Desborough T, et al. Longitudinal prevalence and determinants of early mood disorder post-stroke[J]. J Clin Neurosci, 2007, 14(5): 429-434.
[8] de Man-van Ginkel JM, Hafsteinsdóttir TB, Lindeman E, et al. In-hospital risk prediction for post-stroke depression: development and validation of the Post-stroke Depression Prediction Scale[J]. Stroke, 2013, 44(9): 2441-2445.
[9] Robinson RG, Kubos KL, Starr LB, et al. Mood disorders in stroke patients. Importance of location of lesion[J]. Brain, 1984, 107(Pt 1): 81-93.
[10] Singh A, Black SE, Herrmann N, et al. Functional and neuroanatomic correlations in poststroke depression: the Sunnybrook Stroke Study[J]. Stroke, 2000, 31(3): 637-644.
[11] Terroni L, Amaro E, Iosifescu DV, et al. Stroke lesion in cortical neural circuits and post-stroke incidence of major depressive episode: a 4-month prospective study[J]. World J Biol Psychiatry, 2011, 12(7): 539-548.
[12] Rajashekaran P, Pai K, Thunga R, et al. Post-stroke depression and lesion location: A hospital based cross-sectional study[J]. Indian J Psychiatry, 2013, 55(4): 343-348.
[13] Ahn DH, Lee YJ, Jeong JH, et al. The effect of post-stroke depression on rehabilitation outcome and the impact of caregiver type as a factor of post-stroke depression[J]. Ann Rehabil Med, 2015, 39(1): 74-80.
[14] Sun N, Li QJ, Lv DM, et al. A survey on 465 patients with post-stroke depression in China[J]. Arch Psychiatr Nurs, 2014, 28(6): 368-371.
[15] Wei C, Zhang F, Chen L, et al. Factors associated with post-stroke depression and fatigue: lesion location and coping styles[J]. J Neurol, 2016, 263(2): 269-276.
[16] Zhang T, Jing X, Zhao X, et al. A prospective cohort study of lesion location and its relation to post-stroke depression among Chinese patients[J]. J Affect Disord, 2012, 136(1-2): e83-87.
[17] Mayberg HS, Robinson RG, Wong DF, et al. PET imaging of cortical S2 serotonin receptors after stroke: lateralized changes and relationship to depression[J]. Am J Psychiatry, 1988, 145(8): 937-943.
[18] Starkstein SE, Manes F. Apathy and depression following stroke[J]. CNS Spectr, 2000, 5(3): 43-50.
[19] Wei N, Yong W, Li X, et al. Post-stroke depression and lesion location: a systematic review[J]. J Neurol, 2015, 262(1): 81-90.
[20] Nys GM, van Zandvoort MJ, van der Worp HB, et al. Early depressive symptoms after stroke: neuropsychological correlates and lesion characteristics[J]. J Neurol Sci, 2005, 228(1): 27-33.
