Lembert-Eaton肌无力综合征患者11例运动易化试验
2016年12月
中华神经科杂志,第49卷第12期 第947页-第951页
丁青云,方佳,管宇宙,崔丽英,胡右方
Lambert-Eaton肌无力综合征(Lambert-Eaton myasthenic syndrome, LEMS)是一种神经肌肉接头突触前膜乙酰胆碱释放障碍的免疫介导的或肿瘤相关性疾病,50%~60%的患者合并小细胞肺癌。LEMS患者常见的临床表现包括波动性肢体无力、腱反射消失、自主神经紊乱等。经典的电生理改变是重复电刺激低频刺激波幅递减,高频刺激波幅递增。国外作为常规用运动易化试验(post exercise facilitation, PEF)取代高频刺激。国内很多同道也用该方法,但报道的并不多,且有过报道的文章也未详细阐明检测方法[1]。在此情况下,我们拟初步探讨LEMS患者PEF的具体操作方法及其临床意义。
纳入我院2014年12月至2016年4月临床确诊[2]的LEMS患者11例。11例患者平均病程为(8.3±6.3)个月。所有患者均表现为全身无力,其中6例患者以双下肢无力为首发症状,1例患者以眼睑下垂为首发症状,2例患者确诊为小细胞肺癌。
所有患者均在研究开始前获知检查的获益及风险,并签署知情同意书。所有检测均在丹麦Alpine biomed ApS生产型号为9031A070的肌电、脑诱发电位检测仪上操作完成。检测前受试者休息30 min以上,检测时保持患者皮肤温度大于32 ℃[3]。
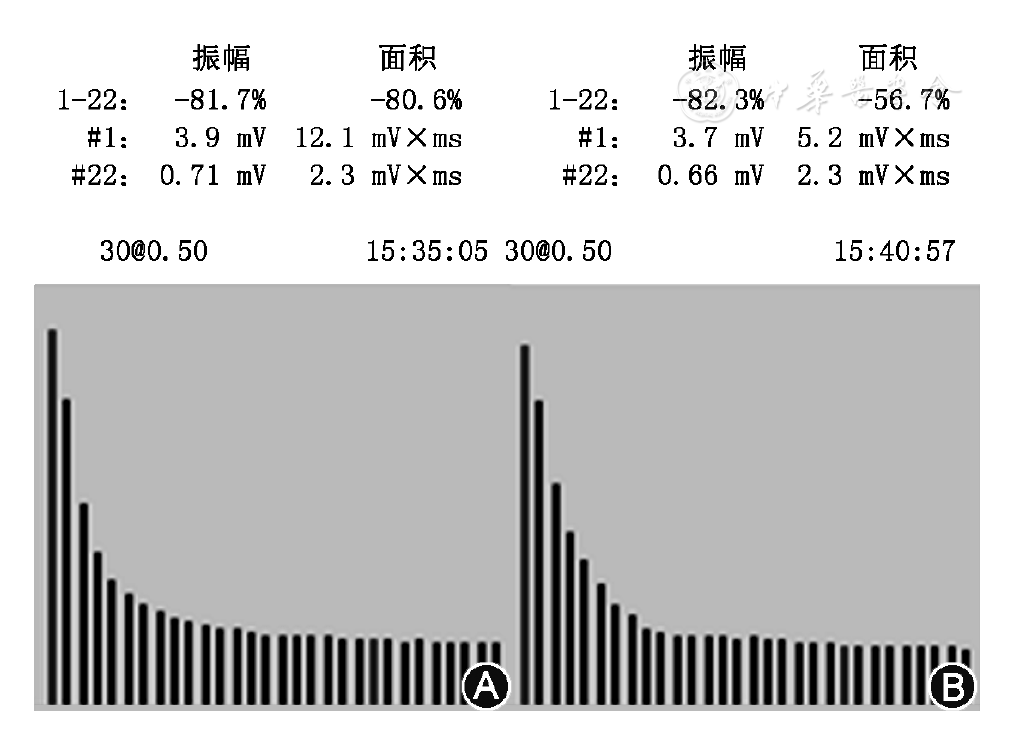
对所有患者进行尺神经-小指展肌、副神经-斜方肌、面神经-眼轮匝肌低频RNS检测(刺激频率3、5 Hz,刺激次数10次);小指展肌高频刺激检测(刺激频率10、20、30、50 Hz,刺激次数75~100次),其中尺神经高频刺激达到最大运动传导复合肌肉动作电位(compound muscle action potential,CMAP)波幅后继续以0.5 Hz的频率刺激尺神经并记录CMAP直至CMAP波幅恢复至初始水平,记录CMAP波幅恢复所需的时间。分析参数包括低频刺激所检肌肉CMAP波幅递减百分比(选取两种频率刺激下1波与4波比较波幅下降更显著者)及高频刺激检测CMAP波幅递增百分比(选取4种频率刺激下1波与最后波比较波幅递增更显著者)。
嘱患者外展小指,保持小指展肌持续收缩,收缩完成后立即刺激尺神经并记录小指展肌CMAP,休息1 min后嘱患者再次收缩小指展肌并在收缩完成后刺激尺神经记录小指展肌CMAP。收缩时间从0 s开始,每次增加2 s,重复上述过程直至记录到的CMAP波幅不再增加。记录患者达到最大CMAP波幅所需运动时间。当患者达到最大CMAP波幅后,以0.5 Hz频率继续刺激尺神经记录小指展肌CMAP,直到CMAP波幅恢复至初始水平。比较PEF与高频刺激检测后继续以0.5 Hz频率刺激尺神经记录到的小指展肌CMAP波幅恢复的过程。
对计量资料进行正态性检验,如为正态分布资料采用均数±标准差表示,不符合正态分布者采用中位数和四分位数表示,计数资料采用例数和百分比表示。
纳入研究的11例LEMS患者中男性8例,女性3例。平均年龄(52.3±13.9)岁,范围24~72岁。该11例患者的低频RNS检测、PEF检测、高频刺激检测的研究结果如
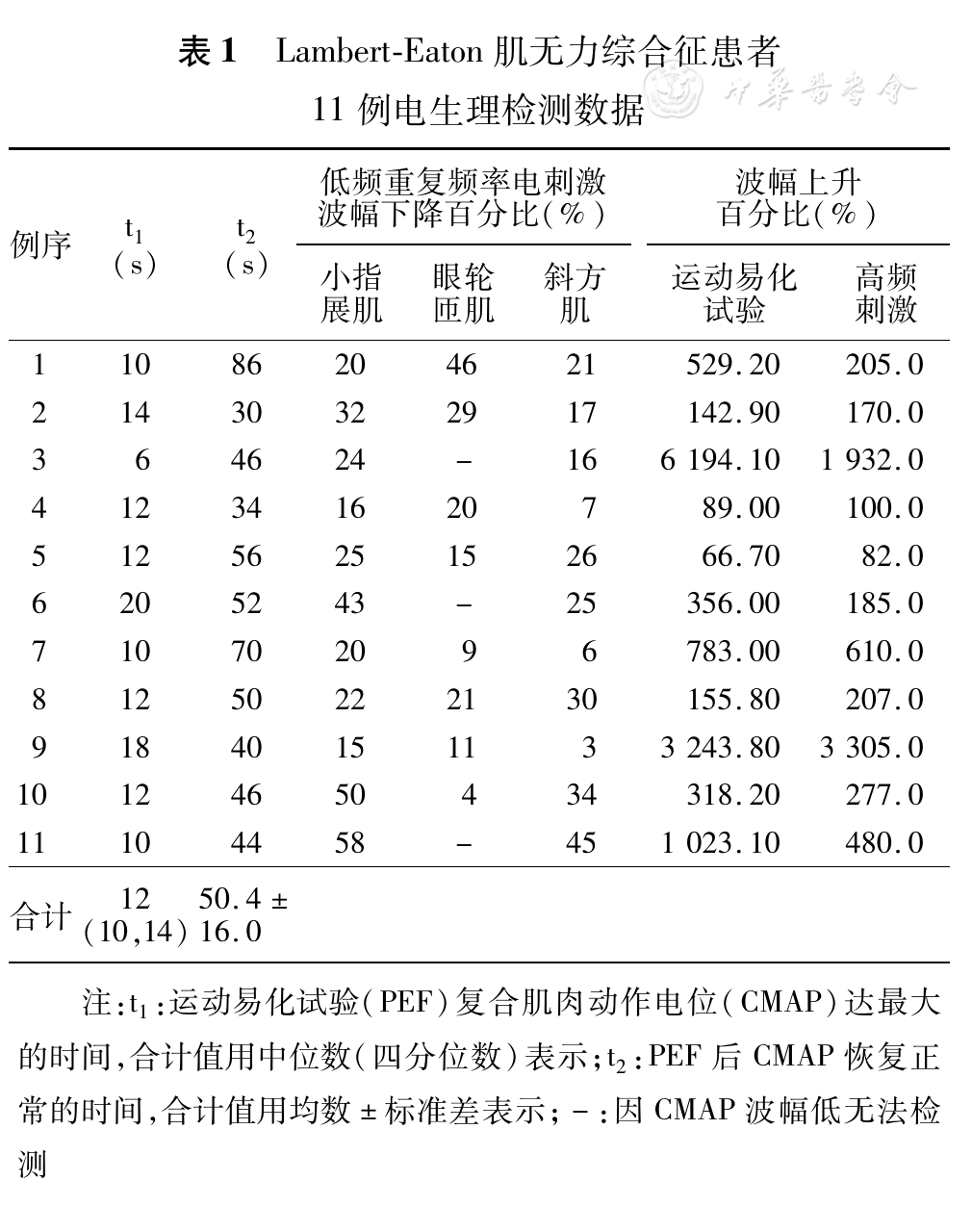
11例患者低频RNS检测均有CMAP波幅递减现象(>15%)。CMAP递减幅度最小为15%,最大达到58%;9例患者尺神经高频刺激检测CMAP波幅上升超过100%,1例波幅上升刚好达100%(例4),另一例波幅上升82.0%(例5)。
9例患者PEF后CMAP波幅较运动前上升超过100%(142%~6 194%),例4 CMAP波幅上升达89%,例5 CMAP波幅上升达67%,所有患者CMAP波幅达到最大值后继续增加运动时间会出现CMAP波幅降低(
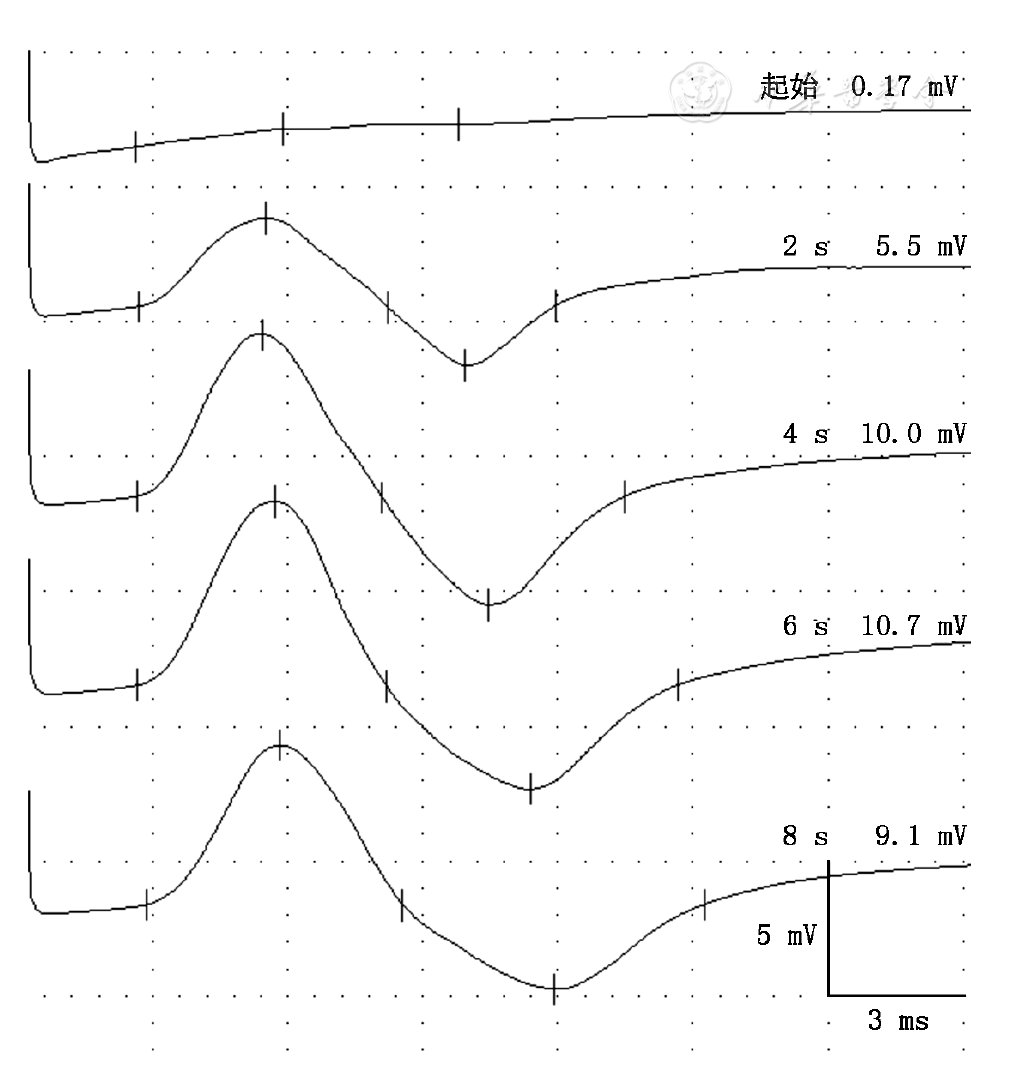
#1:第1次刺激所得数据,#22:第22次刺激所得数据,该患者在第22次刺激时CMAP恢复至初始水平
LEMS患者典型的电生理表现为RNS检测中低频(3、5 Hz)刺激CMAP波幅递减以及高频刺激(10、20、30、50 Hz)检测波幅递增。低频RNS电刺激检测CMAP波幅递减≥15%被认为阳性。本组11例患者低频检测均为阳性,其中小指展肌阳性率最高,CMAP波幅递减幅度也最大,与既往报道相符[4]。St?lberg[5]提出的高频刺激检测CMAP波幅上升≥100%被认为是诊断LEMS的高频刺激"金标准"。而最近Oh等[2]的研究表明,将LEMS患者高频刺激检测CMAP波幅递增标准从100%降至60%后,敏感度从85%提高至97%,而特异度仅从100%降至99%,且这一标准适用于PEF检测和高频刺激检测。我们研究的11例患者均为临床确诊的LEMS,其中1例患者高频刺激检测波幅递增未达到100%,支持Oh等[2]的观点。因此我们采用CMAP波幅增加≥60%为LEMS患者高频刺激以及PEF检测波幅递增阳性的诊断标准。以此诊断标准则本研究中11例患者均出现了高频刺激检测波幅递增现象。
LEMS患者PEF检测可出现递增现象,其意义等同于高频刺激检测,但是可以减轻患者检查时的不适。然而目前关于PEF的检测方法尚没有统一的标准,不同的研究使用的运动时间从10~30 s不等[6]。为了解决运动时间不一致的问题,Hatanaka和Oh[6]进行了相关的研究。在他们的试验中LEMS患者的运动时间由0 s开始,每次增加5 s,最长运动30 s。研究结果显示,PEF中运动0~10 s CMAP波幅出现递增现象,而运动超过10 s以后则出现CMAP波幅递减现象。为了进一步研究达到最大CMAP波幅需要的运动时间,我们缩短了运动的持续时间。运动持续时间由0 s开始,每次增加2 s,直至CMAP波幅不再增加。相比而言,我们所采用的运动时间更短,可以更加精确地研究PEF所需的运动时间。
本研究中11例LEMS患者CMAP波幅均出现了递增现象,而CMAP波幅达到最大后,再增加运动时间CMAP波幅反而下降。将PEF时间运动时间设定为10~12 s时,敏感度可达63.6%。我们所发现的CMAP波幅的变化规律以及达到最大CMAP波幅所需运动时间与Hatanaka和Oh[6]的研究结果接近。同时,值得注意的是患者达到最大CMAP波幅所需运动时间范围分布较广,最短6 s,最长20 s,即PEF所需时间变异较大。由此可见,如果每例患者检查时均采用固定的运动时间,那么获得的CMAP波幅可能并非最大,有出现假阴性结果的可能。在以往的研究中所用运动时间都是固定的且时间并不统一。所以不同研究会出现不同的研究结果。这可能也是对于PEF试验敏感度是否优于高频刺激检测一直存在争议的最主要原因[2,6,7]。但总的来看,即便运动时间不统一,PEF检测的敏感度仍高达84%~96%[2,6,8]。所以为了临床上操作方便,仍然可以采用固定PEF的运动时间用以检测。根据Hatanaka和Oh[6]以及本研究结果,我们推荐的PEF试验运动时间为10~12 s。
而LEMS患者PEF或者高频刺激后CMAP波幅可明显增高。但升高的波幅却无法持续很长时间。关于PEF试验后CMAP波幅变化过程有相关的研究[3,9]。其中Oh等[9]让患者运动10 s后,以3 Hz频率继续刺激尺神经10次,研究CMAP波幅恢复过程发现CMAP波幅持续递减并在1 min左右CMAP波幅恢复至初始水平。我们也对LEMS患者PEF以及高频刺激检测后CMAP的恢复过程进行了探讨。我们在CMAP波幅达到最大后继续使用0.5 Hz频率刺激尺神经并记录CMAP。并与以同样方法获得的高频刺激恢复过程的进行比较。我们之所以采用0.5 Hz频率刺激是因为0.5 Hz可以尽量小地干扰乙酰胆碱的释放,因而可以最小地干扰CMAP波幅恢复过程,从而可以连续观察CMAP的恢复过程。11例患者的CMAP波幅恢复过程结果显示:两种方法获得的恢复时间相似,最长恢复时间为86 s,平均恢复时间为(50.4±16.0) s,且PEF与高频刺激的CMAP波幅的恢复曲线均呈先快后慢的恢复过程,且越接近初始状态的波幅,恢复速度越慢。由此恢复过程可见,CMAP波幅恢复需要时间。因此,为了减少前一次检测对下一次检测结果的影响,两次相邻的RNS高频检测或相邻的PEF检测之间,时间间隔应大于(50.4±16.0) s。
PEF试验具有操作简便﹑无痛且特异度和敏感度均较高的优点[2,6,8,10],可以常规运用于LEMS的诊断和鉴别诊断。健康人PEF试验CMAP波幅变化较小,研究表明15 s的PEF试验其波幅增高≤24%[11]。我们曾对10名健康人进行10~12 s的PEF试验,其波幅增高均未大于24%。所以我们认为,当PEF试验后CMAP波幅增高≤24%可认为试验结果为阴性。根据Oh等[2]的研究,LEMS患者PEF试验后CMAP波幅增高≥60%可认为结果为阳性。而鉴于PEF检测中达最大CMAP波幅所需的运动时间变异性大,且PEF的敏感度尚存在争议,当患者PEF检测出现可疑的递增现象时(24%~60%)可进一步行高频刺激检测。这样可以缩短临床操作时间,避免高频刺激检测给患者带来的痛苦,并且可以克服PEF试验敏感度稍有欠缺的不足。
本研究具有一定的局限性。首先,纳入的患者数量较少,参考值的可靠性有待扩大样本量进行进一步检验;其次,未纳入重症肌无力的患者进行比较,所以无法计算该试验的特异度,未来的试验可通过比较LEMS与重症肌无力及其他神经肌肉接头疾病的差异,探索PEF的特异度。
总而言之,对于临床疑诊LEMS的患者,我们认为在检测中可行时间为10~12 s的PEF试验代替常规的高频刺激重复电刺激检测。当PEF后CMAP波幅较初始升高≥60%时可认为检测结果阳性;CMAP波幅递增≤24%则可认为为阴性;如果PEF检测波幅>24%而未达到60%时可进一步行RNS高频检测,并且需要注意的是无论采用哪种方法,两次检测间隔应大于(50.4±16.0) s。
[1] 张燕,郜晶. 神经电生理检查对Lambert-Eaton综合征的诊断价值[J]. 中国医药指南,2013(10): 234-235.
[2] Oh SJ, Kurokawa K, Claussen GC, et al. Electrophysiological diagnostic criteria of Lambert-Eaton myasthenic syndrome[J]. Muscle Nerve, 2005, 32(4): 515-520.
[3] Maddison P, Newsom-Davis J, Mills KR. Decay of postexercise augmentation in the Lambert-Eaton myasthenic syndrome: effect of cooling[J]. Neurology, 1998, 50(4): 1083-1087.
[4] Tim RW, Massey JM, Sanders DB. Lambert-Eaton myasthenic syndrome: electrodiagnostic findings and response to treatment.[J]. Neurology, 2000, 54(11): 2176-2178.
[5] St?lberg E. Neurophysiological aspects of diagnosis in neuromuscular transmission defects-an update[J]. Electroencephalogr Clin Neurophysiol Suppl, 1997, 50(1): 377-385.
[6] Hatanaka Y, Oh SJ. Ten-second exercise is superior to 30-second exercise for post-exercise facilitation in diagnosing Lambert-Eaton myasthenic syndrome[J]. Muscle Nerve, 2008, 37(5): 572-575.
[7] Tim RW, Sanders DB. Repetitive nerve stimulation studies in the Lambert-Eaton myasthenic syndrome[J]. Muscle Nerve, 1994, 17(9): 995-1001.
[8] Tim RW, Massey JM, Sanders DB. Lambert-Eaton Myasthenic Syndrome (LEMS): Clinical and Electrodiagnostic Features and Response to Therapy in 59 Patients[J]. Ann N Y Acad Sci, 1998, 841(841): 823-826.
[9] Oh SJ, Hatanaka Y, Ito E, et al. Post-exercise exhaustion in Lambert-Eaton myasthenic syndrome[J]. Clin Neurophysiol, 2014, 125(2): 411-414.
[10] Titulaer MJ, Lang B, Verschuuren JJ. Lambert-Eaton myasthenic syndrome: from clinical characteristics to therapeutic strategies[J]. Lancet Neurol, 2011, 10(12): 1098-1107.
[11] Newsom-Davis J, Murray NM. Plasma exchange and immunosuppressive drug treatment in the Lambert-Eaton myasthenic syndrome[J]. Neurology, 1984, 34(4): 480-485.
