SATB2相关综合征一例报道并文献复习
2019年12月
中华神经科杂志,第52卷第12期 第1059页-第1064页
梅道启,梅世月,陈国洪,王媛,方方,王潇娜,张耀东,王营,张君
SATB2相关综合征(special AT-rich binding protein 2-associated syndrome,SAS)是一种由SATB2基因突变引起的累及多系统的常染色体显性遗传性疾病,由Class于1989年首次报道[1],也称Glass综合征[在线人类孟德尔遗传数据库(OMIM):612313],其特征是发育迟缓/智力障碍、严重的语言发育落后、行为异常(孤独行为、多动和攻击行为)、颅面发育畸形(腭裂、高腭弓、悬雍垂裂和小下颌)、牙齿排列及大小异常、头发稀疏;其他表现还包括肌张力减退和喂养困难,而骨骼、心脏及肾脏的畸形、癫痫发作并不常见[2,3]。SATB2基因是一种重要的DNA结合蛋白,位于2号染色体长臂(2q33.1)上,共12个外显子(NM_015265)编码733个氨基酸,相对分子质量为83 000,具有2个剪切结构域和1个同源结构域[4],对多个基因的转录调控和染色质重构起重要作用[5,6]。经检索文献,国际上目前已报道百余例,而国内仅在今年有一家系2例2q33.1微缺失致SATB2基因部分缺失突变导致本病的报道[7]。现报道郑州大学附属儿童医院神经内科2018年1月确诊的1例新发杂合无义突变致SAS的病例,结合文献总结其临床表现、实验室及分子遗传学特征,了解其基因型与表型的相关性,旨在提高临床医生对该病的认识。
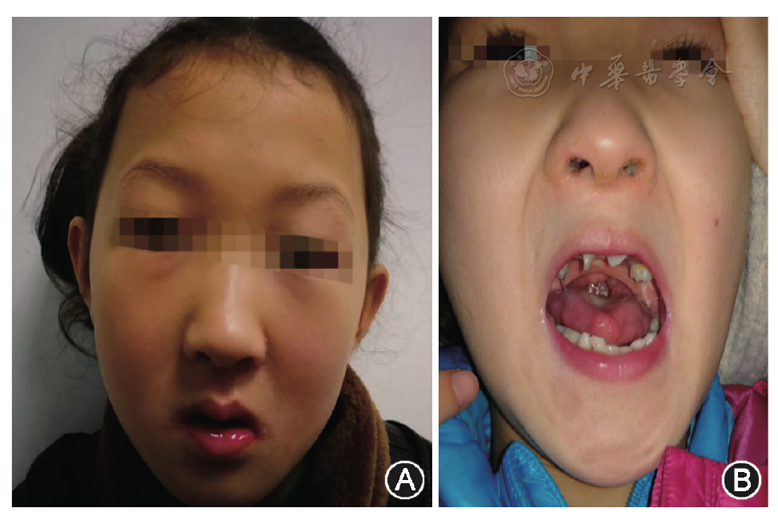
先证者女童,8岁。因"语言及运动发育落后7年,间断抽搐3个月"于2018年1月首次就诊于我院神经内科门诊。患儿系第3胎第3产(G3P3),足月顺产,出生体重2.7 kg,生后1个月发现腭裂,分别于1岁2个月、2岁行"腭裂修补术"。患儿自幼发育落后,4个月抬头,6个月翻身,10个月独坐,12个月会爬,1岁4个月仍不能独走,不会叫人,1岁5个月行康复训练,1岁8个月独走不稳。2岁6月可以说1~2字,无意识叫"爸爸、妈妈"。3岁3个月神经心理发育量表测试相当于12个月龄,运动当量相当于15个月龄;智力发育商评价为低下;图片词汇测试为49分,提示重度低下,诊断为"发育迟缓",间断予综合康复治疗,认知渐进步,但语言及运动依然落后。3个月前无诱因睡眠中出现抽搐2次,间隔时间为1个月,表现为双眼向右侧斜视,牙关紧闭,口唇发绀,呼之不应,右侧肢体强直抖动,持续1~2 min缓解,缓解后嗜睡。家族史:父母体健否认近亲结婚,哥哥及姐姐各1人均健康。入院体检:头围48 cm,身高115 cm,反应迟钝,叫名字有反应,眼神呆滞、情绪易兴奋、欣快,行为举止较幼稚,不理解语言,能听懂简单指令,交流及对答困难,语言发育落后,可说1~2个短语,精细动作笨拙,步态蹒跚不稳,跑跳差,头发稀疏,长脸,额部突出,鼻梁隆,睑裂下斜,低位耳,人中光滑,小下颌,牙排列稀疏,部分牙齿缺如(
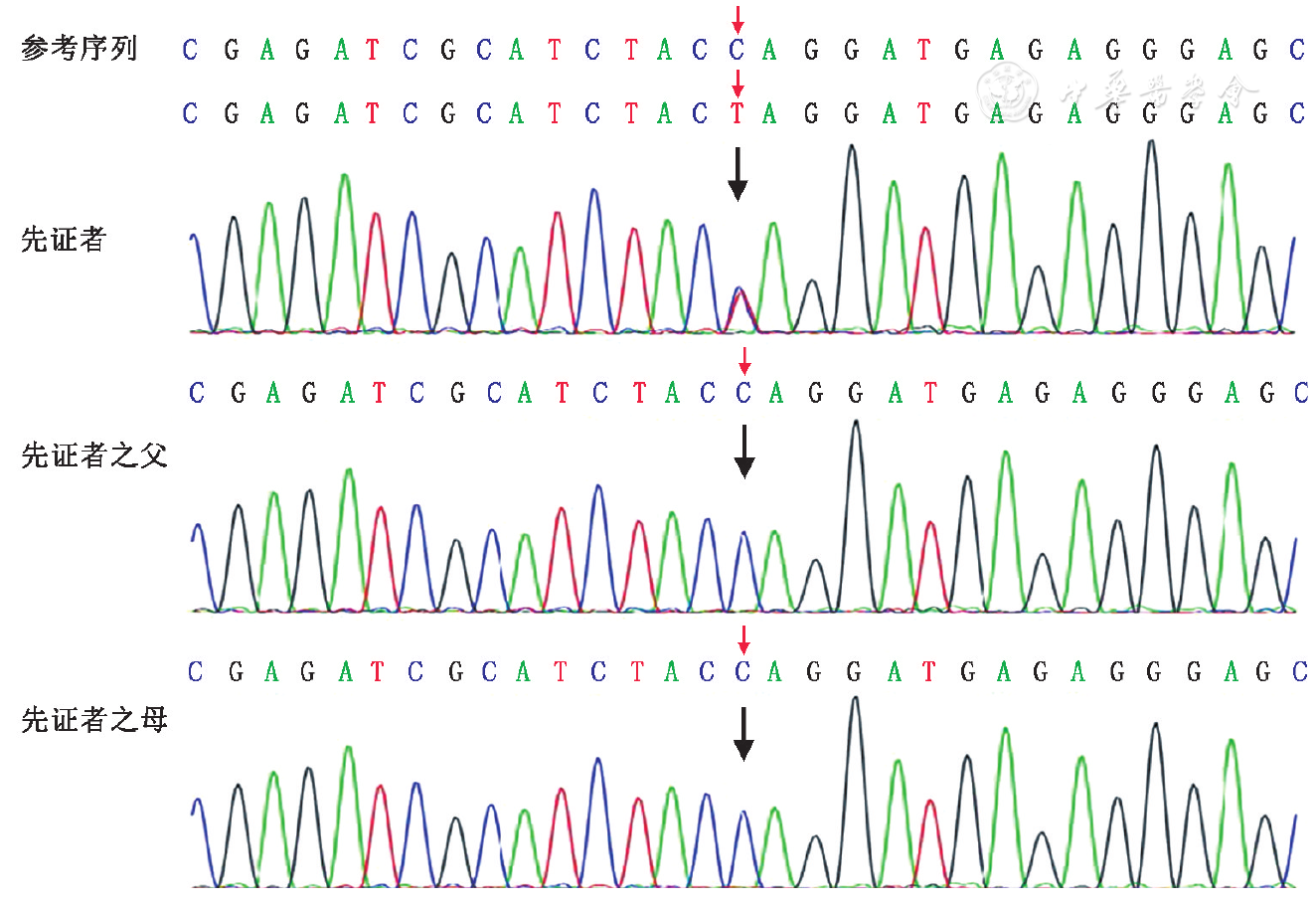
经患儿父母知情同意后,采集患者及其父母外周静脉血各2 ml(乙二胺四乙酸抗凝),进行家系3人全外显子测序(trio-WES)及染色体拷贝变异分析(CNV-Seq),并采用聚合酶链式反应-Sanger测序对可疑变异进行家系验证(基因检测委托北京智因东方医学转化研究中心有限公司)。结果发现患者存在SATB2基因1个新发杂合无义突变:c.1300 C> T(p.Gln434Ter),Sanger测序验证父母均为野生型(
患儿经康复治疗并接受特殊教育学校学习,半年后随访,认知能力较前略有改善,愿意与小朋友主动玩耍,能听懂大人指令,理解力好转;应用奥卡西平单药可控制癫痫发作。
分别以"Glass综合征""SATB2""SATB2相关综合征""2q32-q33缺失综合征"和"2q33.1微缺失综合征"为关键词在万方数据知识服务平台、中国知网进行检索,检索到1篇相关中文文献。以"SATB2-associated syndrome""Glass syndrome""2q32-q33 deletion syndrome""2q33.1 microdeletion syndrome"为检索词查阅OMIM和Pubmed数据库建库截至2019年6月发表的相关文献,共检索到相关外文文献37篇,总结1989年1月至2019年6月SATB2基因所致SAS国内、外病例报道23篇(国外22篇),结合本例报道共158例患者。SATB2基因错义突变49例(31.0%),无义突变38(24.1%),移码突变32例(20.3%),剪切位点突变7例(4.4%),易位突变6例(3.8%),插入突变1例(0.6%),基因缺失22例(13.9%),基因重复3例(1.9%),另有39例在文中只提及为点突变,未描述具体突变类型,国内报道2例为基因缺失突变。
在已报道的158例患者中,男性90例,女性62例,其中有6例性别未描述,确诊年龄为1个月至37岁。神经系统表现:智力发育迟缓158例(158/158,100.0%);生长迟缓44例(44/144,30.6%);面部畸形107例(107/127,84.3%);腭裂70例(70/154,45.5%);牙齿异常135例(135/137,98.5%);语言落后66例(66/152,43.4%);躁动/攻击行为45例(45/145,31.0%);多动症29例(29/145,20.0%);自闭症行为29例(29/145,20.0%);快乐性格36例(36/125,28.8%);癫痫发作29例(29/143,20.3%);流涎、唾液分泌过多96例(96/109,88.1%);睡眠困难66例(66/145,45.5%);肌张力减退67例(33/114,58.8%);步态异常37例(37/102,36.2%);神经影像学异常50例(50/108,46.3%),其中髓鞘发育不良16例(14.8%),胼胝体发育不良12例(11.1%),蛛网膜下腔增宽16例(14.8%),脑萎缩4例(3.7%),脑室增大8例(7.4%)。其他表型:喂养困难89例(89/130,68.5%),骨质疏松33例(33/46,71.7%),斜视51例(51/143,35.7%)。
SAS是一种常染色显性遗传罕见性疾病,该病由编码特异AT序列结合蛋白2基因(OMIM:608148)突变引起[8]。该基因位于染色体2q32.2-q33.1上,SATB2基因的点突变也被称为Glass综合征,SATB2基因缺失突变也被称为2q32-q33/2q33.1微缺失综合征,可统称为SAS。本病早期较难识别,2014年Docker等[2]提出使用以下主要特征的缩略词(S.A.T.B.2)有助于早期对本病的识别:"S:Severe speech anomalies(重度语言障碍);A:Abnormalities of the palate(上腭异常);T:Teeth anomalies(牙齿异常);B:Behavioral issues with or without Bone or Brain MRI anomalies,and age of onset before two years of age(行为障碍伴或不伴骨骼和脑部核磁的异常,且发病年龄为2岁以前)"。由此可见,SAS最主要特征有腭裂、发育迟缓/智力低下和颅面畸形[9]。
在已报道的病例中均存在发育迟缓/智力障碍,且为中、重度落后,智力障碍在本病中更多见、更严重,为首要的临床表现。Asadollahi等[10]曾报道1例SATB2基因4号外显子32 kb重复的患儿,表现为发育迟缓、严重言语迟滞、颅面畸形及行为异常表现。Kaiser等[11]也报道1例10岁女孩在染色体区域2q33.1中有84 kb的重复,包含SATB2基因3号外显子缺失,表现为中重度智力障碍、自闭、睡眠障碍、进食困难、面部及牙齿畸形。有文献报道语言障碍约占43.4%,轻者主要有构音不清、轻-中度的语言发育迟缓、交流困难,严重者表现为中-重度言语缺失,自闭行为[3]。面部和牙齿畸形为本病的次要表现,目前文献报道牙齿畸形(排列、大小和缺如)占98.5%(135/137),面部畸形(腭裂、高腭弓裂、小下颌、高鼻梁)占84%(107/127)。唇腭裂是较常见先天出生缺陷之一,在已报道的病例中腭裂占45.5%(70/154),可能与该基因的外显率有关,研究表明SATB2基因存在一定程度的不完全外显,其单倍剂量不足腭裂的发生率约为20%[3,12]。Gregoric等[13]报道1例成年女性伴有有腭裂和颅面畸形、头发稀疏表现,在染色体2q32.2-33.1上存在8.6 Mb缺失,缺失区内包括了该综合征的SATB2关键基因,2q32-q35区域是一个易患性区带,缺失后易出现腭裂或高腭[14]。Scott等[15]报道本病的其他表现还包括流涎、唾液分泌过多占88.1%、喂养困难占68.5%、肌张力减退占58.8%、睡眠障碍占45.5%及伴有不同程度的步态异常等,值得临床高度重视。其他表现还包括骨骼异常和骨质减少,Boone等[16]报道1例患儿合并了少见的漏斗胸、脊柱侧弯、胫骨弯曲、骨矿化异常等骨骼异常,SATB2通过促进成骨细胞特异性基因(包括SOX9、Runx2、Atf4)的表达来调控骨生成。本病目前癫痫发作的报道较少,在所有报道中约占20.3%。总之,本病的临床表现多样,不同的外显子缺失或重复导致的临床表型不一。小鼠动物试验显示,SATB2的单倍体不足导致颅面缺损、智力低下、生长发育异常等表现,基因的缺失均会引起不同程度的智力障碍,缺失片段的大小与疾病严重程度并无直接关联[17]。
本例患儿为8岁女童,以早期严重发育迟缓、肌张力低下、语言发育延迟、自闭行为和癫痫发作为主要临床表现,面部畸形比较突出,包括长脸、人中光滑、腭裂、小颌畸形、额部高隆、低位耳、鼻梁突出、睑裂下斜、少牙、牙列稀疏、头发稀疏等,患儿临床表型与已报道文献相符。本病癫痫发作不常见,对于癫痫发作的患者,发作形式不完全一致,且脑电图改变多样,Lee等[18]报道了伴有脑电图棘波、棘慢波发放的亚临床癫痫发作。在癫痫的药物治疗方面,单独或联合使用抗癫痫药物疗效各不相同,大部分均能控制发作,文献报道联合使用左乙拉西坦、丙戊酸以及单独使用奥卡西平、卡马西平和拉莫三嗪癫痫控制良好。本例患儿临床发作考虑为局灶性发作,给予奥卡西平单药抗癫痫治疗,随访半年无发作,但观察时间较短,仍需继续观察。
经文献检索,在已报道病例中神经影像学异常占46.3%,均为非特异性异常,如髓鞘发育不良、胼胝体发育不良、蛛网膜下腔增宽、脑萎缩和脑室增大,与其他病因导致的智力低下的核磁表现无法区别,故MRI对于本病诊断提示意义不大。
SATB2基因位于2号染色体长臂(2q33.1)染色体上,长度约201.7 kB,SATB2基因产物是一种转录结合蛋白,参与神经元进化和成骨细胞分化[19,20],在颅面、骨骼和大脑的发育过程中发挥关键作用。SATB2基因蛋白主要在结肠和直肠的上皮细胞中,其次是大脑中的皮质-皮质投射神经元表达,皮质投射神经元占据皮质的表层,可将轴突延伸至中线形成胼胝体,当SATB2基因突变时,轴突不能正常延伸到胼胝体,出现胼胝体发育不良,导致患者出现认知缺陷及智力障碍;也可通过招募其他转录因子,直接或间接地调控相关基因的表达致病[21,22]。
目前国外已经报道了多种SATB2基因突变类型[23,24],包括单核苷酸变异(SNVs)和小的插入/缺失,还包括大片段缺失、重复、平衡易位等。腭裂的发生可能与SATB2基因的位置缺失以及环境或者其他因素的影响有关[25]。也有研究表明发育缺陷严重程度与SATB2的突变种类有关[26,27],如SATB2截短突变干扰了野生型SATB2的抑制功能,导致临床出现智力低下、生长发育落后、腭裂、高腭弓。我们对患儿进行家系trio-WES检测发现,SATB2基因新发无义突变,c.1300 C>T(p. Gln434Ter),可导致基因功能的丧失,经检索文献,目前国内外未见相关报道,本例拓展了本病的基因突变谱。
SAS临床诊断标准尚未统一建立,因该病临床表现无特异性,诊断相对困难,而基因检查可为其提供确诊依据。如果临床早期出现发育迟缓/智力障碍、语言功能严重受损或缺失、腭裂或高腭弓、牙齿畸形、骨骼异常应首先考虑本病可能,发现SATB2基因致病性突变可以确诊。由于目前国际报道本病百余例,许多问题有待进一步研究,国际上已建立了SAS相关数据库(www.SATB2gene.com),为收集更多病例和进一步研究提供了良好基础。
目前本病尚缺乏有效的治疗方法,因此,如何管理与合理监控是关键。营养支持对喂养困难和腭裂畸形的患儿尤为重要。
神经发育评估尤其是语言及行为问题的早期评估对该疾病是有必要的,由于患者多存在语言障碍,康复训练应包括语言康复功能训练、运动功能训练和心理健康指导,康复治疗恢复相对缓慢。如果合并癫痫发作,单独或联合使用的抗癫痫药物是必要的。总体来说SAS预后不良,国外报道儿童发病者可以存活到成人,但缺乏本病对寿命影响的大型综合报道。
[1] Glass IA, Swindlehurst CA, Aitken DA, et al. Interstitial deletion of the long arm of chromosome 2 with normal levels of isocitrate dehydrogenase[J]. J Med Genet, 1989, 26(2): 127-130.
[2] Docker D, Schubach M, Menzel M, et al. Further delineation of the SATB2 phenotype[J]. Eur J Hum Genet, 2014, 22(8): 1034-1039.
[3] Zarate YA, Perry H, Ben-Omran T, et al. Further supporting evidence for the SATB2-associated syndrome found through whole exome sequencing[J]. Am J Med Genet A, 2015, 167A(5): 1026-1032.
[4] FitzPatrick DR, Carr IM, McLaren L, et al. Identification of SATB2 as the cleft palate gene on 2q32-q33[J]. Hum Mol Genet, 2003, 12(19): 2491-1501.
[5] Dobreva G, Dambacher J, Grosschedl R. SUMO modification of a novel MAR-binding protein, SATB2, modulates immunoglobulin mu gene expression[J]. Genes Dev, 2003, 17(24): 3048-3061.
[6] Gyorgy AB, Szemes M, de Juan Romero C, et al. SATB2 interacts with chromatin-remodeling molecules in differentiating cortical neurons[J]. Eur J Neurosci, 2008, 27(4): 865-873.
[7] 靳春雷,雷永良,刘姣,等. 2q33.1微缺失致SATB2基因部分缺失兄妹的表型及遗传学分析[J].中华医学遗传学杂志, 2019, 36(6): 628-631.
[8] Kikuno R, Nagase T, Ishikawa K, et al. Prediction of the coding sequences of unidentified human genes. XIV. The complete sequences of 100 new cDNA clones from brain which code for large proteins in vitro[J]. DNA Res, 1999, 6(3): 197-205.
[9] Jugessur A, Shi M, Gjessing HK, et al. Maternal genes and facial clefts in offspring: a comprehensive search for genetic associations in two population-based cleft studies from Scandinavia[J]. PLoS One, 2010, 5(7): e11493.
[10] Asadollahi R, Oneda B, Joset P, et al. The clinical significance of small copy number variants in neurodevelopmental disorders[J]. J Med Genet, 2014, 51(10): 677-688.
[11] Kaiser AS, Maas B, Wolff A, et al. Characterization of the first intragenic SATB2 duplication in a girl with intellectual disability, nearly absent speech and suspected hypodontia[J]. Eur J Hum Genet, 2015, 23(5): 704-707.
[12] Kikuiri T, Mishima H, Imura H, et al. Patients with SATB2-associated syndrome exhibiting multiple odontomas[J]. Am J Med Genet A, 2018, 176(12): 2614-2622.
[13] Gregoric Kumperscak H, Krgovic D, Vokac NK. Specific behavioural phenotype and secondary cognitive decline as a result of an 8.6 Mb deletion of 2q32.2q33.1[J]. J Int Med Res, 2016, 44(2): 395-402.
[14] Zarate YA, Kalsner L, Basinger A, et al. Genotype and phenotype in 12 additional individuals with SATB2-associated syndrome[J]. Clin Genet, 2017, 92(4): 423-429.
[15] Scott J, Adams C, Simmons K, et al. Dental radiographic findings in 18 individuals with SATB2-associated syndrome[J]. Clinical Oral Investig, 2018, 22(8): 2947-2951.
[16] Boone PM, Chan YM, Hunter JV, et al. Increased bone turnover, osteoporosis, progressive tibial bowing, fractures, and scoliosis in a patient with a final-exon SATB2 frameshift mutation[J]. Am J Med Genet A, 2016, 170(11): 3028-3032.
[17] Rosenfeld JA, Ballif BC, Lucas A, et al. Small deletions of SATB2 cause some of the clinical features of the 2q33.1 microdeletion syndrome[J]. PLoS One, 2009, 4(8): e6568.
[18] Lee JS, Yoo Y, Lim BC, et al. SATB2-associated syndrome presenting with Rett-like phenotypes[J]. Clin Genet, 2016, 89(6): 728-732.
[19] Britanova O, Depew MJ, Schwark M, et al. Satb2 haploinsufficiency phenocopies 2q32-q33 deletions, whereas loss suggests a fundamental role in the coordination of jaw development[J]. Am J Hum Genet, 2006, 79(4): 668-678.
[20] Dobreva G, Chahrour M, Dautzenberg M, et al. SATB2 is a multifunctional determinant of craniofacial patterning and osteoblast differentiation[J]. Cell, 2006, 125(5): 971-986.
[21] Wu L, Chen J, Qin Y, et al. SATB2 suppresses gastric cancer cell proliferation and migration[J]. Tumour Biol, 2016, 37(4): 4597-4602.
[22] Uhlén M, Fagerberg L, Hallstr?m BM, et al. Proteomics. Tissue-based map of the human proteome[J]. Science, 2015, 347(6220): 1260419.
[23] Britanova O, de Juan Romero C, Cheung A, et al. Satb2 is a postmitotic determinant for upper-layer neuron specification in the neocortex[J]. Neuron, 2008, 57(3): 378-392.
[24] Alcamo EA, Chirivella L, Dautzenberg M, et al. Satb2 regulates callosal projection neuron identity in the developing cerebral cortex[J]. Neuron, 2008, 57(3): 364-377.
[25] Fish JL. Developmental mechanisms underlying variation in craniofacial disease and evolution[J]. Dev Biol, 2016, 415(2): 188-197.
[26] Rosenfeld JA, Ballif BC, Lucas A, et al. Small deletions of SATB2 cause some of the clinical features of the 2q33.1 microdeletion syndrome[J]. PLoS One, 2009, 4(8): e6568.
[27] Leoyklang P, Suphapeetiporn K, Srichomthong C, et al. Disorders with similar clinical phenotypes reveal underlying genetic interaction: SATB2 acts as an activator of the UPF3B gene[J]. Hum Genet, 2013, 132(12): 1383-1393.
