视神经脊髓炎谱系疾病患者肠道微生物群落特征的研究
2020年1月
中华神经科杂志,第53卷第1期 第13页-第18页
杨凌飞,耿一萌,刘爱华,戴东闯,滕军放
视神经脊髓炎谱系疾病(neuromyelitis optica spectrum disorders,NMOSDs)是一种具有高度致残率、易复发的中枢神经系统炎性脱髓鞘疾病,有关报道显示NMOSDs的患病率约为(1~5)/10万人年[1],临床上常通过血清水通道蛋白-4(AQP4)抗体水平与多发性硬化(multiple sclerosis,MS)相鉴别[2]。近年来研究发现,肠道微生物群落特征的变化通过微生物-肠-脑轴系统与中枢神经系统炎性脱髓鞘疾病联系紧密[3],同时在NMOSDs病程发展中,IL-6、IL-10、IL-23和转化生长因子(TGF)-α等炎性因子水平亦随之改变[4,5,6,7]。在本研究中我们探讨了NMOSDs患者肠道微生物群落特征及其与脑脊液炎性因子的相互关联,对该疾病的早期诊断具有较高价值。
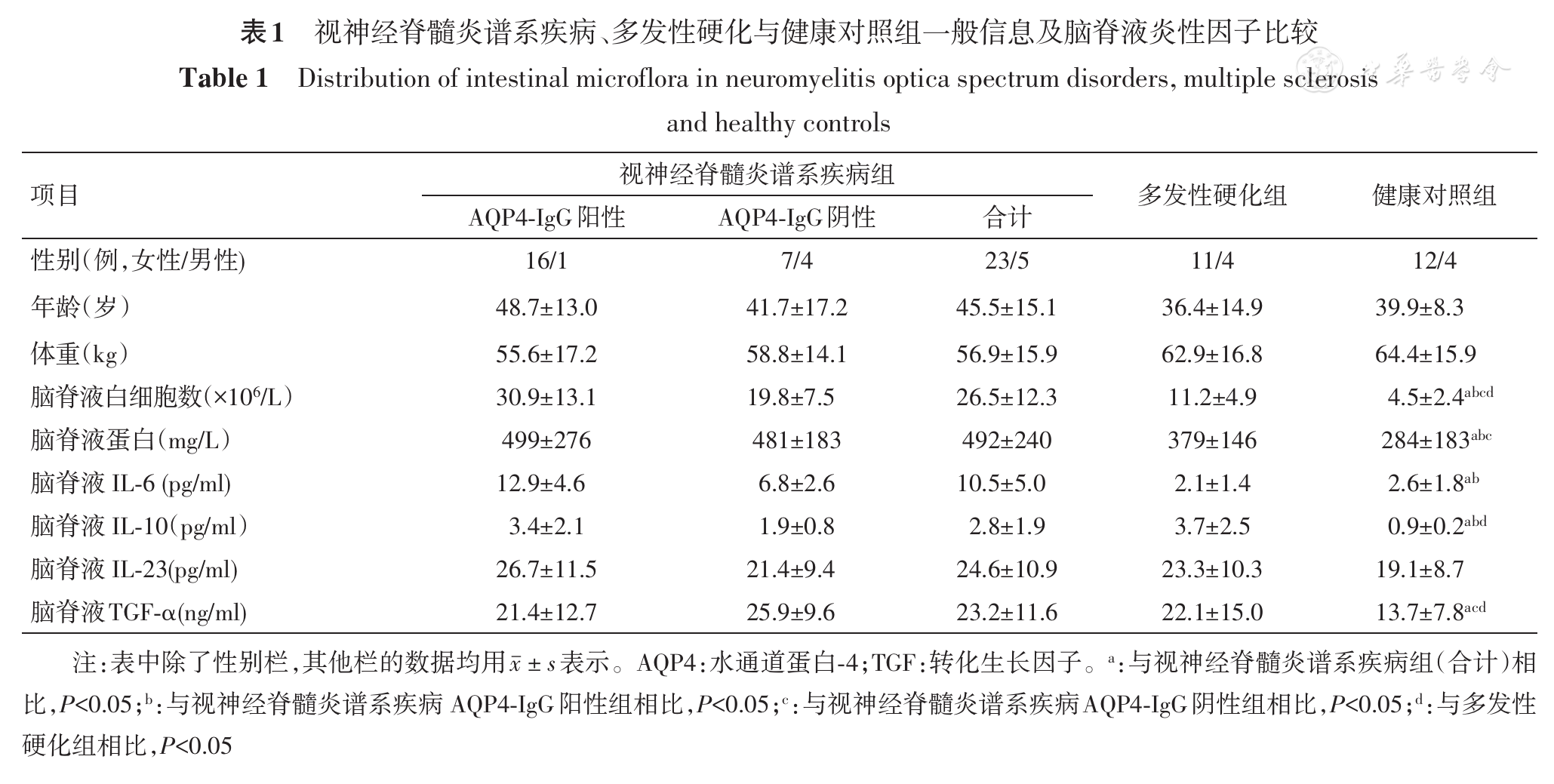
本研究为横断面研究。收集2017年7月至2019年1月郑州大学第一附属医院神经内科收治的28例NMOSDs患者(17例AQP4-IgG阳性,11例AQP4-IgG阴性)和15例MS患者,均由两位神经内科专家根据2015年NMOSDs国际标准[8]及2014年中国专家关于MS诊断的共识[9]共同诊治。本研究纳入标准:(1)同意配合进行脑脊液检测、粪便样本检测,并签署知情同意书;(2)第一次发作的急性期(症状发作后<2周);(3)可使用普通话沟通交流。排除标准:(1)1个月内曾使用抗菌药物;(2)既往有消化道疾病史、颅内感染、中枢神经系统炎性假瘤、重金属中毒等病史;(3)患有其他严重疾病无法配合进行腰椎穿刺术者[10]。同期,募集16名健康对照者自愿参与本研究,均为患者直系亲属、配偶或共同生活者。
收集所有受试者的基本临床特征,包括姓名、性别、年龄、体重、职业、病程、起病症状等。
于第一次发病急性期(免疫治疗前)采集脑脊液样本,取2~3 ml脑脊液用于常规生化、脱落细胞学及细菌培养等检查,另取5~6 ml脑脊液收集在聚丙烯管中,在4 ℃条件下运至神经内科实验室,使用美国Santa Cruz公司生产的ELISA试剂盒检测脑脊液样本中炎性因子(TNF-α、IL-6、IL-10、IL-23等)水平。
用高压灭菌后的微生物取样管收集粪便样品(1.0 g)于干冰包裹下送至安徽微分基因科技有限公司,将粪便样品悬浮在含有20%甘油的磷酸盐缓冲盐水(Life Technologies公司,美国)中,立即用液氮冷冻,并在-80 ℃中保存,根据相关文献方法使用QIAGEN提取试剂盒(QIAGEN公司,德国)提取冷冻的粪便样品中细菌DNA[11],并应用Thermo Qubit(Thermo Fisher公司,美国)对细菌DNA进行实时总DNA质检。
为反映样本中微生物在不同分类学上的群落结构,选择对样本DNA中的V3~V4区域进行16 S rDNA扩增。使用通用引物(正向:5′-CTACGGGNGGCWGCAG-3′;逆向:5′-GACTACHVGGGTWTCTAAT-3′),并在通用引物的5′端加入用于MiSep PE300(Illumina公司,美国)测序的索引序列和接头序列,以样本DNA为模板,使用诺唯赞生物科技公司(中国)的Taq DNA多聚酶进行PCR扩增,运用Fragment Analyzer分析系统(Bioptic公司,中国台湾)对PCR产物文库进行质检以确保扩增的高效性、准确性,使用QIAquick胶回收试剂盒(QIAGEN公司,德国)进行切胶纯化(保留500~750 bp片段),使用lllumina MiSeq PE300(Illumina公司,美国)对PCR产物进行上机测序,得到原始Reads数据,用Usearch软件(http://www.drive5.com/usearch)将Reads数据按照丰度从大到小排序,比对同一性阈值的16 S聚类获得每个样本的分类单位(operational taxonomic units),每个分类单位被认为可代表一个物种,使用RDP方法将分类单位序列与16 S数据库比对[12],评估各个分类水平上(门、纲、目、科、属)的微生物组成比例。
使用Qiime软件做Alpha多样性分析,以chao 1指数(一种较为敏感的通过实际观测物种种类数量推算理论物种丰富度的指标)评估微生物多样性。
采用SPSS 21.0统计软件进行统计学分析。对性别等计数资料采用频数表示,采用χ2检验进行组间比较。正态分布计量资料采用均数±标准差(
NMOSDs、MS患者和健康对照组的人口和临床特征见
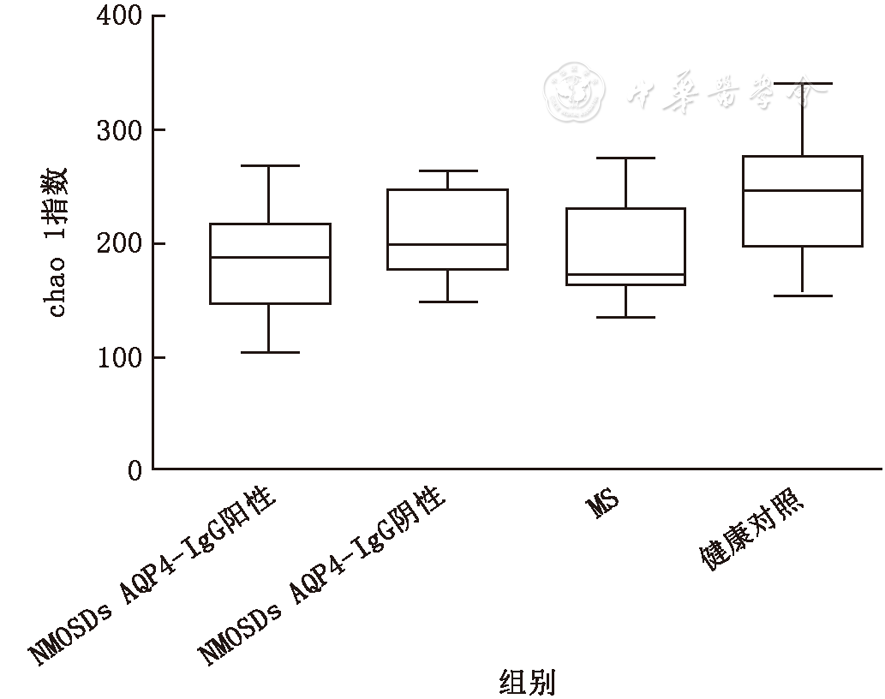
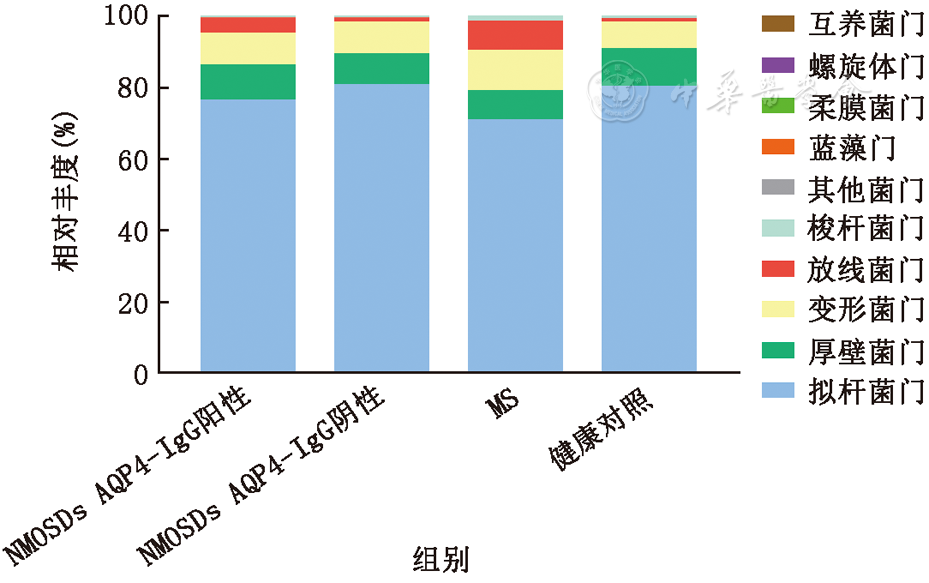
NMOSDs、MS患者和健康对照组受试者的肠道微生物多样性特征及门水平相对丰度见
AQP4:水通道蛋白-4
AQP4:水通道蛋白-4
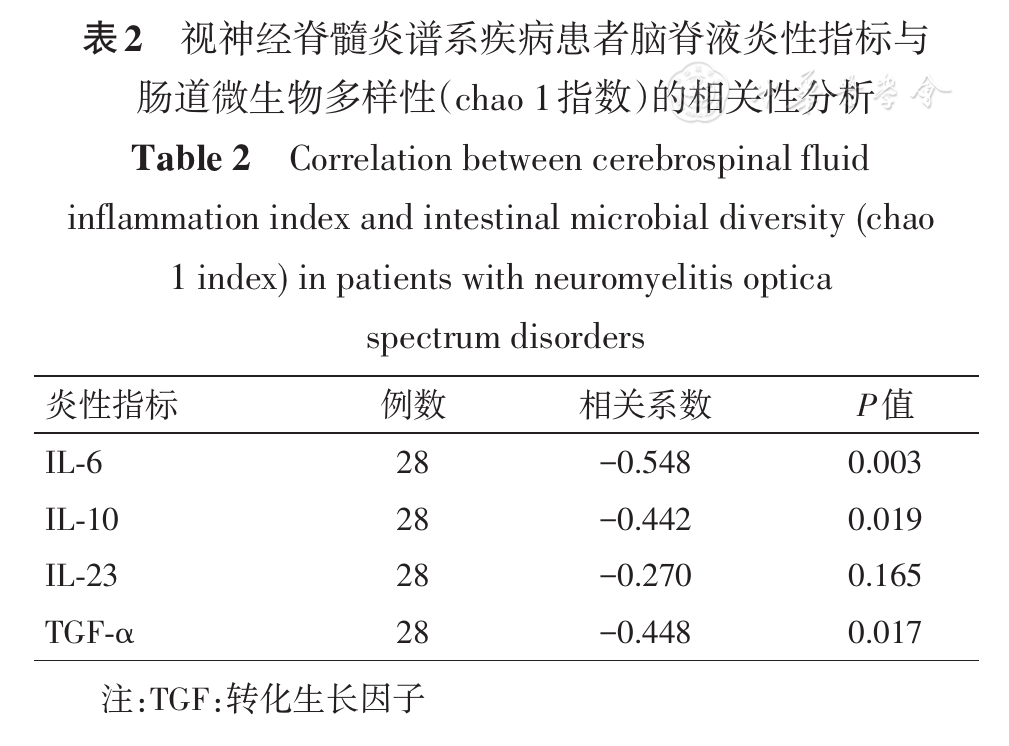
运用Pearson相关分析评估NMOSDs患者脑脊液炎性指标与肠道微生物多样性的相关性,结果详见
近年来,肠道微生物与中枢神经系统疾病的关系引起广泛关注[13],肠道微生物群落组成及其代谢物包括短链脂肪酸(short chain fatty acids,SCFA)作为微生物-肠-脑轴的主要成分,在调节肠道内环境稳定和微生态平衡的同时,也参与活化免疫细胞、调节机体免疫应答等。肠道微生物群落组成一旦被破坏,将通过微生物-肠-脑轴促进小胶质细胞成熟,产生过量的反应性氧化物质和炎性细胞因子,导致中枢神经系统免疫功能异常[14]。NMOSDs作为中枢神经系统炎性脱髓鞘性疾病的一大类,病因尚无定论。遗传和环境因素都可能导致病程的发生发展,肠道微生物菌群可能是诱发机体免疫反应的一种环境因素。
我们通过对受试者粪便样本的16 S rDNA测序分析发现:NMOSDs、MS患者肠道微生物群落组成的多样性有不同程度的减少;亚组分析中,NMOSDs AQP4-IgG阳性组多样性降低更加显著;Usearch分析结果表明,在门水平上,各组人群肠道菌群均以拟杆菌门、放线菌门、变形菌门和厚壁菌门为主,但NMOSDs组与MS、健康对照组肠道微生物的结构存在显著差异。我们发现NMOSDs患者丁酸弧菌属丰度降低,导致肠道内免疫调节相关代谢物丁酸盐水平降低,后者可破坏肠道屏障功能并诱发结肠内免疫反应。有研究结果显示,普雷沃菌属在类风湿性关节炎和炎性肠病中丰度升高,其可通过驱动丁酸的产生参与机体炎性反应[15,16]。相关研究证实炎性肠病患者肠道内双歧杆菌属比例的升高致使丁酸弧菌丰度降低,进一步导致肠道免疫功能紊乱[17]。另外,我们通过比较证实,NMOSDs与MS患者肠道微生物结构中,嗜热链球菌属和普雷沃菌属的定量比较存在显著差异,其可能与机体炎性反应导致的抗氧化酶活性减弱程度相关[18,19],不排除为本研究样本量偏小导致的结果偏倚。
同时我们通过Pearson相关分析发现,NMOSDs患者脑脊液中炎性因子IL-6水平与表示肠道菌群多样性的chao 1指数水平具有强的负相关性,证实了NMOSDs患者肠道微生物菌群多样性减少与机体免疫反应相关。但是否与该疾病的发病机制相关尚需进一步研究。相关研究表明,肠道微生物及其副产物可通过肠道相关淋巴组织(gut-associated lymphoid tissue,GALT)激活机体免疫系统,调节体内炎性因子和细胞因子水平,影响炎性和自身免疫疾病的病程发展[20,21]。IL-6由免疫细胞和活化的星形胶质细胞分泌,在AQP4-IgG阳性患者中,IL-6可促进浆细胞的存活及AQP4抗体的分泌,因此,脑脊液中IL-6常作为NMOSDs较特异性的早期诊断标志物[22]。此外,IL-6可促进活化B细胞中免疫球蛋白的合成和幼稚T细胞分化为促炎性T辅助细胞17(Th17)或细胞毒性T细胞,而肠道微生物菌群失调是肠道中促炎性Th17升高的强诱导因素[23]。本研究证实IL-6与肠道微生物菌群失调相关,间接为肠道微生物参与NMOSDs的炎性反应提供证据支持,为今后肠道菌群移植治疗NMOSDs的研究提供理论依据。
由于各种条件限制,本研究尚存在诸多不足。实验组病例数较少,样本量偏小可导致结果偏倚;未对NMOSDs及MS患者进行随访观察,研究检测的评估点偏少,无法对肠道微生物群落的动态改变进一步评估。
总之,NMOSDs及MS患者肠道微生物群落与健康对照者相比结构失调,菌群多样性指标显著降低,脑脊液中炎性指标IL-6、IL-10、TGF-α显著升高。在NMOSDs亚组分析中,AQP4-IgG阳性患者与AQP4-IgG阴性患者肠道菌群结构存在明显差异,且肠道微生物多样性与脑脊液中炎性因子IL-6水平显著相关。
[1] 张华,任桥桥,张美妮.视神经脊髓炎谱系疾病基因研究进展[J].中国神经免疫学和神经病学杂志, 2019, 26(1): 64-67.
[2] Lennon VA, Wingerchuk DM, Kryzer TJ, et al. A serum autoantibody marker of neuromyelitis optica: distinction from multiple sclerosis[J]. Lancet, 2004, 364(9451): 2106-2112.
[3] Wei Y, Chang H, Li X, et al. Cytokines and tissue damage biomarkers in first-onset neuromyelitis optica spectrum disorders: significance of interleukin-6[J]. Neuroimmunomodulation, 2018, 25(4): 215-224.
[4] Babaloo Z, Aliparasti MR, Babaiea F, et al. The role of Th17 cells in patients with relapsing-remitting multiple sclerosis: interleukin-17A and interleukin-17F serum levels[J]. Immunol Lett, 2015, 164(2): 76-80.
[5] Kadowaki A, Saga R, Lin Y, et al. Gut microbiota-dependent CCR9+ CD4+ T cells are altered in secondary progressive multiple sclerosis[J]. Brain, 2019, 142(4): 916-931.
[6] Hiltensperger M, Korn T. The interleukin (IL)-23/T helper (Th)17 axis in experimental autoimmune encephalomyelitis and multiple sclerosis[J]. Cold Spring Harb Perspect Med, 2018, 8(1). pii: a029637.
[7] Miller PG, Bonn MB, Franklin CL, et al. TNFR2 deficiency acts in concert with gut microbiota to precipitate spontaneous sex-biased central nervous system demyelinating autoimmune disease[J]. J Immunol, 2015, 195(10): 4668-4684.
[8] Wingerchuk DM, Banwell B, Bennett JL, et al. International consensus diagnostic criteria for neuromyelitis optica spectrum disorders[J]. Neurology, 2015, 85(2): 177-189.
[9] 中华医学会神经病学分会神经免疫学组,中国免疫学会神经免疫分会.多发性硬化诊断和治疗中国专家共识(2014版)[J].中华神经科杂志, 2015, 48(5): 362-367.
[10] 齐凌,李菲.粪菌移植的研究现状及其在血液系统疾病中的运用[J].中国实验血液学杂志, 2019, 27(1): 306-310.
[11] Kim SW, Suda W, Kim S, et al. Robustness of gut microbiota of healthy adults in response to probiotic intervention revealed by high-throughput pyrosequencing[J]. DNA Res, 2013, 20(3): 241-253.
[12] Wang X, Ye T, Chen WJ, et al. Structural shift of gut microbiota during chemo-preventive effects of epigallocatechin gallate on colorectal carcinogenesis in mice[J]. World J Gastroenterol, 2017, 23(46): 8128-8139.
[13] 臧凯丽,江岩,孙勇,等.益生菌剂调整肠道疾病人群菌群结构丰度水平的研究[J].食品科学, 2018, 39(13): 133-143.
[14] Erny D, Hrabě de Angelis AL, Jaitin D, et al. Host microbiota constantly control maturation and function of microglia in the CNS[J]. Nat Neurosci, 2015, 18(7): 965-977.
[15] Jangi S, Gandhi R, Cox LM, et al. Alterations of the human gut microbiome in multiple sclerosis[J]. Nat Commun, 2016, 7: 12015.
[16] Kostic AD, Xavier RJ, Gevers D. The microbiome in inflammatory bowel disease: current status and the future ahead[J]. Gastroenterology, 2014, 146(6): 1489-1499.
[17] Wang W, Chen L, Zhou R, et al. Increased proportions of bifidobacterium and the lactobacillus group and loss of butyrate-producing bacteria in inflammatory bowel disease[J]. J Clin Microbiol, 2014, 52(2): 398-406.
[18] Del Carmen S, de Moreno de LeBlanc A, Martin R, et al. Genetically engineered immunomodulatory Streptococcus thermophilus strains producing antioxidant enzymes exhibit enhanced anti-inflammatory activities[J]. Appl Environ Microbiol, 2014, 80(3): 869-877.
[19] Fernández-Navarro T, Salazar N, Gutiérrez-Díaz I, et al. Different intestinal microbial profile in over-weight and obese subjects consuming a diet with low content of fiber and antioxidants[J]. Nutrients, 2017, 9(6). pii: E551.
[20] Stanisavljevi? S, Luki? J, Mom?ilovi? M, et al. Gut-associated lymphoid tissue, gut microbes and susceptibility to experimental autoimmune encephalomyelitis[J]. Benef Microbes, 2016, 7(3): 363-373.
[21] Senda T, Dogra P, Granot T, et al. Microanatomical dissection of human intestinal T-cell immunity reveals site-specific changes in gut-associated lymphoid tissues over life[J]. Mucosal Immunol, 2019, 12(2): 378-389.
[22] Li Y, Lu H, Lv X, et al. Blockade of aquaporin 4 inhibits irradiation-induced pulmonary inflammation and modulates macrophage polarization in mice[J]. Inflammation, 2018, 41(6): 2196-2205.
[23] Thomas S, Izard J, Walsh E, et al. The host microbiome regulates and maintains human health: a primer and perspective for non-microbiologists[J]. Cancer Res, 2017, 77(8): 1783-1812.
