散发型克雅病脑脊液tau蛋白的改变
2020年1月
中华神经科杂志,第53卷第1期 第25页-第30页
黄欣莹,毛晨晖,沙龙泽,刘彩燕,董立羚,周雁,李洁,雷聃,张梦雨,沈东超,李芹,褚姗姗,许琪,彭斌,崔丽英,高晶
Creutzfeldt-Jakob病(Creutzfeldt-Jakob disease,CJD)又称克雅病,是由朊蛋白(prion protein)引起的一种罕见的进展性、致死性中枢神经系统退行性病变。目前CJD主要分为散发性克雅病(sporadic CJD,sCJD)、家族性克雅病(familail CJD)以及医源性克雅病(iatrogenic CJD)。其中以sCJD占绝大多数(85%~95%),发病率约为每年1/1 000 000人[1,2]。其特征性临床表现为快速进展性痴呆(rapidly progressive dementia,RPD)伴肌阵挛、以周期性的三相波为特征的脑电图改变和头磁共振的皮质花边样改变。海绵状改变以及不同类型的淀粉样蛋白斑是其主要的病理改变,伴随有大量的大脑皮质神经细胞死亡、胶质细胞增生。尸体解剖病理改变为CJD诊断的"金标准"[3]。自本病被发现以来,研究者们一直不断努力,力求在患者临床阶段尽早确诊。在脑脊液中寻找标志物成为确诊该病的重要手段之一。1996年脑脊液14-3-3蛋白被纳入了WHO的CJD诊断标准[3],但其特异度在不同研究中存在较大差异,假阳性、假阴性均屡有发生。因此,其他脑脊液标志物的探讨逐渐增加,1997年Otto等[4]提出,CJD患者脑脊液中不仅有14-3-3蛋白,还有tau蛋白水平的升高;也有研究报道磷酸化tau蛋白(P-tau)、总tau蛋白(T-tau)等标志物或许对sCJD的诊断具有重要作用[5]。但我国目前仍欠缺标准、规范化的研究。为了探索脑脊液标志物在痴呆鉴别诊断中的作用,我们进行了一系列的脑脊液生物标志物对不同类型痴呆的鉴别诊断作用的研究。本文则主要报道进行了脑脊液生物标志物检测的临床诊断sCJD的病例,总结其中tau蛋白指标的变化,希望能对临床诊断该病提供帮助。
该研究为横断面研究。从2018—2019年北京协和医院痴呆与脑白质门诊患者中,我们建立了协和医院神经科脑脊液标志物研究队列。按2009年Brain标准[5]及2018年Neurology改良版标准[6]选取其中的sCJD患者;按2011年美国国立老化研究所与阿尔茨海默病(AD)协会标准[7],选择年龄、性别与之相对匹配的AD患者以及认知功能正常的其他神经系统疾病患者作为对照病例,进行分组对照。
本研究经北京协和医院伦理委员会审批(批号:JS-1836),所有受试者临床资料及标本采集均获得书面知情同意。
所有患者均经详细的临床资料(包括影像学检查结果)采集和认知功能评价,脑脊液标本为腰椎穿刺时直接滴落收集,-80 ℃保存,常规、生化、细胞学等统一由北京协和医院检验科及神经病理实验室完成;同时由专门实验室及指定实验员进行T-tau、P-tau测定,采用固相酶联免疫吸附试验(试剂盒为FUJIREBIO,INNOTEST? PHOSPHO-TAU(181P),INNOTEST? β-AMYLOID(1-42),INNOTEST? hTAU Ag,日本)。
按规定疑诊CJD的患者均上报中国疾病预防控制中心并由疾病控制中心出具14-3-3蛋白及PRNP基因检测报告。
3组人群脑脊液标志物水平因呈偏态分布,采用中位数(四分位数)[M(P25,P75)]表示,组间比较采用非参数秩和检验(Mann-whitney U检验);P≤0.05为差异有统计学意义。所有统计学分析及绘图采用Graphad Prism 7完成。
按照诊断标准,共筛选出12例临床诊断符合"很可能的CJD"的患者(男性5例,女性7例,临床资料见
另筛选出49例临床诊断符合"很可能的AD"患者(男性19例,女性30例,中位年龄58.0岁)以及14例认知正常者(男性7例,女性7例,中位年龄58.5岁)入组作研究对照组。3组人群间性别、年龄差异无统计学意义。
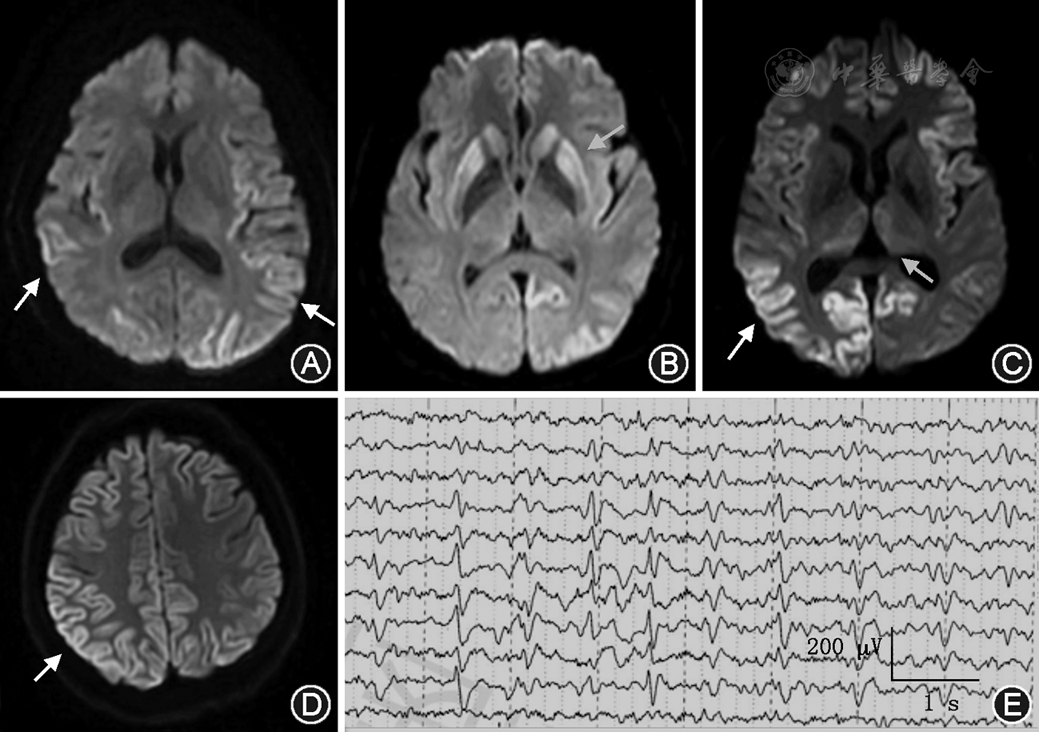
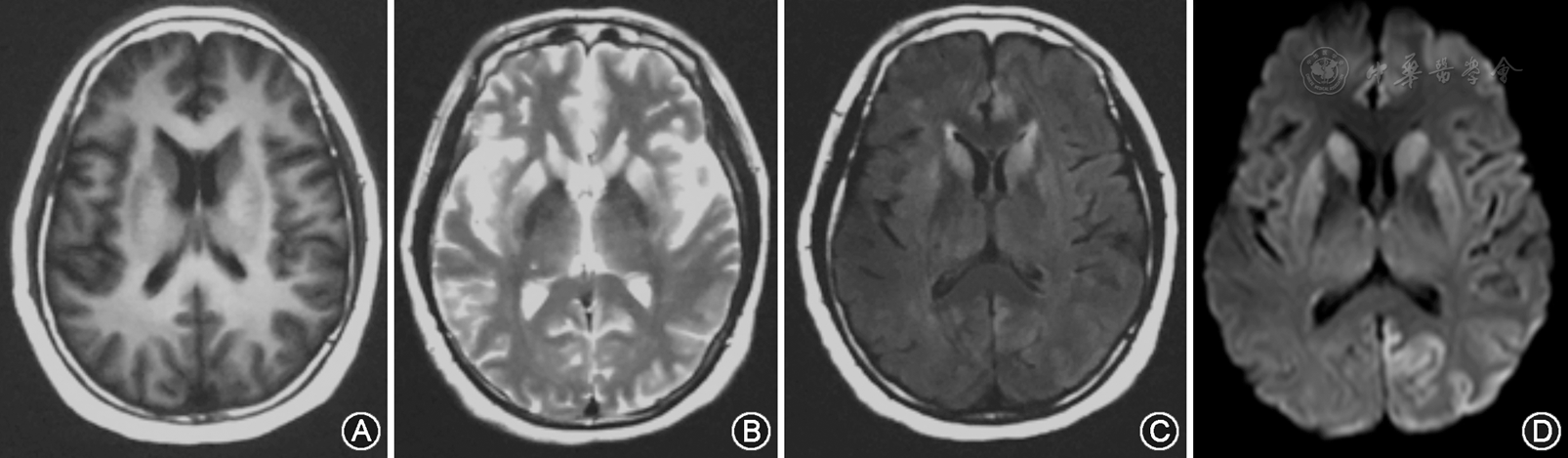
12例sCJD患者均有头颅MRI检查结果,均可见典型"花边征"(
12例sCJD患者中9例接受脑脊液14-3-3蛋白检测(3例患者拒绝送检),4例14-3-3蛋白阳性(44%)。
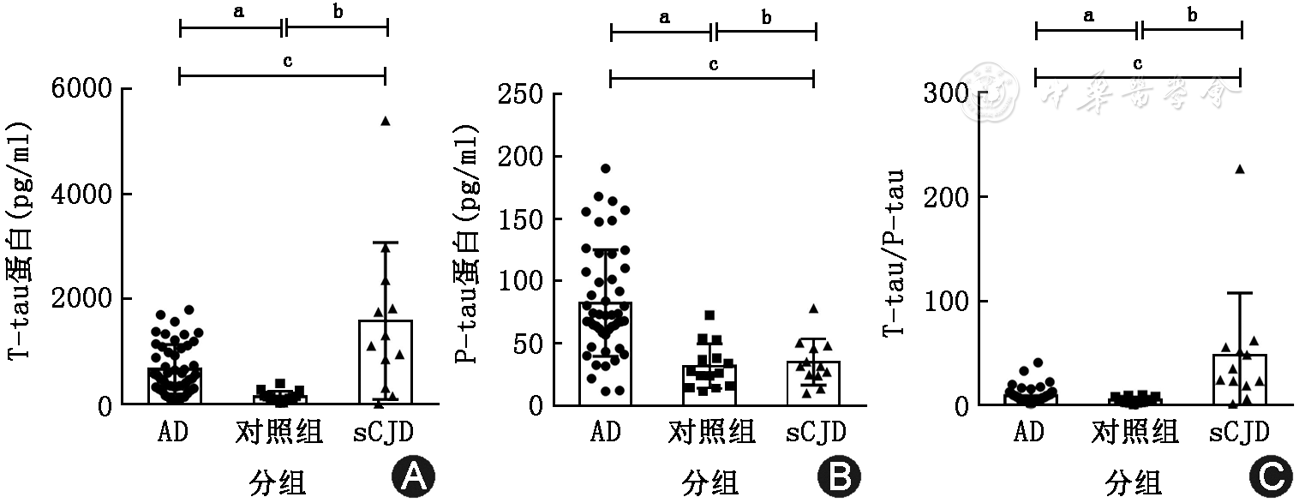
脑脊液T-tau水平在3组人群分别为:sCJD组1211(448,2 227)pg/ml,AD组549(314,1 078)pg/ml,对照组127(79,192)pg/ml。对比发现sCJD组的T-tau浓度高于AD患者(U=178,P=0.0349),两组的T-tau均高于对照组。对照组P-tau水平为27(15,42)pg/ml,AD组患者P-tau水平72(58,109)pg/ml,较对照组显著升高(U=82,P<0.01),但CJD患者P-tau水平32(24,47)pg/ml较对照组无明显改变。结合T-tau、P-tau,我们得到3组人群脑脊液T-tau/P-tau,sCJD的T-tau/P-tau比值达29.77(20.01,54.53),显著高于AD[7.45(4.79,10.43);U=87,P<0.01;
12例sCJD中9例送检疾病控制中心,PRNP基因检测全部未见突变,129位均为M/M型,219位均为E/E。
早在20世纪90年代就有学者提出,可以检测脑脊液标志物用于临床以帮助诊断sCJD[8]。其中广为熟知的标志物,即14-3-3蛋白,于1996年被纳入sCJD的诊断指标。但14-3-3蛋白的诊断效能,尤其是特异度在不同研究中差异较大(波动于43%~92%)[9,10]。14-3-3蛋白假阳性可见于一些急性神经系统疾病(如卒中、中枢神经系统感染、肿瘤或癫痫发作)[9],其他类型的痴呆如血管性痴呆(10.7%)、AD(5.8%)、路易体痴呆(5.3%)亦有报道不同比例的14-3-3蛋白阳性。为弥补14-3-3蛋白在快速进展型痴呆中的鉴别诊断效度,尤其是sCJD与AD等其他神经系统变性病的鉴别诊断,越来越多的脑脊液标志物被提出。其中神经元S100B蛋白、神经丝蛋白轻链(neurofilament light,NF-L)、神经元特异性烯醇化酶(NSE)均可反映神经元损害程度,但这些指标在sCJD诊断及鉴别诊断中的敏感度、特异度普遍较低,难以作为独立检测项目,在不同研究中亦无良好的一致性。而在我们所回顾的12例病例中,9例送检14-3-3蛋白检测,仅4例回报阳性。
tau蛋白被认为是神经元损伤的标志物,1997年就被发现在sCJD患者脑脊液中的水平显著升高(1 533~27 648 pg/ml)[4]。大部分研究证实tau蛋白对于CJD的诊断具有较高价值,鉴别诊断方面较14-3-3蛋白更优。2009年Brain刊登了一项长达10年的回顾性研究[9],对比了245例病理确诊的sCJD、163例临床可能的CJD以及171例对照的脑脊液14-3-3蛋白和tau蛋白水平的差异。研究者发现14-3-3蛋白敏感度高于tau蛋白(分别为86%和81%),但特异度低于tau蛋白(分别为74%和85%)[9]。我们的结果也支持tau蛋白可帮助诊断和鉴别诊断sCJD这一观点。T-tau蛋白在sCJD患者的脑脊液中显著升高,明显高于AD患者。
sCJD的分子亚型的区分主要基于RPNR基因129位密码子的氨基酸类型和病理朊蛋白(PrPSc)的类型,第129位密码子表达蛋氨酸(M)或缬氨酸(V),PrPSc根据蛋白酶抗性核心片段的大小和电泳迁移率,分为1型、2型。由此目前sCJD分为6种亚型:MM1、MM2、MV1、MV2、VV1、VV2。不同分子亚型间临床表现及预后皆有不同。但研究发现脑脊液标志物对CJD的不同分子亚型无明确区分作用[11,12],但在已知基因型的患者中,tau蛋白水平与朊蛋白类型之间存在显著相关性,具有MM和MV基因型的PrP 1型患者的tau蛋白水平显著较高,而具有VV基因型的PrP 1型患者中tau蛋白水平较低,受试者工作特征曲线下面积达0.76~0.80。提示在已知密码子129基因型时,T-tau蛋白可用作评估朊病毒蛋白类型的诊断测试[13]。更进一步验证了tau蛋白对于CJD临床诊断乃至病理层面的意义。
P-tau作为AD特异性标志物对于AD的诊断、鉴别诊断尤为重要。T-tau作为神经元损伤标志物,在癫痫发作(24%)、中枢神经系统肿瘤/副肿瘤(22%)及卒中(18.4%)患者中也存在不同程度升高[14]。既往研究已证实利用T-tau/P-tau区分非典型AD及CJD比利用T-tau蛋白有更高价值。日本研究者Satoh等[15]也提出T-tau/P-tau有助于鉴别CJD和其他神经变性疾病。持有相同观点的还有瑞典研究者,他们在JAMA刊登了对共9 765例死亡患者脑脊液的研究,其中包括93例CJD(其中52例尸检病理证实)[16]。研究发现CJD患者T-tau、T-tau/P-tau均明显升高,但P-tau并未升高;T-tau/P-tau对于鉴别AD及其他痴呆的总特异度为99%,敏感度78.5%,阳性似然比79.9;分组分析鉴别AD的敏感度为78.5%,特异度为99.6%,阳性似然比196.6;鉴别其他痴呆的敏感度为78.5%,特异度为99.3%,阳性似然比109.3[16]。我们的研究结果也与上述研究结果相符,发现P-tau、T-tau/P-tau在sCJD及AD患者间差异存在显著的统计学意义。
CJD临床异质性高,进展快,预后差,临床早期诊断及与其他可治性神经系统变性病的鉴别诊断显得尤其重要。14-3-3蛋白作为经典的脑脊液标志物,在早期即纳入CJD诊断,但多个研究显示其特异度较低,对于鉴别其他存在神经元性损害的疾病略显不足,目前仍是临床诊断CJD的重要指标。Tau蛋白作为神经元损伤的另一标志物,对于CJD的诊断也具有较高的敏感度和特异度,结合P-tau蛋白对鉴别其他类型痴呆就有很高的特异度,可有助于解决14-3-3蛋白假阳性或假阴性的问题。我们的初步研究结果提示了P-tau/T-tau及T-tau蛋白对sCJD的诊断及鉴别诊断价值,期待进一步的病理证据的验证。
近几年来关于CJD的研究主要聚焦在振动诱导转化的朊病毒转化(real time quaking-induced conversion,RT-QuIC)[17],这是一种新型的超灵敏体外试验,可以特异性地靶向出病理性朊病毒蛋白(PrPSc),最早被用于对于脑匀浆中PrPSc的检测,也可以用于血浆、尿液、鼻拭子等检测。已有研究证实脑脊液RT-QuIC具有良好的诊断敏感度(82%~96%)和近100%的特异度[17,18,19]。RT-QuIC也被证实具有对sCJD分子亚型的区分及预测预后的价值。德国研究者对比了2009年版sCJD诊断标准,认为加入RT-QuIC的优化版诊断标准对于诊断sCJD可达到97%的敏感度和99%的特异度[6]。期待更多的检测手段帮助尽早确定诊断sCJD。
[1] Puoti G, Bizzi A, Forloni G, et al. Sporadic human prion diseases: molecular insights and diagnosis[J]. Lancet Neurol, 2012, 11(7): 618-628.
[2] Ladogana A, Puopolo M, Croes EA, et al. Mortality from Creutzfeldt-Jakob disease and related disorders in Europe, Australia, and Canada[J]. Neurology, 2005, 64(9): 1586-1591.
[3] Kretzschmar HA, Ironside JW, DeArmond SJ, et al. Diagnostic criteria for sporadic Creutzfeldt-Jakob disease[J]. Arch Neurol, 1996, 53(9): 913-920.
[4] Otto M, Wiltfang J, Tumani H, et al. Elevated levels of tau-protein in cerebrospinal fluid of patients with Creutzfeldt-Jakob disease[J]. Neurosci Lett, 1997, 225(3): 210-212.
[5] Zerr I, Kallenberg K, Summers DM, et al. Updated clinical diagnostic criteria for sporadic Creutzfeldt-Jakob disease[J]. Brain, 2009, 132(
[6] Hermann P, Laux M, Glatzel M, et al. Validation and utilization of amended diagnostic criteria in Creutzfeldt-Jakob disease surveillance[J]. Neurology, 2018, 91(4): e331-338.
[7] McKhann GM, Knopman DS, Chertkow H, et al. The diagnosis of dementia due to Alzheimer's disease: recommendations from the National Institute on Aging-Alzheimer's Association workgroups on diagnostic guidelines for Alzheimer's disease[J]. Alzheimers Dement, 2011, 7(3): 263-269.
[8] Zerr I, Pocchiari M, Collins S, et al. Analysis of EEG and CSF 14-3-3 proteins as aids to the diagnosis of Creutzfeldt-Jakob disease[J]. Neurology, 2000, 55(6): 811-815.
[9] Stoeck K, Sanchez-Juan P, Gawinecka J, et al. Cerebrospinal fluid biomarker supported diagnosis of Creutzfeldt-Jakob disease and rapid dementias: a longitudinal multicentre study over 10 years[J]. Brain, 2012, 135(
[10] Tagliapietra M, Zanusso G, Fiorini M, et al. Accuracy of diagnostic criteria for sporadic creutzfeldt-jakob disease among rapidly progressive dementia[J]. J Alzheimers Dis, 2013, 34(1): 231-238.
[11] Chohan G, Pennington C, Mackenzie JM, et al. The role of cerebrospinal fluid 14-3-3 and other proteins in the diagnosis of sporadic Creutzfeldt-Jakob disease in the UK: a 10-year review[J]. J Neurol Neurosurg Psychiatry, 2010, 81(11): 1243-1248.
[12] Sanchez-Juan P, Green A, Ladogana A, et al. CSF tests in the differential diagnosis of Creutzfeldt-Jakob disease[J]. Neurology, 2006, 67(4): 637-643.
[13] Karch A, Hermann P, Ponto C, et al. Cerebrospinal fluid tau levels are a marker for molecular subtype in sporadic Creutzfeldt-Jakob disease[J]. Neurobiol Aging, 2015, 36(5): 1964-1968.
[14] Karch A, Zerr I. A comparison of tau and 14-3-3 protein in the diagnosis of Creutzfeldt-Jakob disease[J]. Neurology, 2013, 80(22): 2081.
[15] Satoh K, Shirabe S, Eguchi H, et al. 14-3-3 protein, total tau and phosphorylated tau in cerebrospinal fluid of patients with Creutzfeldt-Jakob disease and neurodegenerative disease in Japan[J]. Cell Mol Neurobiol, 2006, 26(1): 45-52.
[16] Skillback T, Rosen C, Asztely F, et al. Diagnostic performance of cerebrospinal fluid total tau and phosphorylated tau in Creutzfeldt-Jakob disease: results from the Swedish Mortality Registry[J]. JAMA Neurol, 2014, 71(4): 476-483.
[17] McGuire LI, Peden AH, Orru CD, et al. Real time quaking-induced conversion analysis of cerebrospinal fluid in sporadic Creutzfeldt-Jakob disease[J]. Ann Neurol, 2012, 72(2): 278-285.
[18] Bongianni M, Orru C, Groveman BR, et al. Diagnosis of human prion disease using real-time quaking-induced conversion testing of olfactory mucosa and cerebrospinal fluid samples[J]. JAMA Neurol, 2017, 74(2): 155-162.
[19] Atarashi R, Satoh K, Sano K, et al. Ultrasensitive human prion detection in cerebrospinal fluid by real-time quaking-induced conversion[J]. Nat Med, 2011, 17(2): 175-178.
