PSD-95抑制剂ZL006对新生大鼠缺氧缺血性脑损伤的作用探讨
2020年11月
中华神经科杂志,第27卷第11期 第812页-第816页
胡亚楠,刘春丽,梅花,杨光路,张钰恒,呼斯乐
新生儿缺氧缺血性脑损伤(hypoxic-ischemic brain damage,HIBD)是新生儿时期危害最大的常见疾病之一,可引起不可逆的脑损伤,导致一系列的神经系统后遗症,如脑瘫、智力低下、癫痫等[1]。其发病机制尚不明确,亦缺乏特异性治疗方案。目前研究认为HIBD与兴奋性氨基酸的"兴奋毒"作用相关。突触后密度蛋白-95(post synaptic density protein-95,PSD-95)是兴奋性突触中分离纯化出来的一种蛋白质,在中枢神经系统广泛分布,广泛存在于大脑皮质神经元细胞中,参与兴奋性氨基酸的"兴奋毒"作用[2]。基于目前对HIBD发病机制的研究,推测减少"兴奋毒"作用,可减少神经元细胞的损伤及凋亡。基于PSD-95在该毒性作用过程中的重要作用,我们推测PSD-95抑制剂可减少"兴奋毒"作用,从而减少神经元细胞的损伤及凋亡,改善HIBD近远期预后。故本研究拟通过建立HIBD新生大鼠模型实验,明确PSD-95是否参与HIBD的发病过程,探讨其抑制剂ZL006在新生大鼠HIBD中是否存在神经保护作用。
清洁级健康Wistar孕鼠(常州卡文斯动物实验有限公司),许可证号:SCXK(苏)2016-0010。ZL006试剂购自Med Chem Express公司(货号HY-100456)。氯化三苯基四氮唑购自Sigma公司(货号T8877)。4-羟基壬烯醛(4-hydroxynoneal,4-HNE)购自MyBioSource公司(货号MBS736336)。超氧化物歧化酶(superoxide dismutase,SOD)购自南京建成生物工程研究所(货号A001-1)。
选取7日龄健康Wistar新生大鼠80只,应用随机数字表随机分为正常对照组20只、假手术组20只、手术组(HIBD模型组)40只,手术组又随机分为ZL006治疗组20只与非治疗组20只。
HIBD模型通过Rice-Vannucci法建立:将Wistar大鼠术前进行称重及编号,乙醚麻醉,于手术台固定,常规消毒铺巾,颈部正中偏右做长约6 mm切口。分离并用5-0丝线双重结扎右侧颈总动脉;缝合皮肤切口,术后恢复1 h,然后放入缺氧舱中给予8%氧气和92%氮气混合气2.5 h,后置于常氧母鼠笼中饲养。假手术组仅做颈部皮肤切口分离右侧颈总动脉,不予结扎,缝合切口,不做缺氧处理。操作过程保持恒温。依据文献[3,4],手术组中的治疗组于模型建立完成后给予ZL006 10 mg/kg进行腹腔注射1次,非治疗组不予任何干预。
手术后第1天和第7天,分别于4组新生鼠中应用抽签法各随机选取3只,通过TTC染色法观察脑组织梗死程度。将脑组织在4 ℃生理盐水中冰冻5 min,沿冠状面做1~2 mm厚度连续切片。将切片置于2%TTC溶液中,37 ℃避光孵育30 min,磷酸盐缓冲液清洗后,使用4%多聚甲醛固定。染成红色的为正常脑组织,白色为梗死脑组织。
手术后第1天和第7天,分别于4组新生鼠中应用抽签法各随机选取3只,将大鼠损伤区域的脑组织加入蛋白裂解液后在冰上进行匀浆,离心(4 ℃,15 000 r/min)30 min,取上清液进行蛋白定量检测,常规电泳,显色压片后使用扫描仪采集电子图像信息进行分析,观察PSD-95表达情况。
手术后第1天和第7天,分别于4组新生鼠中应用抽签法各随机选取3只,在冰上迅速分离出大脑皮质,称取脑组织质量加9倍生理盐水,制成10%匀浆液,离心(4 ℃,15 000 r/min,30 min),收集上清液。4-HNE、SOD根据试剂说明书进行常规ELISA操作,利用酶标仪进行检测后采集电子数据进行分析。
采用SPSS 18.0统计软件进行统计学分析,符合正态分布的计量资料以均数±标准差(Mean±SD)表示,多组间比较采用单因素方差分析,组间多重比较采用LSD-t检验,不符合正态分布的计量资料应用Kruskal-Wallis H检验,P<0.05为差异有统计学意义。
术后第1天,非治疗组大鼠脑损伤最严重,ZL006治疗组脑梗死减少,术后第7天手术组仍可见少许梗死灶,见
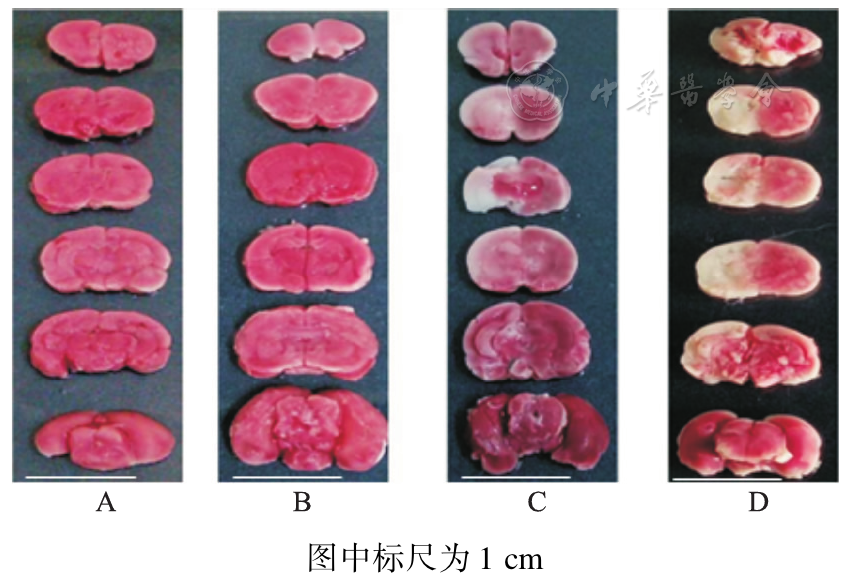
A.正常对照组;B.假手术组;C.ZL006治疗组;D.非治疗组。沿大鼠脑冠状面做连续切片,每只大鼠脑组织获得6张切片,白色区域为脑梗死区。
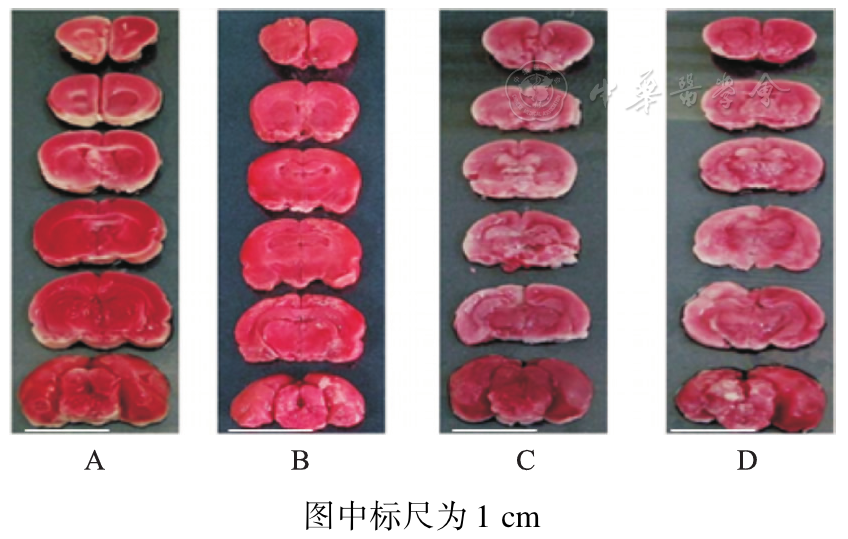
A.正常对照组;B.假手术组;C.ZL006治疗组;D.非治疗组。沿大鼠脑冠状面做连续切片,每只大鼠脑组织获得6张切片,白色区域为脑梗死区。
术后第1天,正常对照组及假手术组PSD-95蛋白表达差异无统计学意义(P>0.05),ZL006治疗组及非治疗组表达量显著高于正常对照组及假手术组(P<0.01),ZL006治疗组与非治疗组比较其表达量差异有统计学意义(P<0.05),术后第7天各组间差异无统计学意义,见
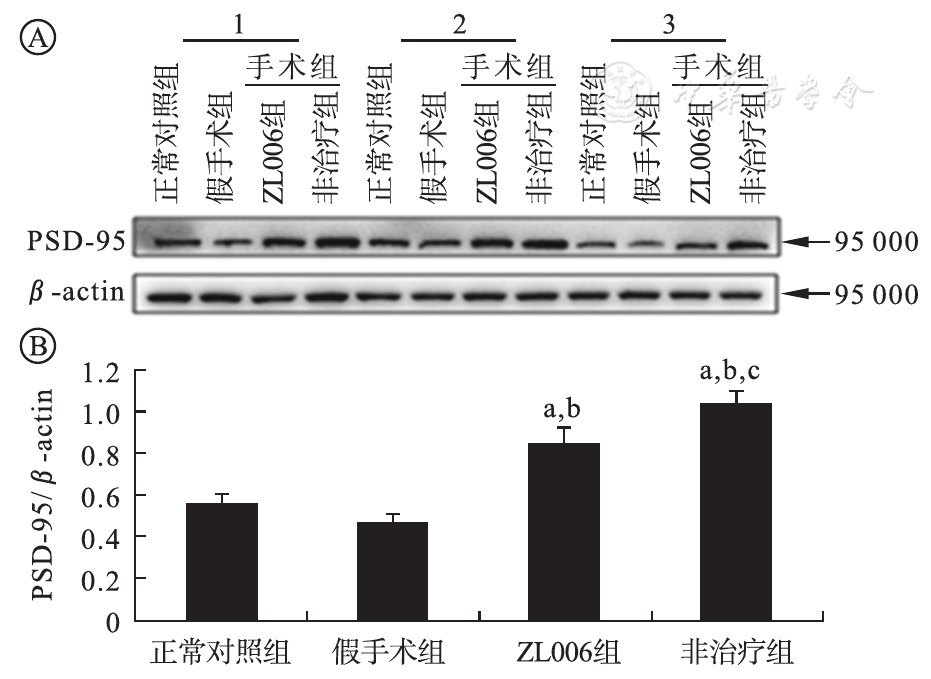
A为各组PSD-95蛋白表达的Western blot条带图;B为各组PSD-95蛋白相对表达水平比较柱形图(n=3);与正常对照组比较,aP<0.01;与假手术组比较,bP<0.01;与ZL006治疗组比较,cP<0.05。
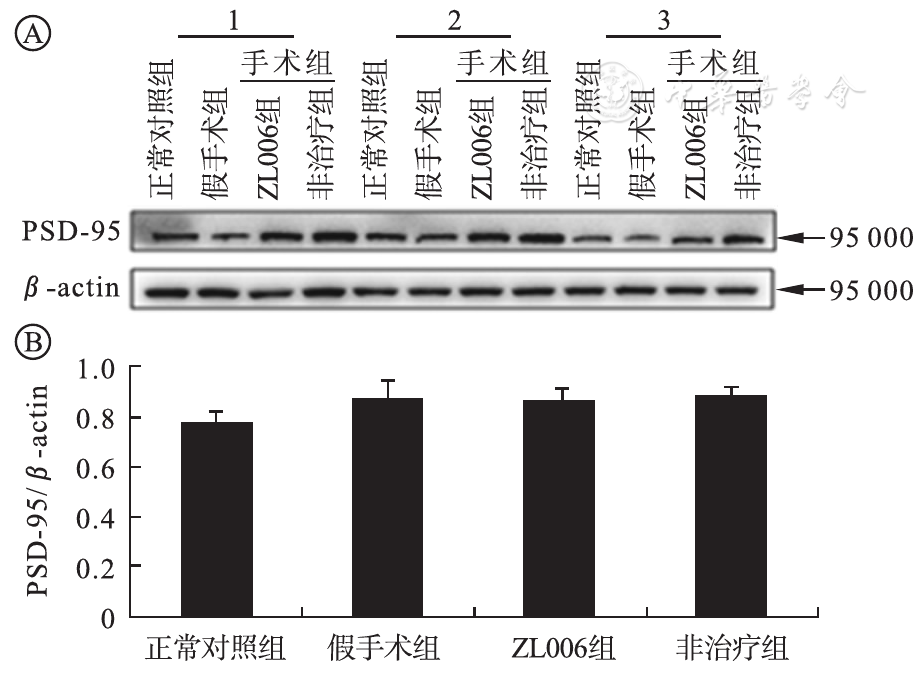
A为各组PSD-95蛋白表达的Western blot条带图;B为各组PSD-95蛋白相对表达水平比较柱形图(n=3)(P均>0.05)。
4-HNE在术后第1天中手术组表达量显著高于正常对照组及假手术组(P<0.01),且非治疗组高于ZL006治疗组(P<0.05),SOD在术后1 d手术组中表达显著低于正常对照组及假手术组(P<0.01),且非治疗组低于ZL006治疗组(P<0.05),见
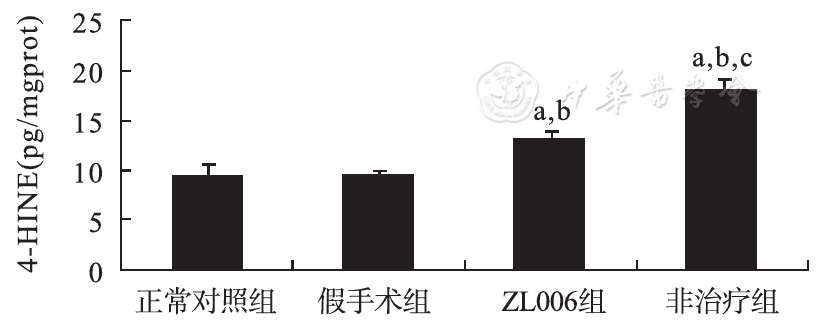
与正常对照组比较,aP<0.01;与假手术组比较,bP<0.01;与ZL006治疗组比较,cP<0.05。
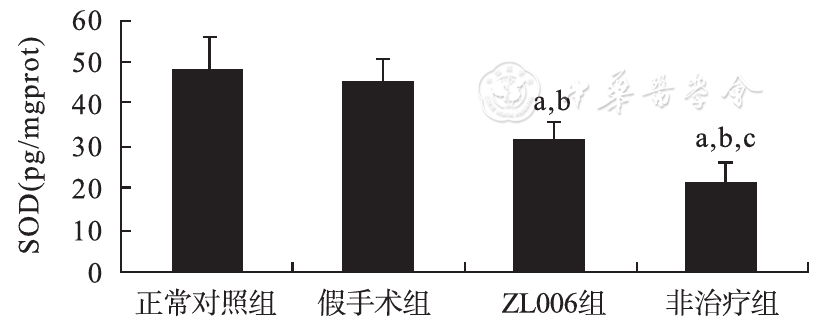
与正常对照组比较,aP<0.01;与假手术组比较,bP<0.01;与ZL006治疗组比较,cP<0.05。
目前普遍认为,当足够严重的HIBD消耗完体内所有的储存能量后,可迅速发展为酸中毒,谷氨酸兴奋性毒性反应,生成活性氧及产生氧化应激,并可导致长期的延迟性细胞死亡或凋亡以及炎性反应[5,6]。PSD-95是兴奋性突触的重要组成蛋白之一,对兴奋性突触的发生及功能维持具有极为重要的意义。PSD-95与谷氨酸受体激活后受体操纵钙通道开放,脑缺血再灌注后引起谷氨酸释放增加和摄取减少,突触后神经元谷氨酸受体过度激活,在谷氨酸的刺激下,N-甲基-D-天门冬氨酸受体(N-methyl-D-aspartate receptor,NMDAR)通过PSD-95激活一系列信号分子而实现其毒性作用。另外,PSD-95还能结合其下游的特异性信号分子如神经元一氧化氮合酶(neuronal nitricoxide-synthase,nNOS)等,使Ca2+内流,激活其靶酶,产生大量的活性氧分子、氧自由基、一氧化氮及高活性的过硝基化合物等有害物质,从而引起炎性细胞因子释放、膜脂质过氧化、caspase激活等,导致神经元的损伤和凋亡。生理状态下,体内低浓度的4-HNE参与细胞周期调控及细胞分化信号的传导;病理状态下,活性氧与细胞膜或细胞浆膜的花生四烯酸等脂质发生过氧化反应后产生具有高度活性的4-HNE,可直接导致细胞凋亡[7]。SOD是体内十分重要的抗氧化酶,其活性反映了机体抗氧化能力。基于目前HIBD发病机制及4-HNE和SOD的生物学效应,4-HNE、SOD的测定可间接反映脑损伤的严重程度。
目前多项研究表明,在缺氧缺血情况下,抑制PSD-95的表达或PSD-95与NMDAR的结合对HIBD有保护作用,且抑制PSD-95并未影响NMDAR的正常功能,从而规避了阻断受体本身的不利结果[8,9,10]。NA-1是目前关注度最高的PSD-95抑制剂,且已开始应用于部分成人的神经系统疾病,如防治颅内动脉瘤介入术后的继发脑梗死[11]。ZL006是近些年来研制的生物学效应更高、价格相对便宜的PSD-95抑制剂,其主要作用是选择性阻断PSD-95与nNOS之间的联系,从而干预NMDAR/PSD-95/nNOS信号途径。在大鼠短暂性大脑中动脉阻塞模型中,缺血再灌注1 h后,静脉给予ZL006 1.5 mg/kg,与对照组相比,给药组显著改善神经功能评分并降低脑梗死面积[12]。目前,ZL006正在进行深入的临床药理研究,且其在成人疾病中,如创伤性脑损伤、脑卒中、出血后疼痛的相关研究较多[13,14,15],在新生儿疾病的研究极少。
基于目前研究表明的PSD-95与缺血性脑损伤的相关性,推测PSD-95通过兴奋毒作用参与了HIBD,故进行了本研究。本研究HIBD模型通过Rice-Vannucci法建立,手术组均发生严重脑损伤,表明造模是可靠的。本研究发现,手术组PSD-95蛋白表达量显著高于正常对照组及假手术组,故推测PSD-95参与了HIBD的发病过程。应用ZL006治疗的大鼠在术后第1天脑梗死面积、PSD-95蛋白表达量等均较非治疗组明显减少,提示应用PSD-95抑制剂阻断其作用途径可减少脑损伤程度。进一步行4-HNE和SOD的检测发现,4-HNE在术后第1天手术组中表达量显著高于正常对照组SOD(P<0.01),显著低于正常对照组(P<0.01),提示存在氧化应激反应及SOD过度消耗。ZL006治疗组中4-HNE和SOD的表达量与非治疗组比较差异均有统计学意义,亦推测PSD-95抑制剂可减轻HIBD。这一结果与以往研究结果一致,表明兴奋毒性反应是缺血缺氧损伤的重要机制;PSD-95抑制剂对新生鼠HIBD存在保护作用[16]。
梁红霞等[17]研究发现,在大鼠脑损伤后3~6 h,PSD-95蛋白表达升高,12 h出现第1个高峰,随后短暂回落,在5 d时又继续升高,达第2个高峰,7 d开始下降,即呈现升高-回落-升高-回落的趋势。本研究中手术组大鼠术后第1天脑损伤严重,PSD-95表达量最高,第7天时降至正常,不排除受上述研究现象影响所致。本研究选取术后第1天及术后第7天进行研究,未进行术后第5天的观察,故其结果可能受到影响。另外,新生大鼠脑为非成熟脑,其自我修复能力较强,所以术后第7天时手术组的脑梗死灶已基本恢复,因新生大鼠短日龄内行为表现观察难度较大,且本研究未进行后期大日龄鼠的行为能力观察,尚不能得知术后第7天脑梗死修复后的大鼠远期神经损伤情况。
本研究为PSD-95及其抑制剂ZL006对新生大鼠HIBD作用机制的初步探讨,存在诸多不足:(1)研究时间节点选择:在HIBD鼠造模中,依据不同需要通常选择的时间节点为出生后1 d、3 d、5 d、7 d、14 d等,出生后7~10 d的大鼠脑组织类似于32~40周妊娠胎儿的大脑发育[18]。本研究主要探讨新生鼠缺氧缺血性脑损伤,且因经费、人力有限等原因,选择了生后7日龄鼠术后1 d及7 d 2个时间节点,未能进一步细化研究;(2)ZL006的剂量及用法选择:目前研究中ZL006的剂量选择1.0~50 mg/(kg·次),单次或间隔数次给予,静脉用药或腹腔注射[3,4,12,19]。因实验鼠日龄小,体重小,静脉注射难度相对较大,故选用腹腔注射。蒋子剑等[3]研究表明,ZL006 10 mg/kg腹腔单次注射时大鼠脑水肿减轻效果最佳,故本研究选用该剂量进行研究,没有进一步做不同剂量不同给药方法的对比研究。如上不足导致的结果偏倚需继续增加样本量及细化作用时间点、ZL006应用剂量等予以进一步论证。
综上所述,推测PSD-95可能参与了HIBD的早期发病过程,其抑制剂ZL006对新生大鼠HIBD可能存在神经保护作用,但均需进一步论证。
[1] 顾卉,纪莲,黄天楚,等.蛋白激酶R样内质网激酶的磷酸化对缺氧缺血性脑损伤新生大鼠脑神经细胞凋亡的影响[J].中国小儿急救医学,2015,22(5):316-319.
[2] 王卫平.儿科学[M].8版.北京:人民卫生出版社,2013:107-109.
[3] 蒋子剑,杨甜,马文科,等.ZL006阻断PSD-95信号途径调节线粒体功能在创伤性脑损伤中的作用[J].中华神经外科疾病研究杂志,2015,14(6):519-522.
[4] 赵媛,蔡亚兰,陈竹,等.PSD-95信号通路介导5-HT1A受体激动剂改善大鼠病理性攻击行为的调控机制[J].第三军医大学学报,2018,40(3):222-229.
[5] Brackmann FA, Alzheimer C, Trollmann R,et al.Activin A in perinatal brain injury[J].Neuropediatrics,2015,46(2):82-87.
[6] Pavlovic V, Sarac M.The role of ascorbic acid and monosodium glutamate in thymocyte apoptosis [J].Bratisl Med J,2010,111(6):357-360.
[7] Awasthi YC, Sharma R, Cheng JZ,et al.Role of 4-hydroxynonenal in stress-mediated apoptosis signaling[J].Mol Aspects Med,2003,24(4):219-230.
[8] Cook DJ, Tymianski M.Nonhuman primate models of stroke for translational neuroprotection research[J].Neurotherapeutics,2012,9(2):371-379.
[9] Bell KF, Bent RJ, Meese-Tamuri S,et al.Calmodulin kinase IV-dependent CREB activation is required for neuroprotection via NMDA receptor-PSD95 disruption[J].J Neurochem,2013,126(2):274-287.
[10] Flemming A.Stroke:Can PSD-95 inhibitors widen the therapeutic window?[J].Nat Rev Drug Discov,2012,11(4):272.
[11] Hill MD, Martin RH, Mikulis D,et al.Safe and efficacy of NA-1 in patients with iatrogenic stroke after endovascular aneurysm repair (ENACT):a phase2,randomised,duble-blind,placebo-controlled trial[J].Lancet Neurol,2012,11(11):942-950.
[12] Zhou L, Li F, Xu HB,et al.Treatment of cerebral ischemia by distupting ischemia -induced interaction of nNos with PSD-95[J].Nat Med,2010,16(12):1439-1443.
[13] Wang DL, Qian XD, Lin YH,et al.ZL006 promotes migration and differentiation of transplanted neural stem cells in male rats after stroke[J].J Neurosci Res,2017,95(12):2409-2419.
[14] Liu SG, Wang YM, Zhang YJ,et al.ZL006 protects spinal cord neurons against ischemia-induced oxidative stress through AMPK-PGC-1α-Sirt3 pathway[J].Neurochem Int,2017,108:230-237.
[15] Lin YH, Liang HY, Xu K,et al.Dissociation of nNOS from PSD-95 promotes functional recovery after cerebral ischaemia in mice through reducing excessive tonic GABA release from reactive astrocytes[J].J Pathol,2018,244(2):176-188.
[16]
[17] 梁红霞,李如波,王福远,等.大鼠钝力性脑挫伤后PSD-95的表达[J].中国法医学杂志,2010,25(4):242-244.
[18] Allah Yar R, Akbar A, Iqbal F,et al.Creatine monohydrate supplementation for 10 weeks mediates neuroprotection and improves learning/memory following neonatal hypoxia ischemia encephalopathy in female albino mice[J].Brain Res,2015,1595:92-100.
[19] Sherwin E, Lennon A, Harkin A.Regional Specific Modulation of Stress-Induced Neuronal Activation Associated with the PSD95/NOS Interaction Inhibitor ZL006 in the Wistar Kyoto Rat[J].Int J Neuropsychopharmacol,2017,20(10):833-843.
