以急性胃肠损伤分级系统为导向的儿童急性肠衰竭临床分析
2020年11月
中华神经科杂志,第27卷第11期 第858页-第860页
何小兵,陈飞燕,张锦,杨镒宇,吴强,钟军,柴成伟,李玖军
儿童急性肠衰竭是因多种病因造成的肠道吸收、运动功能障碍,肠屏障功能破坏,并可在短期内诱发脓毒症及多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)。现有国内外共识认为肠衰竭的疾病特征在于肠道的吸收功能无法维持机体的营养需求和平衡[1,2],但目前对于该病的诊断和肠功能评估仍缺乏明确的标准和客观的临床指标,加之儿童患者存在表述困难、依从性差等特点,给临床诊疗造成了困难。现结合相关文献,将我科收治的26例急性肠衰竭患儿的临床资料报道如下。
选取广州市妇女儿童医疗中心胃肠外科及重症监护病房2016年9月至2020年1月收治的儿童急性肠衰竭26例,其中男18例,女8例,年龄1~120个月,平均年龄(18.1±25.1)个月,具体临床资料见
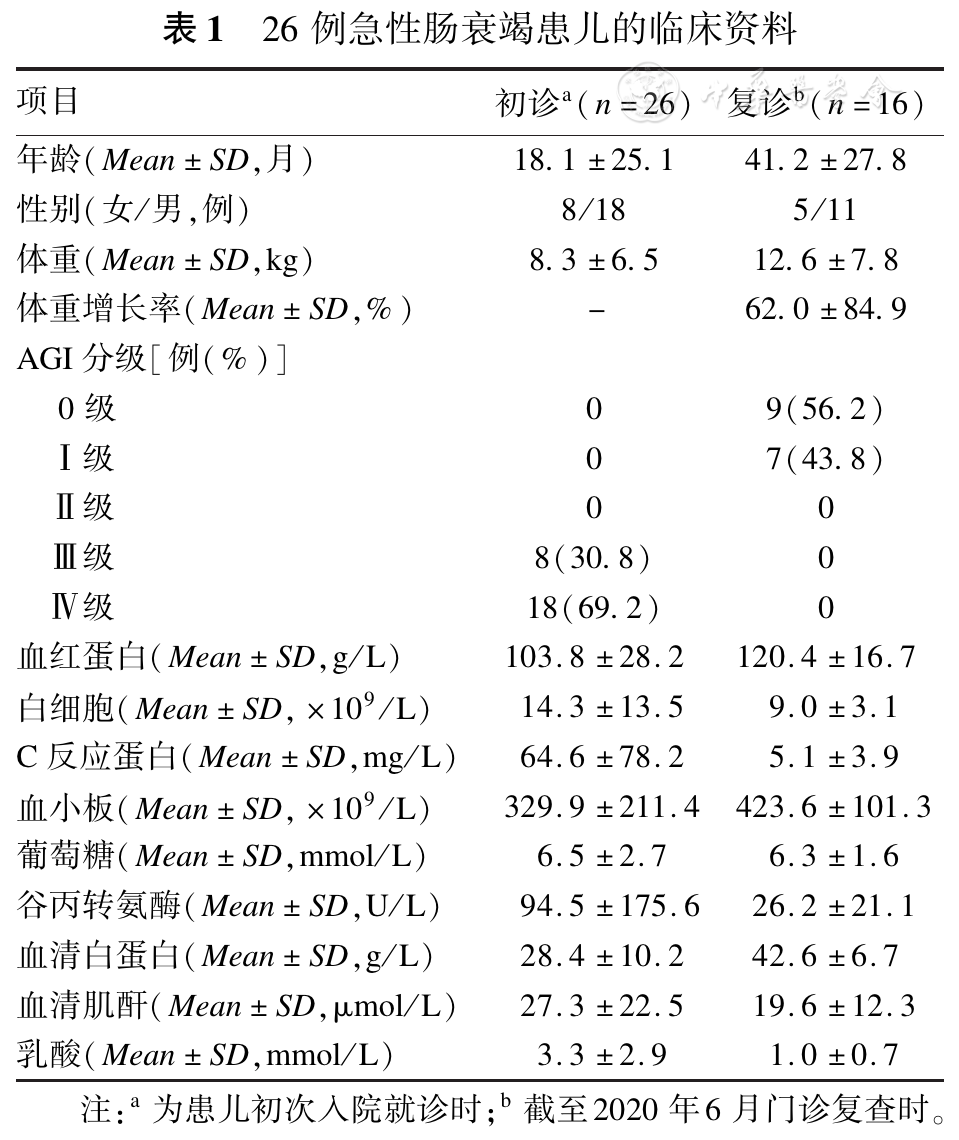
急性肠衰竭的诊断依据2012年欧洲危重病学会(ESICM)腹部疾病工作组提出的危重患者急性胃肠损伤(acute gastrointestinal injury,AGI)分级系统[3]:0级:正常胃肠功能;Ⅰ级:存在发展为胃肠功能不全或衰竭风险(病因明确、持续短暂、可自限状态);Ⅱ级:胃肠功能不全(与全身病情变化关系不密切,需干预治疗);Ⅲ级:胃肠功能衰竭(合并多器官功能障碍,保守干预不能逆转的肠功能障碍);Ⅳ级:胃肠功能衰竭并多脏器功能障碍或休克(存在腹腔间隙综合征、肠源性脓毒症等威胁生命的危险因素)。本组患儿为达到AGI Ⅲ~Ⅳ级者。
确诊患儿予危重监护并启动MOST,包括:(1)抗休克,纠正脱水及电解质、酸碱平衡紊乱,应用血管活性药物维持血压、循环稳定,有出血倾向者予输血或补充凝血因子;(2)呼吸支持,改善肺氧合功能,对于常频呼吸机辅助通气不能纠正的呼吸衰竭,及时予气管插管或高频振荡通气;(3)合并急性肾功能衰竭或血流动力学不稳定者予床边持续肾脏替代治疗以维持液体平衡并清除体内炎症介质;(4)针对检出病原选用敏感抗生素或亚胺培南、万古霉素等经验性抗感染治疗;(5)其他支持治疗,包括护肝、护胃、促胃肠动力药物的应用,静脉滴注免疫球蛋白,胃肠减压及肛管排气等对症处理。
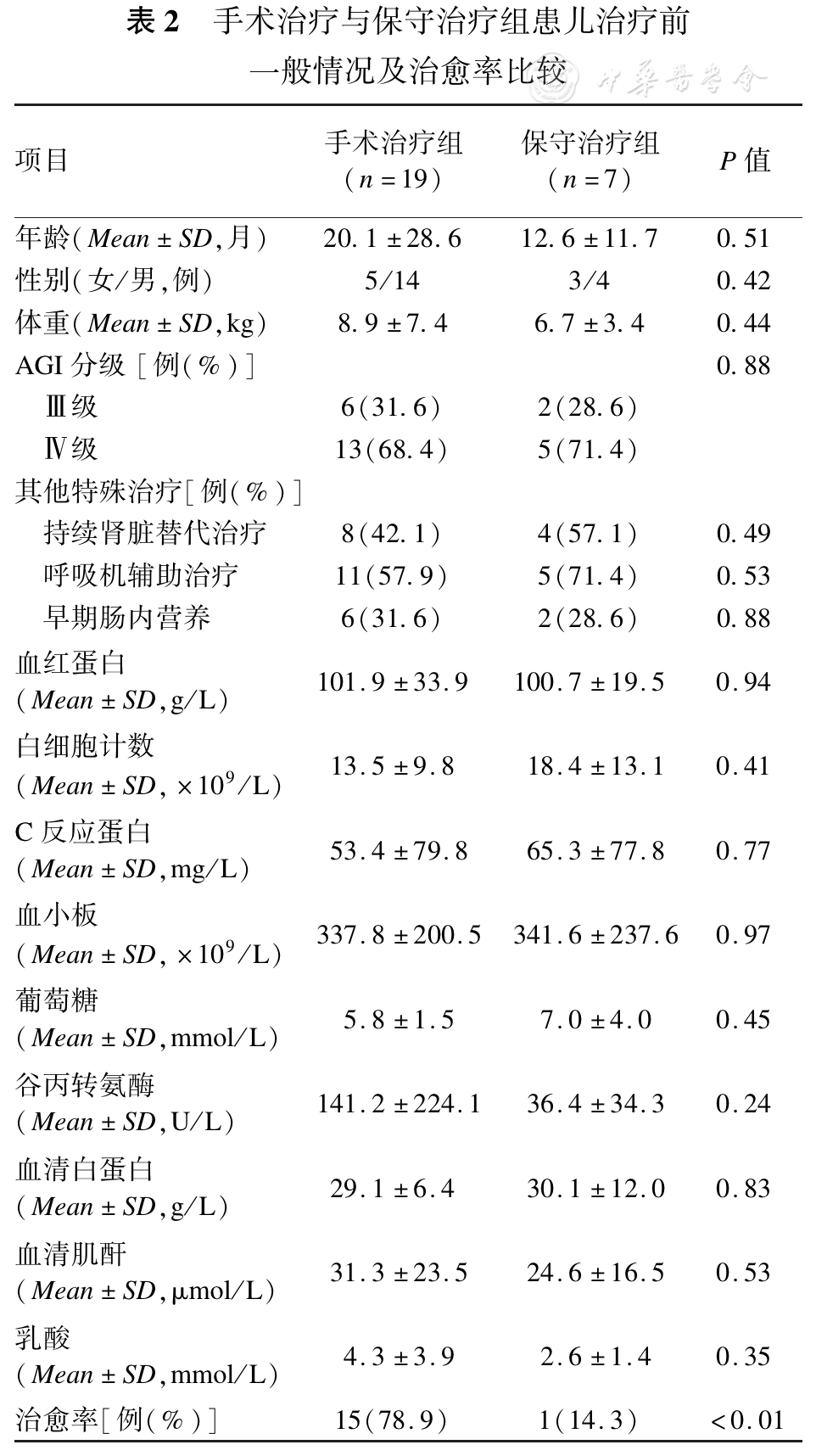
8例(30.8%)患儿予早期肠内营养(入PICU 24~48 h内),并监测肠功能,若腹部及全身症状改善,肠功能改善则予少量鼻饲喂养并逐渐增量。通常选用经鼻饲管喂养,一般给予普通配方奶,个别依据病情及治疗前喂养方式选用母乳,量从1~2 mL/kg开始,每2~4小时1次。19例(73.1%)患儿行手术治疗(手术治疗组),其中行肠造口10例,肠切除+肠造口6例,肠切除+梅克尔憩室切除1例,肠套叠复位+肠造口1例,巨结肠根治+肠造口1例。考虑到目前尚无以AGI分级系统指导儿童急性肠衰竭治疗确切的实践报道,手术指征及时机的评估主要依据医师治疗经验,并须充分考虑患儿手术、麻醉耐受情况及家属的治疗意愿。
采用SPSS 22.0统计软件分析,计量资料以均值±标准差(Mean±SD)表示,计数资料以例(%)表示,经Mann-Whitney检验和Chi-square检验比较两组患儿临床指标及治愈情况, P<0.05为差异有统计学意义。
经以上治疗,16例(61.5%)患儿治愈并预后良好(AGI 0~Ⅰ级),恢复自主进食,平均体重增长率(62.0±84.9)%[截至2020年6月,平均随访时间(22.8±13.9)个月],见
接受早期手术治疗组治愈率显著高于保守治疗组(78.9%比14.3%,P<0.01),见
因长期缺乏明确定义及统一的诊断标准,关于儿童急性肠衰竭的发病率及长期预后暂无确切统计数据,结合本组预后及近年国内外报道[4,5],该病通常进展迅速,本组患儿均在出现临床症状后1周内(平均2.6 d)发展至MODS,伴随较高病死率,且有一定概率出现手术后及肠外营养相关并发症,包括肝肾功能损害、导管相关性血流感染、静脉炎症及萎缩等[6,7]。
发展中国家导致儿童急性肠衰竭的病因主要是肠炎性疾病,而发达国家则多继发于先天或胃肠道术后短肠综合征[8]。但在临床实际中,较多患儿可因早期缺乏典型临床及影像学表现而未能明确病因,或仅予常规保守处理而延误诊治。因而,在病因未明的情况下,以肠功能损害程度为导向的分级标准的建立,为危重患儿的病情监测和治疗方案的制订提供了重要依据。
AGI分级系统自建立以来,在国内外成人患者的诊疗中已得到成熟运用[9,10],并形成了相应的诊疗路径和指南[3,10,11]。目前已知与AGI分级密切相关的影响因素包括序贯器官衰竭评估、高血糖、水及电解质酸碱平衡紊乱、血管活性药物应用等[12];在治疗上,一般认为肠衰竭患者(AGI Ⅲ级)需以排除、处理腹部病理因素,促胃肠动力及腹内高压治疗,尝试少量肠道内喂养/辅以肠外喂养(1周后)为原则,AGI Ⅳ级者需积极手术干预[3,10,11]。然而,以上共识多基于病因明确的成人胃肠功能障碍,AGI分级系统在儿童急性肠衰竭中的应用仍报道较少。
儿童急性肠衰竭具有起病隐匿、进展迅速等临床特点,本组手术及病理结果显示,多数患儿存在较重的组织学损伤,或肠套叠、梅克尔憩室等明确手术指征,但其在发病早期临床表现却缺乏特异性,可能仅表现为肠胀气和(或)病毒性腹泻等常见消化道疾病相似的症状而致误诊或漏诊。此外,儿童器官功能发育尚未完全,对肠衰竭病程中缺血缺氧、水电解质及酸碱平衡紊乱等危险因素的耐受性较差,因此我们建议急性肠衰竭患儿早期监测肠功能并启动MOST,并及时外科干预以明确病因,如未能明确病因亦可予肠道减压或造口改善症状。
本研究以AGI分级系统作为评估肠功能及制订治疗方案的依据,证实了其在治疗儿童急性肠衰竭的预测和指导意义,结果显示对AGI Ⅲ~Ⅳ级患儿积极手术干预有助于明确病因。从治疗结果来看,本组患儿总体治愈率同近年文献报道近似[13,14],尚有进一步提高空间,早期手术者治愈率显著高于保守治疗者,且大多肠功能恢复良好,但在儿童患者的治疗中还需考虑其远期并发症的发生及对生长发育的影响,因此儿童急性肠衰竭的远期治疗效果仍有待于进一步随访观察。
[1] Nucci AM, Ellsworth K, Michalski A,et al. Survey of nutrition management practices in centers for pediatric intestinal rehabilitation[J]. Nutr Clin Pract,2018,33(4):528-538.
[2] 黎介寿.肠衰竭——概念、营养支持与肠粘膜屏障维护[J].肠外与肠内营养,2004,11(2):65-67.
[3] Blaser AR, Malbrain ML, Starkopf J,et al.Gastrointestinal function in intensive care patients:terminology,definitions and management. Recommendations of the ESICM Working Group on Abdominal Problems[J].Intensive Care Med,2012,38(3):384-394.
[4] Dong Z, Nan L, Lihua D,et al.Evaluation of clinical application of ESICM acute gastrointestinal injury grading system:a single-center observational study[J].Chin Med J (Engl),2014,127(10):1833-1836.
[5] Belza C, Fitzgerald K, Silva ND,et al.Predicting Intestinal Adaptation in Pediatric Intestinal Failure:A Retrospective Cohort Study[J].Ann Surg,2017,269(5):1.
[6] Kaufman SS, Matsumoto CS. Management of pediatric intestinal failure[J]. Minerva Pediatr,2015,67(4):321.
[7] 梁兵,关文贺,王丽杰.不同营养支持方式对PICU患儿营养状态的影响[J].中国小儿急救医学,2018,25(7):546-548.
[8] Gondolesi GE, Pattín F, Nikkoupur H,et al.Management of intestinal failure in middle-income countries,for children and adults[J].Curr Opin Organ Transplant,2018,23(2):212-218.
[9] 王艳,王建荣,柳伟伟,等.危重患者急性胃肠损伤分级综合预测模型的构建[J].中华胃肠外科杂志,2018,21(3):325-330.
[10] Klingensmith NJ, Coopersmith CM.The Gut as the Motor of Multiple Organ Dysfunction in Critical Illness[J].Crit Care Clin,2016,32(2):203-212.
[11] Hu B, Sun R, Wu A,et al.Severity of acute gastrointestinal injury grade is a predictor of all-cause mortality in critically ill patients:a multicenter,prospective,observational study[J].Crit Care,2017,21(1):188.
[12] Chapman MJ, Nguyen NQ, Deane AM.Gastrointestinal dysmotility:Evidence and clinical management[J].Curr Opin Clin Nutr Metab Care,2013,16(2):209-216.
[13] Khan FA, Squires RH, Litman HJ,et al.Predictors of Enteral Autonomy in Children with Intestinal Failure:A Multicenter Cohort Study[J].J Pediatr,2015,167(1):29-34.
[14] Herbison K, Kostrzewski A, Dijkstra K,et al.Intestinal failure in paediatric inpatients:a five year audit at a tertiary children's hospital in New Zealand[J]. Transplantation,2017,101(6S2):S129.
