线粒体DNA耗竭综合征12例临床表型及基因型特点
2019年3月
中华儿科杂志,第57卷第3期 第211页-第216页
代丽芳,方方,刘志梅,沈丹敏,丁昌红,李久伟,任晓暾,吴沪生
线粒体DNA耗竭综合征(mitochondrial DNA depletion syndromes,MDS)是一组由核基因编码的引起线粒体DNA(mitochondrial DNA, mtDNA)合成或复制障碍,导致mtDNA数量严重减少的常染色体隐性遗传病,是一组能量代谢障碍性疾病,可累及多个组织或器官。根据主要受累组织器官可分为:肌病型、脑肌病型、肝脑病型及神经胃肠病型。肌病型多于2岁前起病,表现为进行性肌无力、肌张力减低,致病基因为TK2和SLC25A4。脑肌病型多于婴儿期起病,表现为肌张力减低、喂养困难、发育迟滞、听力损害、抽搐等进行性神经系统损伤,致病基因包括RRM2B、SUCLA2、SUCLG1、FBXL4。肝脑病型多于婴幼儿期起病,表现为早发的肝功能损伤、脑病和难治性癫痫,致病基因包括POLG、TWNK、TFAM、DGUOK、MPV17。神经胃肠病型多于20岁前起病,表现为进行性胃肠蠕动障碍、周围神经病,致病基因为TYMP。近年来随着基因变异疾病谱的不断增加,TWNK基因变异亦可以导致临床表现类似肝脑病型,但无肝病表现的婴儿起病的脊髓小脑共济失调(infantile-onset spinocerebellar ataxia,IOSCA)[1,2,3]。目前国内仅数例MDS个例报道[4,5,6,7,8],现对首都医科大学附属北京儿童医院神经内科诊断的12例MDS的临床表型及基因型特点进行分析,以提高临床医生对此类疾病的认识。
收集首都医科大学附属北京儿童医院神经内科2010年10月至2018年4月经遗传学检测确诊的12例MDS患儿的资料,男8例,女4例,回顾性分析其临床特点和基因检查结果。本研究通过首都医科大学附属北京儿童医院伦理委员会批准(2014-10),均取得患儿家长的知情同意。
收集患儿临床资料包括:性别、年龄、出生日期、起病年龄、起病诱因、主要症状、出生史、既往史、智力、体力发育情况、家族史及辅助检查,并通过门诊或电话进行随访。采用二代测序技术(靶向捕获线粒体病/肌病基因检测包或全外显子组测序)方法,对患儿外周血白细胞基因组DNA进行测序,并使用Sanger测序方法进行验证及分析父母来源。对于未见文献报道的新变异,依据美国医学遗传学与基因组学学会于2015年发布的"序列变异解读标准和指南"进行致病性评估[9]。并对100名正常对照DNA进行该变异检测,以排除单核苷酸多态性。
描述性分析。计数资料以例表示,不符合正态分布的计量资料以M(范围)表示。
12例患儿的临床特征见
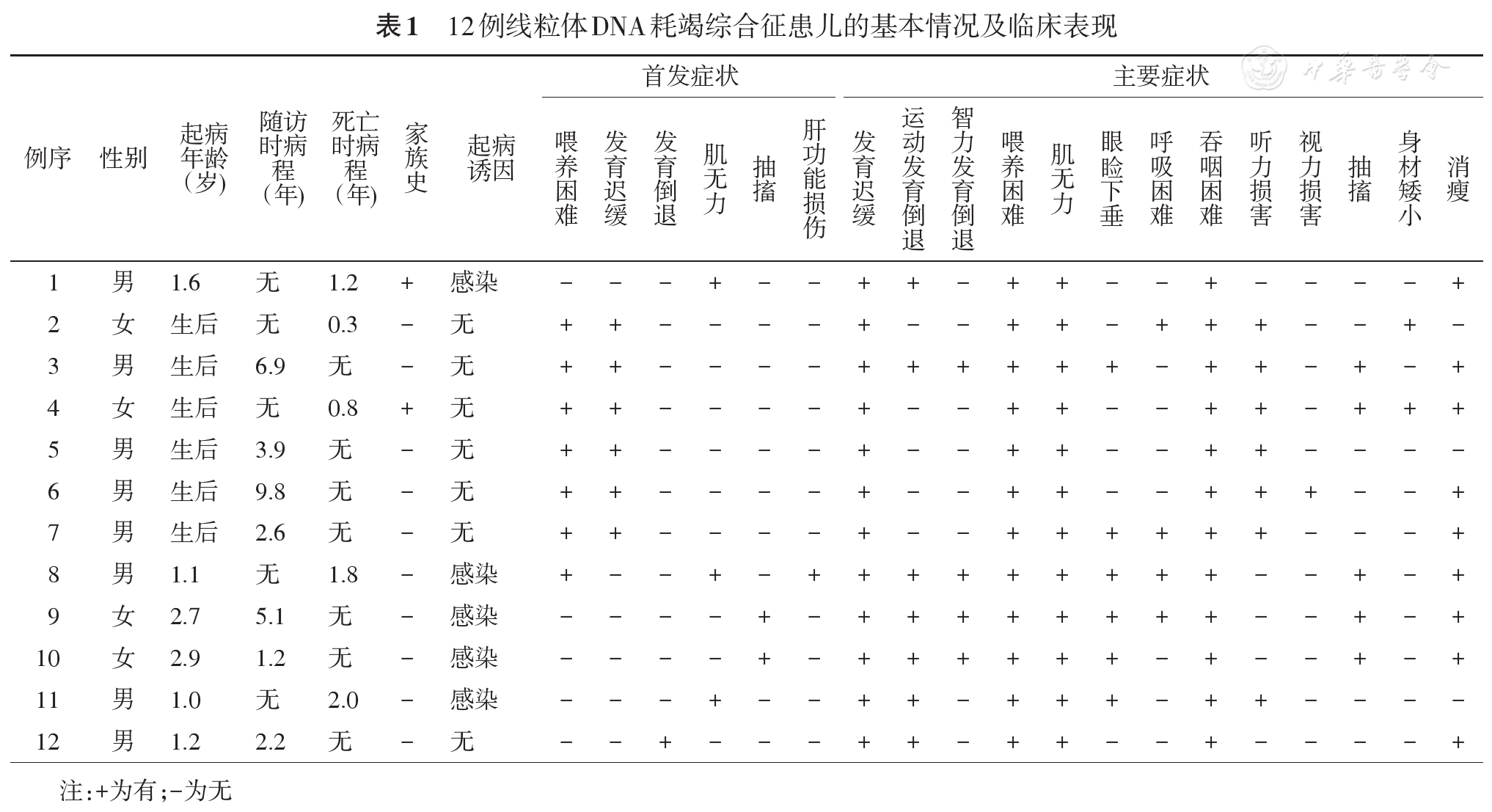
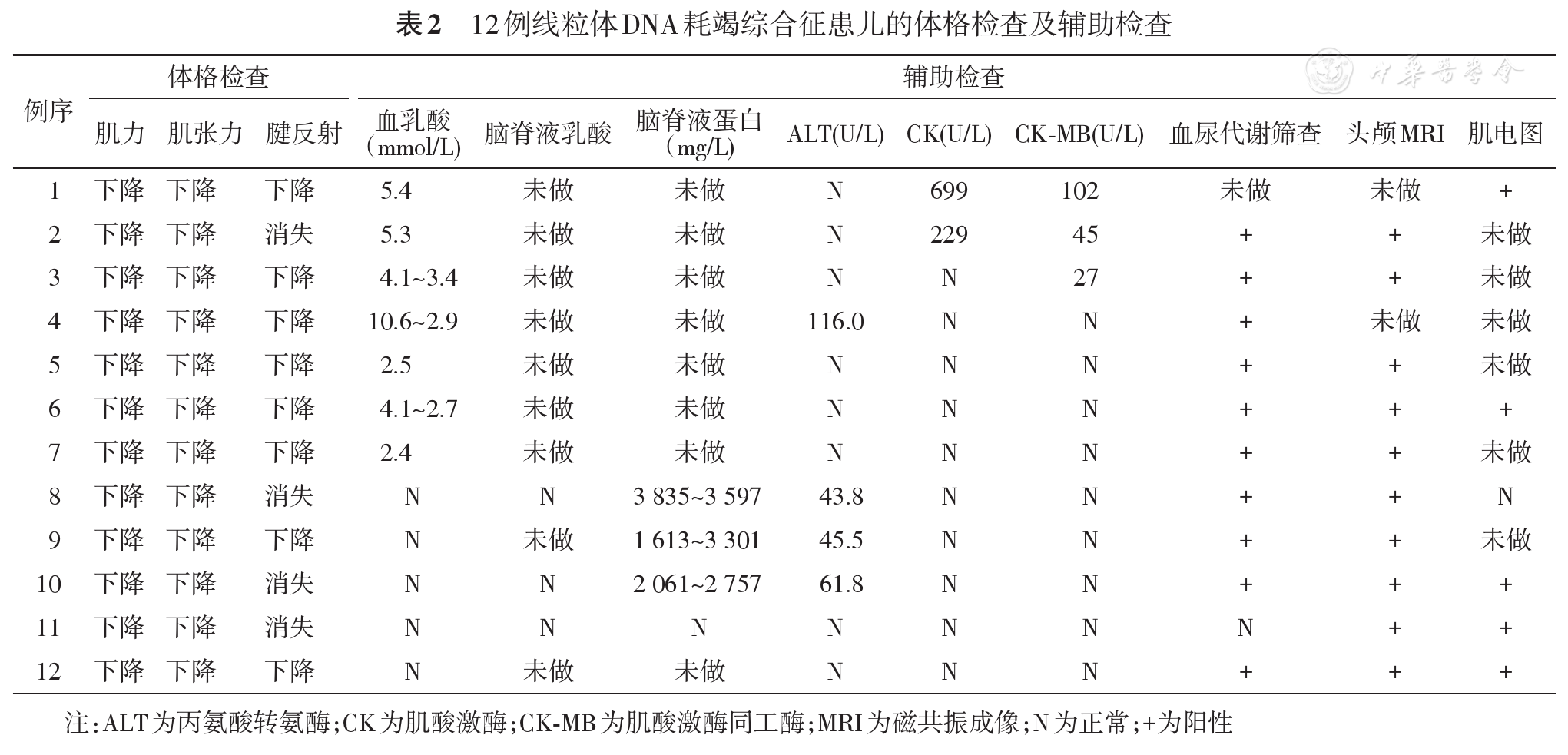
1例TK2基因变异肌病型MDS(例1),男,起病前智力、体力发育正常,1.6岁时感染后起病,主要表现为肌无力,呈进行性加重,逐渐出现运动发育落后、喂养困难、吞咽困难,血乳酸5.4 mmol/L(正常值0.5~2.2 mmol/L),肌酸激酶(creatine kinase, CK)699 U/L(正常值25~200 U/L),肌酸激酶同工酶(CK-MB)102 U/L(正常值0~25 U/L),肌电图示肌源性损害,在病程1.2年时因肺炎、呼吸衰竭死亡。其姐姐有类似病史,在病程1.2年时死亡。
男4例,女2例,均为生后即出现喂养困难、发育迟缓,之后均逐渐出现肌无力、吞咽困难、听力损害(例2、例3、例5新生儿期听力筛查未通过),2例眼睑下垂,2例抽搐。3例SUCLG1基因变异(例3、例4、例5);2例SUCLA2基因变异(例6、例7);1例RRM2B基因变异(例2),血乳酸均升高(2.39~10.6 mmol/L),5例尿甲基丙二酸轻度升高(正常值的13.8~30.7倍),1例血尿代谢筛查非特异性改变(天冬氨酸、甘氨酸、丝氨酸略升高),6例中5例进行了头颅磁共振成像(magnetic resonance imaging, MRI)检查,4例为Leigh样改变,表现为双侧壳核及尾状核头部对称性长T2信号,1例表现为髓鞘化延迟。2例(例2、例4)死亡,分别在病程0.3年死于心跳呼吸骤停、病程0.8年死于多器官衰竭。例4姐姐有相似病史,生后第2天因呼吸困难、肺出血、胃出血死亡。
男1例,女2例,均为POLG基因变异(例8、例9、例10),起病前发育正常或轻度落后,发病年龄为1.1~2.9岁,均为感染后起病,1例首发症状为肝功能损害、喂养困难、肌无力,2例以抽搐起病,3例均出现发育迟缓伴倒退、难治性癫痫、喂养困难、消瘦、肌无力、眼睑下垂、吞难困难,病史中均无胆汁淤积表现,血乳酸均正常,肝酶轻度升高[43.8~61.8 U/L(正常值5~40 U/L)],例9早期给予丙戊酸钠抗癫痫治疗后监测肝酶升高不明显,但4个月后出现凝血功能纤维蛋白原进行性降低[1.08?0.31 g/L(正常值2~4 g/L)],同时总胆红素轻度升高[1.9?103.0 μmol/L(正常值2~19 μmol/L)],以间接胆红素升高为主[0.2?62.8 μmol/L(正常值1.7~13.0 μmol/L)]。3例血糖、甘油三酯、血清铁蛋白、甲胎蛋白均正常。脑脊液蛋白明显升高[1 613~3 597 mg/L(正常值20~450 mg/L)],血尿代谢筛查示非特异性改变(酮性双羧酸尿、乙酰肉碱升高)。视频脑电图示一侧或双侧多灶性棘波、棘慢复合波。3例头颅MRI示大脑皮层或基底节肿胀、硬膜下积液。1例肌电图示双下肢周围神经受损。1例(例8)在病程1.8年因频繁抽搐、肺炎死亡。
2例均为TWNK基因变异,其中1例(例11),男,生后1岁感染后肌无力起病,逐渐出现运动发育倒退、喂养困难、眼睑下垂、听力损害,血乳酸正常,头颅MRI示左侧内囊后肢、丘脑条片状异常信号,脑萎缩样改变,在病程2年时因肺炎死亡。另1例(例12)生后1.2岁时无明显诱因出现运动发育倒退,逐渐出现肌无力、消瘦、喂养困难、吞咽困难、共济失调,血乳酸正常,1例尿代谢筛查示轻度酮尿症。头颅MRI示髓鞘发育不良,未见小脑萎缩改变。均未行脊髓MRI。2例患儿肌电图均示周围神经受损。
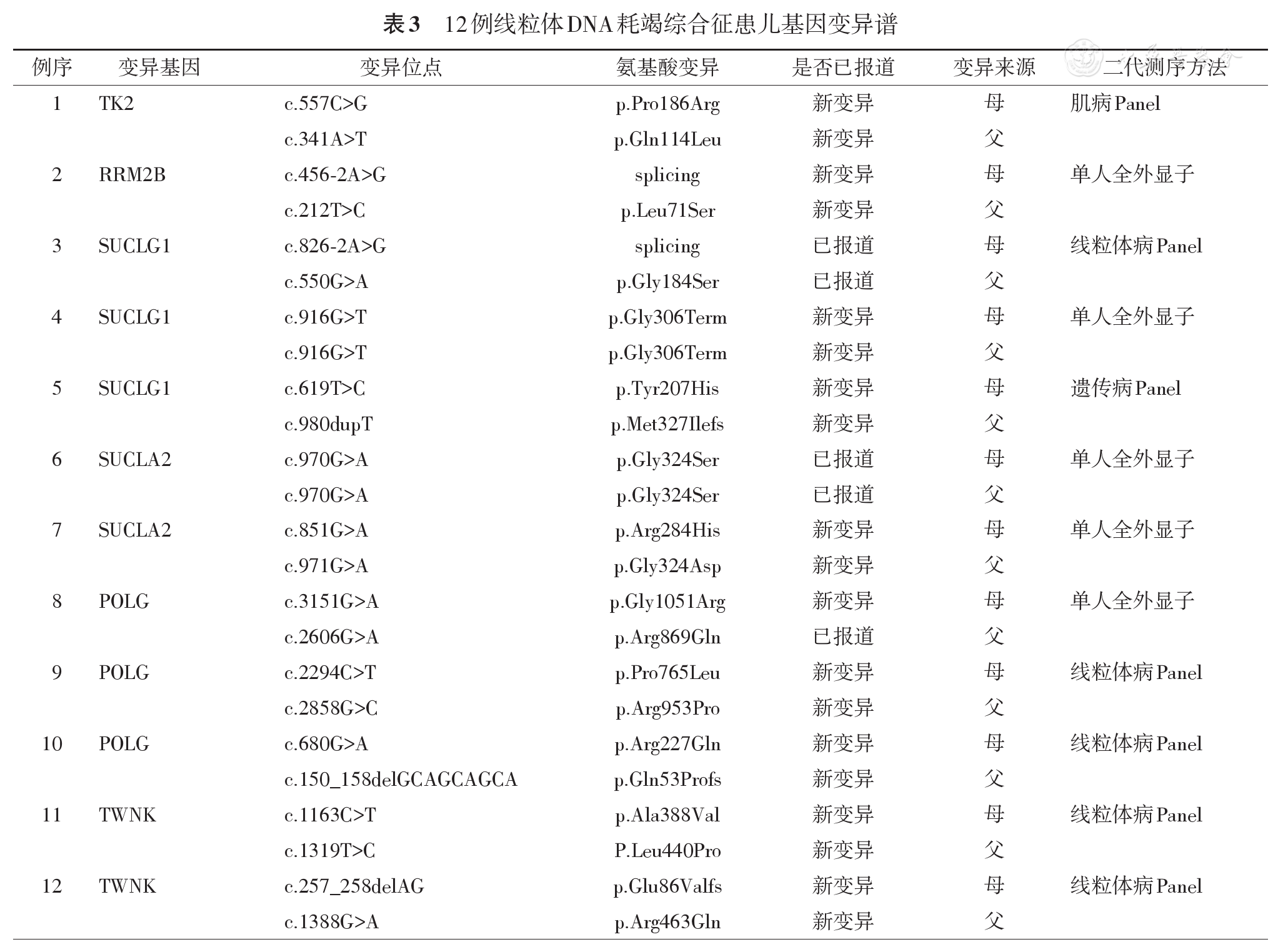
12例患儿的基因变异特征见
MDS是mtDNA拷贝数严重降低导致的线粒体功能障碍引起的线粒体病。Moraes等[10]于1991年首次报道,目前已报道12种MDS的致病基因,包括:影响脱氧核苷三磷酸(deoxy-ribonucleoside triphosphate, dNTP)合成的基因TK2、DGUOK、RRM2B、SUCLA2、SUCLG1、SLC25A4、MPV17、TYMP,影响mtDNA复制的基因POLG、TWNK、TFAM以及功能未知的FBXL4[1,2,3]。
编码线粒体胸苷激酶2的TK2基因和编码脱氧鸟苷激酶的DGUOK基因均参与嘧啶核苷补救途径,介导了线粒体基质中嘧啶核苷磷酸化的第一步和限速步骤,TK2和DGUOK基因变异导致dNTP的合成受损,从而导致mtDNA数量减少和耗竭而发病[11]。TK2基因变异所致肌病型MDS根据起病年龄可分为:婴儿型、儿童型和晚发型,婴儿型及儿童型患者占82%。目前国际上已报道82例TK2基因变异患者,共发现47个变异[12]。本组中1例TK2相关肌病型MDS起病前发育正常,1岁发病,表现为肌无力,呈进行性加重,血乳酸及肌酶升高,肌电图示肌源性损害,发病1年后均因肺炎死亡,其姐姐有相似的临床表现和疾病演变过程。本例TK2基因复合杂合错义变异c.557C>G和c.341A>T均为新变异。TK2编码的胸苷激酶2磷酸化核苷脱氧胞苷和脱氧胸苷,生成脱氧胸苷单磷酸(deoxythymidine mono-phosphate, dTMP)和脱氧胞苷单磷酸酯(deoxycytidine monophosphate, dCMP),TK2基因变异会导致dTMP和dCMP不足,使得mtDNA的复制受阻,因此Lopez-Gomez等[13]给TK2变异的小鼠添加dTMP和dCMP治疗,可修复mtDNA拷贝数及提高线粒体呼吸链酶活性,延长小鼠寿命。
RRM2B基因编码的核苷酸还原酶M2B亚单位通过将核糖核苷二磷酸直接还原成其相应的脱氧核糖核苷二磷酸,来催化脱氧核糖核苷合成的最后步骤,RRM2B基因变异导致mtDNA合成的dNTP不足而致病。RRM2B基因变异患者可出现慢性进行性外眼肌麻痹、上睑下垂、四肢肌肉无力、肌张力低下、肾小管病变、共济失调、耳聋和乳酸酸中毒等表现[14]。目前已报道81例RRM2B基因变异患者,共发现43个变异[15]。本组中1例RRM2B基因变异脑肌病型,主要表现为生后即出现肌无力、肌张力减低、反应弱、喂养困难、发育落后,随着病程的进展出现生长迟缓、呼吸困难、吞咽困难、感音神经性耳聋、血乳酸和肌酶升高,头颅MRI示髓鞘化延迟,在病程0.3年时因心跳呼吸骤停死亡。本例RRM2B基因变异的一个剪切位点变异c.456-2A>G和错义变异c.212T>C均为新变异。
SUCLG1和SUCLA2基因编码的蛋白分别组成琥珀酰辅酶A连接酶(succinate-coenzyme A ligase, SUCL)的α和β亚基,SUCL与核苷二磷酸激酶形成复合物,在mtDNA合成过程中,对脱氧核糖核苷酸的打捞起决定作用,SUCL缺陷可能影响核苷二磷酸激酶功能,影响mtDNA的合成,导致mtDNA耗竭[16]。琥珀酰辅酶A是由甲基丙二酰辅酶A转化而来,SUCL缺陷也可导致尿甲基丙二酸轻度升高[17]。SUCL缺陷多在生后6个月内出现进行性肌张力减退、肌肉萎缩、发育落后、生长迟缓、喂养困难、听力障碍、反复呼吸道感染、脊柱侧凸或后凸畸形、癫痫发作、眼睑下垂和眼外肌麻痹等。目前报道SUCLG1和SUCLA2基因变异患者分别为30例和50余例[18,19]。本组3例SUCLG1基因变异中1例c.826-2A>G和c.550G>A变异为已报道[7],余2例c.619T>C和c.980dupT变异及c.916G>T纯合无义变异,均为新变异。2例SUCLA2基因变异中1例c. 970G>A纯合错义变异为已报道[5],另1例c.851G>A和c.971G>A变异,均为新变异。
POLG基因编码DNA聚合酶γ的催化亚基,DNA聚合酶γ是人类中唯一可以复制和修复mtDNA的DNA聚合酶,是mtDNA合成所必需的[20]。TWNK基因(也称C10orf2基因)编码的twinkle蛋白具有DNA复制所需的DNA解旋酶功能[21]。目前已报道100多例POLG基因变异[2]。POLG基因变异导致的肝脑病型MDS,又称Alpers-Huttenlocher综合征,起病高峰在2~4岁,50%以癫痫首发,呈进行性加重,多发展为部分性癫痫持续状态和药物难治性癫痫、脑病、肝功能损伤、凝血功能障碍、脑脊液蛋白不同程度升高等。丙戊酸会诱发致死性肝衰竭,应禁止使用[14]。本组3例均表现为顽固性癫痫、发育迟缓、肝功损害、肌无力,脑脊液蛋白明显升高等。3例中发现c.3151G>A,c.2294C>T,c.2858G>C,c.680G>A 4个错义变异和1个缺失变异c. 150_158delGCAGCAGCA为新变异。TWNK基因相关MDS包括肝脑病型MDS和IOSCA,肝脑病型MDS主要表现为新生儿或婴儿期肝病、乳酸性酸中毒、发育迟缓和肌张力低下、肌萎缩、反射减退、共济失调、感觉神经病、癫痫等[21]。IOSCA与肝脑病型MDS临床表现类似,但无肝病表现。本组2例TWNK基因变异均在1岁时因感染后肌无力或运动倒退起病,逐渐出现喂养困难、眼睑下垂、听力损害、共济失调,周围神经受损,血乳酸均正常,2例均无肝病,3个错义变异c.1163C>T、c.1319T>C3、c.1388G>A和1个缺失变异c.257_258delAG均为新变异。
本组患儿中未发现神经胃肠病型MDS患儿,推测可能与神经胃肠病型起病年龄偏大,多以胃肠功能紊乱为突出表现,未到神经内科就诊相关。
综上,MDS的临床表型及基因变异谱异质性强,临床表现复杂。MDS为罕见病,诊断困难,目前缺乏有效的治疗,病死率高。本组发现6种MDS基因的18种新变异,丰富了儿童MDS临床表型及基因型,并为遗传咨询奠定了基础。
[1] El-Hattab AW, Scaglia F. Mitochondrial DNA depletion syndromes: review and updates of genetic basis, manifestations, and therapeutic options[J]. Neurotherapeutics, 2013,10(2):186-198.
[2] Viscomi C, Zeviani M. MtDNA-maintenance defects: syndromes and genes[J]. J Inherit Metab Dis, 2017,40(4):587-599.
[3] El-Hattab AW, Craigen WJ, Scaglia F. Mitochondrial DNA maintenance defects[J]. Biochim Biophys Acta Mol Basis Dis, 2017,1863(6):1539-1555.
[4] Fang F, Liu Z, Fang H, et al. Erratum to: The clinical and genetic characteristics in children with mitochondrial disease in China[J]. Sci China Life Sci, 2018,61(12):1606.
[5] 刘志梅,方方,丁昌红,等. SUCLA2相关脑肌病型线粒体DNA耗竭综合征一例并文献复习[J].中华儿科杂志,2014,52(11):817-821.
[6] 移艳红,吴晔,熊晖,等. TK2相关线粒体DNA耗竭综合征2例并文献复习[J].中华实用儿科临床杂志,2016,31(15):1188-1191.
[7] 刘玉鹏,李溪远,丁圆,等.琥珀酰辅酶A连接酶缺陷导致继发性甲基丙二酸尿症四例的临床与实验室研究[J].中华儿科杂志,2016, 54(5):365-369.
[8] 陆相朋,李东晓,段凤阳,等.婴儿脑肌病型线粒体DNA耗竭综合征1例报告[J].临床儿科杂志,2017,35(11):810-814.
[9] Richards S, Aziz N, Bale S, et al. Standards and guidelines for the interpretation of sequence variants: a joint consensus recommendation of the American College of Medical Genetics and Genomics and the Association for Molecular Pathology[J]. Genet Med, 2015,17(5):405-424.
[10] Moraes CT, Shanske S, Tritschler HJ, et al. mtDNA depletion with variable tissue expression: a novel genetic abnormality in mitochondrial diseases[J]. Am J Hum Genet, 1991,48(3):492-501.
[11] Chanprasert S, Wang J, Weng SW, et al. Molecular and clinical characterization of the myopathic form of mitochondrial DNA depletion syndrome caused by mutations in the thymidine kinase (TK2) gene[J]. Mol Genet Metab, 2013,110(1-2):153-161.
[12] Wang J, Kim E, Dai H, et al. Clinical and molecular spectrum of thymidine kinase 2-related mtDNA maintenance defect[J]. Mol Genet Metab, 2018,124(2):124-130.
[13] Lopez-Gomez C, Levy RJ, Sanchez-Quintero MJ, et al. Deoxycytidine and deoxythymidine treatment for thymidine kinase 2 deficiency[J]. Ann Neurol, 2017,81(5):641-652.
[14]
[15] Finsterer J, Zarrouk-Mahjoub S. Phenotypic and genotypic heterogeneity of RRM2B variants[J]. Neuropediatrics, 2018,49(4):231-237.
[16] Ostergaard E, Christensen E, Kristensen E, et al. Deficiency of the alpha subunit of succinate-coenzyme A ligase causes fatal infantile lactic acidosis with mitochondrial DNA depletion[J]. Am J Hum Genet, 2007,81(2):383-387.
[17] Van Hove JL, Saenz MS, Thomas JA, et al. Succinyl-CoA ligase deficiency: a mitochondrial hepatoencephalomyopathy[J]. Pediatr Res, 2010,68(2):159-164.
[18] Maalej M, Tej A, Bouguila J, et al. Clinical, molecular, and Computational Analysis in two cases with mitochondrial encephalomyopathy associated with SUCLG1 mutation in a consanguineous family[J]. Biochem Biophys Res Commun, 2018,495(2):1730-1737.
[19] Couser NL, Marchuk DS, Smith LD, et al. Co-occurring Down syndrome and SUCLA2-related mitochondrial depletion syndrome[J]. Am J Med Genet A, 2017,173(10):2720-2724.
[20] Stumpf JD, Copeland WC. Mitochondrial DNA replication and disease: insights from DNA polymerase γ mutations[J]. Cell Mol Life Sci,2011,68(2):219-233.
[21] Paramasivam A, Meena AK, Pedaparthi L, et al. Novel mutation in C10orf2 associated with multiple mtDNA deletions, chronic progressive external ophthalmoplegia and premature aging[J]. Mitochondrion, 2016, 26:81-85.

收藏此内容
推荐给朋友