结直肠癌患者外周血T淋巴细胞亚群的研究
2019年6月
中华放射学杂志,第58卷第6期 第453页-第455页
肖体先,张冠南,邱志峰,邢春根,李太生
结直肠癌(CRC)是一种常见恶性肿瘤,在我国,多数CRC患者发现时已属中晚期[1]。CRC的发生、发展与患者年龄、免疫状况、肿瘤周围微环境等存在密切联系。近年研究表明,CD4+、CD8+细胞的浸润模式在正常-腺瘤-癌序列中以及腺瘤的低、中、高级别细胞中呈渐进改变[2,3],主要表现为CD8+、CD45+细胞的减少,可能导致肿瘤细胞逃避免疫攻击,最终发生癌的浸润、转移。本研究观察自然杀伤(NK)细胞、T细胞亚群在结直肠癌患者及健康对照者的分布差异,探索相关的免疫机制。
本研究为横断面研究。病例组纳入2017年9月至2018年4月就诊于北京协和医院基本外科,符合入组标准的结直肠癌患者,收集临床资料及手术治疗前3 d内的外周静脉血进行分析。入组标准:(1)按美国癌症联合委员会(AJCC)制订的第8版TNM分期标准,结肠镜活检病理证实为结直肠腺癌TNM分期Ⅰ~Ⅲ期;(2)未经手术及新辅助治疗;(3)无糖尿病,无严重心、肝、肾功能不全,无急性及严重播散性感染性疾病;(4)未使用类固醇和免疫抑制剂;(5)无其他肿瘤或CRC远处转移;(6)自愿参加并签署同意书。本研究经北京协和医院医学伦理委员会批准(批文号:JS-1405),所有研究对象均签署知情同意书。
从北京协和医院1 068例健康体检人群的淋巴细胞亚群检测数据库中选取性别与病例组匹配的健康人群外周静脉血淋巴细胞亚群数值作为正常对照,该1 068例健康志愿者年龄18~80岁,严格按照SENIEUR协议指南中规定的标准,排除人类免疫缺陷病毒(HIV)阳性、全身感染、结缔组织病、肿瘤标志物异常或癌症[4]。
采用真空采血管采集外周静脉血2 ml,加入流式检测管中。分别检测NK细胞(CD3-CD56+CD16+)、CD4+T细胞(CD3+CD4+)、CD8+T细胞(CD3+CD8+)、CD4+T细胞中CD45RA表达比例(CD45RA+ CD4+ T/CD4+ T、CD45RA-CD4+ T/CD4+ T)、CD8+T细胞的HLA-DR、CD38表达比例(HLA-DR+CD8+ T/CD8+T、CD38+CD8+ T/CD8+T)等[4]。
使用SPSS24.0统计学软件进行分析。正态分布计量资料采用
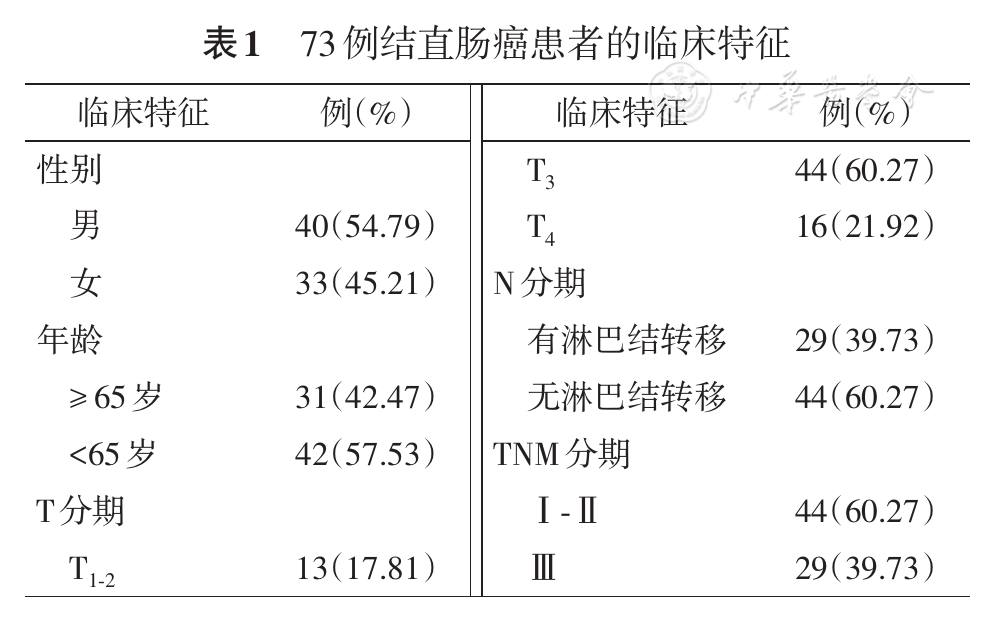
共73例结直肠腺癌患者纳入分析,年龄31~84(62.16±11.76)岁,基本临床资料见
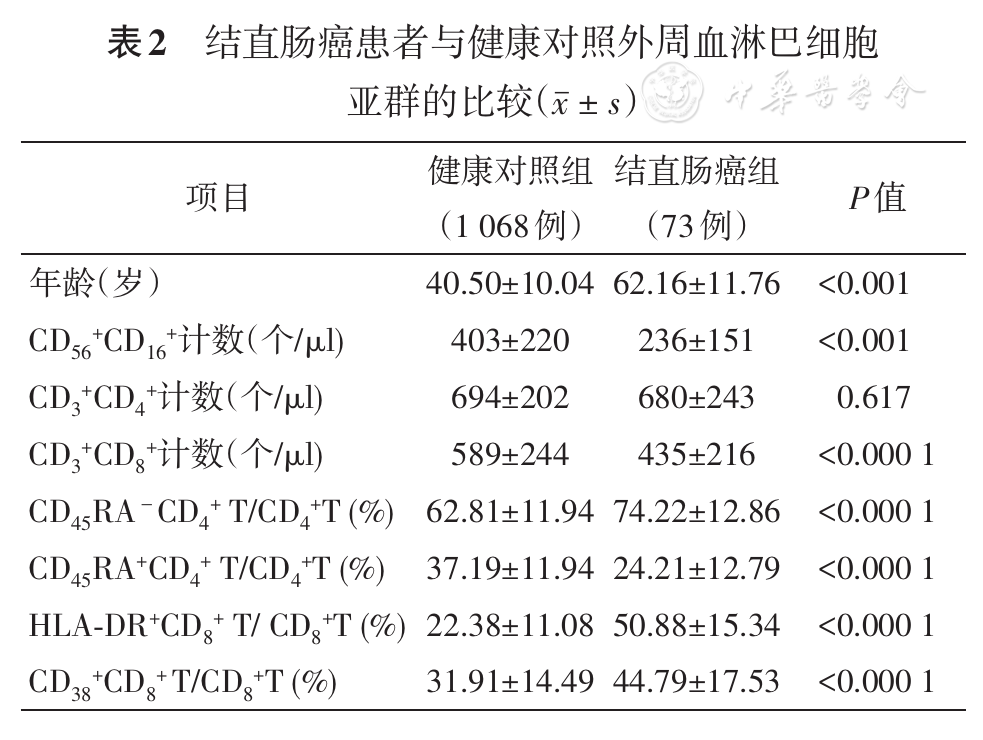
两组的CD4+T细胞计数的差异无统计学意义(P=0.617)。但CRC患者的NK细胞(CD56+CD16+)数量、CD8+T细胞数量及纯真CD4+T细胞(CD4+CD45RA+)百分比明显低于健康对照(P值均<0.001)。而记忆CD4+T细胞亚群(CD4+ CD45RA-)、激活亚群(HLA-DR+CD8+ T细胞及CD38+CD8+ T细胞)百分比明显高于健康对照(P值均<0.001)。
在肿瘤发生、进展、转移的过程中,一直处于机体的免疫监视和攻击之下。但有些肿瘤细胞因免疫耐受或免疫逃逸未被免疫系统杀伤,甚至出现转移。其中机体免疫细胞、亚群在数量或比例上的变化至关重要。本研究观察了部分免疫细胞及亚群在CRC患者中的改变。
NK细胞、CD8+T细胞杀伤癌细胞机制相似。从我们的统计结果中可以看出,CRC患者NK细胞数量和CD8+T细胞数量明显下降。癌症患者外周血中NK细胞数量减少与先前许多报道吻合,但机制还缺乏相关研究。同时,近期有报道称,在CRC患者外周血中NK细胞的表型发生改变[5]。其中NK细胞活性的重要调节受体NKG2D,其表达水平的降低可能与CRC患者中NK细胞活性的抑制有关[6]。由此推测,肿瘤细胞对患者外周血中NK细胞数量及质量均存在抑制作用。因此,患者外周血NK细胞的检测或许可以对术前肿瘤免疫状态及手术预后情况的评估有一定价值。
CD8+T细胞的减少或许与其通过接触抑制肿瘤细胞的抗癌机制有关。本研究中CRC患者CD8+T细胞数量减少,其机制可以用Yu等[7]的Notch信号通路进行解释。外周血中较低数量的CD8+T细胞使机体对抗肿瘤及其他疾病能力降低。
虽然CRC患者CD4+T细胞计数与健康对照没有明显差异,但我们在统计结果中观察到,患者纯真CD4+T细胞的比例相较于健康人明显减少,而记忆CD4+T细胞比例则明显增多。Woltman等[8]的研究显示,纯真CD4+T细胞可选择性地对外来抗原产生免疫应答,进而形成记忆CD4+T细胞。我们认为这一解释在肿瘤疾病中同样适用,即可能是由于癌细胞抗原的激活作用,使纯真CD4+T细胞转变为效应T细胞和记忆CD4+T细胞,以行使适应性免疫功能。有研究表明,记忆T细胞的百分比上升使机体内抗肿瘤反应增强,该指标与肿瘤预后呈正相关[9,10]。虽然本研究属于横断面研究,但研究结果更倾向于是由肿瘤的发生导致纯真T细胞比例减少,并且部分活化成为记忆T细胞参与抗肿瘤免疫。
更进一步,在本研究中还观察到肿瘤患者HLA-DR和CD38阳性细胞的比例升高。二者共表达定义了CD8+T细胞的经典激活表型。一些研究表明,该亚群具有较高的效应功能,如增殖、细胞毒性和细胞因子的产生,且该亚群细胞更易死亡[11,12]。在Morandi等[13]的小鼠食管癌模型实验显示,CD38+CD8+ T/CD8+T细胞比例的增高可能是肿瘤细胞刺激引起。HLA-DR+CD8+ T细胞有接触抑制作用,可能涉及相邻T细胞之间的CTLA-4信号[14],而HLA-DR表达的缺失则会降低肿瘤微环境中T细胞群内辅助性T细胞的比例,使肿瘤细胞逃避免疫监视[15]。基于我们实验中CD38+CD8+/CD8+、HLA-DR+CD8+/CD8+比例明显上调的结果,可推测CRC患者存在活跃的细胞免疫反应。
在本研究中,我们发现CRC患者外周血直接杀伤肿瘤作用较健康人降低,但仍然存在明显的免疫激活[9,10]。综合考量患者外周血中T细胞的含量,对评估患者预后将有所帮助。但健康对照组与结直肠癌组年龄上存在差异,不能完全排除年龄因素的影响。同时,因本研究是横断面研究,无法回答这些现象是肿瘤微环境所造成的结果,还是随着机体免疫力低下导致了CRC的发生。这些现象的意义需要今后进一步结合患者预后和生存情况进行深入研究。
[1] 中华人民共和国卫生和计划生育委员会医政医管局,中华医学会肿瘤学分会.中国结直肠癌诊疗规范(2017年版)[J].中华外科杂志, 2018, 56(4):241-258.
[2] Jang TJ. Progressive increase of regulatory T cells and decrease of CD8+ T cells and CD8+ T cells/regulatory T cells ratio during colorectal cancer development[J]. Korean J Pathol, 2013,47(5):443-451.
[3] Maglietta A, Maglietta R, Staiano T, et al. The immune landscapes of polypoid and nonpolypoid precancerous colorectal lesions[J]. PLoS One, 2016, 11(7): e0159373.
[4] Qin L, Jing X, Qiu Z, et al. Aging of immune system: Immune signature from peripheral blood lymphocyte subsets in 1068 healthy adults[J]. Aging (Albany NY), 2016,8(5):848-859.
[5] Rocca YS, Roberti MP, Arriaga JM, et al. Altered phenotype in peripheral blood and tumor-associated NK cells from colorectal cancer patients[J]. Innate Immun, 2013,19(1):76-85.
[6] Shen Y, Lu C, Tian W, et al. Possible association of decreased NKG2D expression levels and suppression of the activity of natural killer cells in patients with colorectal cancer[J]. Int J Oncol, 2012, 40(4): 1285-1290.
[7] Yu W, Wang Y, Guo P. Notch signaling pathway dampens tumor-infiltrating CD8+ T cells activity in patients with colorectal carcinoma[J]. Biomed Pharmacother, 2018,97:535-542.
[8] Woltman AM, van der Kooij SW, de Fijter JW, et al. Maturation-resistant dendritic cells induce hyporesponsiveness in alloreactive CD45RA+ and CD45RO+ T-cell populations[J]. Am J Transplant, 2006,6(11):2580-2591.
[9] Anitei MG, Zeitoun G, Mlecnik B, et al. Prognostic and predictive values of the immunoscore in patients with rectal cancer[J]. Clin Cancer Res, 2014,20(7):1891-1899.
[10] Galon J, Costes A, Sanchez-Cabo F, et al. Type, density, and location of immune cells within human colorectal tumors predict clinical outcome[J]. Science, 2006,313(5795):1960-1964.
[11] Miller JD, van der Most RG, Akondy RS, et al. Human effector and memory CD8+ T cell responses to smallpox and yellow fever vaccines[J]. Immunity, 2008,28(5):710-722.
[12] Lindgren T, Ahlm C, Mohamed N, et al. Longitudinal analysis of the human T cell response during acute hantavirus infection[J]. J Virol, 2011,85(19):10252-10260.
[13] Morandi F, Morandi B, Horenstein AL, et al. A non-canonical adenosinergic pathway led by CD38 in human melanoma cells induces suppression of T cell proliferation[J]. Oncotarget, 2015,6(28):25602-25618.
[14] Arruvito L, Payaslián F, Baz P, et al. Identification and clinical relevance of naturally occurring human CD8+HLA-DR+ regulatory T cells[J]. J Immunol, 2014,193(9):4469-4476.
[15] Higashi M, Tokuhira M, Fujino S, et al. Loss of HLA-DR expression is related to tumor microenvironment and predicts adverse outcome in diffuse large B-cell lymphoma[J]. Leuk Lymphoma, 2016,57(1):161-166.
