帕金森病患者黑质小体-1影像特征的磁敏感加权成像评价及临床意义
2019年8月
中华放射学杂志,第52卷第8期 第620页-第624页
陈琪琪,陈仪婷,蒋震,张彩元,张月,于洪昌,王福茹,沈钧康,罗蔚锋
帕金森病(Parkinson′s disease)是一种常见的运动障碍疾病,病情多呈渐进性发展。帕金森病的诊断及药物治疗后的疗效评价主要依赖于患者的临床表现。帕金森病主要的病理改变机制是中脑黑质中的多巴胺能神经元变性死亡,由此纹状体多巴胺含量显著性减少而致病[1]。磁敏感加权成像(SWI)以T2*加权梯度回波技术作为基础,采用高分辨率、三维完全流动补偿的梯度回波技术进行图像采集[2]。健康的黑质小体-1在SWI上表现为"燕尾征"[3,4]。国内外多个研究证明"燕尾征"的缺失与帕金森病的关系密切,运用磁共振技术以"燕尾征"缺失为标准,诊断帕金森病的准确度差异较大,约为74.8%~96%[5,6,7,8,9]。研究显示,部分帕金森病患者的黑质表现为不明确的"燕尾征",即"模糊燕尾征"[5]。本研究目的在于通过运用SWI技术来评价帕金森病患者黑质小体-1的不同影像学特征,并探究其与临床病程、病情等的相关性。
收集2014年9月至2016年4月就诊于苏州大学附属第二医院、经神经内科医生诊断的帕金森病患者及年龄、性别与之匹配的健康人。帕金森病诊断标准为中华医学会神经病学分会帕金森病及运动障碍学组2006年制定的帕金森病诊断标准[10]。排除标准:(1)具有上、下运动神经元功能障碍的患者,如脑出血、脑梗死、中枢系统神经脱髓鞘疾病等;(2)经简易精神状态检查(Mini-Mental State Examination,MMSE)、蒙特利尔认知评定量表(Montreal Cognitive Assessment,MoCA)评估发现有认知障碍的患者;(3)有肝、肾功能障碍的患者;(4)接受过任何临床治疗。
本研究为病例对照研究,通过苏州大学附属第二医院伦理委员会审核批准(批准文号:LK2016016)。所有受试者签署知情同意书。
采集受试者的一般资料,包括性别、年龄及伴随疾病等。对帕金森病患者进行MMSE、统一帕金森病评定量表第三部分(UPDRS-Ⅲ)、改良Hoehn-Yahr(H-Y)分级、汉密尔顿抑郁量表(HAMD)和汉密尔顿焦虑量表(HAMA)等神经心理学量表的评定。
检查设备为Philips Achieva 3.0 T TX全身磁共振成像系统,采用32通道头线圈。检查前告知受检者在检查过程中避免任何运动。受检者在检查过程中需佩戴防噪耳塞。部分躯体症状较明显的帕金森病患者检查时用泡沫固定头部,以尽量减少图像的运动伪影。若图像伪影较大则重新扫描。所有轴位图像采集均以平行于胼胝体体部的平面为基准。扫描序列包括:轴位T1加权像(T1 weighted image,T1WI)、轴位T2加权像(T2 weighted image,T2WI)、矢状位T2WI、轴位扩散加权成像(diffusion-weighted imaging)、轴位液体衰减反转恢复序列(fluid attenuated inversion recovery)及轴位SWI序列。SWI序列具体扫描参数如下:重复时间25 ms,回波时间31 ms,层厚1.8 mm,层间距0 mm,翻转角10°,视野230 mm×205 mm,矩阵256×227。总扫描时间18 min。
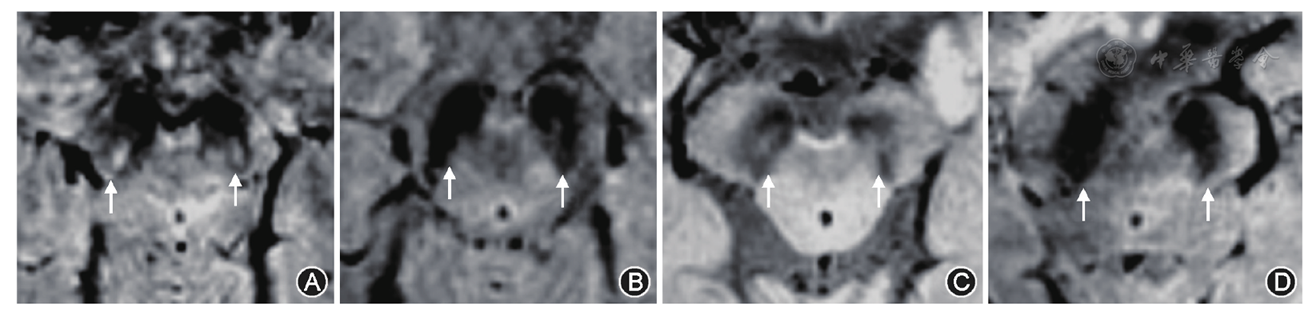
图像分析采用专用显示屏,分辨率为1 200×1 600。由2名从事神经影像诊断工作的高年资医师在不知道患者临床信息的情况下,评判SWI图上双侧黑质的"燕尾征"。尽管黑质小体-1的物理尺寸仅为几毫米,但健康的黑质小体-1在SWI上是可被观察到的。判断标准如下:若黑质尾部中央可见明确的水滴状或线状高信号结构,则判定为"清晰燕尾征",即健康黑质小体-1;若上述结构完全消失,即判断为"缺失燕尾征";若介于两者之间,黑质尾部中央仅见稍高信号,即判定为"模糊燕尾征"(
采用SPSS 22.0统计学软件包对数据进行统计学分析。对计量资料首先进行正态性检验,符合正态分布的计量资料用均数±标准差(
最终共32例帕金森病患者纳入研究,男性21例,女性11例,年龄63.0(10.0)岁,病程42.0(64.5)个月;改良H-Y分级结果为:1级8例,1.5级11例,2级11例,2.5级1例,3级1例;UPDRS-Ⅲ评分结果为(23.0±9.8)分;HAMD评分为5(2)分;HAMA评分为3(2)分;MMSE评分为(25.6±2.8)分,MoCA评分均>15分,结合患者的文化水平,无明显智力及认知障碍者。共收集年龄、性别与帕金森病组相匹配的健康对照者20名作为对照组,其中男性10名,女性10名,年龄57.0(12.5)岁。
在帕金森病组中,MR SWI显示21例双侧黑质均表现为"缺失燕尾征",5例双侧黑质均表现为"模糊燕尾征",5例一侧黑质为"缺失燕尾征",对侧黑质为"模糊燕尾征",1例双侧黑质均表现为"清晰燕尾征"(
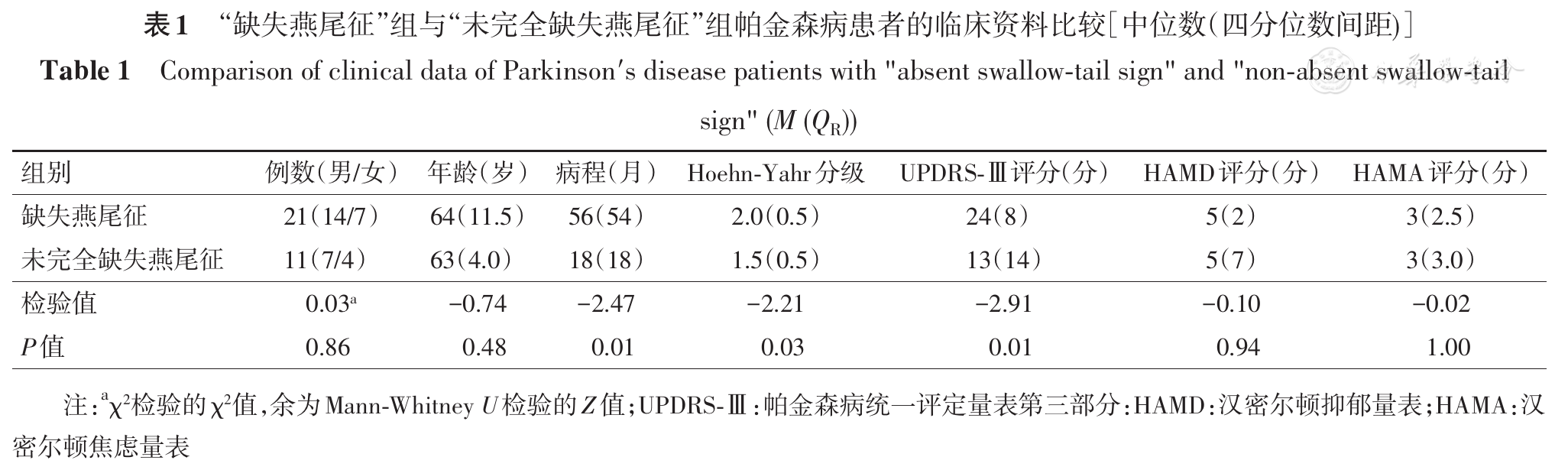
根据帕金森病组患者黑质小体-1的影像学特征将其进一步分组,显示双侧黑质"缺失燕尾征"的患者纳入"缺失燕尾征"组,其余患者为"未完全缺失燕尾征"组。两组患者的年龄与性别差异均无统计学意义(U=-0.74, P=0.48;χ2=0.03, P=0.86)。"缺失燕尾征"组的病程[56(54)个月]显著长于"未完全缺失燕尾征"组[18(18)个月,U=-2.47,P=0.01]。"缺失燕尾征"组患者的改良H-Y分级[2.0(0.5)级]显著高于"未完全缺失燕尾征"组[1.5(0.5)级,U=-2.21, P=0.03)。两组患者的UPDRS-Ⅲ评分[24(8)、13(14)分]差异也有统计学意义(U=-2.91,P=0.01)。但是,两组患者的HAMD评分[5(2)、5(7)分,U=-0.10,P=0.94]及HAMA评分[3.0(2.5)、3.0(3.0)分,U=-0.02,P=1.00]差异无统计学意义(
本研究结果显示,在SWI图像上,帕金森病患者的黑质存在不同的影像学特征,包括清晰、模糊及缺失3种。"缺失燕尾征"组帕金森病患者较"未完全缺失燕尾征"组帕金森病患者的病程更长、病情更严重,提示黑质小体-1的影像学特征可以用来反映帕金森病患者的病情。
国内外多项研究运用磁共振技术以黑质缺失"燕尾征"为标准来诊断帕金森病,但研究结果显示诊断的准确性差异较大,为74.8%~96%[6,7,8,9]。Schwarz等[4]和Meijer等[5]的研究结果显示,部分帕金森病患者及健康者的黑质均可表现为不确定的"燕尾征",即"模糊燕尾征",但并未研究其与临床之间的相关性。正是这部分"模糊燕尾征"者,影响了以"缺失燕尾征"为标准诊断帕金森病的准确性。目前国内外尚没有关于帕金森病患者黑质小体-1不同影像学特征或分级与临床病程、病情及运动症状相关性的进一步研究。因此,对于帕金森病患者黑质小体-1的不同影像学特征及其与临床相关性的研究是有必要的,对于我们从影像学上评估帕金森病患者的病情也将有重要意义。
本研究结果显示,"缺失燕尾征"组帕金森病患者的改良H-Y分级及UPDRS-Ⅲ评分较"未完全缺失燕尾征"组更高,反映该组患者的病情更严重。推测其原因如下:研究表明,在3.0 T及7.0 T场强下,运用SWI序列对健康人和帕金森病患者的中脑黑质标本进行检测,对照钙结合蛋白免疫染色结果,证明正常黑质尾部中央的特征性高信号区域对应黑质小体-1的解剖位置[11,12]。黑质小体为健康黑质内的多巴胺能细胞聚集的小簇[13]。尸检研究显示,帕金森病患者黑质小体-1为多巴胺神经元最丰富的部位,且多巴胺神经元最大损失达98%[12]。帕金森病患者的黑质小体-1由于不同程度的多巴胺神经元丢失,因此表现出不同的影像学特征。"缺失燕尾征"组帕金森病患者黑质多巴胺神经元丢失得更多,因此临床表现更重。而"未完全缺失燕尾征"组患者的黑质可能有更多残存的多巴胺能神经元,所以临床症状也更轻。这为临床判断帕金森病患者的病情提供了一种有价值的影像学依据,可能有助于指导该类患者的及早治疗与病情监测。
本研究结果提示,在帕金森病组中,5例受试者表现为双侧黑质不对称的信号改变,一侧为"缺失燕尾征"而对侧为"模糊燕尾征"。在临床中,帕金森病患者往往是身体一侧起病并逐渐发展为双侧。也许黑质的改变也是从一侧开始,逐渐累积对侧黑质,因此我们观察到部分患者两侧黑质有着不同的影像学特征。另外,我们在研究中并未发现患者的黑质出现一侧清晰对侧缺失的情况,间接反映了帕金森病患者双侧黑质的病变是相关的,没有只累及单侧黑质的情况。另外,我们发现1例患者表现为双侧"清晰燕尾征",考虑原因可能是:(1)该患者病程较短,仅3个月左右;(2)在临床上,早期原发性帕金森病与帕金森叠加综合征鉴别困难,该患者需进一步与帕金森叠加综合征相鉴别。
我们在对照组20名健康人的黑质中发现两种影像学特征:双侧"清晰燕尾征"和双侧"模糊燕尾征"。本研究对照组中同一个体的双侧黑质表现是对称的,而帕金森病组中部分患者则表现为黑质不对称改变。在临床工作中,健康人群中的"模糊燕尾征"表现影响了"燕尾征"作为帕金森病影像学标志物进行诊断的准确性。由于部分健康人及帕金森病患者均可表现为"模糊燕尾征",因此,过去的研究中运用磁共振技术以"燕尾征"缺失为标准,诊断帕金森病的准确性差异较大[5,6,7,8,9]。健康人的"模糊燕尾征"可能有以下两个原因:一方面可能与正常退变有关;另一方面,这部分健康人可能会是潜在的帕金森病患者,但还是未可知的,可继续对该人群进行密切随访。
我们还发现"缺失燕尾征"组帕金森病患者的病程更长,说明帕金森病随着患病时间的延长,多巴胺神经元的丢失亦增加。临床上帕金森病患者的病情多呈渐进性发展,这也进一步支持了本研究结果。研究提示,在帕金森病患者早期尚存在多巴胺神经元时,应积极采取保护性药物治疗,如单胺氧化酶B型抑制剂。帕金森病患者除了静止性震颤、运动迟缓等运动症状外,还会出现如抑郁、焦虑等神经精神症状[14]。本研究结果显示,两组帕金森病受试者的HAMD和HAMA评分差异无统计学意义,说明黑质小体-1的改变与患者的抑郁及焦虑程度无明确相关性。Shin等[15]的研究支持本研究结果,非运动症状与黑质磁化率的值无明确的相关性。
本研究仍存在如下局限:首先,"燕尾征"的判断仍存在一定的主观性;其次,样本数量不够充足,受试者中一侧"模糊燕尾征"和双侧"模糊燕尾征"患者之间的临床差异有待进一步比较,未来大样本的研究将为帕金森病的临床诊断和评估提供更可靠的证据。
综上所述,"缺失燕尾征"组的帕金森病患者较"未完全缺失燕尾征"组患者的病程更长、病情及运动症状更重,表明黑质小体-1的影像学特征可以用来反映帕金森病患者的病情严重程度。利用MR SWI评价帕金森病患者黑质小体-1的影像学特征,将有助于辅助临床早期诊断帕金森病、对帕金森病患者的病情及其治疗后的疗效进行评价。
[1] Braak H,Del TK. Neuropathological staging of brain pathology in sporadic Parkinson′s disease: separating the wheat from the chaff[J]. J Parkinsons Dis, 2017, 7(s1): S71-85.
[2] Yamada N,Imakita S,Sakuma T, et al. Intracranial calcification on gradient-echo phase image: depiction of diamagnetic susceptibility[J]. Radiology, 1996, 198(1): 171-178.
[3] Damier P,Hirsch EC,Agid Y, et al. The substantia nigra of the human brain. I. Nigrosomes and the nigral matrix, a compartmental organization based on calbindin D (28K) immunohistochemistry[J]. Brain, 1999, 122 (
[4] Schwarz ST,Afzal M,Morgan PS, et al. The 'swallow tail' appearance of the healthy nigrosome -a new accurate test of Parkinson′s disease: a case-control and retrospective cross-sectional MRI study at 3 T[J]. PLoS One, 2014,9(4): e93814.
[5] Meijer FJ,Steens SC,van Rumund A, et al. Nigrosome-1 on susceptibility weighted imaging to differentiate Parkinson′s disease from atypical parkinsonism: an in vivo and ex vivo pilot study[J]. Pol J Radiol, 2016, 81: 363-369.
[6] 管晓军,谢非,徐晓俊.定量磁敏感图黑质"燕尾征"在帕金森病诊断中的应用价值[J].中国现代神经疾病杂志, 2018, 4: 247-251.
[7] Al-Radaideh AM,Rababah EM. The role of magnetic resonance imaging in the diagnosis of Parkinson′s disease: a review[J]. Clin Imaging, 2016, 40(5): 987-996.
[8] Murakami Y,Kakeda S,Watanabe K, et al. Usefulness of quantitative susceptibility mapping for the diagnosis of Parkinson disease[J]. AJNR Am J Neuroradiol, 2015, 36(6): 1102-1108.
[9] 眭未凡,张洪英,徐俊,等.燕尾征在诊断帕金森病中的价值[J].中华医学杂志, 2016, 96(1): 30-32.
[10] 中华医学会神经病学分会运动障碍及帕金森病学组.帕金森病的诊断[J].中华神经科杂志, 2006, 39(6): 408-409.
[11] Cosottini M,Frosini D,Pesaresi I, et al. Comparison of 3 T and 7 T susceptibility-weighted angiography of the substantia nigra in diagnosing Parkinson disease[J]. AJNR Am J Neuroradiol, 2015, 36(3): 461-466.
[12] Blazejewska AI,Schwarz ST,Pitiot A, et al. Visualization of nigrosome 1 and its loss in PD: pathoanatomical correlation and in vivo 7 T MRI[J]. Neurology, 2013, 81(6): 534-540.
[13] Damier P,Hirsch EC,Agid Y, et al. The substantia nigra of the human brain: Ⅱ. Patterns of loss of dopamine-containing neurons in Parkinson′s disease[J]. Brain, 1999, 122(
[14] 刘振国,干静.帕金森病非运动症状再认识[J].中华神经科杂志, 2017, 50(11): 801-804.
[15] Shin C,Lee S,Lee JY, et al. Non-motor symptom burdens are not associated with iron accumulation in early Parkinson′s disease: a quantitative susceptibility mapping study[J]. J Korean Med Sci, 2018, 33(13): e96.
