低剂量双源CT颅脑灌注成像在超急性期脑梗死中的诊断价值
2020年2月
中华放射学杂志,第54卷第2期 第112页-第118页
陈鹏军,林桂涵,卢陈英,陈苏杭,惠俊国,赵中伟,纪建松
近半数幸存的脑梗死患者会出现不同程度的神经功能损伤[1],影像学上将发病时间在6 h以内的脑梗死称为超急性期脑梗死,在此阶段进行溶栓治疗可明显提高临床疗效并改善预后[2]。脑梗死患者的预后与核心梗死区范围和病变区侧支血流情况密切相关,及时恢复病变脑组织血供可挽救缺血半暗带神经细胞及功能[3]。因此,早期确诊脑梗死并及时进行干预、治疗已成为国内外医学研究的热点。颅脑CT灌注成像(computed tomography perfusion imaging,CTP)可实时反映缺血脑组织的血流动力学情况,能早期准确显示脑缺血的部位、范围以及缺血程度,但其辐射剂量较高,目前改良320层容积CTP的辐射剂量为3.28 mSv,相较之下,断层颅脑CT平扫辐射剂量为0.92 mSv,螺旋扫描为1.38 mSv,故而在检查获益和辐射危险之间难以取舍[4]。双源CT灌注成像可将管电压降至70 kV[5],使用双源CT灌注成像可将辐射剂量降至1.80~2.98 mSv,同时可获得良好的图像质量[5]。笔者旨在探讨当管电压为70 kV时不同管电流和采集频次对CTP图像质量及辐射剂量的影响,及其在超急性期脑梗死中的早期诊断价值。
本研究为前瞻性研究,通过了浙江省丽水市中心医院伦理委员会的批准,批准文号科研伦审(2017)第(55)号。
连续收集2017年12月至2019年2月浙江省丽水市中心医院符合以下标准的患者。纳入标准:(1)临床可疑超急性期脑梗死患者,所有患者均在发病6 h内行双源CT平扫及CTP检查,诊断满足《中国急性缺血性脑卒中诊治指南2014》或《中国急性缺血性脑卒中诊治指南2018》中的相关诊断要求;(2)既往无出血性或缺血性脑卒中病史;(3)在发病1周内复查颅脑CT和(或)MRI检查明确是否存在脑梗死。排除标准:(1)合并严重精神疾病,不能配合检查;(2)心肺功能不全、肝肾功能异常;(3)对碘对比剂过敏;(4)妊娠及哺乳期妇女。
190例患者纳入研究,男115例,女75例,年龄29~94(70.7±12.1)岁。接受检查的时间距离发病1.5~5.5 h,平均(4.3±1.1)h。合并高血压108例,糖尿病30例,冠心病55例。
采用德国Siemens Somatom Force双源CT机进行扫描。首先行头颅CT平扫,扫描范围从颅底到颅顶。头先进,扫描参数管电压100 kV,采用自动管电流调制技术(344、303 mA),矩阵512×512,层厚5 mm,层间距3 mm。将患者按照数字表法随机分为4组,A、B、C组均50例,D组40例。
CTP检查扫描方案:经肘前静脉使用高压注射器注入碘克沙醇(含碘320 mg/ml)50 ml,注射流率5 ml/s,管电压70 kV,矩阵512×512,扫描范围114 mm,延迟时间4 s,行高级模拟迭代重组。A组管电流120 mA,B组和C组管电流均为100 mA,D组管电流80 mA。A、B、D组采集频次21次,具体为2次×3.0 s+17次×1.5 s+2次×3.0 s,总扫描时间37.5 s;C组采集频次17次,3次×3.0 s+12次×1.5 s+2次×5.0 s,总扫描时间37.0 s。
将扫描获得数据传至Syngo图像工作站,利用Neuro Perfusion软件进行图像后处理,获得相应脑血流量(crerbral blood flow,CBF)、脑血容量(crerbral blood volume,CBV)、平均通过时间(mean transit time,MTT)、达峰时间(time to peak,TTP)等参数的伪彩图。发现灌注异常时,选择圆形工具在异常灌注区内多处勾画感兴趣区,面积0.4~0.5 cm2,同时获得患侧及对侧CBF、CBV、MTT和TTP值。选取大脑中动脉为基线血管,获得时间-密度曲线,选取峰值时间原始数据薄层图像,重建出CTA图像和MIP图像。
2名放射科副主任医师在不知晓患者分组的情况下先分别对图像质量进行评分,再讨论达成一致。
评估伪彩图CBF、CBV、MTT及TTP的图像质量。采用3级评分法进行评估(0分差、1分中等、2分好),评估内容包括灰白质灌注伪彩图色阶差异,缺血区与正常组织灌注伪彩图色阶差异,图像均质性和有无伪影[6]。各项分值相加,最高分值8分,>6分图像为质量高,>3分且≤6分为质量中等,≤3分图像为质量差,不能诊断。灌注参数比较:根据阿尔伯塔脑卒中计划早期CT评分,选择圆形工具在每例患者大脑中动脉供血区的正常额、颞、顶叶灰质及白质区各勾划一感兴趣区,面积0.4~0.5 cm2,获得对应CBF、CBV、MTT及TTP值。
评估参数包括图像噪声评级、血管管腔边缘锐利度和整体图像质量,评估对象包括颈内动脉、大脑中动脉。图像噪声评级分为4级,4级为图像噪声小;3级为图像噪声稍大;2级为图像噪声较大,仍可满足诊断;1级为图像噪声大,无法诊断。血管管腔边缘锐利度分为4级,4级为锐利,3级为良好,2级为可接受,1级为无法诊断。整体图像质量分为4级,4级为图像质量优;3级为良好;2级为可接受,能满足诊断要求;1级为不能诊断。
记录主要辐射参数值,包括容积CT剂量指数(volume CT dose index,CTDIvol)、剂量长度乘积(dose length product,DLP),根据公式计算有效剂量(effective dose,ED),ED=DLP×K,k为组织权重因子,颅脑检查时k值为0.002 3 mSv·mGy-1·cm-1。
采用SPSS 22.0软件对数据进行统计学分析。Kolmogorov-Smirnov检验计量资料是否符合正态分布,正态分布的资料以
4组CTP伪彩图灰质和白质灌注参数(CBF、CBV、MTT及TTP)的差异均无统计学意义(
4组患者重组CT血管成像(computed tomography angiography,CTA)最大密度投影图像质量评分,颈内动脉的图像噪声评级、血管管腔边缘锐利度、整体图像质量和大脑中动脉的血管管腔边缘锐利度差异有统计学意义(
双源CT灌注检查参数相同时,不同患者的CTDIvol及DLP基本相等,CT平扫及A、B、C、D组的ED分别为1.10、2.11、1.76、1.42、1.40 mSv,差异有统计学意义(F=164 529.741,P<0.05)。与A组相比,B、C及D组的ED均有不同程度的降低,分别降低16.6%(0.35/2.11)、32.7%(0.69/2.11)及33.6%(0.71/2.11),差异均有统计学意义(P均<0.05,
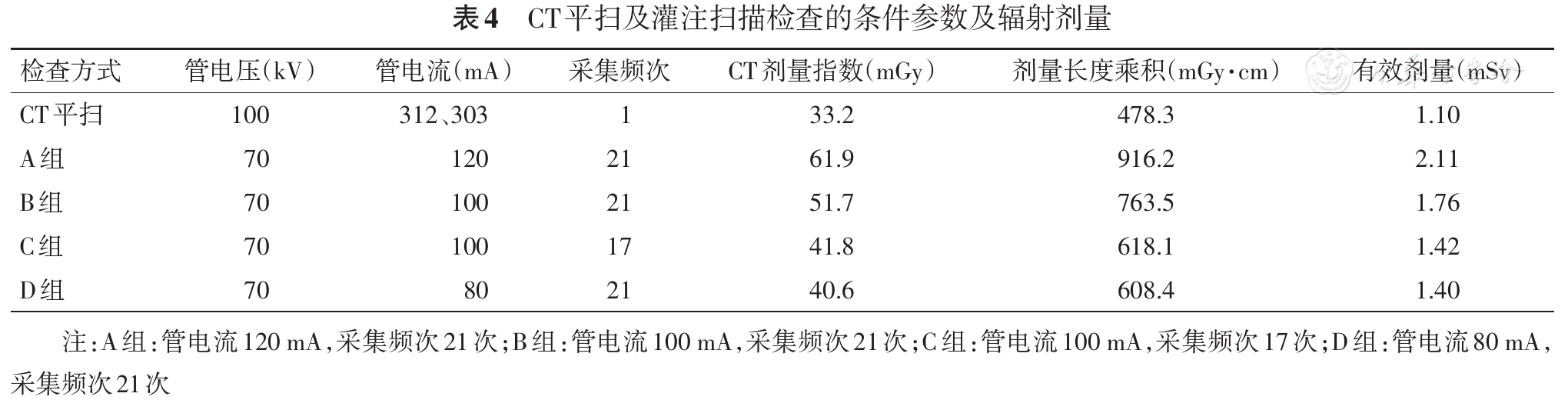
纳入的可疑超急性期脑梗死患者190例中,经复查确诊脑梗死184例(
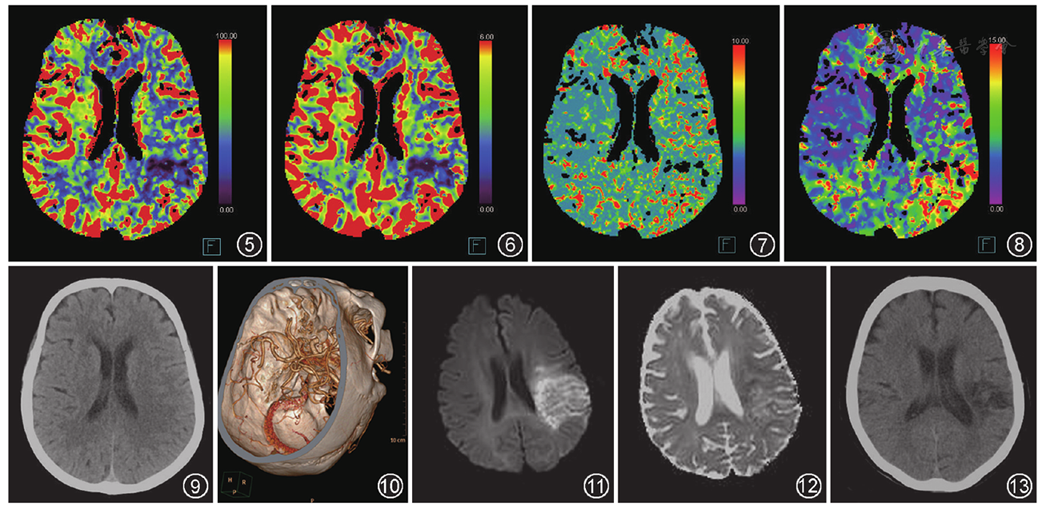
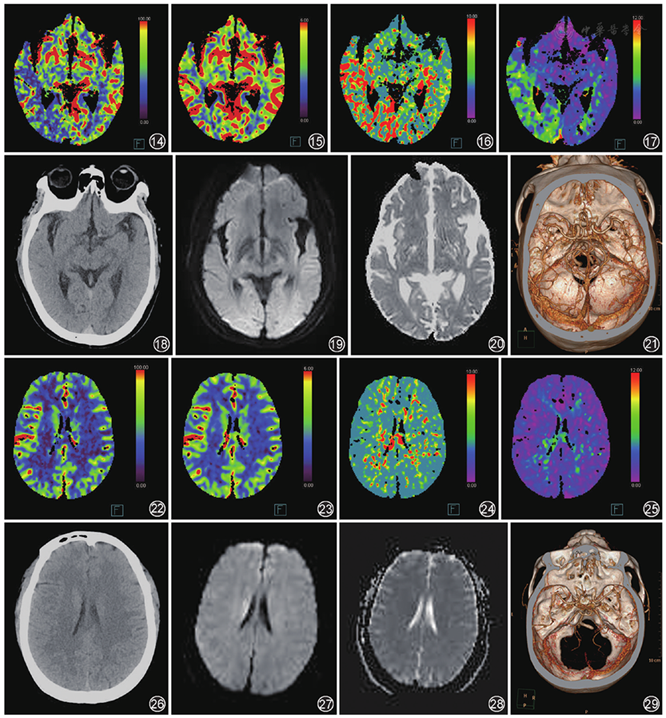
经扩散加权成像和测量表观扩散系数值复查确诊腔隙性脑梗死43例(
近年来,通过改变灌注扫描条件及后处理方法,低剂量CTP的研究得到了明显发展,包括降低管电压、降低管电流、减少采集频次等。笔者采用双源CT进行扫描,管电压为现有灌注检查中最低的70 kV,观察不同管电流及采集频次时灌注图像和重组CTA图像质量和辐射剂量。黄益龙等[7]报道,管电流下降至50 mA以下时,CTP各参数图像质量才会明显下降。本研究最低管电流80 mA,所获得的重组CTA图像质量欠佳,难以满足临床诊疗需求。一般认为图像采集时间40~45 s可获得较可靠的灌注值,Kasasbeh等[8]研究发现,将采集时间降低至32.7 s,灌注图像仍可满足诊断需求,目前临床研究采集时间多为36~40 s。在此时间范围内减少采集频次可显著降低辐射剂量,但采集频率超过3 s,图像质量不能满足诊断要求。本研究中管电流100 mA、采集频次为17次时,可将DLP降低至618.1 mGy-1·cm-1,ED为1.42 mSv,为CT平扫的1.29倍,同时所得图像(主要为重组CTA图像)可满足临床诊断需求。
当病变部位脑血流量及血容量下降超过脑组织代谢储备力时,神经元将发生不可逆转的功能及形态学改变,进一步发展即为脑梗死[9]。正常人脑组织血流量为50~60 ml·min-1·100 g-1,当血流量为轻、中度降低时,患侧与对侧CBF比值≥0.2,即血流量≥10 ml·min-1·100 g-1时,及时恢复血流再灌注,神经元功能仍可恢复正常;当血流量重度降低,患侧与对侧CBF比值<0.2,即血流量<10 ml·min-1·100 g-1时,脑缺血不可逆,大部分神经元细胞将在数分钟之内死亡[10]。CTP检查速度快,禁忌证较少,能实时反映缺血脑组织的血流灌注情况,准确显示脑缺血的部位、范围及缺血程度,通过灌注参数CBF和CBV定量对比可识别不可逆性的核心梗死区与可逆转的缺血半暗带,并可通过CTA重组显示狭窄或闭塞的供血动脉,对临床脑梗死的早期诊疗具有较重要的临床价值[11]。
腔隙性脑梗死是脑深部穿通动脉或微小动脉病变引起局部脑组织缺血,本研究结果显示阳性率仅为16.3%。在缺血发生30 min后,CTP图像上即可发现与临床症状相对应的灌注异常区,灌注参数MTT、TTP出现异常可认为患者有灌注缺损[12]。这些结果表明CTP对于脑干及基底节区较小的早期脑梗死病灶不太敏感;临床对于该类可疑患者,即使CT灌注成像阴性,仍需提高警惕。
另外,有6例患者存在灌注异常,重组CTA正常,1周内复查MRI检查未见明确脑梗死征象,提示在短暂性脑缺血发作缓解期或脑缺血的早期,此时又称为脑梗死前期[9]。这可能由于脱落的微小栓子部分堵塞供血动脉引起继发性动脉反射性痉挛从而引起功能区脑组织缺血,此时可出现临床症状,之后由于外源性和(或)内源性溶栓酶集聚使得血管再通,缺血部位脑组织恢复再灌注,CBF和CBV恢复正常[13]。
首先,未能排除由于颈总动脉或颈内动脉颅外段病变引起脑血流动力学改变的可能性;其次,限于CT本身性能,低剂量CT颅脑灌注成像对于脑干及基底节区超急性期腔隙性脑梗死的检出不太敏感,仍有待进一步研究;再次,部分脑梗死患者具体发病时间不详,为了研究的真实性,笔者排除了这部分患者的入组,这可能会造成数据的准确性欠佳。
综上所述,低剂量双源CTP能显著降低患者辐射剂量,直观反映超急性期甚至脑梗死前期脑组织的血流动力学异常,并可通过对各个参数综合分析能间接判断病变区脑组织病理生理学状态,从而对超急性期脑梗死尤其是腔隙性脑梗死的诊断及治疗提供信息。
[1] Kwon H, Kim K, Jo YH, et al. Early detection of cerebral infarction with middle cerebral artery occlusion with functional near-infrared spectroscopy: a pilot study[J]. Front Neurol, 2018, 9: 898.
[2] 毛传万,付玉川,叶信健,等.磁共振3D-pcASL灌注成像在鉴别急性脑梗死和脑炎的应用价值[J].中华医学杂志, 2015. 95(23): 1846-1848.
[3] Kim BJ, Kim H, Jeong HG, et al. Tenacity of collateral perfusion in proximal cerebral arterial occlusions 6-12 h after onset[J]. Cerebrovasc Dis, 2018, 45(5-6): 263-269.
[4] 马恩裕,朱希松.320排容积CT低剂量全脑灌注成像研究进展[J].浙江实用医学, 2017,22(5): 388-390.
[5] Li ZL, Li H, Zhang K, et al. Improvement of image quality and radiation dose of CT perfusion of the brain by means of low-tube voltage (70 kV)[J]. Eur Radiol, 2014, 24(8): 1906-1913.
[6] Othman AE, Brockmann C, Yang Z, et al. Effects of radiation dose reduction in volume perfusion CT imaging of acute ischemic stroke[J]. Eur Radiol, 2015, 25(12): 3415-3422.
[7] 黄益龙,韩丹,蔡莉,等.低管电压及低管电流颅脑容积CT灌注成像检查的可行性研究[J].实用放射学杂志, 2017,33(11): 1761-1764.
[8] Kasasbeh AS, Christensen S, Straka M, et al. Optimal computed tomographic perfusion scan duration for assessment of acute stroke lesion volumes[J]. Stroke, 2016, 47(12): 2966-2971.
[9] 黄瑞庭,张德佳,黄海松,等.脑梗死前期脑局部低灌注的CT灌注成像表现及分期[J].中华放射学杂志, 2003,37(10): 115-119.
[10] Chalela JA, Alsop DC, Gonzalez-Atavales JB, et al. Magnetic resonance perfusion imaging in acute ischemic stroke using continuous arterial spin labeling[J]. Stroke, 2000, 31(3): 680-687.
[11] Wu O, Koroshetz WJ, Ostergaard L, et al. Predicting tissue outcome in acute human cerebral ischemia using combined diffusion-and perfusion-weighted MR imaging[J]. Stroke, 2001, 32(4): 933-942.
[12] Kajimoto K, Moriwaki H, Yamada N, et al. Cerebral hemodynamic evaluation using perfusion-weighted magnetic resonance imaging: comparison with positron emission tomography values in chronic occlusive carotid disease[J]. Stroke, 2003, 34(7): 1662-1666.
[13] Johnson L, Yester M, Barnes G. SU-E-I-53: Optimal kVp for image quality and noise in iodine contrast in head CTA[J]. Med Phys, 2012, 39(6Part4): 3637.
