出生前后侧脑室周围假性囊肿的MRI评价及预后分析
2020年3月
中华放射学杂志,第54卷第3期 第235页-第240页
孙聪,陈欣,巩涛,蔡先云,陈昱帆,王团团,汤虹,王光彬
侧脑室周围假性囊肿(periventricular pseudocysts,PVPC)是一类位于侧脑室周围且囊壁无上皮细胞覆盖,仅内衬有生殖细胞、胶质细胞的假性囊肿[1]。Epelman等[2]根据囊肿位置将PVPC分为先天性囊肿和室管膜下囊肿。胎儿时期PVPC因其发生率较高逐渐被关注。MRI具有成像视野大、软组织分辨率高、多方位成像的特点,能够精确显示病变的位置,清晰显示可能合并的其他结构异常,已成为产前诊断胎儿中枢神经系统异常的重要方法[3]。但是,目前国内外关于出生前后PVPC的MRI及其预后的研究较少,探讨先天性囊肿、室管膜下囊肿二者预后差异的报道鲜见。笔者旨在分析评价出生前后不同类型PVPC的MRI变化及其预后情况。
回顾性分析2015年6月至2018年7月山东省医学影像学研究所符合以下标准的胎儿临床及影像资料。纳入标准:产前MRI检查诊断为PVPC[1,4],包括(1)先天性囊肿:囊肿位于侧脑室前角外侧下方、孟氏孔前方[2];(2)室管膜下囊肿:囊肿位于侧脑室前角与体部交界处的外侧,孟氏孔区或孟氏孔后方[2]。排除标准:图像质量不佳,临床资料不全,不能用于分析。产前诊断为PVPC的67例胎儿中,伴颅内外其他异常者33例,包括侧脑室增宽(18例)、枕大池增宽(6例)、胎儿宫内生长受限(2例)、缺氧缺血性脑病(2例)、巨细胞病毒感染(2例)、胼胝体发育不良(1例)、染色体畸形(1例)、结节硬化(1例)。对67例诊断为PVPC的胎儿进行生后随访,其中24例失访,2例出生后死亡,存活的41例胎儿纳入随访对象。孕妇年龄21~40(30±2)岁;初次诊断时孕周23~39(33±3)周。所有受试者均无MRI扫描禁忌证。
根据囊肿位置[2]及是否伴有其他颅内外异常[5]分为孤立性先天性囊肿、先天性囊肿伴其他异常、孤立性室管膜下囊肿、室管膜下囊肿伴其他异常4组。存活的41例胎儿于生后0~3岁行颅脑MRI扫描及婴幼儿智力发育Gesell量表评分,由2名高年资放射科医师采用双盲法独立分析,对比胎儿期及出生后颅脑MRI图像,对囊肿位置、囊腔数量、囊肿大小、是否伴有其他异常及出生前后变化情况进行判读并准确描述,其中囊肿大小测量包括囊肿前后径及高度测量,前后径在颅脑轴面图像上测量,高度在颅脑矢状面图像测量。由1名高年资儿科医师对婴幼儿进行智力发育Gesell量表测试。
胎儿时期:采用MAGNETOM Amira MR扫描仪(Siemens Shenzhen Magnetic Resonance Ltd,China),梯度场强40 mT·m-1·s-1,接收线圈为13通道相控阵体线圈,在自由呼吸状态下扫描。孕妇取仰卧位头先进或左侧卧位。所有胎儿均行颅脑冠状面、矢状面、轴面扫描,扫描序列包括半傅立叶单次激励快速自旋回波(half-Fourier acquisition single-shot turbo spin-echo,HASTE)、真实稳态进动快速成像(true fast imaging with steady-state precession,True FISP)、T1WI、扩散加权成像(diffusion weighted imaging,DWI)序列。具体参数如下:(1)HASTE:重复时间(repetition time,TR)1 300 ms,回波时间(echo time,TE)100 ms,反转角180°,层厚3.5 mm,层间距0 mm,矩阵256×198,视野380 mm×309 mm,空间分辨率1.5 mm×1.5 mm×3.5 mm,每次扫描时间28 s;(2)True FISP:TR 621.61 ms,TE 1.76 ms,反转角79°,层厚4 mm,层间距0 mm,矩阵304×199,视野380 mm×310 mm,空间分辨率1.3 mm×1.3 mm×4.0 mm,每次扫描时间12 s。
出生后0~3岁:采用MAGNETOM Skyra MR扫描仪(Siemens Healthcare,Erlangen,Germany),接收线圈为头部线圈,在自由呼吸状态下扫描。婴幼儿取头先进仰卧位,扫描序列包括T1WI、T2WI、液体衰减反转恢复序列(fluidattenuated inversion recovery,FLAIR)、DWI序列。
Gesell发育量表是国际上较为经典的儿童发育量表[5],在我国一直被广泛地应用于评估各类儿童的发育水平,结果用发育商(developmental quotient,DQ)表示:发育商(DQ)=发育年龄/实际年龄×100,当DQ≥85时,发育正常;75≤DQ<84,发育处于边缘状态;当55≤DQ<75时,发育轻度迟缓;当40≤DQ<55时,发育中度迟缓;当DQ<40时,发育重度迟缓。
将67例PVPC胎儿依次编号1~67号,由2名高年资放射科医师采用双盲法分别对胎儿时期囊肿进行分类及测量;对41例出生前后PVPC的位置、囊腔数量、囊肿大小、是否伴有其他异常及出生前后大小变化情况进行判读并准确描述,然后取2名医师的平均值用于后续分析。
应用SPSS 20.0统计软件进行分析。计量资料经Shapiro-Wilk正态性检验后,符合正态分布用
2名医师对41例出生前后PVPC的单/双侧、囊腔数量、囊肿大小、是否伴有其他异常及出生前后大小变化情况的一致性均为好,ICC值分别为0.865、0.931、0.798、0.904、0.879。
67例胎儿中,先天性囊肿、室管膜下囊肿MRI特点见

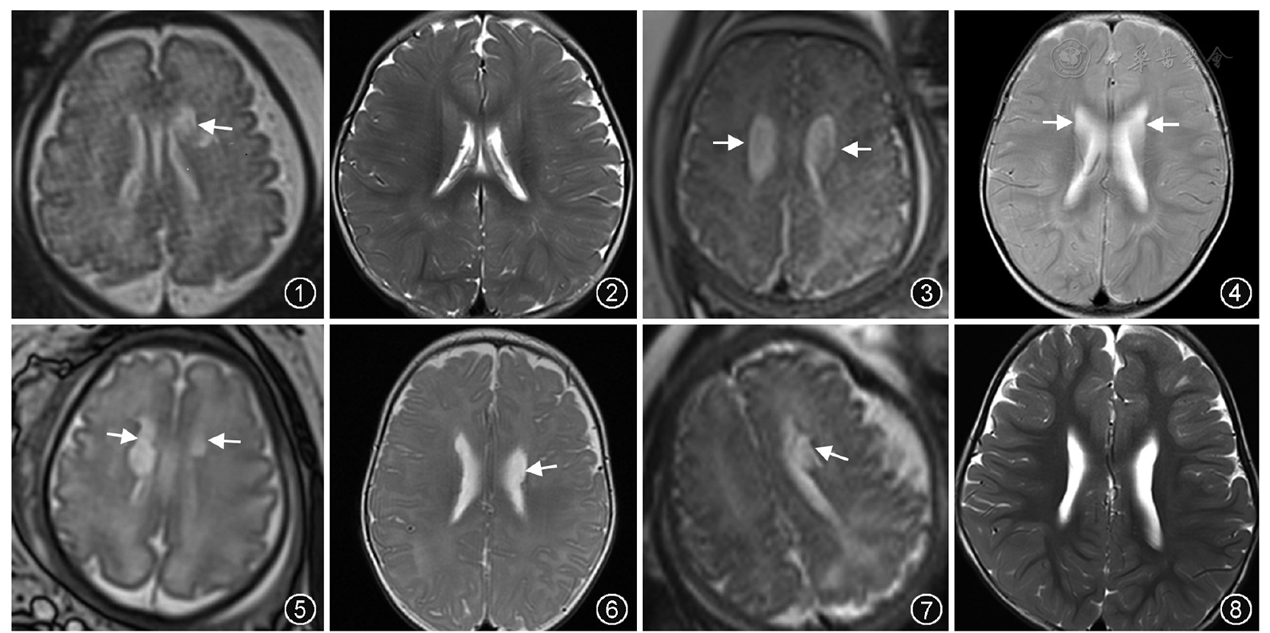
出生后,先天性囊肿组DQ均正常,预后较好;孤立性室管膜下囊肿组(14例)DQ正常13例,预后较好;室管膜下囊肿伴其他异常组(9例),其中2例伴胎儿宫内生长受限,2例出生时伴缺氧缺血性脑病,1例伴枕大池增宽及枕大池囊肿,2例伴侧脑室轻度增宽,1例伴侧脑室重度增宽,1例伴交通性脑积水,DQ正常仅2例,发育迟缓7例。出生后Gesell量表DQ的评分及比较见

Rademaker等[4]根据影像学位置对PVPC、脑室周围白质软化症(periventricular leukomalacia,PVL)进行了区分,认为PVL引起的囊性变跨越侧脑室额角,位于其上方,PVPC位于侧脑室额角下方。Epelman等[2]根据PVPC解剖学位置不同,进一步将其分为先天性囊肿和室管膜下囊肿。目前先天性囊肿是由于侧脑室额角近外角部分的室壁足够接近至接触时形成的类圆形的囊性结构,很多情况下代表正常变异[2,6,7,8,9,10,11]。室管膜下囊肿的发病机制有两种类型,一种是室管膜下获得性出血或微梗死形成的囊肿[12],一种是由侧脑室室管膜下生发层基质消退分解残留形成的[13],可能与先天性病毒感染(主要是巨细胞病毒和风疹病毒)[14]、代谢紊乱、线粒体消耗综合征[15]、染色体畸变、局灶性缺氧缺血性损伤、母体服用可卡因[16]相关,但二者很难从影像学鉴别。
本研究中,67例诊断为PVPC的患儿,平均胎龄(33±3)周,主要发生在妊娠晚期;其中先天性囊肿24例,单侧9例,双侧15例,双侧占比例62.5%;室管膜下囊肿43例,单侧5例,双侧38例,双侧占比例88.4%。两种类型的囊肿均以双侧多见。Larcos等[17]报道,室管膜下囊肿通常呈泪滴状,最大径2~11 mm,在我们的研究中囊肿的大小范围很广,先天性囊肿最大径范围0.4~2.6 cm,平均前后径(1.00±0.40)cm,平均高度(0.60±0.19)cm;室管膜下囊肿最大径范围0.5~3.2 cm,平均前后径(1.66±0.65)cm,平均高度(0.71±0.20)cm,造成此差异的原因,可能与样本量相关,也可能随着医师对囊肿的认识逐渐深化,仪器的分辨率不断提高,从而提高了囊肿的检出率。既往研究显示双侧室管膜下囊肿较单侧室管膜下囊肿体积增大[13],并且随着大小的增加,不良预后的发生率增加;此外Esteban等[9]认为,囊肿直径大于9 mm是危险因素,本研究中未对囊肿大小、单双侧囊肿与预后进行相关性分析,这将是我们今后努力的方向[10]。
孤立性室管膜下囊肿组与孤立性先天性囊肿组相比,出生后DQ差异无统计学意义,囊肿多减小或自行消失,预后较好。本研究中,出生后先天性囊肿18例,囊肿均变小或消失,DQ均正常,2001年Pal等[8]研究中11例孤立性先天性囊肿10例出生后神经发育均正常,这可能与其形成机制密切相关。目前,已有研究证明室管膜下囊肿在健康新生儿中也常作为一种孤立性囊肿存在[15,18,19]。本研究中,出生后孤立性室管膜下囊肿14例,其中囊肿变小或消失12例,DQ正常13例,预后较好,这与2013年Cevey-Macherel等[20]对74例新生儿室管膜下囊肿18和46个月神经发育结局的前瞻性研究相一致。
室管膜下囊肿伴其他异常组与孤立性室管膜下囊肿相比,其DQ明显减低,预后较差。本研究中,出生后室管膜下囊肿伴其他异常组存活胎儿9例,DQ正常仅2例,发育迟缓7例。纳入病例中,进行TORCH病毒学检查孕妇仅有32例,其中阳性2例,出生后失访;剩余孕妇中,1例孕期未进行TORCH病毒学检查,出生后5个月巨细胞病毒感染死亡,所以孕期诊断为侧脑室周围假性囊肿时,应及时进行TORCH病毒学检查,若为阳性,应进行严格产前咨询。此外,已有相关文献报道当观察到严重的脑内或脑外异常时,室管膜下囊肿的预后本身不是主要问题[20],又因MRI能够清晰显示脑室周围假性囊肿伴有的其他颅内外异常[21],较B超成像方面具有明显优势,所以超声诊断为胎儿室管膜下囊肿时,应严格进行MRI、血液学、病毒学等检查,排除相关危险因素。
出生后室管膜下囊肿伴其他异常组与先天性囊肿伴其他异常组相比,其DQ明显减低。本研究中,先天性囊肿伴有的其他异常多为侧脑室轻度增宽、枕大池增宽,一般不伴有病毒感染、缺氧缺血性脑病、染色体畸形、代谢性疾病等危险致病因素,而室管膜下囊肿相对较多伴有以上危险致病因素,这是否能进一步证明二者形成机制、致病因素不同还是样本量偏差引起的偏倚值得我们进一步研究。
第一,本研究对出生后胎儿只进行了1次MRI及智力发育Gesell量表的随访,未进行远期持续随访,对远期智力发育的影响尚未得出明确结论;第二,在选择终止妊娠的病例中未进行尸检获得明确的病理结果,但对41例存活胎儿均进行了出生后影像学及临床随访;第三,未分别对足月儿、早产儿的智力发育情况进行单独研究。
综上所述,胎儿脑室周围假性囊肿不伴有其他颅内外异常时,囊肿在生后多会减小或自行消失,预后较好;胎儿室管膜下囊肿伴有其他脑或形态学异常时,生后患儿发育可出现不同程度迟缓,预后较差。先天性囊肿预后较好。
[1] Larroche JC. Sub-ependymal pseudo-cysts in the newborn[J]. Biol Neonate,1972,21(3):170-183.
[2] Epelman M, Daneman A, Blaser SI, et al. Differential diagnosis of intracranial cystic lesions at head US: correlation with CT and MR imaging[J]. Radiographics,2006,26(1):173-196.
[3] 王光彬,单瑞芹,尹虹,等.MRI在胎儿中枢神经系统中的临床应用[J].中华放射学杂志,2005, 39(6):627-630.
[4] Rademaker KJ, De Vries LS, Barth PG. Subependymal pseudocysts: ultrasound diagnosis and findings at follow-up[J]. Acta Paediatr,1993,82(4):394-399.
[5] Lee J, Kalia V, Perera F, et al. Prenatal airborne polycyclic aromatic hydrocarbon exposure, LINE1 methylation and child development in a Chinese cohort[J].Environ Int,2017,99:315-320.
[6] Cooper S, Bar-Yosef O, Berkenstadt M, et al. Prenatal evaluation, imaging features, and neurodevelopmental outcome of prenatally diagnosed periventricular pseudocysts[J]. AJNR Am J Neuroradiol,2016,37(12):2382-2388.
[7] Chang CL, Chiu NC, Ho CS, et al. Frontal horn cysts in normal neonates[J]. Brain Dev,2006,28(7):426-430.
[8] Pal BR, Preston PR, Morgan ME, et al. Frontal horn thin walled cysts in preterm neonates are benign[J]. Arch Dis Child Fetal Neonatal Ed,2001,85(3):F187-F193.
[9] Esteban H, Blondiaux E, Audureau E, et al. Prenatal features of isolated subependymal pseudocysts associated with adverse pregnancy outcome[J]. Ultrasound Obstet Gynecol,2015,46(6):678-687.
[10] Unger S, Salem S, Wylie L, et al. Newborn frontal horn cysts: cause for concern?[J]. J Perinatol,2011,31(2):98-103.
[11] Tan ZY, Naidoo P, Kenning N. Case of the month. Ultrasound and MRI features of connatal cysts: clinicoradiological differentiation from other supratentorial periventricular cystic lesions[J]. Br J Radiol,2010,83(986):180-183.
[12] Bats AS, Molho M, Senat MV, et al. Subependymal pseudocysts in the fetal brain: prenatal diagnosis of two cases and review of the literature[J]. Ultrasound Obstet Gynecol,2002,20(5):502-505.
[13] Malinger G, Lev D, Ben Sira L, et al. Congenital periventricular pseudocysts: prenatal sonographic appearance and clinical implications[J]. Ultrasound Obstet Gynecol,2002,20(5):447-451.
[14] Malinger G, Lev D, Zahalka N, et al. Fetal cytomegalovirus infection of the brain: the spectrum of sonographic findings[J]. AJNR Am J Neuroradiol,2003,24(1):28-32.
[15] Rohrbach M, Chitayat D, Maegawa G, et al. Intracerebral periventricular pseudocysts in a fetus with mitochondrial depletion syndrome: an association or coincidence[J]. Fetal Diagn Ther,2009,25(2):177-182.
[16] Smith LM, Qureshi N, Renslo R, et al. Prenatal cocaine exposure and cranial sonographic findings in preterm infants[J]. J Clin Ultrasound,2001,29(2):72-77.
[17] Larcos G, Gruenewald SM, Lui K. Neonatal subependymal cysts detected by sonography: prevalence, sonographic findings, and clinical significance[J].AJR Am J Roentgenol,1994,162(4):953-9566.
[18] Yang M, Jiang Y, Chen Q, et al. Prenatal diagnosis and prognosis of isolated subependymal cysts: a retrospective cohort study[J]. Prenat Diagn,2017,37(13):1322-1326.
[19] Fernandez Alvarez JR, Amess PN, Gandhi RS, et al. Diagnostic value of subependymal pseudocysts and choroid plexus cysts on neonatal cerebral ultrasound: a meta-analysis[J]. Arch Dis Child Fetal Neonatal Ed,2009,94(6):F443-F446.
[20] Cevey-Macherel M, Forcada Guex M, Bickle Graz M, et al. Neurodevelopment outcome of newborns with cerebral subependymal pseudocysts at 18 and 46 months: a prospective study[J]. Arch Dis Child,2013,98(7):497-502.
[21] Correa F, Lara C, Carreras E, et al. Evolution of fetal subependymal cysts throughout gestation[J]. Fetal Diagn Ther,2013,34(2):127-130.
