氧化低密度脂蛋白在动脉粥样硬化性心血管疾病诊断中的作用
2021年7月
中华检验医学杂志,第44卷第7期 第563页-第568页
杨鑫,胡炎伟
动脉粥样硬化(atherosclerosis,AS)是一种以脂代谢紊乱、血管内皮受损、血管壁脂质沉积、单核巨噬细胞增生、粥样斑块形成等为主要病理特征的慢性系统性疾病。AS主要累及大、中型动脉,可引起心肌缺血、冠心病、脑梗死及外周血管病等多种心脑血管疾病,严重威胁人类生命健康[1, 2]。AS发病机制复杂,早期临床表现隐匿,并发症严重,进展周期长。利用循环生物标志物早期诊断和动态监测AS的发生发展,对改善心血管疾病的诊断、治疗和预后具有重要意义。研究表明,氧化修饰低密度脂蛋白(oxidized low-density lipoprotein,oxLDL)在AS的发生发展过程中发挥关键作用,其含量在AS患者循环血液中明显升高,被认为是AS性心血管疾病的潜在生物标志物。
氧化低密度脂蛋白是指低密度脂蛋白(low-density lipoprotein,LDL)内大量不饱和脂肪酸在过量自由基或其他致氧因素作用下发生过氧化反应,最后产生丙二醛(malondialdehyde,MDA),MDA与LDL表面的载脂蛋白(apolipoprotein apo)B结合发生化学修饰的产物。LDL是一种运载胆固醇进入外周组织细胞的球形脂蛋白颗粒,直径约22 nm,核心包括1 500个胆固醇酯、800个磷脂和500个游离胆固醇分子;LDL外层apoB100。如
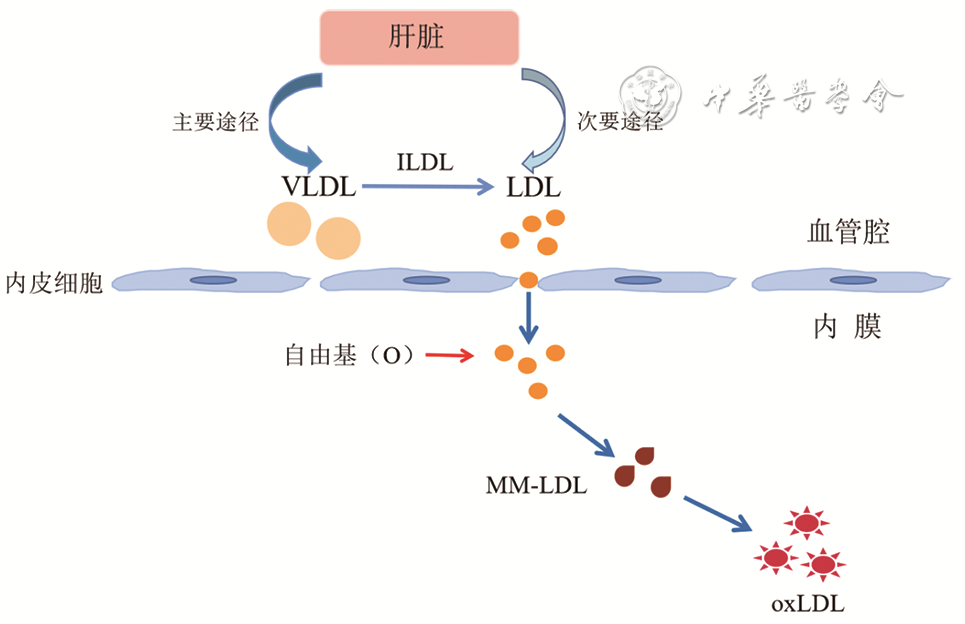
注:VLDL为极低密度脂蛋白,ILDL为中间低密度脂蛋白,LDL为低密度脂蛋白,MM-LDL为轻度修饰低密度脂蛋白,oxLDL为氧化低密度脂蛋白
LDL氧化反应主要分为两步[4]:第一步LDL被轻度氧化修饰,LDL内的不饱和脂肪酸被快速氧化为脂质过氧化物,此时形成的LDL被称为轻度修饰LDL(minimally modified LDL,MM-LDL),MM-LDL仍能被LDL受体所识别。第二步MM-LDL被完全氧化为oxLDL,脂质过氧化物分解为MDA、4-羟烯酸(4-hydroxy acid,4-HNE)后与apoB结合形成新的抗原决定簇,不能被LDL代谢途径正常代谢,但能被巨噬细胞和平滑肌细胞上的清道夫受体识别。完全氧化后的主要产物为溶血卵磷脂(LPC),是发挥致病性的主要成分。
AS的发病机制复杂,影响因素众多,其中oxLDL被认为是致AS的关键因子。AS的病理分期包括脂点、脂纹、斑块前期、粥样斑块期、纤维斑块期和复合病变期[5]。oxLDL在AS形成的不同时期均发挥着重要作用。如
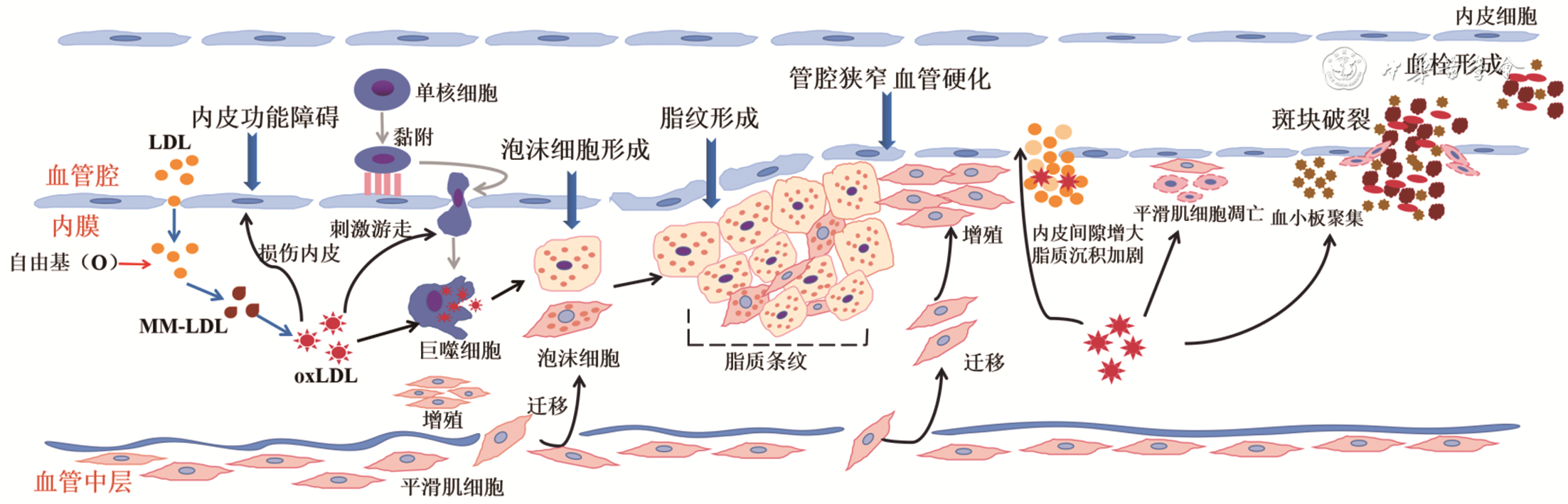
注:LDL为低密度脂蛋白,MM-LDL为轻度修饰低密度脂蛋白,oxLDL为氧化低密度脂蛋白
AS是脂质代谢、炎性因子以及血小板活化等多因素共同作用的结果。根据影响因素,将AS的实验室标志物分为炎症标志物、血栓标志物及脂质标志物。炎症标志物主要包括超敏C反应蛋白、补体C1q、同型半胱氨酸、脂蛋白相关磷脂酶A2等。大多数炎症标志物易受感染等全身因素的影响,不能作为AS的特异性标志物。同型半胱氨酸和脂蛋白相关磷脂酶A2是与脂质相关的炎症因子,具有相对较高的特异性,但与疾病的预后关系尚不明确[12, 13]。AS过程中,相关凝血纤溶标志物也会出现相应变化,如血栓调节蛋白、凝血酶-抗凝血酶复合物、纤溶酶抗纤溶酶复合物、组织型纤溶酶原激活物-溶酶原激活抑制物-1复合物等[14, 15]。这些血栓标志物对AS相关心血管疾病的独立诊断价值不大,但却能作为病情进展和临床疗效监测的辅助指标。脂质标志物主要包括血清总胆固醇、低密度脂蛋白、高密度脂蛋白、载脂蛋白等。脂代谢异常是引起AS的主要因素,脂蛋白等也是目前临床实验室的常规检测项目[16]。其中,LDL早期被认为是与AS联系最密切的脂蛋白。后来研究表明,oxLDL才是导致泡沫细胞形成的直接原因。oxLDL能够直观地反映患者体内的氧化应激状态,是引发AS的独立危险因子,在AS的预防、早期诊断及预后都具有重要意义[17]。oxLDL与早期AS、冠状动脉疾病、急性冠状动脉综合征及缺血性心肌梗死等AS的各个阶段密切相关。
1.oxLDL在无症状期AS中的诊断价值:在亚临床AS中,循环oxLDL水平与内皮功能障碍和血管舒张功能受损有关。Matsumoto等[18]发现,在冠状动脉造影正常者中,循环oxLDL与心律失常和冠状动脉扩张剂对缓激肽反应相关,能够反映冠状动脉的内皮功能。Rietzschel等[19]在35~55岁的健康人群中发现,oxLDL水平升高与左心室壁厚度增加和左心室舒缩功能下降有关。上述研究表明,在尚未出现临床症状和明显病理改变的AS早期,循环性oxLDL升高能够提示心血管结构功能受损。若能实时监测oxLDL的变化,对早期预防AS的进一步发展具有重要意义。
2.oxLDL在冠心病中的诊断价值:研究表明,轻度或重度冠状动脉狭窄患者oxLDL水平明显高于血管造影正常者;不稳定性心绞痛患者的oxLDL水平明显高于稳定性心绞痛患者;急性心肌梗死患者(AMI)的oxLDL水平明显高于不稳定性或稳定性心绞痛患者[20]。Naruko等[21]在102例因AMI入院并治愈出院的患者中,发现6个月内发生再狭窄患者的oxLDL水平明显高于未发生再狭窄的患者,提示oxLDL可能与冠心病的预后不良有关。研究[22]还发现,oxLDL在AMI发生后第7天出现峰值,随后数月逐渐下降;而经皮冠状动脉介入治疗(percutaneous transluminal coronary intervention,PCI)和经皮腔内血管成形术后,oxLDL明显升高,6 h后恢复至基线。但在冠状动脉完全闭塞的患者中,PCI后的7 d内oxLDL水平仍呈逐渐升高的趋势。这可能是由于AMI或PCI引起动脉粥样硬化斑块破裂,oxLDL释放入血所致。冠心病是严重危害人类健康的主要心血管疾病,寻找合适的生物标志物对其预防和控制均具有重要意义。oxLDL在冠心病中的诊断价值明确,并且动态观察oxLDL变化情况可用于提示病情的严重程度和斑块的稳定性。oxLDL若一过性升高可能与PCI治疗有关,若持续升高则提示冠状动脉可能存在严重狭窄,病情进展不佳。
3. oxLDL在心力衰竭中的诊断价值:Jorde等[23]比较了48例慢性心力衰竭(chronic heart failure,CHF)患者和12名健康对照者的静止和最大运动量下的血浆oxLDL水平。结果发现,运动可引起CHF患者的血浆oxLDL升高,而健康对照组在运动前后oxLDL血浆水平无明显变化,提示oxLDL可能与CHF预后不良有关。许多研究发现,oxLDL抗体(oxLDL-Ab)对重度CHF的判别能力优于血清B型利钠肽[24]。Charach等[25]监测了284例重症CHF患者的oxLDL-Ab水平,结果发现oxLDL-Ab可用于预测CHF发病率和病死率。CHF是一类伴随着心肌细胞的肥大、糖脂代谢紊乱、炎症反应等多种病理改变的疾病,随着对其发病机理的深入研究,发现氧化应激在CHF中也发挥着重要作用。作为氧化应激的标志分子,oxLDL在CHF患者中具有潜在的诊断价值,尤其是在重度CHF患者中诊断意义更为突出。
4. oxLDL在急性脑梗死中的诊断价值:研究发现,急性脑梗死(acute cerebral infarction,ACI)患者血浆中oxLDL含量是正常对照组的2倍,oxLDL在ACI发生后的第3天达到峰值,30 d内恢复基线水平[26]。血浆oxLDL水平与ACI的发生密切相关,尤其对皮层梗死患者具有良好的诊断价值,而在大面积半球病变的患者血浆中oxLDL并无明显变化[27]。但有研究认为,超敏C反应蛋白、FIB等急性时相反应蛋白而非oxLDL可以预测ACI的严重程度及预后[28]。颈动脉发生AS后,颈动脉斑块导致管腔狭窄,斑块脱落形成栓子及血流动力学改变是ACI的重要发病机制。ACI患者经过对症治疗和康复治疗后机体各项功能也难以恢复至发病前水平,故早预测、早诊断、早治疗对于改善ACI的预后尤为重要。而oxLDL水平在AS早期就发生变化,这对ACI患者的早期诊断具有重大意义,但oxLDL在ACI中的预后评估价值仍有待进一步探究。
近年来,随着检测技术的不断发展,许多研究发现在血清或血浆中也能检测到oxLDL。目前用于循环血中oxLDL的检测方法主要包括酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)、免疫胶体金技术、荧光探针等,但仍没有一种方法被批准应用于常规临床实践中。
1.ELISA方法:仍是目前检测oxLDL最常用的技术。90年代以来,针对oxLDL氧化衍生物的不同抗原表位,制备了多株单克隆抗体,建立了测定外周血oxLDL含量的ELISA方法。Holvoet等[29]构建了针对apoB100中被醛基修饰的赖氨酸残基表位的单抗-4E6抗体,并评估了以4E6抗体为基础的竞争性ELISA方法。结果发现,该方法的检测敏感度约为78%,特异度为61%。该方法不足之处在于:(1)4E6抗体不能识别赖氨酸修饰较少的oxLDL(<60个);(2)尽管4E6抗体与血浆oxLDL的结合能力是LDL的1 000倍,但它仍与天然LDL存在交叉反应,限制了其临床应用。在早期,Itabe等[30]和Toshima等[31]构建的FOH1a/DLH3抗体,只特异性识别磷脂酰胆碱氧化产物,不识别天然LDL和MDA-LDL,特异性更高。但以FOH1a/DLH3抗体为基础的双抗夹心ELISA直接测定分离的LDL而非血浆,其结果反映oxLDL在血浆总LDL成分中的比例(oxPL/apoB),即oxLDL氧化修饰率,检测敏感度为78%,特异度为72%。这种方法的虽然克服了交叉反应等缺点,提高了特异性,但由于需要分离LDL,耗时费力,成本高,不适合大规模筛查。
2.荧光探针技术:研究发现,循环血中oxLDL及其抗体能够形成免疫复合物(immune complexes, IC)[32]。Sato等[33]利用异硫氰酸荧光素(FITC)标记的七肽(Lys-Trp-Tyr-Lys-Asp-Gly-Asp,FITC-KP6)特异性地结合免疫复合物(oxLDL-ICs和MM-LDL-ICs),建立了一种测定循环血中oxLDL的新方法。该方法利用聚乙二醇(PEG)沉淀免疫复合物,FITC-KP6与IC以剂量依赖性的方式特异性结合,而与天然的LDL不结合,具有一定的特异性。同时,荧光探针的使用提高了敏感性。与ELISA相比,具有较高的灵敏性,最小检出量为12 ng/ml的oxLDL和MM-LDL,但其特异性不明确。该方法减少了抗体的使用,节约了成本,但仍存在一定的局限性:(1)目前尚不清楚FITC-KP6是否只能识别2种oxLDL(oxLDL-ICs和MM-LDL-ICs);(2)FITC荧光容易被血红蛋白等猝灭,稳定性较低。尽管存在不足之处,但以FITC标记为基础的荧光探针技术仍为oxLDL的检测提供了新方向。
3.纳米金检测技术:随着金纳米等新型材料兴起与发展,基于金纳米材料的检测技术已经成为方法学研究的热点。Hinterwirth等[34]和Haller等[35]利用金纳米粒子(GNP)表面易于修饰的特点,将GNP分别与抗oxLDL抗体和抗MDA-LDL抗体偶联,用于捕获氧化磷脂酰胆碱和MDA-LDL氧化产物,经超声处理洗脱、提纯后,再利用液相色谱仪串联质谱仪进行分析,极大提高了oxLDL的检出率。将基于GNP的生物分析用于oxLDL的靶向选择以及LC-MS/MS的快速灵敏检测为筛选氧化应激脂质标志物提供了新的可能性,但其在临床中的检测灵敏性和特异性仍需进一步探究。在最新的研究中,Tan等[36]则利用GNP为基础建立了一种侧向免疫层析方法(LFIA)检测oxLDL与β2-糖蛋白I(β2GPI)形成的复合物(oxLDL/β2GPI),检出限为50 ng/ml,灵敏性与ELISA方法相似。但LFIA法不需要洗涤,操作简单,检测快速,更适合临床快速诊断与筛查。
4.其他检测技术:Ramm Sander等[37]利用oxLDL在1.17、1.18、1.20 ppm的特征性共振态进行质谱分析,将其与天然的LDL鉴别。该方法不需特殊的预处理,检测时间短,可同时检测所有的LDL氧化产物,但需要特殊的仪器,仪器成本高。硫代巴比妥酸反应物(TBARS)方法是利用脂质氧化产物与硫代巴比妥酸反应生成TBARS,反应物经离心、提取后在523 nm处有最大吸收峰,再与标准溶液的吸光度对比来反映oxLDL的浓度。TBARS方法的回收率为101.63%±12%,变异系数为3.14%,重复性差,检测限约为0.9 μmol/L。且由于血浆中的糖和氨基酸均能与硫代巴比妥酸反应,因此该方法缺乏特异性,操作复杂,难以应用于临床。
oxLDL作为AS病变演化历程中的关键分子,在损伤内皮细胞,诱导泡沫细胞形成,促进平滑肌细胞增殖、迁移,导致结缔组织增生,影响斑块的不稳定性和促进血栓形成等方面发挥重要作用。oxLDL作为与AS有关的循环生物标志物,已被列为许多急性或慢性炎性疾病的独立危险因素,尤其是在冠心病、心力衰竭及脑梗死等与AS相关的心血管疾病中的诊断价值尤为重要。尽管目前有许多研究报道oxLDL具有AS早期诊断、评估预后和预警的潜力,相应的检测方法也在不断发展优化,但目前大多数研究仍处于实验室阶段,尚未被广泛应用。其原因有:(1)oxLDL半衰期短、外周血含量少,传统方法难以检测;(2)目前仍缺乏标准化的检测方法,不同检测方法间比较的差异性、一致性尚不明确;(3)一些具有高灵敏性、高特异性的方法存在成本高、操作复杂、需要专业仪器等缺陷,难以在临床普及。因此,未来亟需研发和优化高特异性、高灵敏度、方便及时、具有标准化的oxLDL定量检测方法,完善临床数据,尽早应用到临床,为AS相关疾病的早发现、早诊断、早治疗提供有力支持。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
26
27
28
29
30
31
32
33
34
35
36
37
收藏此内容
推荐给朋友