射波刀治疗前列腺癌寡转移灶的临床分析
2017年6期
中华泌尿外科杂志,第38卷第6期 第453页-第456页
赵宪芝,沈钰新,阳青松,朱晓斐,代智涛,王晓艳,曹飞,居小萍,张火俊
前列腺癌的治疗多采用手术、放疗、去势治疗等手段[1,2,3,4]。目前,关于前列腺癌寡转移灶的治疗研究较少,结果尚无定论。立体定向放疗(stereotactic body radiotherapy ,SBRT)作为精确放疗的代表,具有创伤小、局部控制率(local control rate,LCR)高等优点。射波刀作为最新型的SBRT设备,采用5种高度精确追踪系统,包括:同步呼吸追踪、6D颅骨追踪、X-sight脊柱追踪、金标追踪以及X-sight肺同步呼吸追踪方式,在单次剂量大、分割次数少的情况下,提供高适形、高剂量治疗,正越来越多地被应用到肿瘤治疗中[5,6]。我们回顾性分析2012年5月至2017年2月我院31例行射波刀治疗的前列腺癌患者的临床资料,旨在观察射波刀治疗前列腺癌寡转移灶的安全性和有效性,为临床治疗提供选择。
31例入组患者均符合以下标准:①组织病理学证实为前列腺癌;②组织病理学和/或影像学检查证实为前列腺癌转移灶,影像学检查包括:CT、ECT、MRI、PET-CT、PET-MR等;③预计生存期≥3个月。
除外以下情况患者:①既往转移灶有放射治疗病史;②严重肝肾功能不全者;③寡转移灶的数目>5个。
本组31例(共50个寡转移灶)。年龄52~83岁,中位年龄67岁。放疗前PSA 0~300.0ng/ml,中位值8.4 ng/ml。Gleason评分9例7分,7例8分,11例9分,2例10分,2例Gleason评分不详。从诊断前列腺癌至出现寡转移灶的时间为0~122.1个月,中位值8.4个月。出现寡转移灶至SBRT的时间为0.1~20.8个月,中位值1.3个月。50个寡转移灶位置:24个脊柱转移灶,2个肋骨转移灶,3个头颅转移灶,3个肺转移灶,7个淋巴结转移,1个肱骨转移灶,8个髋骨转移灶,1个肾上腺转移灶,1个锁骨转移灶。其中,2例前列腺癌原发灶与单个转移灶同时行射波刀治疗,18例含单个转移灶,1例含2个异时转移灶,4例含2个同时转移灶,1例含2个同时转移灶和1个异时转移灶,1例先后分别有2个同时转移灶,3例同时治疗3个转移灶,1例同时治疗4个转移灶。根据D′Amico标准,由于PSA水平、T分期或Gleason评分较高,本组患者均为高危前列腺癌。19例患者SBRT前有雄激素剥夺治疗(androgen deprivation therapy,ADT)史,13例患者SBRT同时联合ADT。
完善肝肾功能、凝血功能、血常规、肿瘤标志物等相关检查,并评估患者的体能状态。采用fiducial追踪方式的病灶行B超或CT引导下穿刺植入金标(长5.0 mm,直径0.8 mm)1~4个,同一病灶植入的每2个金标间距需>2 cm[7]。穿刺1周后定位。
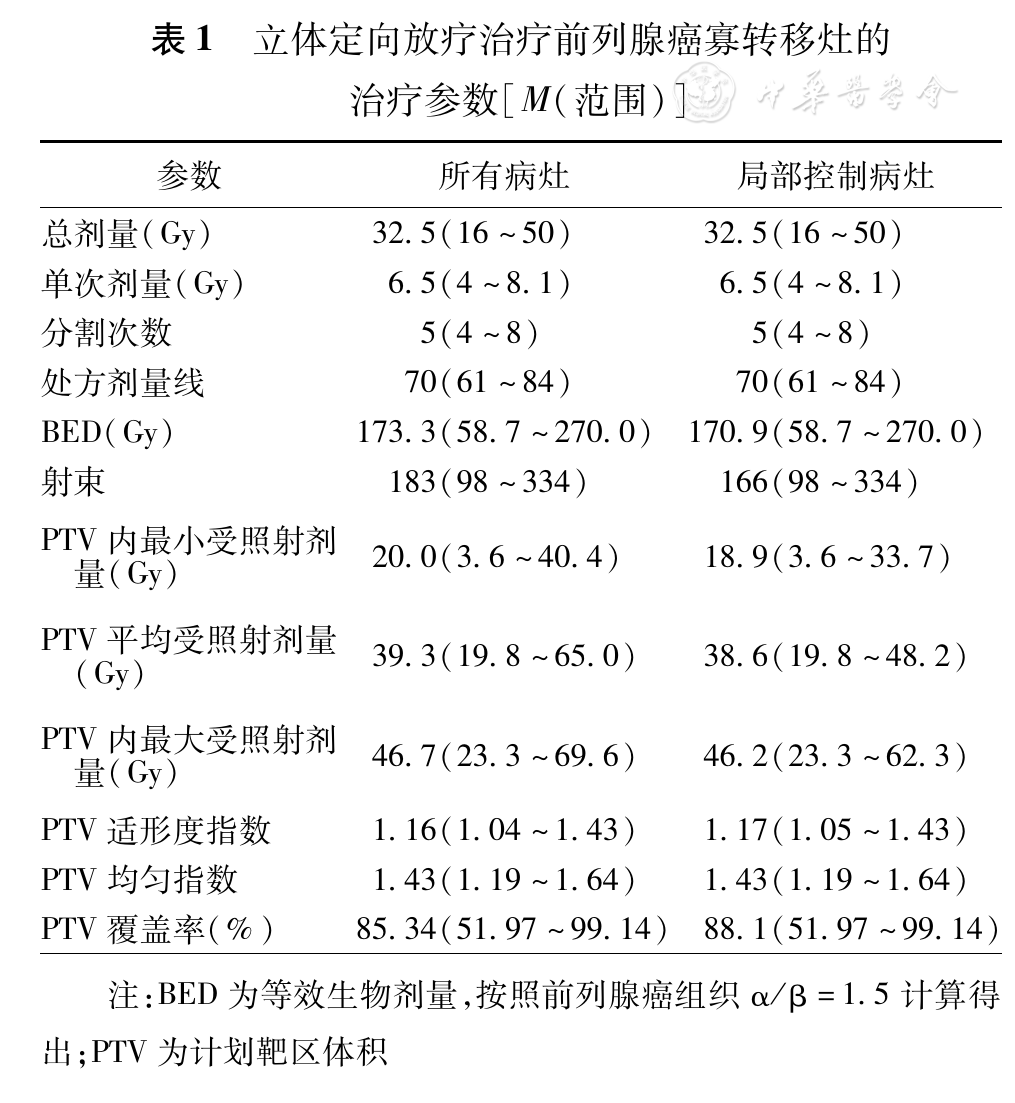
大体肿瘤体积(gross tumor volume ,GTV)定义为影像学上看到的肿瘤体积,GTV勾画参考患者定位前的CT、MR、PET等影像检查资料。计划靶区体积(planning target volume,PTV)定义为GTV加上肿瘤的运动范围及摆位误差。确定危险器官,包括:肝脏、脊髓、胃、肠道、肺、肾脏、股骨头等。44个转移灶采用X-sight脊柱追踪方式,3个头颅转移灶采用6D颅骨追踪方式,1个盆底淋巴结、2个前列腺+髋骨转移灶采用金标追踪。制定物理计划,见
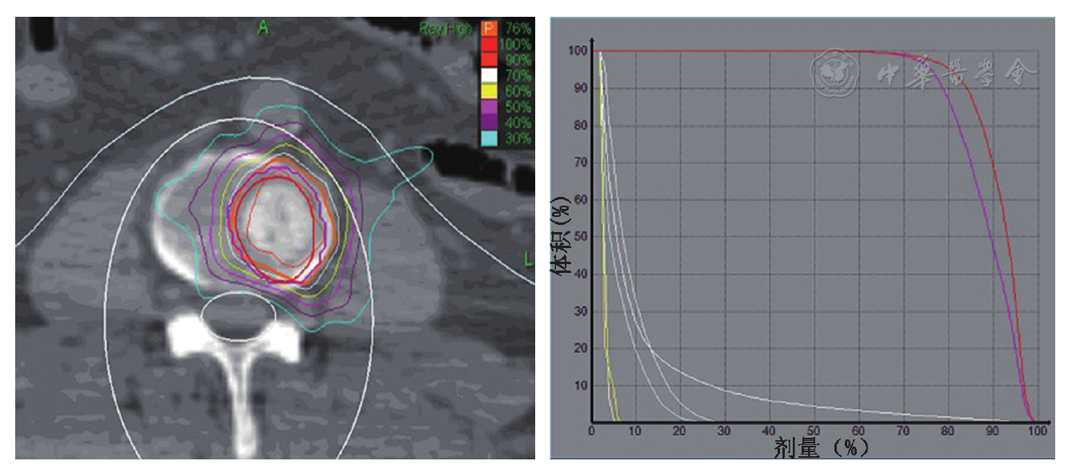
A.靶区的剂量分布图;B.靶区计划的剂量体积直方图
(3)治疗方式:所有病灶均采用美国Accuray公司生产的射波刀SRS治疗系统(第四代,G4)治疗。
患者每月复查PSA,每3~6个月复查PET-CT、ECT、MR或PET-MR等观察肿瘤治疗后反应。截止患者死亡日期或随访日期,查看靶病灶的局部控制状态。PSA无进展生存(PSA progression-free survival,PSA-PFS)时间定义为从射波刀治疗开始至PSA值下降至最低点后增加2ng/ml的时间。局部控制时间为从射波刀治疗开始至目标病灶出现进展或死亡的时间。SBRT至开始ADT时间定义为从射波刀治疗开始至放疗后开始使用ADT的时间。
采用SPSS 18.0统计软件处理数据,不符合正态分布的数据采用中位数(范围)表示。采用Kaplan-Meier法计算PSA-PFS和LCR。
所有患者均顺利完成治疗,未出现严重的早期反应(SBRT治疗后3个月内发生的不良反应)和晚期反应(SBRT治疗后3个月后发生的不良反应)。伴骨转移的患者未出现放疗后骨折现象。
31例均获随访,SBRT治疗后随访时间1.2 ~58.3个月,中位时间20.7个月。25例患者生存,6例死亡。其中,1例因ADT治疗导致急性肾衰竭而死亡,总生存期(overall survival,OS)为32.1个月。5例因远处转移而死亡,OS分别为5.1、6.1、8.1、9.0、9.0个月。无死于靶病灶局部控制失败或治疗相关不良反应的病例。
1年LCR为90.4%,2年LCR为86.9%,4年LCR为82.6%。11例患者转移灶引起的疼痛于射波刀治疗后均有明显缓解。20例患者转移灶未引起明显症状。
局部控制失败病灶的后续治疗:①1个L5椎体转移灶局部控制21.3个月后复发。第1次SBRT前患者PSA为13.7 ng/ml,放疗后8.2个月降至最低点0.01 ng/ml,后逐渐升高至1.5 ng/ml,放疗后21.3个月复查PET-MR提示L5椎体转移灶复发,再次行射波刀治疗,给予处方剂量32.5Gy/5f,复查PSA逐渐下降至0.1 ng/ml,复查PET-MR未见复发征象。②1个T9椎体转移灶局部控制3.9个月后进展,治疗后PSA持续升高,出现全身多发骨转移,持续给予ADT治疗。③1个髋骨转移灶局部控制14.1个月后复发,PSA由SBRT前的10.9 ng/ml下降至5.0 ng/ml后逐渐升高,给予ADT治疗,局部控制稳定,ADT治疗25个月后发生去势抵抗,予序贯化疗。④1例患者的3个肺转移灶局部控制9.0个月后进展,进展后病灶分别行粒子植入及局部消融治疗,间断化疗并序贯ADT治疗。
本组31例患者SBRT后PSA-PFS为0~58.3个月,中位时间5.3个月;1年PSA-PFS率为52.0%,2年PSA-PFS率为36.7%,4年PSA-PFS率为36.7%。21个转移灶放疗后PSA控制在正常范围,未出现进展,此21例的中位PSA-PFS时间为12.3个月(1.2~58.3个月);29个转移灶放疗后出现PSA进展,其中22个转移灶放疗后PSA持续升高,7个转移灶放疗后PSA先下降后升高。
31例患者SBRT后至开始ADT治疗的中位时间为5.0个月(0~58.3个月)。其中,8例放疗后PSA控制良好,未增加ADT治疗,中位随访时间为10.6个月(2.9~58.3个月);4例放疗后PSA进展,因一般状况较差未增加ADT治疗,中位OS为8.1个月(6.1~9.0个月);7例放疗后增加ADT治疗,SBRT至开始ADT的中位时间为13.3个月(3.0~24.0个月)。12例患者放疗前后持续ADT治疗。
已有文献报道射波刀治疗前列腺癌寡转移灶具有良好的疗效及安全性[8,9,10,11]。Ost等[8]的研究中,从多个中心入组了≤3个转移灶的前列腺癌患者119例,共163个转移灶,其中86例有单个转移灶,22例有2个转移灶,11例有3个转移灶;在163个转移灶中,60%为淋巴结转移,36%为骨转移,4%为内脏转移;中位随访时间为36个月,生物等效剂量(biologically effective dose, BED)≤100 Gy组的3年LCR为79%,BED>100 Gy组的3年LCR为99%,17例(14%)出现Ⅰ级不良反应,3例(3%)出现Ⅱ级不良反应,未出现Ⅲ级及以上不良反应。Muldermans等[9]的研究中,66例前列腺癌患者含81个转移灶行SBRT治疗,其中,74个骨转移灶,6个淋巴结转移灶,1个肝转移灶,中位随访时间16个月(3~49个月),2年LCR为82%,2年PSA-PFS率为54%。本研究结果同样显示了射波刀治疗前列腺癌寡转移灶具有良好的疗效和安全性,1年LCR为90.4 %,2年LCR为86.9 %,4年LCR为82.6%。1年PSA-PFS率为52.0%,2年PSA-PFS率为36.7%,4年PSA-PFS率为36.7%。未发现射波刀治疗相关的严重不良反应。
寡转移灶通常指≤3个或≤5个的转移灶。研究结果显示前列腺癌患者会受益于转移灶的局部治疗[10,11]。目前,SBRT对于寡转移灶个数的选择尚不明确,本研究关于SBRT治疗前列腺癌寡转移灶的治疗指征主要为:①病灶数目<5个,通常≤3个;②对于病灶数目较多者,建议先行全身治疗,个别病灶全身治疗后疗效欠佳者,可局部行SBRT;③引起严重临床症状的转移灶。
放疗后远处转移是导致PSA进展的主要原因,因此,SBRT是否需要联合全身治疗以及如何有效联合全身治疗来控制远处转移是值得深究的问题。本组患者每月定期检测PSA,5例患者发现PSA进展时,影像学检查提示肿瘤已经明显进展,临床治疗效果欠佳;1例患者PSA未进展,影像学检查却提示远处转移。因此,PSA似乎并不能及时反映微转移灶情况,寻找PSA外的能及时有效预测疾病发展的生物标志物迫在眉睫。
本组有6个局部控制失败的病灶,局部控制时间分别为:21.3(L5椎体)、3.9(T9椎体)、14.1(髋骨)、9.0(同一患者含3个肺转移灶)个月。分析原因可能为:①靶区边缘存在影像学不可见的亚临床病灶;②因椎体转移瘤位置靠近脊髓,为降低脊髓受照射剂量,常降低靶区剂量;③为准确评估正常肺组织接受的照射剂量以更好地保护正常肺组织,3个肺转移灶共用一个计划,采用X-sight脊柱追踪方式,处方剂量为45Gy/6f,导致靶区内剂量降低且分布不均。
总之,射波刀治疗前列腺癌寡转移灶的LCR高,能有效延长无进展生存期,安全性好。寻找PSA外的能及时有效预测微转移灶的生物标志物刻不容缓。对于前列腺癌寡转移患者,单纯应用SBRT疗效有限,如何有效联合ADT、化疗等综合治疗来提高治疗效果有待进一步研究。
[1] Hamdy FC, Donovan JL, Lane JA, et al. 10-Year outcomes after monitoring, surgery, or radiotherapy for localized prostate cancer[J]. N Engl J Med, 2016, 375: 1415-1424.
[2] Amini A, Rusthoven CG, Jones BL, et al. Survival outcomes of radiotherapy with or without androgen-deprivation therapy for patients with intermediate-risk prostate cancer using the National Cancer Data Base[J]. Urol Oncol, 2016 , 34: 165.e1-9.
[3] Taplin ME, Montgomery B, Logothetis CJ, et al.Intense androgen-deprivation therapy with abiraterone acetate plus leuprolide acetate in patients with localized high-risk prostate cancer: results of a randomized phase II neoadjuvant study[J]. J Clin Oncol, 2014 , 32: 3705-3715.
[4] 高旭,施振凯,张火俊,等. 射波刀放疗治疗前列腺癌的临床经验[J]. 中华泌尿外科杂志,2014,35:502-506.
[5] Liang P, Huang C, Liang SX, et al. Effect of CyberKnife stereotactic body radiation therapy for hepatocellular carcinoma on hepatic toxicity[J]. Onco Targets Ther, 2016 , 9: 7169-7175.
[6] Snyder KC, Kim J, Reding A, et al. Development and evaluation of a clinical model for lung cancer patients using stereotactic body radiotherapy (SBRT) within a knowledge-based algorithm for treatment planning[J]. J Appl Clin Med Phys, 2016 , 17: 6429.
[7] 董洋,李丰彤,王境生,等.置入软组织金标数目对射波刀系统影像定位精度影响[J].中华放射肿瘤学杂志,2010,1549:465-467.
[8] Ost P, Jereczek-Fossa BA, As NV, et al. Progression-free survival following stereotactic body radiotherapy for oligometastatic prostate cancer treatment-naive recurrence: a multi-institutional analysis[J]. Eur Urol, 2016 , 69: 9-12.
[9] Muldermans JL, Romak LB, Kwon ED, et al. Stereotactic body radiation therapy for oligometastatic prostate cancer[J]. Int J Radiat Oncol Biol Phys, 2016 , 95: 696-702.
[10] Ost P, Jereczek-Fossa BA, Van As N, et al. Pattern of Progression after stereotactic body radiotherapy for oligometastatic prostate cancer nodal recurrences[J]. Clin Oncol (R Coll Radiol), 2016 , 28: e115-e120.
[11] Ricardi U, Badellino S, Filippi AR. Clinical applications of stereotactic radiation therapy for oligometastatic cancer patients: adisease-oriented approach[J]. J Radiat Res, 2016, 57(