根治性前列腺切除术后病理检查对模板引导下经会阴前列腺穿刺活检准确性的再评估
2018年1期
中华泌尿外科杂志,第39卷第1期 第14页-第18页
肖雨,麦智鹏,严维刚,周毅,周智恩,梁智勇,纪志刚,李汉忠
前列腺穿刺活检是确诊前列腺癌最常用的方法,也是决定肿瘤危险分级并进一步治疗的基础。对于低危前列腺癌,主动监测是一种有效且有较高生活质量的方法;对于中危前列腺癌,则可以考虑使用局部治疗[1,2,3]。主动监测和局部治疗对前列腺穿刺活检的准确性提出了更高的要求,其不仅体现在要有较高的阳性率,更重要的是要能做到主要肿瘤的检出、提高穿刺定位的敏感性和特异性、准确的Gleason评分、有临床意义前列腺癌的检出等。
经直肠途径是目前前列腺穿刺活检的主流,但存在假阴性率偏高、低估前列腺癌危险度、不准确的前列腺癌病灶空间分布(如前列腺前尖部的低检出率)、感染发生率偏高[4,5]。而经会阴途径活检,尤其是模板引导下系统性经会阴途径活检有显著的优势,可以准确评估病灶的空间分布及Gleason评分,为决定是否行主动监测和局部治疗提供依据[6]。前列腺穿刺活检(包括经会阴或经直肠途径)可以验证影像学检查如MRI的准确性;经直肠途径活检的准确性可以通过模板引导下经会阴途径活检来证实;而验证模板引导下经会阴途径活检准确性的最可靠的方法是与对应的大体病理检查结果进行比较[6,7,8,9]。
我们既往对模板引导下经会阴前列腺穿刺活检的准确性和病灶的空间分布进行了总结[10]。为进一步明确经会阴前列腺穿刺活检的准确性,指导前列腺穿刺活检的思路及进一步的治疗,本研究采用腹腔镜根治性前列腺切除术(laparoscopic radical prostatectomy,LRP)术后病理对模板引导下经会阴前列腺穿刺活检进行验证。
2013年4月至2015年12月,前瞻性选取行模板引导下系统性经会阴11区前列腺穿刺活检证实为前列腺癌的患者纳入研究。纳入标准:①首次经会阴前列腺穿刺活检证实为前列腺腺癌;②无局部淋巴结或远处转移,临床分期T1c~T3a;③前列腺特异性抗原(PSA)<50 ng/ml;④前列腺癌确诊后未经治疗(包括内分泌治疗、放疗和化疗);⑤无经尿道前列腺切除术史。
活检方法为模板引导下经会阴11区前列腺穿刺活检[10]。采用静脉麻醉或局麻。活检针为18 G一次性活检装置(美国Bard公司),取材长度18 mm。前列腺穿刺区域示意图见
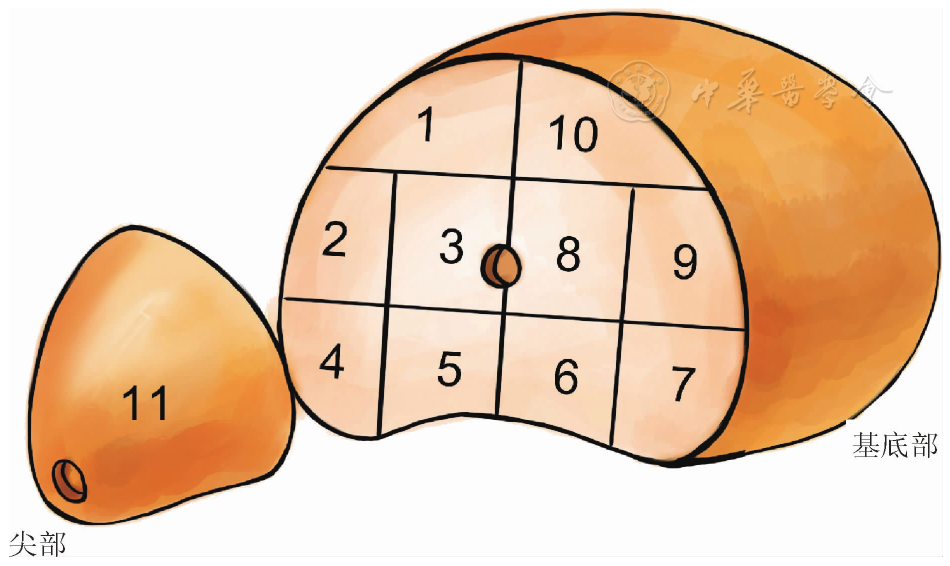
本组患者均由同一术者行LRP。术后离体前列腺标本置于10%中性甲醛中固定48 h。前列腺尖部定义为前列腺最下端至其以上0.5 cm部分;基底部定义为前列腺最上端至其以下1.0 cm部分;尖部和基底部之间为前列腺中部[11]。在前列腺标本表面均匀涂抹蓝色墨水,前列腺尖部或基底部垂直于墨水涂抹的表面切片,层厚约0.2 cm,连同中部的大切片一起送检。病理切片由同一名有10年以上泌尿病理工作经验的病理科医生镜下核对后,利用NanoZoomer 2.0-RS数字切片扫描设备(日本Photon公司)制作成数字切片。在数字切片上勾勒出所有肿瘤的轮廓,计算肿瘤不同分区的面积并行Gleason评分。肿瘤体积计算方法为切片上肿瘤面积之和×切片厚度(大切片为0.4 cm,小切片为0.2 cm)×校正系数1.12[12]。主要肿瘤定义为Gleason评分最高或相同Gleason评分中体积最大的肿瘤[13]。镜下观察到染墨的前列腺切片表面有肿瘤细胞侵犯定义为手术切缘阳性[14]。
前列腺穿刺活检诊断的无临床意义肿瘤包括:①极低危前列腺癌,诊断标准[15]为同时符合Gleason评分≤6分,阳性针数<3针且任何一针肿瘤范围不超过50%,PSA密度<0.15 ng/(ml·cm3);②低危前列腺癌,诊断标准[16]为同时符合Gleason评分≤6分,PSA<10 ng/ml且临床TNM分期≤T2aN0M0。大体病理无临床意义肿瘤定义为肿瘤体积<0.5 ml,Gleason评分≤6分,T2期且切缘阴性[15]。
对于同一前列腺的所有大切片利用Adobe Photoshop CS3软件(美国Adobe Systems公司)重新描绘并利用3D Studio Max 2015软件(美国Autodesk公司)重建前列腺立体模型。前列腺立体模型的俯视图呈现肿瘤在横断面上的分布。若俯视图上肿瘤所对应区域穿刺活检结果阳性则定义为穿刺能发现此肿瘤,反之为穿刺未能发现此肿瘤。
比较LRP术后病理与经会阴前列腺穿刺活检病理,分析主要肿瘤的穿刺活检检出率;以LRP术后病理为金标准,分析经会阴前列腺穿刺活检的敏感性和特异性;分析LRP术后病理Gleason评分相对经会阴前列腺穿刺活检病理的变化,以及两种病理检查对无临床意义肿瘤的检出率。
采用SPSS 19.0统计学软件处理数据。符合正态分布的数据(如患者年龄、平均穿刺最大肿瘤长度和主要肿瘤体积等)采用
本研究共纳入103例患者,年龄(65±6)岁。血清PSA中位值11.7 ng/ml(IQR 7.2~19.1 ng/ml)。前列腺体积中位值33 ml(IQR 26~43 ml)。64例穿刺前行MRI检查,其中48例有异常发现。34例采用静脉麻醉,69例采用局麻。穿刺活检总针数中位值为22针(IQR 15~28针),阳性区中位值3区(IQR 2~5区)。穿刺最大肿瘤长度(0.6±0.4)cm,最大肿瘤百分比(48±30)%。临床分期T1c 50例(48.5%),T2a 15例(14.6%),T2b 10例(9.7%),T2c 25例(24.3%),T3a 3例(2.9%)。Gleason评分6~9分,中位值7分(IQR 6~7分)
103例LRP术后大体病理检出肿瘤总数为281个,每例平均2.7个。肿瘤体积中位值为0.050 ml(IQR 0.007~0.900 ml)。103个主要肿瘤的肿瘤体积中位值为1.2 ml(IQR 0.5~3.3 ml)。103例的Gleason评分分别为6分17例(16.5%),3+4分50例(48.5%),4+3分23例(22.3%),8分4例(3.9%),9分9例(8.7%),中位值7分(IQR 7~7分)。病理分期分别为pT2a 14例(13.6%),pT2b 6例(5.8%),pT2c 58例(56.3%),pT3a 17例(16.5%),pT3b 8例(7.8%)。切缘阳性27例(26.2%),其中前列腺尖部、中部、基底部切缘阳性例数分别为20例(19.4%)、21例(20.3%)、12例(11.7%)。
103个主要肿瘤中,穿刺活检能发现89个(86.4%)。余14个不能发现的主要肿瘤体积为0.007~0.810 ml[(0.3±0.3)ml],其中10个为有临床意义肿瘤,其Gleason评分均>3+4分,3个肿瘤体积>0.5 ml。95个(92.2%)主要肿瘤为同一病例中体积最大肿瘤,8个主要肿瘤体积非同一病例中体积最大肿瘤。17例有包膜侵犯的肿瘤均为体积最大的主要肿瘤。
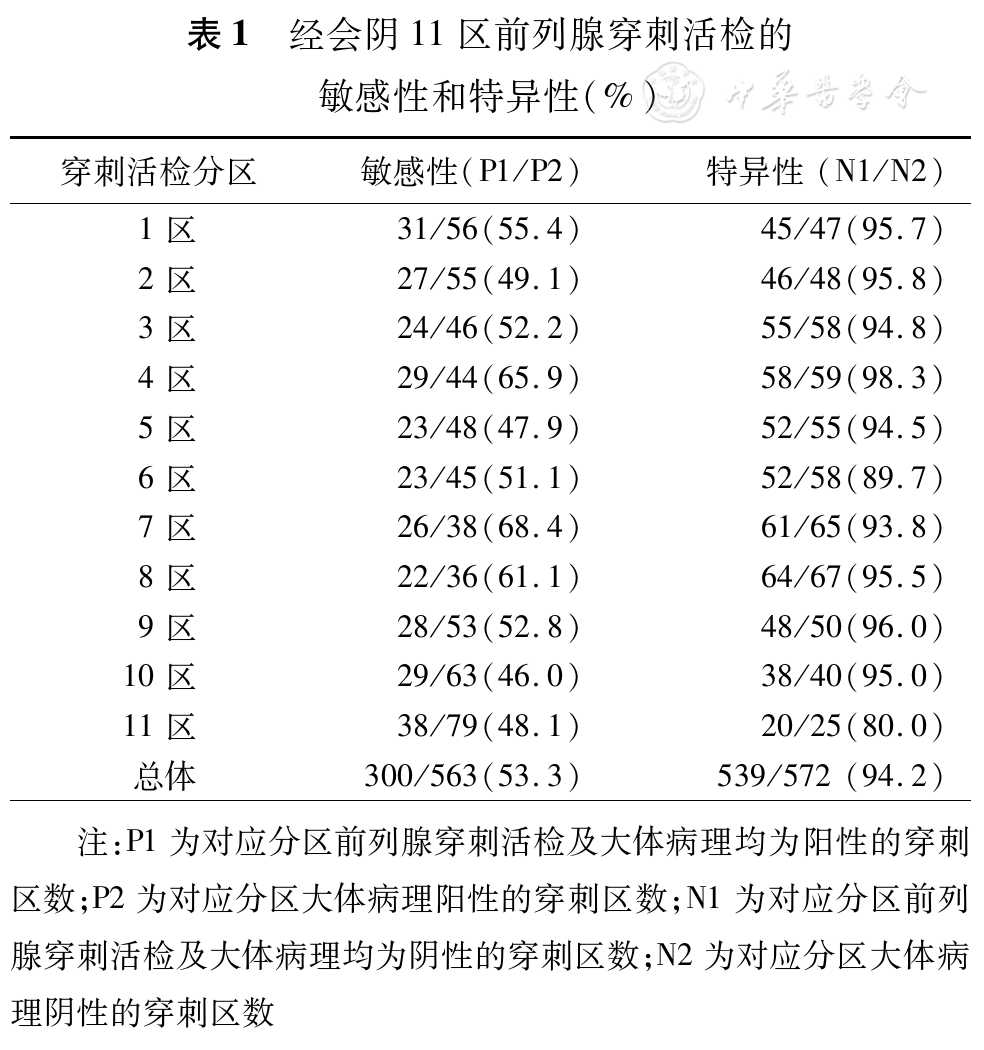
以LRP术后大病理为金标准,经会阴途径活检的总体敏感性为53.3%,特异性为94.2%(
与穿刺活检病理相比,LRP术后病理Gleason评分不变75例(72.8%),升高24例(23.3%),降低4例(3.9%)。其中Gleason评分≥3+4分为86例(83.5%)。
穿刺活检病理诊断的无临床意义肿瘤为20例(19.4%),其中极低危前列腺癌(Epstein无临床意义肿瘤)10例(9.7%)。LRP术后病理检出的281个肿瘤中,无临床意义肿瘤74个(26.3%),肿瘤体积为0.0002~0.4000 ml。20例穿刺活检病理诊断为无临床意义肿瘤中,8例(40.0%)大体病理诊断为无临床意义肿瘤;12例为有临床意义肿瘤,其中8例肿瘤体积>0.5 ml,7例肿瘤Gleason评分≥7分。83例穿刺活检诊断为有临床意义肿瘤中,80例(96.4%)的大体病理诊断为有临床意义肿瘤;3例为无临床意义肿瘤,术前PSA均>10 ng/ml。
与文献报道一致,本研究结果也提示前列腺癌多数为多病灶,其中一个体积最大、通常也是Gleason评分最高的为主要肿瘤,它最终决定肿瘤发展方向[17]。而其他体积小、Gleason评分低的病灶甚至可以认为是非恶性肿瘤[18]。因此对于早期前列腺癌可以行针对主要肿瘤的局部治疗,尽管至今尚缺少长期疗效的研究结果,但中短期疗效还是比较满意的[3,19]。局部治疗需要较精确的穿刺方法,对肿瘤位置、大小尤其是主要肿瘤的定位提出了更高的要求[3,20],目前认可的方法有MRI引导下靶向穿刺或模板引导下经会阴途径前列腺穿刺活检[3]。本研究结果显示,模板引导下经会阴11区穿刺活检(中位穿刺针数22针)可以发现大多数的主要肿瘤,病理结果有一定的参考价值。通常情况下主要肿瘤也是体积最大的肿瘤,本研究中两者的相符率为92.2%(95/103),与Baco等[21]报道的相符率(98%)基本一致。
局部治疗对前列腺穿刺活检的准确定位提出了更高的要求。我们的穿刺方法对肿瘤分区定位的敏感性仅为53.3%,对肿瘤的定位仅能作参考。而Fumadó等[22]报道的12针法模板引导下前列腺穿刺活检结果提示该方法不能作为行前列腺癌局部治疗的依据,该研究中对112例穿刺活检诊断为单侧前列腺癌患者行根治手术,术后病理检查发现1/3的患者对侧前列腺存在有临床意义肿瘤或主要肿瘤。本研究结果显示61例前列腺穿刺活检诊断为单侧前列腺癌者,59%的LRP术后病理诊断为双侧前列腺癌,其中26%为高级别前列腺癌,与Fumadó等[22]报道的结果接近。Huo等[9]分析了414例行模板引导下经会阴系统性12区(22针)穿刺活检证实为前列腺癌患者的根治术后病理,发现该穿刺方法对各区肿瘤定位的敏感性仅为48.0%,特异性为84.1%。本研究结果与Huo等[9]的结果接近,说明平均22.6针的模板引导下经会阴途径前列腺穿刺活检对肿瘤的具体定位仍有不足。因此,优化穿刺方法以更好地定位肿瘤是非常必要的。
近年来,随着筛查手段和治疗理念的进步,越来越多无临床意义肿瘤被发现。本研究的无临床意义肿瘤定义中包括符合NCCN标准[16]的低危前列腺癌和符合Epstein标准[15]的极低危前列腺癌。这些患者适合行主动监测,可以减少前列腺癌的过度治疗,但需要把握好主动监测的适应证。无临床意义肿瘤的认定需要有可靠的诊断方法。Merrick等[4]对131例经直肠途径活检证实的低危(59例)和极低危(72例)前列腺癌患者再次行经会阴途径活检(41~78针),结果显示两组中无肿瘤、极低危或低危前列腺癌患者比例分别为低危组32.2%(19/59),极低危组83.3%(60/72),说明经直肠途径穿刺活检诊断的无临床意义前列腺癌患者中有很大一部分并非真正的无临床意义。本研究结果显示,模板引导下经会阴穿刺活检诊断的20例无临床意义前列腺癌中仅8例LRP术后病理诊断为无临床意义肿瘤,余12例的患者为有临床意义肿瘤。其原因是>50%的患者LRP术后Gleason评分升高至3+4分以上,这种根治术后Gleason评分升高是常见现象[9]。这些病例若采用主动监测有一定的风险,因此我们认为经会阴途径11区前列腺穿刺活检对判断是否为有临床意义肿瘤只能作为参考。MRI-TRUS融合穿刺和MRI引导下实时前列腺穿刺活检可能是优化穿刺活检、提高无临床意义肿瘤诊断准确性、减少无临床意义肿瘤检出率的有效方法[23,24]。但也有文献报道术前MRI检查仍可能漏诊28%的高级别肿瘤以及20%的主要肿瘤[13]。
本研究存在的局限性:首先,11区活检还不够精细,对于肿瘤的空间定位不够精细,应该有更多的分区(如基底部和中部),这一缺陷可能导致对无临床意义肿瘤的诊断和指导局部治疗仅能作为参考。其次,由于研究设计时未将MRI作为必须检查,因此缺少MRI、前列腺穿刺活检、根治术后病理的三者比较。
总之,本研究结果提示,模板引导下系统性经会阴前列腺穿刺活检能检出大部分主要肿瘤,有一定的可靠性。但该方法对各区肿瘤空间定位的敏感性尚存在不足,对无临床意义肿瘤的诊断及指导局部治疗仅能作为参考。该方法有待于进一步优化。
[1] Tosoian JJ, Mamawala M, Epstein JI, et al. Intermediate and longer-term outcomes from a prospective active-surveillance program for favorable-risk prostate cancer[J]. J Clin Oncol, 2015, 33: 3379-3385.
[2] Hayes JH, Ollendorf DA, Pearson SD, et al. Active surveillance compared with initial treatment for men with low-risk prostate cancer:a decision analysis[J]. JAMA, 2010, 304: 2373-2380.
[3] Donaldson IA, Alonzi R, Barratt D, et al. Focal therapy:patients, interventions, and outcomes-a report from a consensus meeting[J]. Eur Urol, 2015, 67: 771-777.
[4] Merrick GS, Delatore A, Butler WM, et al. Transperineal template-guided mapping biopsy identifies pathologic differences between very-low-risk and low-risk prostate cancer:implications for active surveillance[J]. Am J Clin Oncol, 2017, 40: 53-59.
[5] Chang DT, Challacombe B, Lawrentschuk N. Transperineal biopsy of the prostate-is this the future?[J]. Nat Rev Urol, 2013, 10: 690-702.
[6] Crawford ED, Rove KO, Barqawi AB, et al. Clinical-pathologic correlation between transperineal mapping biopsies of the prostate and three-dimensional reconstruction of prostatectomy specimens[J]. Prostate, 2013, 73: 778-787.
[7] Baco E, Rud E, Eri LM, et al. A randomized controlled trial to assess and compare the outcomes of two-core prostate biopsy guided by fused magnetic resonance and transrectal ultrasound images and traditional 12-core systematic biopsy[J]. Eur Urol, 2016, 69: 149-156.
[8] Bittner N, Merrick GS, Butler WM, et al. Incidence and pathological features of prostate cancer detected on transperineal template guided mapping biopsy after negative transrectal ultrasound guided biopsy[J]. J Urol, 2013, 190: 509-514.
[9] Huo AS, Hossack T, Symons JL, et al. accuracy of primary systematic template guided transperineal biopsy of the prostate for locating prostate cancer:a comparison with radical prostatectomy specimens[J]. J Urol, 2012, 187: 2044-2049.
[10] 严维刚,周毅,周智恩, 等. 模板引导下经会阴前列腺穿刺活检10年经验总结[J]. 中华泌尿外科杂志, 2015, 36: 39-43.
[11] D′Amico AV, Davis A, Vargas SO, et al. Defining the implant treatment volume for patients with low risk prostate cancer:does the anterior base need to be treated?[J]. Int J Radiat Oncol Biol Phys, 1999, 43: 587-590.
[12] Perera M, Lawrentschuk N, Bolton D, et al. Comparison of contemporary methods for estimating prostate tumour volume in pathological specimens[J]. BJU Int, 2014, 113: 29-34.
[13] Le JD, Tan N, Shkolyar E, et al. Multifocality and prostate cancer detection by multiparametric magnetic resonance imaging:correlation with whole-mount histopathology[J]. Eur Urol, 2015, 67: 569-576.
[14] Richters A, Derks J, Husson O, et al. Effect of surgical margin status after radical prostatectomy on health-related quality of life and illness perception in patients with prostate cancer[J]. Urol Oncol, 2015, 33: e9-e15.
[15] Epstein JI, Walsh PC, Carmichael M, et al. Pathologic and clinical findings to predict tumor extent of nonpalpable (stage T1c) prostate cancer[J]. JAMA, 1994, 271: 368-374.
[16] Mohler JL, Armstrong AJ, Bahnson RR, et al. Prostate cancer, Version 3.2012:featured updates to the NCCN guidelines[J]. J Natl Compr Canc Netw, 2012, 10: 1081-1087.
[17] Ahmed HU. The index lesion and the origin of prostate cancer[J]. N Engl J Med, 2009, 361: 1704-1706.
[18] Ahmed HU, Arya M, Freeman A, et al. Do low-grade and low-volume prostate cancers bear the hallmarks of malignancy? [J]. Lancet Oncol, 2012, 13: e509-517.
[19] Ahmed HU, Dickinson L, Charman S, et al. Focal ablation targeted to the index lesion in multifocal localised prostate cancer:a prospective development study[J]. Eur Urol, 2015, 68: 927-936.
[20] Singh PB, Anele C, Dalton E, et al. Prostate cancer tumour features on template prostate-mapping biopsies:implications for focal therapy[J]. Eur Urol, 2014, 66: 12-19.
[21] Baco E, Ukimura O, Rud E, et al. Magnetic resonance imaging-transectal ultrasound image-fusion biopsies accurately characterize the index tumor:correlation with step-sectioned radical prostatectomy specimens in 135 patients[J]. Eur Urol, 2015, 67: 787-794.
[22] Fumadó L, Cecchini L, Juanpere N, et al. Twelve core template prostate biopsy is an unreliable tool to select patients eligible for focal therapy[J]. Urol Int, 2015, 95, 197-202.
[23] Siddiqui MM, Rais-Bahrami S, Turkbey B, et al. Comparison of MR/ultrasound fusion-guided biopsy with ultrasound-guided biopsy for the diagnosis of prostate cancer[J]. JAMA, 2015, 313: 390-397.
[24] Thompson JE, Moses D, Shnier R, et al. Multiparametric magnetic resonance imaging guided diagnostic biopsy detects significant prostate cancer and could reduce unnecessary biopsies and over detection: a prospective study[J]. J Urol, 2014, 192: 67-74.