肾上腺嗜酸细胞腺瘤CT和MRI表现特征分析
2018年4期
中华泌尿外科杂志,第39卷第4期 第289页-第293页
张丽红,王林省,陈东风,陈月芹,李娴,郭静
肾上腺嗜酸细胞腺瘤(adrenal oncoctyoma,AOC)是一种少见的肾上腺肿瘤[1,2,3,4,5,6,7,8]。国内外有关其影像学表现的报道较少,多为病例报告[9,10,11,12]。因缺少系统研究,对其影像学表现认识不足,临床上AOC的误诊率较高[1,7]。此外,AOC具有恶性倾向,术前正确诊断有助于评估患者的预后情况[2,10]。我们回顾性分析2006年3月至2017年8月济宁市第一人民医院(3例)和济宁医学院附属医院(8例)经手术病理证实的11例AOC患者的临床资料,结合病理资料,分析其影像学表现特征,以提高对该肿瘤的认识。
本组11例。男3例,女8例。年龄24~65岁,平均46.8岁。2例因肥胖、体重增加就诊,其余9例均为体检发现。入院后实验室检查示2例皮质醇明显升高。11例均否认有肿瘤病史及家族史。
本组11例中,误诊为腺瘤6例,嗜铬细胞瘤3例,神经鞘瘤及节细胞神经瘤各1例。
11例均行CT平扫,其中9例同时行增强扫描。采用德国西门子公司Siemens Emotion 16排和美国通用公司Light Speed 64层螺旋CT扫描仪。CT平扫及增强扫描均利用螺旋扫描方式进行,层厚5 mm,层间距5 mm。螺距采用1.0和1.375,管电压120 kV,管电流300 mA。患者经肘前静脉以3.0 ml/s的流速注射碘海醇或碘普罗胺(碘300 mg /ml)90~100ml(1.5 mg/kg)后35~40 s、60~73 s、300~480 s行动脉期、静脉期及延迟期扫描。扫描完成后,利用层厚0.750 mm和0.625 mm重建。检查时用铅衣遮盖生殖器官。
8例采用德国西门子公司1.5T MRI扫描仪,采用快速自选回波T2WI [重复时间(time of repeatation,TR) 4 300 ms,回波时间(time of echo,TE) 92 ms,矩阵384×288],T2WI压脂相(TR 3 300 ms,TE 80 ms,矩阵320×240)分别行轴位和冠状位扫描,快速自选回波T1WI(TR 235 ms,TE 4.76 ms,矩阵320×256),反相位(TR 235 ms,TE 2.38 ms,矩阵320×256)。弥散加权(b值=1 000)(TR 5 916.81ms,TE 78 ms,矩阵320×256)。
由2位有10年以上工作经验的副主任以上职称的影像诊断医师共同对所有CT和MRI图像进行回顾性分析,评价肿瘤的侧别、形态、大小、密度(与肾皮质密度比较)、信号(与腰大肌比较)、边缘、强化程度和方式、病灶与周围结构关系。意见不一致时进行协商取得一致意见。瘤灶强化情况描述采用以下标准:①当静脉期病灶密度与肾上腺密度比值低于动脉期该比值时称为早期快速廓清,而静脉期病灶密度与肾上腺密度比值大于动脉期时称为延迟强化;②根据强化均匀程度分为均匀强化和不均匀强化;③根据瘤灶CT检查强化程度分为轻度强化(CT值增加<20 HU)、中度强化(CT值增加≥20 HU、<40 HU)、明显强化(CT值增加≥40 HU),根据MRI强化程度分为轻度强化(与邻近腰大肌强化幅度相似)、明显强化(强化幅度与健侧肾上腺相似或更显著)、中度强化(介于两者之间)。
由2位经验丰富的病理科医师读片,结果不一致时协商达成一致。
依照Bisceglia等[2]提出的嗜酸细胞瘤病理分类评分标准。主要诊断标准:有丝分裂相>5个/50个高倍视野,非典型有丝分裂,静脉浸润。次要诊断标准:肿瘤直径>5 cm和/或质量>200 g,组织坏死,包膜浸润,血窦浸润。均不符合主要及次要诊断标准者视为良性;当符合≥1个次要诊断标准视为具有恶性倾向,当符合≥1个主要诊断标准视为恶性。
11例(13枚)中,10例为单发(
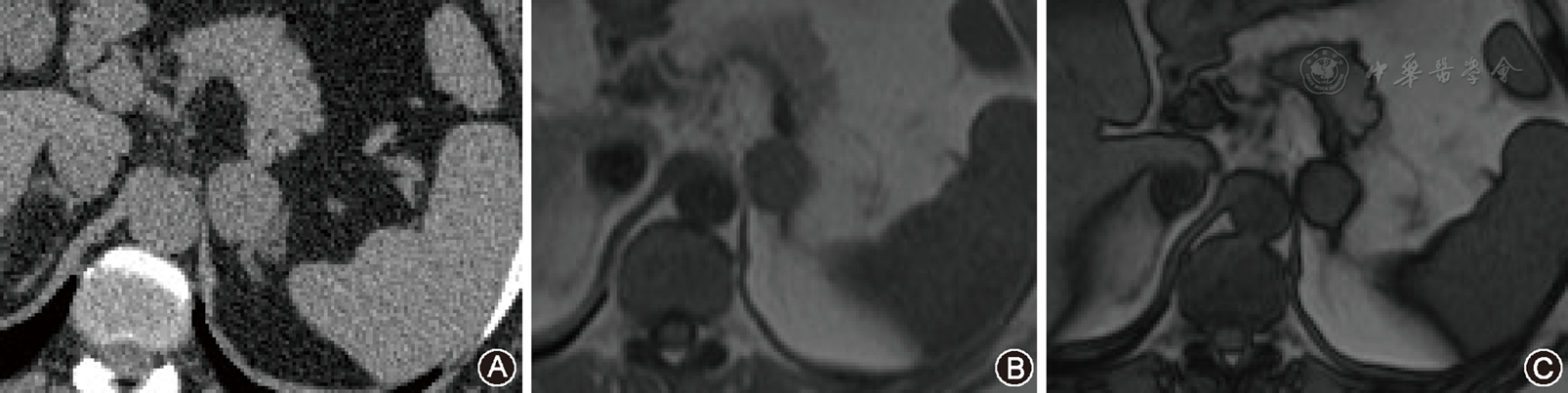
11例中,8例MRI平扫(与腰部肌肉信号比较)T1WI呈等信号或略低信号(
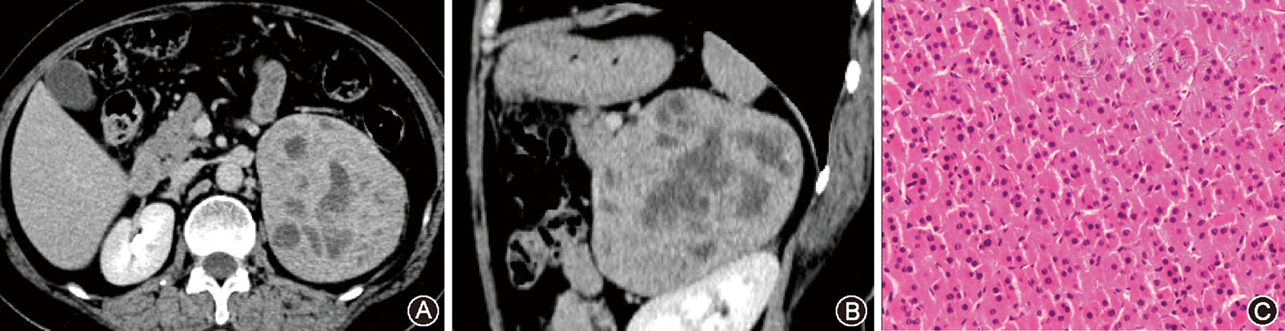
肉眼观察:11例肿块切面呈灰黄色或灰红色,均有完整纤维包膜,4例瘤内可见囊变坏死区,1例瘤内见局灶性钙化灶。镜下嗜酸性肿瘤细胞弥漫分布于整个肿瘤组织,瘤细胞呈巢状、腺状或索状分布(
术后随访3~47个月,11例均无复发及转移。
AOC属于少见病,常发生于女性,发病年龄为27~72岁,左侧多于右侧[1,10]。AOC多无功能,常在体检时偶然发现,部分可有内分泌异常,以Cushing综合征、男性女性化或女性男性化常见,所占比率为17%~50%[3,9]。实验室检查可有皮质醇、醛固酮、睾酮等激素分泌增高表现[9]。本组结果与文献报道基本相似。
组织学上AOC多有完整纤维包膜,瘤内出血、坏死及囊变少见[3]。光镜下瘤细胞大小一致,具有低脂滴嗜酸性胞质,核居中,排列成巢状、管状。肿瘤间质丰富,主要由纤维结缔组织和数量不等的血管构成。AOC很少有核分裂象。免疫组化染色检查示大多数瘤细胞的抗线粒体抗体强阳性,可表现为MES-13强阳性,波形蛋白阳性,CK阴性[1,12]。本组资料与文献报道基本一致,但本组资料中瘤内囊变坏死率较高,占30.7%(4/13),其肿瘤直径均超过5.0 cm,可能与肿瘤较大,瘤内供血不足有关。
AOC多表现为良性,少数可有恶性倾向或为恶性。许敬平等[9]回顾性分析18例AOC的资料发现其良性、恶性倾向和恶性所占比分别为66.7%、27.8%和5.5%;本组资料中良性和恶性倾向比率为69.3%和30.7%,无恶性AOC,可能与病例较少及恶性肿瘤发生率较低有关。对AOC性质的判断标准目前主要参考Bisceglia等[2]提出的病理评估系统,尽管恶性AOC具有邻近器官侵袭及转移特征,但与肾上腺腺癌相比预后较好。本组中4例恶性倾向病例术后随访均无肿瘤复发或转移,支持该瘤预后良好的特征[3]。
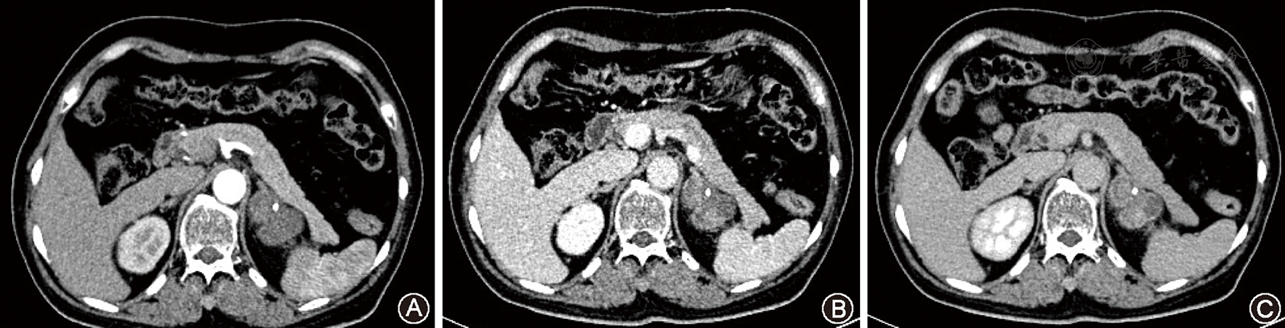
关于AOC的影像资料报道较少[4,10,11,12],缺少大宗病例报道。我们结合文献总结其影像学表现如下:AOC多为单发性病变,少数可以多发,本组中有1例单侧多发,约占9.1%。AOC CT平扫常表现为边界清晰、圆形或类圆形、均匀软组织密度影,与组织学上其细胞内缺少脂质、瘤内少囊变坏死有关。该特征与肾上腺富含脂质的腺瘤明显不同,富含脂质的腺瘤密度值多低于20 HU,部分CT值为负值[10]。AOC瘤体较大时瘤内可出现低密度囊变、坏死区,其纤维包膜在CT平扫上呈软组织密度影,常不易显示,增强扫描常呈较明显延迟强化,部分学者认为纤维包膜是AOC特征性CT表现[12],但大量文献显示肾上腺多数肿瘤均具有完整包膜[10,13,14],因此,我们认为其并不具有特征性。此外,与肾嗜酸细胞腺瘤瘤内常合并瘢痕组织不同[15],既往文献[1,3,4,5,6,7,8,9,10,11,12]及本组资料显示AOC内均无瘢痕组织,可能与AOC生长部位不同有关,尚有待进一步研究。本组病理资料显示因AOC瘤内间质含有血管成分多少不一,致使其增强程度亦表现不一,以中度及明显强化常见,与游瑞雄等[10]报道相似,但与既往文献报道的AOC属于乏血供肿瘤不同[4],分析原因可能与病例较少有关。多期增强扫描肿瘤实质呈延迟强化的特征,其强化峰值位于静脉期,尚未见相似文献报道,可能与其未行多期增强扫描有关[4,10,11,12]。AOC与肾嗜酸细胞腺瘤强化方式相似[15],这可能与瘤内存在丰富疏松的间质纤维成分,对比剂在瘤内扩散有迟滞作用有关。该征象与肾上腺腺瘤快速廓清的强化特征明显不同[10],是AOC强化特征之一。良性AOC瘤周脂肪间隙清晰,无肿大淋巴结及邻近脏器受侵征象,但少数恶性AOC可有周围侵犯或远处转移征象[4]。本组中7例为良性,4例具有恶性倾向,但均无包膜浸润、邻近结构侵犯及远处转移的征象。
本组MRI资料显示,与腰大肌信号比较,AOC实质在T1WI常表现为边界清晰、信号均匀的等或略低信号,在T2WI上呈均匀高信号或以高信号为主的混杂信号,瘤内信号不均匀与瘤内的实质和间质分布不均及囊变坏死有关。既往文献[4,11,12]及本组组织学检查结果显示AOC瘤细胞内常缺乏脂质,其在MRI反相位图像上信号常无改变,这与肾上腺腺瘤明显不同;肾上腺腺瘤(细胞内多存在丰富脂质)在MRI反相位图像上肿瘤信号常有不同程度减低[12]。本组资料显示AOC弥散加权像上常有轻度扩散受限,与孟晓岩等[12]的报道相似。既往文献[11,12]及本组资料显示肿瘤纤维包膜在T1WI和T2WI上多呈低信号,AOC包膜及实质部分在MRI增强扫描图像上与其CT强化方式相似,均表现为中度至明显延迟强化特征,较大肿块因瘤内存在囊变坏死而呈不均匀强化。
AOC术前误诊率较高,本组资料术前均被误诊,其中以腺瘤最为多见,约占54.5%(6/11),其次是嗜铬细胞瘤,约占27.3%(2/11),神经鞘瘤及节细胞神经瘤最少。因本病具有恶性倾向,其治疗方式及术后随访与肾上腺其他肿瘤存在差异,因而有必要与其相鉴别。①肾上腺腺瘤:瘤细胞内多含有脂质,其密度较低,CT值-20~20 HU;MRI反相位图像上常有信号减低,多期增强扫描快速廓清[10];与AOC在CT平扫上常表现为软组织密度、MRI反相位无信号减低且多期增强扫描呈延迟强化明显不同,两者易于鉴别。对于乏脂的腺瘤,主要靠强化方式的差异鉴别。②嗜铬细胞瘤:多为功能性,具有典型的临床表现和内分泌异常,且瘤内常合并出血、坏死及囊变,CT平扫均表现为密度及信号不均匀,增强扫描动脉期强化明显[16],临床表现和强化方式的差异有助于两者鉴别。③神经鞘瘤:临床上无内分泌异常[14],与功能性AOC易于鉴别,但与非功能性AOC不易鉴别,两者影像学表现具有相似性,需借助于组织学检查。④肾上腺皮质腺癌:形态不规则、密度及信号不均匀且常有邻近结构侵犯破坏及周围淋巴结转移[10],与良性AOC易于鉴别,但与恶性AOC不易鉴别,需靠组织学检查确诊。
综上所述,AOC是一种少见的具有恶性倾向的良性肾上腺肿瘤,可伴有内分泌异常的改变。病理上肿瘤具有完整包膜,瘤细胞内含脂质较少。其CT平扫表现为边界清楚的软组织密度影,MRI同反相位图像上信号无改变;多期增强扫描常表现为较明显不均匀延迟强化的特征。临床工作中当发现肾上腺上述影像学特征时应考虑到AOC的可能。
[1] Mearini L, Del Sordo R, Costantini E,et al.Adrenal oncocytic neoplasm: a systematic review[J]. Urol Int, 2013,91:125-133.
[2] Bisceglia M, Ludovico O, Di Mattia A,et al.Adrenocortical oncocytic tumors: report of 10 cases and review of the literature[J]. Int J Surg Pathol,2004,12:231-243.
[3] Wong DD, Spagnolo DV, Bisceglia M,et al.Oncocytic adrenocortical neoplasms-a clinicopathologic study of 13 new cases emphasizing the importance of their recognition[J]. Hum Pathol,2011,42:489-499.
[4] 李永伟,杨嗣星,夏樾,等.巨大肾上腺皮质嗜酸细胞腺瘤(附1例报告)[J].国际泌尿系统杂志,2010,30:629-630.
[5] 丁雪飞,周广臣.肾上腺皮质嗜酸细胞腺瘤一例[J].中华医学杂志,2011,91:2687.
[6] Xiao GQ, Pertsemlidis DS, Unger PD.Functioning adrenocortical oncocytoma: a case report and review of the literature[J]. Ann Diagn Pathol,2005,9:295-297.
[7] 田晓军,马潞林,肖春雷,等.肾上腺嗜酸细胞腺瘤一例报告并文献复习[J]. 中华泌尿外科杂志,2007,28:460-462.
[8] 宋伟,杨金瑞,易路,等.肾上腺嗜酸细胞腺瘤一例[J].中华肿瘤杂志,2010,32:319.
[9] 许敬平,吴红花,高燕明,等. 18例肾上腺皮质嗜酸细胞腺瘤患者的临床特征[J]. 中华内分泌代谢杂志,2011,27:14-16.
[10] 游瑞雄,余德君,张宇阳. 肾上腺嗜酸细胞腺瘤的CT表现[J].临床放射学杂志,2014,33:1879-1882.
[11] Gandras EJ, Schwartz LH, Panicek DM,et al.Case report.Adrenocortical oncocytoma:CT and MRI findings[J]. J Comput Assist Tomogr,1996,20:407-409.
[12] 孟晓岩,陈晓,李晓娟,等.肾上腺嗜酸细胞腺瘤两例[J].放射性实践,2017,32: 92-93.
[13] Hamrahian AH, Ioachimescu AG, Remer EM,et al.Clinical utility of noncontrast computed tomography attenuation value (hounsfield units) to differentiate adrenal adenomas/hyperplasias from nonadenomas: Cleveland Clinic experience[J]. J Clin Endocrinol Metab,2005,90:871-877.
[14] 夏丽莹,王传卓,周大昕,等. 肾上腺神经鞘瘤的CT和MRI表现[J].中国医学影像技术,2015,31:110-114.
[15] 李清海,侯君,严福华. 肾嗜酸细胞腺瘤的影像学表现与病理对照分析[J].中华放射学杂志,2008,42:97-99.
[16] 周建军,曾蒙苏,严福华,等.多发嗜铬细胞瘤的CT诊断价值[J].放射性实践,2008,23:1321-1324.