炎症微环境下线粒体融合蛋白2及其介导的内质网-线粒体偶联对牙周膜干细胞成骨分化能力的影响
2018年7期
中华泌尿外科杂志,第53卷第7期 第453页-第458页
翟启明,李蓓,王智伟,刘露,金岩,金钫
牙周炎是一种慢性炎症性疾病,主要表现为牙周支持组织的持续性破坏,最终导致牙齿丧失;还可诱发或导致内分泌、心血管等多种全身系统性疾病,危害口腔及全身健康。目前牙周病的治疗手段主要通过去除致病菌斑及牙石以控制疾病发展,对已经发生的牙周支持组织丧失则无法修复。牙周膜中存在一类间充质干细胞——牙周膜干细胞(periodontal ligament stem cells,PDLSC),这些细胞具有良好的自我更新和再生能力[1]。以往研究发现,牙周炎来源的PDLSC成骨分化能力与正常组织来源的PDLSC相比明显降低,导致其再生能力下降[2]。因此,明确炎症PDLSC再生能力下降的调控机制是解决牙周炎组织缺损修复再生的关键。
线粒体与内质网在细胞的生命活动中联系密切。内质网膜与线粒体膜在特定部位存在特殊的物理连接,称为内质网-线粒体结构偶联[3]。线粒体融合蛋白2(mitofusin 2,Mfn2)在结构偶联处富集,存在于线粒体外膜及内质网膜上,具有直接介导内质网与线粒体偶联的重要作用[4]。线粒体-内质网结构偶联与钙信号调控、线粒体形态调控、内质网应激等都有密切联系[5]。Xue等[6]研究表明,炎症微环境中PDLSC出现内质网应激导致其成骨分化能力下降。本研究通过在透射电镜及共聚焦显微镜下观察对比健康及炎症来源PDLSC中内质网与线粒体偶联结构,在分子水平进一步证明内质网-线粒体偶联结构是否发生改变,探讨内质网与线粒体偶联及Mfn2在PDLSC中对其成骨分化能力的影响,为促进牙周炎患者牙周组织再生提供理论基础和治疗靶点。
本研究时间为2016年6月至2017年12月。研究经过第四军医大学口腔医学院伦理委员会的批准(批准号:IRB-REV-2015005)。所有受试者均签署了知情同意书。
α-最小必需培养基(α-minimum essential medium,α-MEM)、L-谷胺酰胺、磷酸盐缓冲液(phosphate buffered saline,PBS)、1 000 U/ml青霉素及链霉素(Gibco,美国);胰蛋白酶(Amresco,美国);胎牛血清(杭州四季青生物工程有限公司);Ⅰ型胶原酶、β-甘油磷酸钠、维生素C、地塞米松、茜素红、肿瘤坏死因子α(tumor necrosis factor alpha,TNF-α)(Sigma,美国);小干扰RNA Mfn2(siMfn2)(Santa Cruz,美国);总RNA提取试剂(Trizol Regent,Life Technologies,美国);cDNA反转录试剂盒及实时荧光定量PCR(quantitative real-time PCR,qPCR)试剂盒(Takara,日本);线粒体绿色荧光探针(Mito-Tracker Green)、内质网红色荧光探针(ER-Tracker Red)、Lipo6000?转染试剂(上海碧云天生物技术有限公司)。
CO2恒温培养箱(Thermo,美国);体式显微镜、倒置相差显微镜及照相系统、激光共聚焦显微镜(Olympus,日本);6孔板、平底96孔板(Falcon,美国);酶联免疫检测仪(Thermo,美国);CFX96 qPCR仪(Bio-Rad,美国);透射电镜(FEI,美国)。
由第四军医大学口腔医学院口腔颌面外科门诊收集18~35岁正常(因正畸或阻生原因拔除)及牙周炎牙齿(因牙周炎拔除)各9颗。牙周炎患牙纳入标准:附着丧失>1 mm,探诊深度>3 mm,X线片显示牙槽骨吸收至釉质牙骨质界1/3以下;PBS冲洗50~100次,刮取牙周膜组织,加入Ⅰ型胶原酶,37 ℃消化1 h后用含10%胎牛血清的α-MEM终止消化,1 200 r/min离心5 min(离心半径14.5 cm),弃上清液。α-MEM培养基(含10%胎牛血清、100 U/ml青霉素,100 U/ml链霉素)重悬后接种于6孔板,恒温37 ℃、5% CO2孵箱中培养。待细胞爬出组织块,获取原代牙周膜细胞。
取原代细胞,PBS洗2次,0.25%胰蛋白酶消化2 min,加入等量或过量含10%胎牛血清的α-MEM细胞培养液停止消化,吹离细胞并收集于离心管中,1 200 r/min离心5 min(离心半径14.5 cm)后弃上清液,加入α-MEM培养基重悬,将细胞密度调整至10个/ml,以0.1 ml/孔接种至96孔板,在上述培养箱中孵育。细胞贴壁后选择含单细胞的孔进行标记,加入0.1 ml培养液,每2~3天换液1次。当细胞生长汇合度达1/2时,消化并混合多孔单克隆的细胞悬液,扩大培养。本实验使用第2至4代PDLSC。用常规流式细胞仪检测原代PDLSC的干细胞表型。
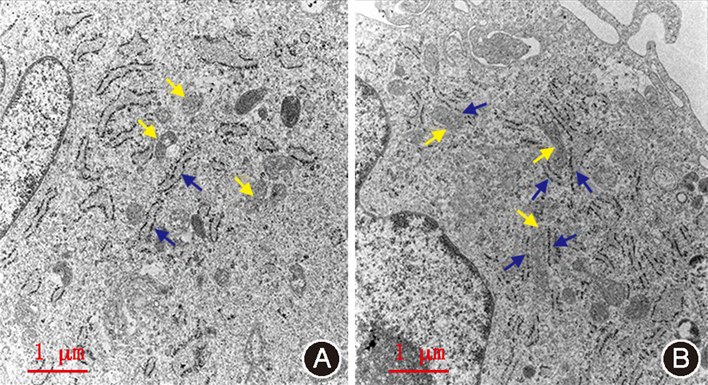
分别选取第3代H-PDLSC及P-PDLSC,将其消化离心收集于1.5 ml EP管内,2.5%戊二醛固定,4 ℃下保存,送至第四军医大学口腔医学院电镜中心检测。应用Image Pro Plus 6.0(Media Cybernetics,美国)进行线粒体及内质网测绘分析。制作透射电镜样本,每个样本选10张切片,每张切片选3个视野,应用Image Pro Plus 6.0在每个视野中分别描绘并测量内质网、线粒体周长及内质网-线粒体偶联部分长度,分别用内质网-线粒体偶联长度与线粒体及内质网周长之比,作为透射电镜下内质网-线粒体偶联水平的指标。
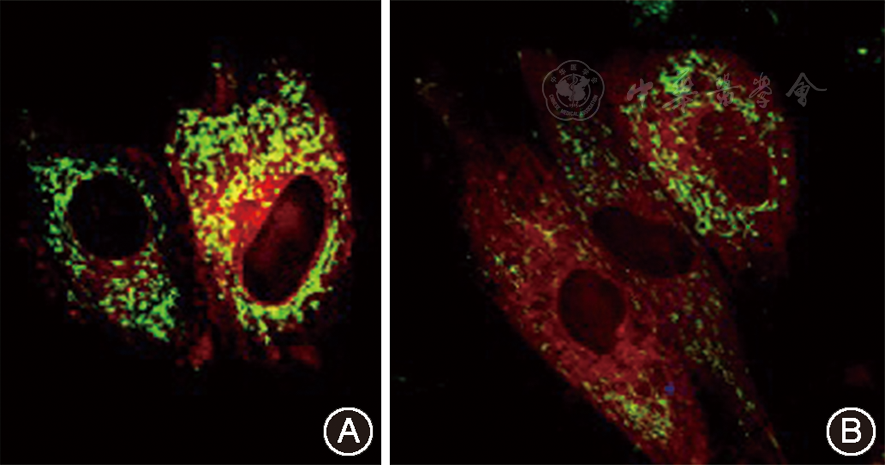
去除细胞培养液,PBS洗涤2次后吸弃洗涤液,加入ER-Tracker Red、Mito-Tracker Green染色工作液,与细胞37 ℃共孵育20~25 min,去除染色液,PBS反复洗涤,激光共聚焦显微镜下观察内质网及线粒体染色情况,应用Image Pro Plus 6.0进行共定位分析。
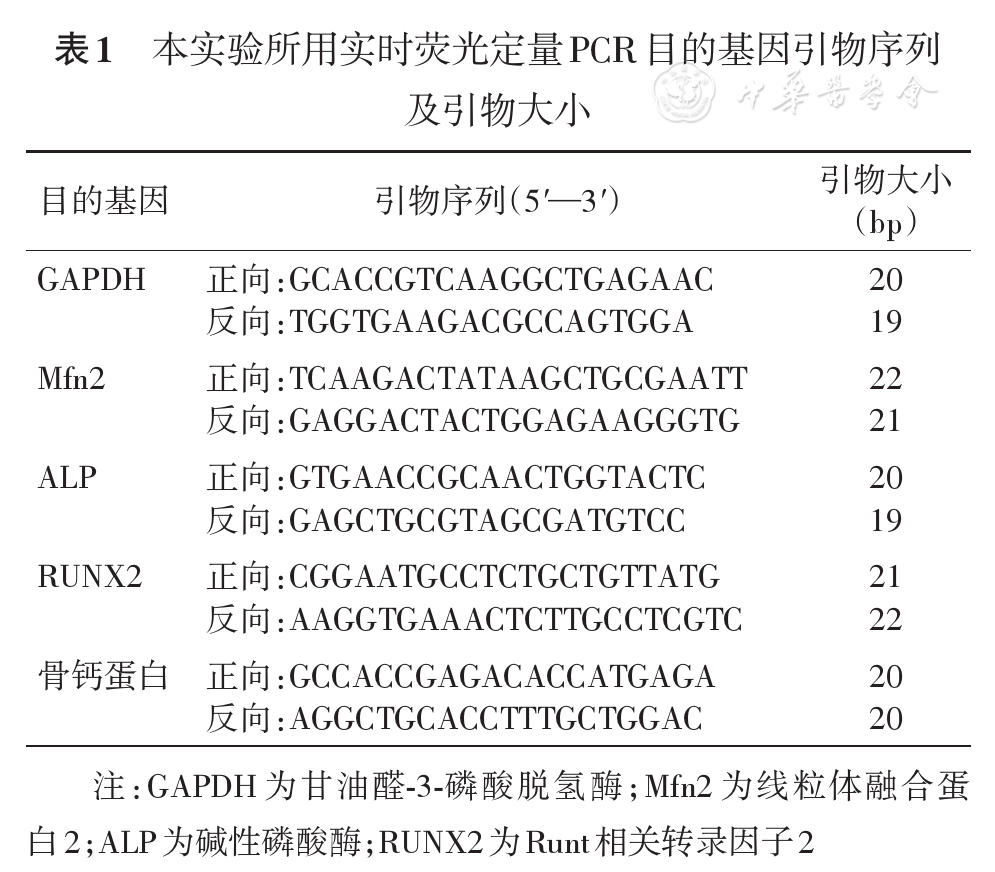
取第4代H-PDLSC及P-PDLSC,消化离心后传代至6孔板,在H-PDLSC中分别加入0、5、10 mg/L TNF-α,细胞汇合度达80%后收集,用Trizol一步法抽提总RNA,反转录合成cDNA,观察对比H-PDLSC与P-PDLSC,H-PDLSC、H-PDLSC+TNF-α(5 mg/L)与H-PDLSC+TNF-α(10 mg/L)组中Mfn2表达,PCR引物序列见
转染前将细胞接种至6孔板,待细胞达90%~95%汇合时,转染前2 h换无血清无双抗培养液。以Lipo6000TM转染试剂为载体,实验组转入siMfn2,对照组仅加入Lipo 6000,6 h后终止转染。24~48 h后提取RNA检测其干扰效率。干扰24 h后换成骨诱导培养基诱导(地塞米松100 nmol/L、含10%胎牛血清的α-MEM、维生素C 50 mg/L、β甘油磷酸钠10 mmol/L)。每组分别重复3个孔。成骨诱导7 d时提取两组RNA,qPCR检测Runt相关转录因子2(Runt-related transcription factor-2,RUNX2)、碱性磷酸酶(alkaline phosphatase,ALP)和骨钙素成骨相关基因的表达。成骨诱导28 d进行茜素红染色及氯化十六烷基吡啶定量:60%异丙醇室温固定5 min,用ddH2O水化处理细胞2 min,染色1 min,ddH2O冲洗2次,大体及镜下观察矿化结节形成情况。照相后每孔加入500 μl氯化十六烷基吡啶,充分溶解。在96孔板中每组6个复孔,每孔加入150 μl,酶联免疫检测仪检测562 nm处吸光度值。
用SPSS 16.0统计软件对结果数据进行统计学分析,本实验中所有数据均采用K-S法进行正态性检验,结果为P>0.05,数据均符合正态分布。两组间比较采用两独立样本t检验,多组间比较采用单因素方差分析,组间两两比较采用Dunnett分析法,结果以"
原代H-PDLSC中CD105、CD90、CD45及CD34阳性率分别为99.90%、99.01%、0.10%及0.22%;P-PDLSC中CD105、CD90、CD45及CD34阳性率分别为99.06%、99.09%、0.12%及0.32%。本实验所检测的PDLSC中,间充质干细胞标志物CD105、CD90呈强阳性表达,造血系统来源细胞表面标志物CD45、CD34呈阴性表达,说明本实验分离培养的PDLSC为间充质干细胞。
P-PDLSC组内质网-线粒体偶联部分的长度与所在切面内质网及线粒体周长之比均显著高于H-PDLSC组(P<0.01,
qPCR结果显示,P-PDLSC组介导内质网线粒体偶联的关键蛋白Mfn2表达增加,P-PDLSC组Mfn2表达量(1.46±0.10)显著高于H-PDLSC组Mfn2表达量(0.99±0.08)(n=9,t=11.070,P=0.000)。
5和10 mg/L TNF-α刺激H-PDLSC 7 d后qPCR结果显示,H-PDLSC+TNF-α(5 mg/L)组Mfn2表达量(1.28±0.19)及H-PDLSC+TNF-α(10 mg/L)组Mfn2表达量(1.54±0.43)均显著高于H-PDLSC组(0.82±0.14)(n=9,F=15.113,P=0.000)。
见
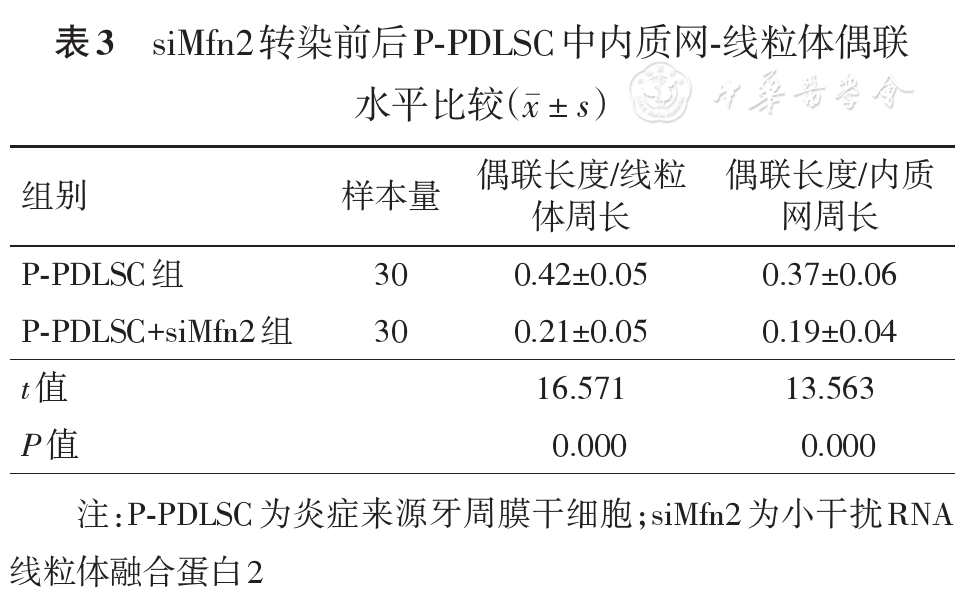
P-PDLSC+siMfn2组成骨相关基因ALP、RUNX2及骨钙蛋白mRNA的表达量均显著高于P-PDLSC组(P<0.01,
近年来越来越多的研究表明,内质网-线粒体偶联与众多疾病的病理过程密切相关。已有大量研究报道,内质网-线粒体偶联结构与功能的紊乱可能是神经退行性疾病、肿瘤、肥胖及心血管等疾病发生的重要先兆。有研究表明,炎症刺激可以使细胞启动内质网应激过程,以应对不良环境中的物质合成及代谢紊乱。内质网是细胞钙库,在细胞受到外界刺激时释放钙离子,而由于线粒体在空间位置上与内质网接近,能吸收大量钙离子[7]。此外,这种内质网-线粒体偶联结构与线粒体的分裂融合过程密切相关。在线粒体即将分裂时,内质网小管与线粒体紧密接触,包裹线粒体,并使其局部被压缩从而启动分裂[8]。因此,内质网与线粒体偶联的存在为实现细胞器的物质交流、信号转导及调控细胞器的生物学行为提供了重要的结构基础。以往研究表明,炎症微环境中PDLSC内质网应激水平显著增强,且能进一步调控PDLSC的成骨分化能力[6,9],说明PDLSC的成骨分化能力在受多种信号通路调控的同时[10,11],更可能与细胞器的活动有直接相关关系。然而,在此过程中内质网-线粒体偶联是否参与PDLSC的炎症应答反应,以及是否能进一步调控PDLSC的成骨分化尚不清楚。
电子显微镜和荧光显微镜是研究内质网-线粒体偶联的主要手段。透射电镜下可见内质网与线粒体毗邻,但二者细胞器膜并不发生融合,结构偶联不连续,以相互簇拥的形式呈现[12]。荧光显微镜下内质网与线粒体某些区域位置高度重合,彼此"叠加"[13]。这种共定位性是由于其特定的物理连接起作用。因此,本实验通过透射电镜直接观察内质网与线粒体结构,并分别用红绿细胞器特异性荧光探针标记显示内质网与线粒体,首先可直接观察到P-PDLSC中内质网与线粒体簇拥密集度增加,以及代表两种细胞器的红绿两色叠加率显著增加;其次,通过软件测量及半定量分析偶联结构与内质网及线粒体膜长度之比,反映其毗邻程度,通过荧光共定位反应其叠加程度。本实验在物理结构水平证明:与H-PDLSC相比,P-PDLSC的内质网-线粒体偶联水平显著增强。
Mfn2在结构偶联处富集,其不仅存在于线粒体,也存在于内质网。位于线粒体外膜和内质网膜上的两个Mfn2分子形成二聚体,对内质网-线粒体偶联结构起重要的物理连接作用。de Brito和Scorrano[14]研究发现,Mfn2基因敲除后线粒体-内质网结构偶联间距变大,并可导致线粒体和内质网形态异常。本实验同样检测正常及炎症来源PDLSC中Mfn2的表达量,并进一步应用炎症刺激因子TNF-α模拟炎症微环境,结果显示炎症来源及炎症因子刺激下的PDLSC中Mfn2表达升高,从分子水平再次验证了炎症微环境可使PDLSC的内质网-线粒体偶联水平增加。以往研究表明,炎症来源的PDLSC成骨分化能力下降[2],但内质网-线粒体偶联的改变是否与其成骨分化能力下降有关尚不明确。本实验通过siMfn2下调P-PDLSC中Mfn2的表达量,Mfn2表达量下调后PDLSC中内质网-线粒体偶联水平下降,成骨分化能力增强,说明P-PDLSC成骨分化能力的下降与其内质网-线粒体偶联增强有关,并且通过下调Mfn2水平使偶联减弱后,其成骨分化能力能得以恢复。
综上,炎症微环境下PDLSC中内质网-线粒体偶联增加,其主要介导分子Mfn2升高,从而使PDLSC成骨分化能力下降。PDLSC中内质网-线粒体偶联改变调控其成骨分化的机制尚需进一步研究,以寻找牙周炎在细胞器结构水平上新的治疗靶点。
[1] Seo BM, Miura M, Gronthos S, et al. Investigation of multipotent postnatal stem cells from human periodontal ligament[J]. Lancet, 2004, 364(9429):149-155.
[2] Liu Y, Liu W, Hu C, et al. MiR-17 modulates osteogenic differentiation through a coherent feed-forward loop in mesenchymal stem cells isolated from periodontal ligaments of patients with periodontitis[J]. Stem Cells, 2011, 29(11):1804-1816.
[3] Rowland AA, Voeltz GK. Endoplasmic reticulum-mitochondria contacts: function of the junction[J]. Nat Rev Mol Cell Biol, 2012, 13(10):607-625.
[4] Montisano DF, Cascarano J, Pickett CB, et al. Association between mitochondria and rough endoplasmic reticulum in rat liver[J]. Anat Rec, 1982, 203(4):441-450.
[5] Schon EA, Area-Gomez E. Mitochondria-associated ER membranes in Alzheimer disease[J]. Mol Cell Neurosci, 2013, 55:26-36.
[6] Xue P, Li B, An Y, et al. Decreased MORF leads to prolonged endoplasmic reticulum stress in periodontitis-associated chronic inflammation[J]. Cell Death Differ, 2016, 23(11):1862-1872.
[7] Danese A, Patergnani S, Bonora M, et al. Calcium regulates cell death in cancer: Roles of the mitochondria and mitochondria-associated membranes (MAMs)[J]. Biochim Biophys Acta, 2017, 1858(8):615-627.
[8] Youle RJ, van der Bliek AM. Mitochondrial fission, fusion, and stress[J]. Science, 2012, 337(6098):1062-1065.
[9] 薛芃,李蓓,谈珺,等.脂多糖诱导的内质网应激在牙周膜干细胞中的表达及其对成骨分化的影响[J].中华口腔医学杂志, 2015, 50(9):548-553.
[10] 张戎,张勉,李成华,等.碱性成纤维细胞生长因子和血管内皮生长因子对人牙周膜干细胞体外增殖、迁移和黏附的影响[J].中华口腔医学杂志, 2013, 48(5):278-284.
[11] 朱宏,罗兰堃,王颖,等.细胞外调节蛋白激酶信号通路调控牙周膜干细胞内皮分化的机制研究[J].中华口腔医学杂志, 2016, 51(3):154-159.
[12] Boncompagni S, Rossi AE, Micaroni M, et al. Mitochondria are linked to calcium stores in striated muscle by developmentally regulated tethering structures[J]. Mol Biol Cell, 2009, 20(3):1058-1067.
[13] Rizzuto R, Pinton P, Carrington W, et al. Close contacts with the endoplasmic reticulum as determinants of mitochondrial Ca2+ responses[J]. Science, 1998, 280(5370):1763-1766.
[14] de Brito OM, Scorrano L. Mitofusin 2 tethers endoplasmic reticulum to mitochondria[J]. Nature, 2008, 456(7222):605-610.