体外培养扩增的自体根尖牙乳头干细胞在年轻恒牙根尖周炎组织再生中的作用
2018年7期
中华泌尿外科杂志,第53卷第7期 第459页-第465页
杨杰,王文君,贾维茜,赵玉鸣,葛立宏
年轻恒牙由于外伤、发育畸形和龋齿造成牙髓感染,进而发展为牙髓坏死、根尖周炎,一直是口腔医学需要解决的一个难题。由Kaiser与Frank提出的传统治疗方法——根尖诱导成形术及Shabahang提出的三氧化矿物凝聚体(mineral trioxide aggregate,MTA)根尖封闭术在治疗年轻恒牙根尖周炎中都取得了较好的效果,但也存在不足。通过上述两种方法,可以使年轻恒牙的根尖封闭,但牙根长度和根管壁厚度不能增加,根尖形态也异于正常牙根。此类牙齿远期易出现根折和再感染[1,2],且难以进行永久修复,预后并不乐观。
2001年Iwaya等[3]将牙髓再血管化(dental pulp revascularization)作为一种全新的针对年轻恒牙根尖周炎的治疗方法首次提出,通过有效控制感染,根尖引血入根管,达到牙根继续发育,包括根管壁增厚、根尖闭合的理想效果。此后牙髓再血管化用于治疗年轻恒牙根尖周病变的方法受到广泛关注,国内外很多口腔医师将这种方法用于年轻恒牙根尖周病的治疗,取得了理想的效果[4,5]。但在进一步研究中,Wang等[6]通过动物实验发现应用牙髓再血管化不能实现真正的组织再生,而只是损伤的修复,通过根尖引血进入根管的干细胞并不能形成牙髓牙本质复合体以及使牙根继续发育的牙髓干细胞(dental pulp stem cell,DPSC)和根尖牙乳头干细胞(stem cells from apical papillae,SCAP),而是牙周膜干细胞和骨髓基质干细胞。其原因在于在牙髓坏死、根尖周感染的状态下,存活的根尖来源的内源性DPSC和SCAP数量明显减少,不利于牙髓再生和牙根继续发育[7]。
因此,本研究旨在以动物实验为基础,结合组织工程学手段,导入体外扩增培养的自体SCAP,即体外分离培养的SCAP,研究其在年轻恒牙根尖周病牙髓再血管化中的作用。
本研究已通过北京大学生物医学伦理委员会的审查(批准号:LA2011-045),研究时间为2012年1月至2015年7月。
选用雄性驯化纯种20周龄比格犬3只(北京Marshall生物技术有限公司提供,遗传背景清楚明确),于北京大学口腔医学院·口腔医院中心实验室动物实验室饲养,饲养级别为清洁级。选取比格犬上颌第三切牙进行SCAP的分离培养,选择上颌及下颌具有两个牙根的第三、四前磨牙作为年轻恒牙根尖周炎牙髓再血管化的研究牙齿。本研究使用3只比格犬的24颗前磨牙进行实验研究。
对比格犬使用3%戊巴比妥钠按30 mg/kg静脉注射进行麻醉,采用分角线投射技术拍摄犬上颌前牙根尖X线片,观察到上颌第三切牙牙根形成2/3时拔除该牙,分离牙根末端的根尖牙乳头。将分离的根尖牙乳头即刻置于含双抗(链霉素-青霉素)的D-Hanks液中浸泡,剪碎后加入1 ml的3 g/LⅠ型胶原酶(Sigma,美国)和4 g/L分散酶(Sigma,美国)轻轻振荡,37 ℃下消化30 min,过70 μm的细胞筛(BD,美国)后获取单细胞悬液,加入α-改良伊格尔培养基(α-modification of Eagle's medium,α-MEM,Gibco,美国)中和,1 000 r/min离心5 min(离心半径为65 mm),弃上清液,使用1 ml培养基重悬,接种于60 mm培养皿,于37 ℃、5% CO2孵箱中培养,2~3 d换液1次,待细胞生长汇合,消化收集细胞,传代培养。
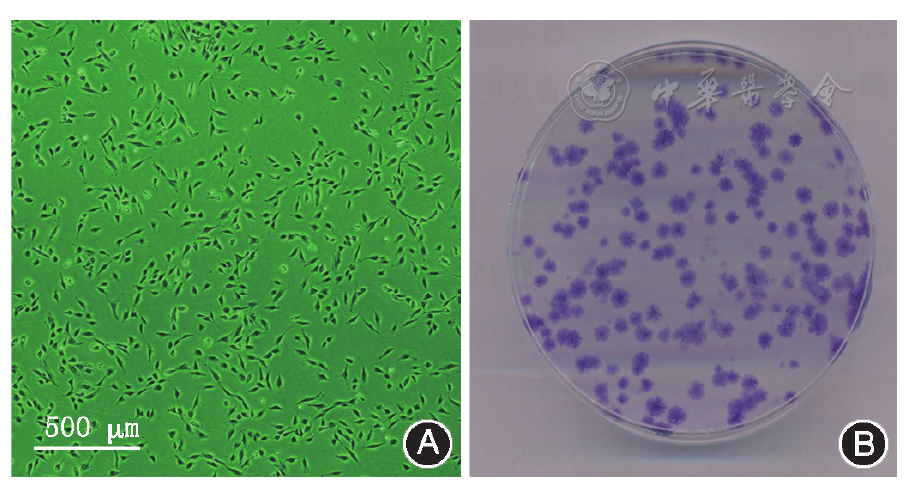
取培养的第2代比格犬SCAP,用0.02%乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)+ 0.1%胰蛋白酶消化,制成浓度为500个细胞/ml的单细胞悬液,并将1 ml细胞悬液接种于100 ml的培养皿中,每3天换液1次。10 d后使用4%多聚甲醛固定,0.1%甲苯胺蓝(Sigma,美国)染色,观察犬SCAP克隆形成单位(colony forming unit,CFU),记录犬SCAP在50个细胞以上的克隆数。
将第2代比格犬SCAP以8 000个/孔的密度接种于24孔板中爬片生长,培养24 h后用4%多聚甲醛固定。3% H2O2室温下孵育10 min,阻断内源性过氧化物酶,磷酸盐缓冲液(phosphate buffer saline,PBS)洗2 min×3次,正常山羊血清封闭30 min,分别滴加鼠抗人STRO-1(稀释梯度1∶100,BD Bioscience Pharmingen,美国),兔抗人CD146工作液和兔抗人细胞角蛋白(cytokeratin,CK)工作液(北京中杉金桥生物技术有限公司)单克隆抗体,将切片置于湿盒中4 ℃下过夜。其余步骤同上述成软骨诱导分化Ⅱ型胶原免疫组化染色。
按照以往文献报道的人SCAP多向分化潜能研究的方法[8],对犬SCAP的体外成骨分化、成脂分化和成软骨分化等多向分化能力进行检测。
成骨分化:将第2代比格犬SCAP以5×104个/孔的密度接种于6孔板,培养至80%汇合后,成骨诱导组更换成骨诱导培养液(α-MEM、10%胎牛血清、10 nmol/L地塞米松、10 mmol/L β-甘油磷酸钠及50 mg/L L-抗坏血酸)进行培养,对照组继续用细胞培养液培养,每3天换液1次,21 d后4%多聚甲醛固定20 min,PBS漂洗1次,2%茜素红(pH=4.2)(Sigma,美国)染色,肉眼及镜下观察。
成脂分化:用同样的方法将第2代比格犬SCAP接种于6孔板,培养至80%汇合后,成脂诱导组更换成脂诱导培养液(α-MEM、10%胎牛血清、10 nmol/L地塞米松、0.5 mmol/L 3-异丁基-1-甲基黄嘌呤、10 g/L胰岛素、60 μmol/L吲哚美辛及50 mg/L L-抗坏血酸)进行培养,对照组继续用细胞培养液培养,每3天换液1次,21 d后4%多聚甲醛固定,PBS漂洗,0.3%油红O(Sigma,美国)染色,镜下观察。
成软骨分化:将第2代比格犬SCAP消化,制成单细胞悬液,调整细胞浓度为1×106个/ml,转移至15 ml离心管,1 600 r/min离心6 min,加入成软骨诱导培养液(4.5 g/L高糖达尔伯克必需基本培养基、10%胎牛血清、1%胰岛素-转铁蛋白-亚硒酸混合液、10-7 mol/L地塞米松、50 mg/L L-抗坏血酸、2 mmol/L丙酮酸及10 μg/L转化生长因子β1),每3天换液1次,21 d后4%多聚甲醛固定、包埋,制备5 μm切片,脱蜡至水,3% H2O2室温孵育10 min,阻断内源性过氧化物酶,PBS洗2 min×3次,正常山羊血清封闭30 min,滴加入兔抗人Ⅱ型胶原工作液(北京中杉金桥生物技术有限公司)单克隆抗体,将切片置湿盒4 ℃下过夜。次日将切片置室温下1 h复温,PBS洗2 min×3次,滴加入生物素标记二抗工作液,室温30 min,PBS洗2 min×3次,滴加辣根酶标记链酶卵白素工作液,室温30 min,PBS洗2 min×3次,光镜控制下二氨基联苯氨(diaminobenzidine,DAB)室温下显色。对照组用PBS代替一抗,其余步骤同前。用苏木精复染,脱水透明,中性树胶封片。光镜观察Ⅱ型胶原的表达。
从24颗研究用牙齿中选取3颗第三前磨牙作为正常对照组;剩余21颗牙齿分为3个实验组,分别为根尖引血组、外周血组和外周血重悬SCAP组,以牙根为单位进行观察。
3只比格犬术前拍根尖X线片,观察牙根发育情况,选择3个实验组的21颗第三、四前磨牙牙根形成2/3时作为建立根尖周炎动物模型的时间。采用3%戊巴比妥钠静脉麻醉,对研究牙齿进行开髓、拔髓,取临床比格犬口内牙菌斑溶于生理盐水形成菌斑液,将蘸取菌斑液相同时间的棉捻封入根管。每周拍摄上颌及下颌第三、四前磨牙根尖X线片,观察根尖病变的形成。
对上述21颗建立年轻恒牙根尖周炎动物模型的研究牙齿按美国牙髓病学会推荐的年轻恒牙牙髓再血管化治疗的消毒方法进行标准一致的根管消毒,包括:根管冲洗(5.25% NaOCl+17% EDTA+生理盐水依次冲洗)和根管封药(三联抗生素糊剂,环丙沙星∶甲硝唑∶米诺环素为1∶1∶1),控制感染。
在进行彻底的根管消毒后,分别对3个实验组采取再血管化操作。根尖引血组:采用传统的刺破根尖组织的方法引血进入根管;外周血组:不进行根尖引血,抽取比格犬外周血导入根管;外周血重悬SCAP组:使用外周血重悬收集的第4代SCAP,调整细胞浓度为1×107个/ml,导入根管。为避免排斥反应,使用导入根管的细胞选用来自同一只比格犬第三切牙培养的SCAP。随后对3个实验组的冠方用MTA和复合树脂充填严密封闭。每2周对实验牙拍摄根尖X线片观察牙根继续发育(牙根长度和根管壁厚度增加)情况。当观察到牙根发育完成(根尖闭合)后处死动物,截取相应区域的颌骨,EDTA脱矿8周,4%多聚甲醛固定、包埋,制备5 μm厚切片,行HE染色观察硬组织形成情况。
经酶消化法获得的比格犬SCAP形态较短小,呈典型成纤维细胞形态(
犬SCAP STRO-1、CD146呈阳性表达,CK呈阴性表达(
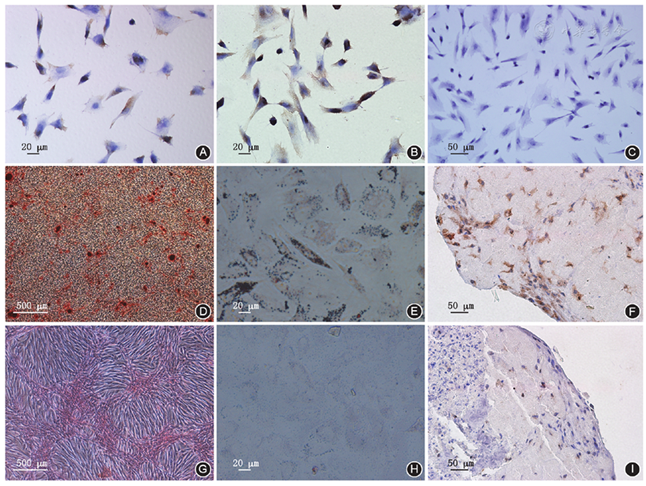
经成骨及成脂肪诱导分化后21 d犬SCAP可以形成矿化结节(
比格犬年轻恒牙开髓、拔髓、根管内封菌斑捻1周后,口内检查可见牙齿Ⅱ度松动,牙龈红肿,牙周出现溢脓。根尖X线片检查显示犬上下颌前磨牙根尖周和根分歧下出现低密度影(
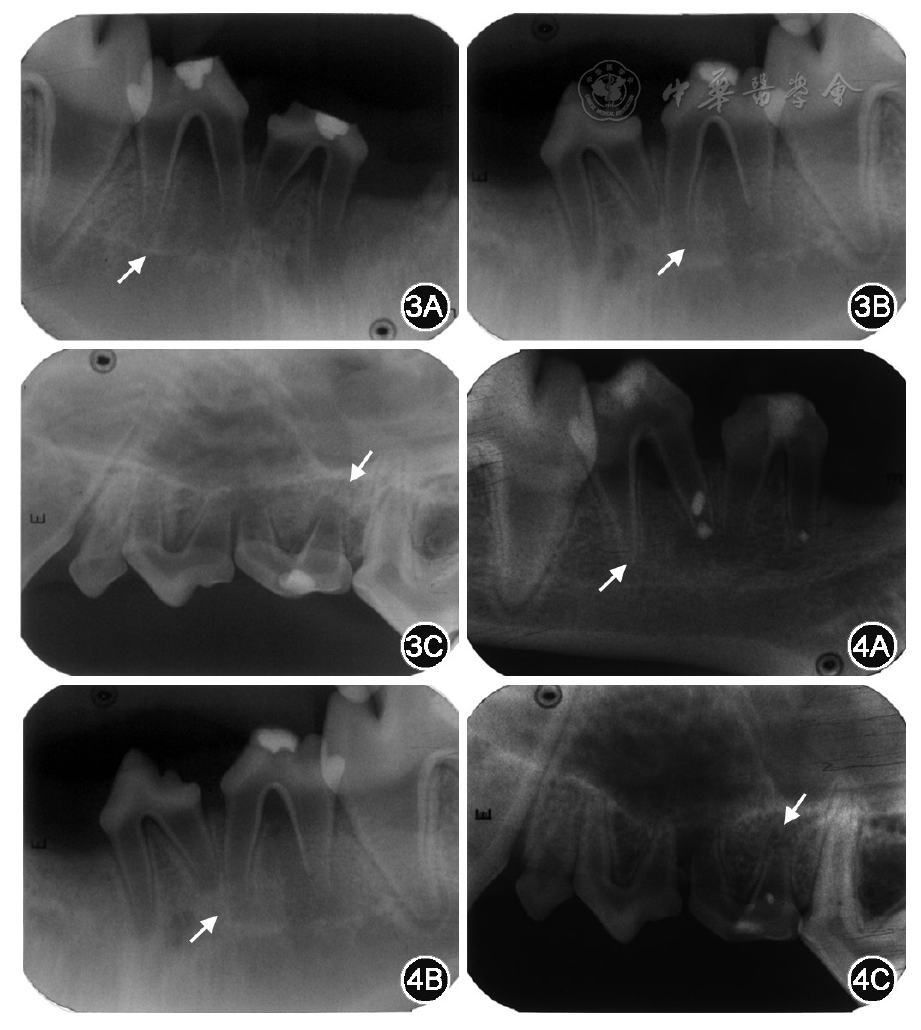
通过严格的根管冲洗和根管封药控制感染,按照实验设计分别进行根尖引血、导入外周血和导入外周血的重悬SCAP,严密冠向封闭12周后,根尖X线片可见正常对照组根管壁明显增厚,根尖形成;根尖引血组、外周血组和外周血重悬SCAP组的共计21颗牙齿42个牙根中,20个牙根(48%)成功控制感染(根尖引血组7个、外周血组6个、外周血重悬细胞组7个),出现硬组织沉积,根管壁增厚,但与正常对照组相比根管壁的总体厚度均较薄,虽然根尖出现封闭,但牙根形态并不表现为正常对照组的逐渐缩窄变细(
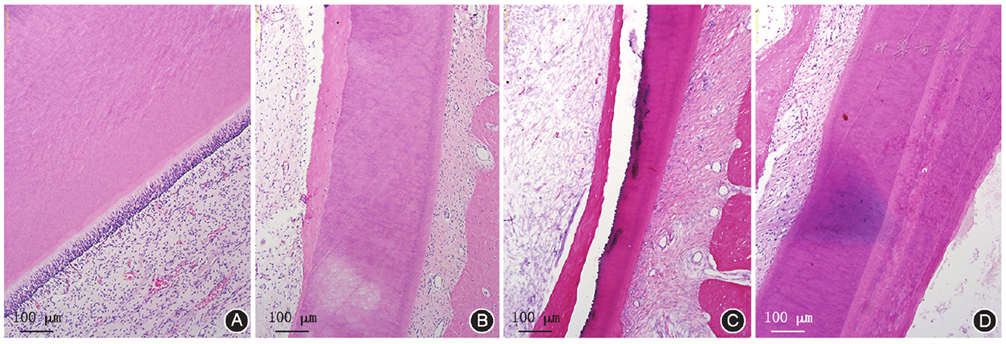
①正常对照组,可以观察到规则排列的牙本质小管贯穿根管壁,高柱状的成牙本质细胞层排列于髓腔内壁(
Huang[7]关于牙髓再血管化进行大量的临床研究和动物实验,指出牙髓再血管化成功的理论基础在于年轻恒牙根尖孔开放,含有大量牙髓组织且髓腔与根周组织的充足血供交通,因此当出现根尖周病变时牙髓组织可以仅部分坏死或感染[3,9]。因此,Huang等[9]设想在控制感染的条件下,只要有存活的牙髓组织和根尖牙乳头,则其中所含的SCAP即有可能使牙根继续形成,DPSC就可能重建牙髓组织,并分化成为成牙本质细胞参与牙根的继续发育,使牙髓再生成为可能。
但以往的动物实验和临床病例报道均显示,应用牙髓再血管化进行年轻恒牙根尖周炎治疗时,髓腔内新生的硬组织主要是牙骨质样组织和骨样组织,而不是牙本质样组织[10,11,12,13,14]。Huang[7]认为其原因在于患根尖周炎的年轻恒牙根管内和根尖周大部分组织已坏死,且感染或病变的时间越长,存活的内源性干细胞就越少,难以实现牙根的继续发育和牙髓再生。
因此,牙髓再血管化的理念虽好,但基础不足,即单纯以细胞归巢的方式引入内源性干细胞并不足以支持组织再生,且再生组织的性质也不确定。因此,本研究以年轻恒牙根尖周炎动物模型为基础,在控制感染的前提下导入体外培养扩增的自体干细胞,观察其介导的组织再生。如前所述,实现牙髓再血管化的最高目标为牙髓再生,这需要牙根的继续发育和牙髓组织的再生,本研究的重点为探讨牙髓再血管化中再生的硬组织的性质,而SCAP是牙根发育的主要干细胞,因此选取SCAP作为研究对象。
根据以往报道及本课题组前期研究[15,16,17],本研究成功分离、培养、鉴定了犬SCAP,成功建立了年轻恒牙根尖周炎动物模型,并按照美国牙髓病学会牙髓再血管化的操作指南进行根管消毒和感染控制。在研究SCAP在牙髓再血管化中介导的组织再生研究中,本研究提出使用外周血重悬体外分离培养的SCAP后再导入根管。这样既保证进入根管内的血液量足够,避免了临床上所用刺破根尖引血入根管的方法可能出现进入根管的血量不足、根管空虚的现象;同时也保证了进入根管内的干细胞主要为SCAP而不是骨髓基质干细胞和牙周膜干细胞,并且干细胞数量足够。此外,本研究在外周血重悬组中导入的细胞来自同一只比格犬第三切牙培养的SCAP,属于自体细胞移植,避免了免疫排斥反应。
牙髓再血管化成功的前提是有效的感染控制,本研究中虽然48%的牙根出现牙髓再血管化失败的现象,但在成功控制感染的牙根中,根尖引血组、外周血组和外周血重悬SCAP组术后12周影像学表现均显示根尖闭合和根管壁增厚。3个实验组的组织学表现各不相同,且都不同于正常对照组。在根尖引血组中可以观察到根管内壁有一层含有骨陷窝、但无牙本质小管样结构的新组织形成,这与以往报道一致[6],这层组织可能来自于根尖区的骨髓基质干细胞形成的骨样组织,而并非真正的牙本质。其根本原因在于通过根尖引血的方法从根尖区进入根管内的SCAP量明显不足或与骨髓基质干细胞相比不占优势,因此在新形成的组织中并未观察到牙本质的结构特点。在外周血组可见在根管内壁有一层与根尖引血组相似的硬组织形成,同样含有骨陷窝而无牙本质小管样结构,但这层组织却并不像根尖引血组那样与原根管壁紧密结合,而是出现了分离。这可能是由于在外周血组导入的外周血中并不含有干细胞,而是通过根尖区的干细胞迁移过来,这与根尖引血组在刺破根尖组织引血入根管的同时干细胞即已进入根管相比,干细胞进入根管的速度明显不同。因此,形成的新组织和原根管内壁的紧密程度较差,导致在标本处理和切片染色过程中这两层组织出现分离。在外周血重悬SCAP组中,可见形成的新组织有明显的牙本质小管样结构,但小管的方向不一致,具有多向性,包括与根管壁垂直、平行以及不同角度的斜行走向;并且在新形成的组织中并未观察到骨陷窝样结构。提示新形成的组织具有与牙本质相似的结构,其形成源自导入的体外扩增培养的自体SCAP,而不是来自根尖区的牙周膜干细胞或骨髓基质干细胞;但导入的体外扩增培养的自体SCAP分布及分化而成的成牙本质细胞的排列方向不同于正常对照组,因此,新形成的硬组织中牙本质小管的排列方向不一致。此外,本研究还观察到在外周血重悬SCAP组中新形成的组织与根尖引血组和外周血组相比厚度增加,这主要是与前者导入了较高浓度的SCAP悬浮液有关。
因此,在控制感染的前提下,SCAP在年轻恒牙根尖周炎组织再生中具有重要作用。但由于数量的缺乏,通过根尖来源的内源性SCAP可能不足以获得真正意义上的组织再生,而导入足够量的体外扩增培养的自体SCAP可能会实现这一目标。
[1] Bose R, Nummikoski P, Hargreaves K. A retrospective evaluation of radiographic outcomes in immature teeth with necrotic root canal systems treated with regenerative endodontic procedures[J]. J Endod, 2009, 35(10):1343-1349.
[2] Cvek M. Prognosis of luxated non-vital maxillary incisors treated with calcium hydroxide and filled with gutta-percha. A retrospective clinical study[J]. Endod Dent Traumatol, 1992, 8(2):45-55.
[3] Iwaya SI, Ikawa M, Kubota M. Revascularization of an immature permanent tooth with apical periodontitis and sinus tract[J]. Dent Traumatol, 2001, 17(4):185-187.
[4] Banchs F, Trope M. Revascularization of immature permanent teeth with apical periodontitis: new treatment protocol?[J]. J Endod, 2004, 30(4):196-200.
[5] Petrino JA, Boda KK, Shambarger S, et al. Challenges in regenerative endodontics: a case series[J]. J Endod, 2010, 36(3):536-541.
[6] Wang X, Thibodeau B, Trope M, et al. Histologic characterization of regenerated tissues in canal space after the revitalization/revascularization procedure of immature dog teeth with apical periodontitis[J]. J Endod, 2010, 36(1):56-63.
[7] Huang GT. A paradigm shift in endodontic management of immature teeth: conservation of stem cells for regeneration[J]. J Dent, 2008, 36(6):379-386.
[8] Sonoyama W, Liu Y, Fang D, et al. Mesenchymal stem cell-mediated functional tooth regeneration in swine[J]. PLoS One, 2006, 1:e79.
[9] Huang GT, Sonoyama W, Liu Y, et al. The hidden treasure in apical papilla: the potential role in pulp/dentin regeneration and bioroot engineering[J]. J Endod, 2008, 34(6):645-651.
[10] Zhu X, Zhang C, Huang GT, et al. Transplantation of dental pulp stem cells and platelet-rich plasma for pulp regeneration[J]. J Endod, 2012, 38(12):1604-1609.
[11] Zhu W, Zhu X, Huang GT, et al. Regeneration of dental pulp tissue in immature teeth with apical periodontitis using platelet-rich plasma and dental pulp cells[J]. Int Endod J, 2013, 46(10):962-970.
[12] Yamauchi N, Nagaoka H, Yamauchi S, et al. Immunohistological characterization of newly formed tissues after regenerative procedure in immature dog teeth[J]. J Endod, 2011, 37(12):1636-1641.
[13] Martin G, Ricucci D, Gibbs JL, et al. Histological findings of revascularized/revitalized immature permanent molar with apical periodontitis using platelet-rich plasma[J]. J Endod, 2013, 39(1):138-144.
[14] Shimizu E, Ricucci D, Albert J, et al. Clinical, radiographic, and histological observation of a human immature permanent tooth with chronic apical abscess after revitalization treatment[J]. J Endod, 2013, 39(8):1078-1083.
[15] Thibodeau B, Teixeira F, Yamauchi M, et al. Pulp revascularization of immature dog teeth with apical periodontitis[J]. J Endod, 2007, 33(6):680-689.
[16] Yamauchi N, Yamauchi S, Nagaoka H, et al. Tissue engineering strategies for immature teeth with apical periodontitis[J]. J Endod, 2011, 37(3):390-397.
[17] 杨杰,赵玉鸣,王文君,等.犬根尖牙乳头干细胞的分离培养和生物学特性[J].北京大学学报:医学版, 2012, 44(6):921-926.