B细胞活化因子对自身免疫性疾病引起的寻常型间质性肺炎与特发性肺纤维化的鉴别诊断
2018年7期
中华泌尿外科杂志,第41卷第7期 第544页-第550页
赵玉月,连宏建,李姗,方楚玲,黄慧,徐作军
特发性肺纤维化(idiopathic pulmonary fibrosis, IPF)是指一类病因不明的慢性进展性纤维化性肺疾病[1],高分辨率CT(HRCT)及组织病理学表现为寻常型间质性肺炎(usual interstitial pneumonia, UIP)。2011年美国胸科协会和欧洲呼吸协会指南[2]建议:在除外其他已知病因后,依据典型HRCT表现,约50% IPF患者可免于肺活检[3]。但HRCT表现为UIP的患者中30%~50%病理表现与影像学并不一致[4],特别是继发于自身免疫疾病(autoimmune diseases,AIDs)的UIP患者[5],鉴别IPF与AIDs-UIP是在临床工作的重点及难点。
B细胞活化因子(B cell activating factor of the TNF family, BAFF)主要表达于单核细胞、巨噬细胞等骨髓细胞,参与调节B细胞的分化、发育、成熟及增殖,与多种AIDs的致病过程密切相关[6]。目前认为IPF的发病机制中,免疫紊乱在IPF的发病中起到重要作用,且BAFF参与IPF的致病过程[7],但目前关于B细胞在IPF中的作用研究很少。本研究通过测定IPF及AIDs-UIP患者血浆BAFF水平,分析BAFF与肺功能指标的相关性及在IPF与AIDs-UIP的鉴别诊断价值。
回顾性分析2015年1月至2016年3月于北京协和医院就诊的IPF患者(IPF组,34例)、AIDs-UIP患者(AIDs-UIP组,23例)及同期体检的健康对照者(对照组,21名)。其中IPF组男31例,女3例,年龄40 ~77岁,平均(63±8)岁;AIDs-UIP组男16例,女7例,年龄25 ~73岁,平均(60±9)岁,其中类风湿关节炎(rheumatoid arthritis, RA) 12例,系统性血管炎7例,干燥综合征(sj?gren syndrome, SS)2例,系统性硬化症(systemic sclerosis, SSc)1例,具有自身免疫特征的间质性肺炎(interstitial pneumonia with autoimmune features, IPAF)1例;对照组男17名,女4名,年龄51 ~ 80岁,平均(64±8)岁。3组的年龄及性别比较差异均无统计学意义。
排除标准:已接受免疫治疗[包括糖皮质激素(激素)、免疫抑制剂或生物制剂等];存在感染或慢性心、肝、肾功能衰竭;合并恶性肿瘤;存在药物、粉尘及放射等因素引起的间质性肺疾病;结节病、慢性过敏性肺泡炎等其他间质性肺疾病等。
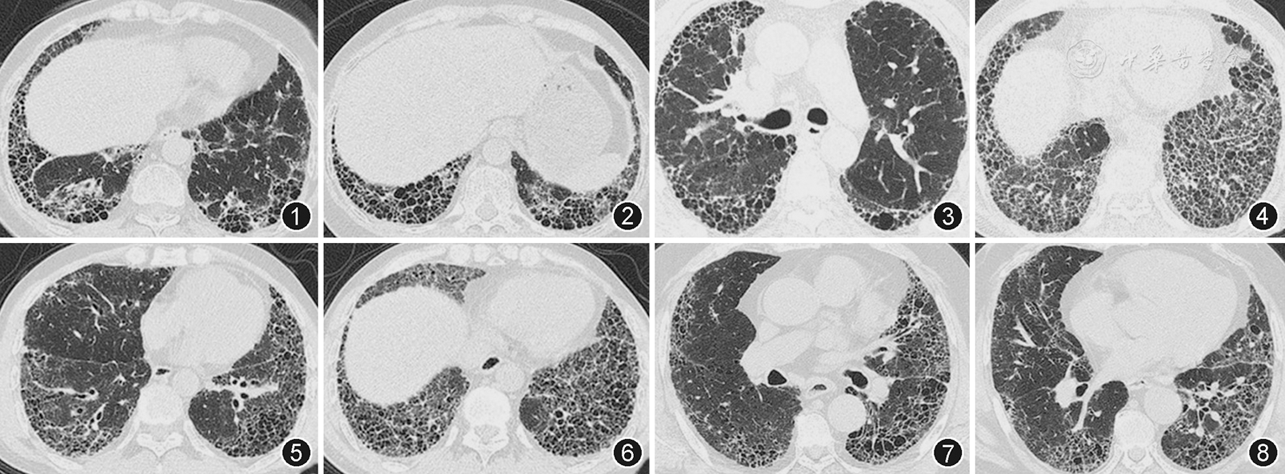
所有IPF患者符合2011年美国胸科协会和欧洲呼吸协会的"特发性肺纤维化诊治指南"诊断标准[2]或2016年特发性肺纤维化诊断和治疗中国专家共识[8]。自身免疫疾病的诊断分别符合1988年美国风湿病协会的RA诊断标准[9],2012年美国Chapel Hill会议更新的关于系统性血管炎命名分类法分型标准[10],2002年SS的国际分类标准[11],1980年美国风湿病协会SSc的分类标准[12],2015年IPAF的命名及诊断标准[13]。本研究中自身免疫疾病患者的UIP的影像学表现诊断标准参照根2011年美国胸科协会和欧洲呼吸协会指南[2]:(1)分布以胸膜下和基底部为主;(2)可见网格影;(3)存在蜂窝影伴或不伴牵拉性支气管扩张;(4)未见与UIP不一致的特征性影像学表现。与UIP不一致的特征性表现包括:(1)病变主要分布在上或中肺叶;(2)沿支气管血管束分布;(3)大片的磨玻璃影(分布面积大于网格影);(4)多发微结节(双侧、上叶分布为主);(5)囊性改变(多发、双侧、远离蜂窝影分布区);(6)弥漫马赛克改变或气体陷闭(双侧、多个肺叶),(7)支气管肺叶/段分布的实变。
受试者在空腹状态,使用EDTA抗凝管,抽取4 ml静脉血,于4 ℃下以3 000 r/min离心10 min,离心半径:6 cm。将上清液分装于干净的EP管后置于-80 ℃保存。选用酶联免疫吸附试验法(ELISA )检测血浆BAFF浓度(美国R&D公司)。通过自动酶标仪进行比色分析,在450 nm波长处测定样本的吸光度值(A),绘制标准曲线,根据吸光度值计算样本浓度。
收集UIP患者的临床资料,包括血常规、ESR、超敏C反应蛋白、动脉血气分析、肺功能检查、BALF细胞学检查和影像学资料(
采用SPSS 20.0软件进行数据分析,使用Kolmogorov-Smirnov test检验变量是否服从正态性分布。计数资料用例数表示,计量资料用均值±标准差(
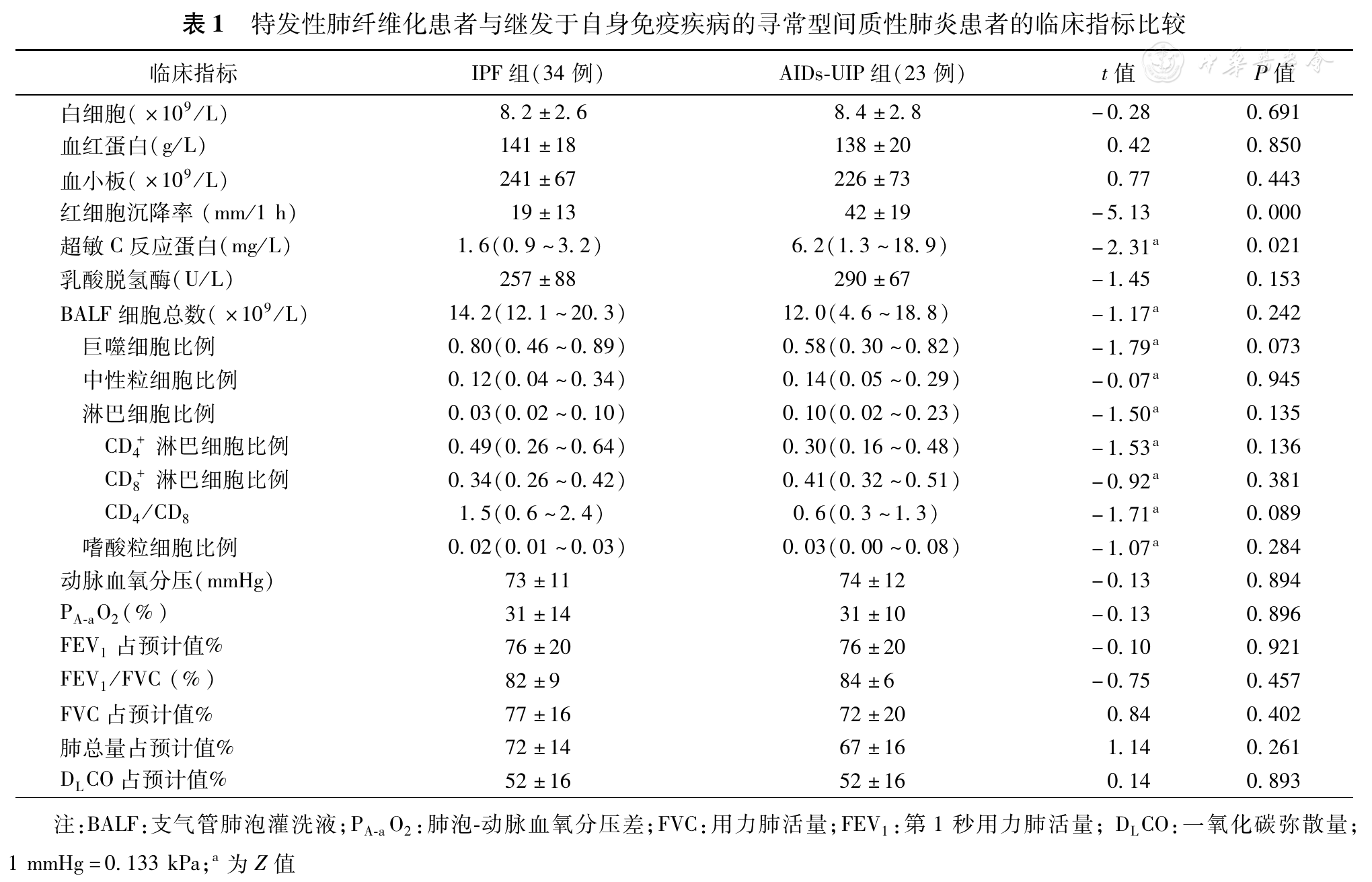
IPF组炎性指标、ESR(t=-5.13, P=0.000)及超敏C反应蛋白(Z=-2.31, P = 0.021)均低于AIDs-UIP组,组间比较差异有统计学意义,但血常规、动脉血气分析、肺功能指标及BALF检查结果两组比较差异无统计学意义(P>0.05,
AIDs-UIP组血浆中BAFF浓度为(2.3±0.9) ng/ml,明显高于IPF组[(1.6±0.4) ng/ml,t=3.05,P=0.005]及对照组[(1.2 ± 0.2) ng/ml, t=5.12,P<0.001],IPF组与对照组比较差异也有统计学意义(t=4.76,P<0.001,
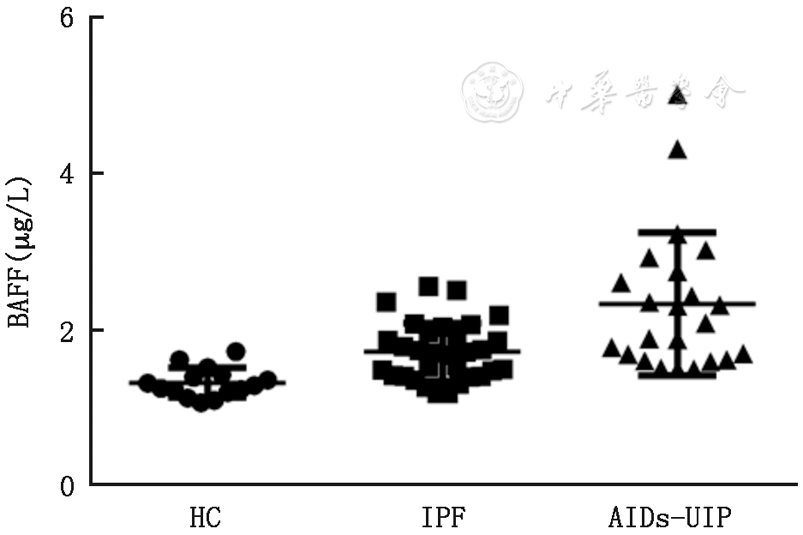
注:BAFF:B细胞活化因子;HC:健康对照组;IPF:特发性肺纤维化;AIDs:自身免疫疾病;UIP:寻常型间质性肺炎
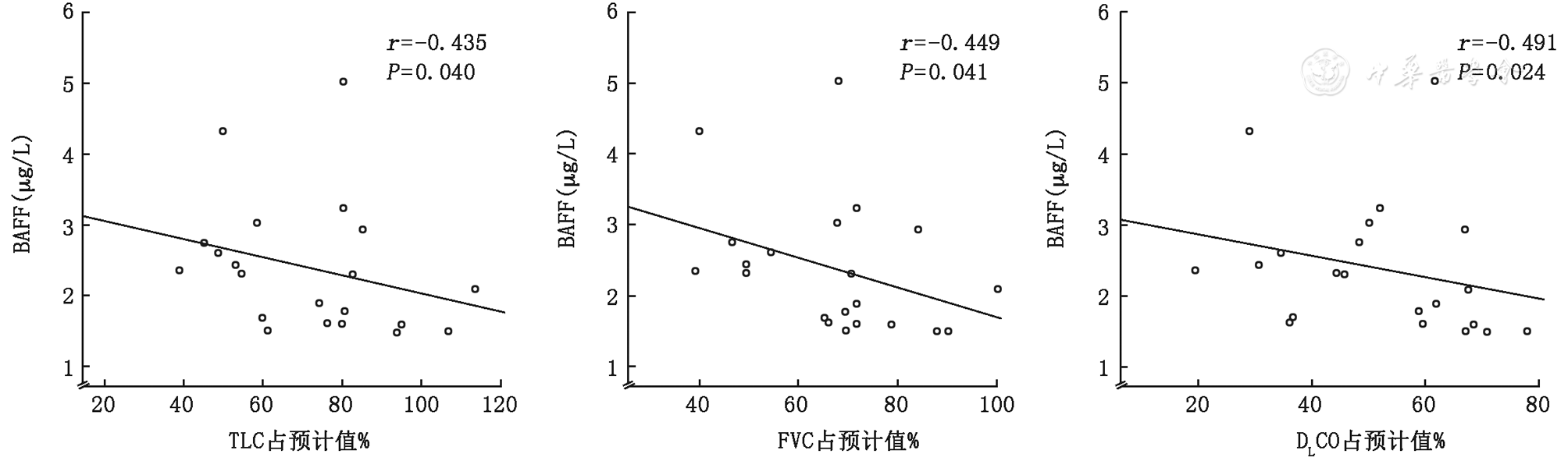
注:BAFF:B细胞活化因子;FVC:用力肺活量;FEV1:第1秒用力肺活量;TLC:肺总量;DLCO :一氧化碳弥散量
当临界值取1.5 ng/ml时,诊断为AIDs-UIP的受试者工作特征曲线下面积最大为0.784(P<0.01,95%CI: 0.663 ~ 0.905,标准误为0.062),敏感度为64.5%,特异度为90.0% (
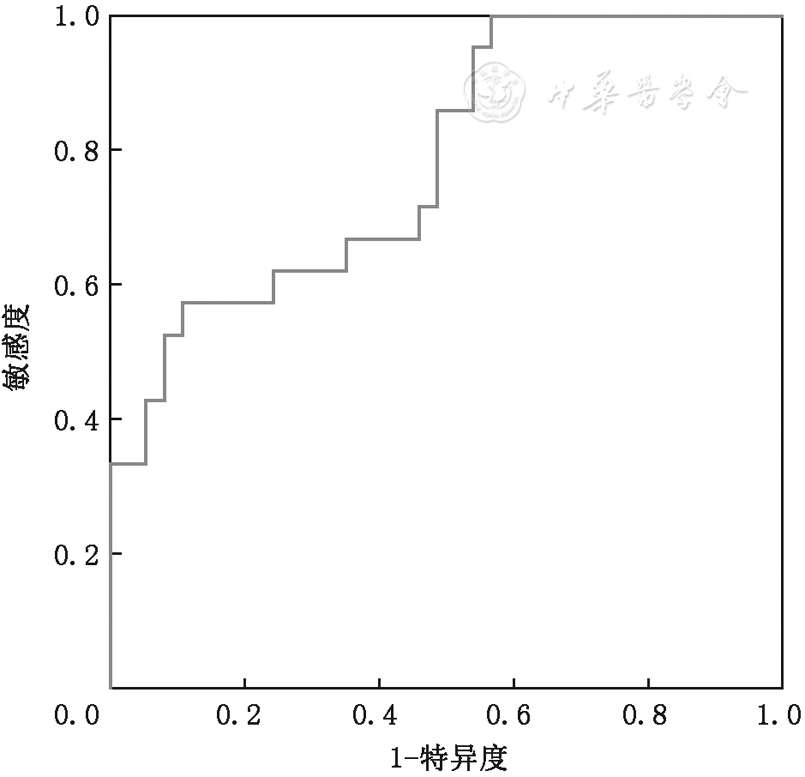
注:BAFF:B细胞活化因子;AUC:曲线下面积
IPF在HRCT及病理上以UIP为主要特征,起病隐匿、预后差,中位生存期约2.5~3.5年,目前指南推荐抗纤维化的药物有吡非尼酮和尼达尼布,但这些药物仅能延缓肺功能下降进展,尚缺乏有效治疗药物,是目前呼吸系统疾病中的诊治难点和研究热点[14]。诊断IPF需要首先排除其他已知病因,特别是AIDs。
约75%的AIDs患者可存在间质性肺炎,表现类型包括非特异性间质性肺炎(nonspecific interstitial pneumonia,NSIP)、UIP、机化性肺炎(organizing pneumonia,OP)、弥漫性肺泡损伤(diffuse alverolar damage,DAD)和淋巴细胞间质性肺炎(lymphocytic interstitial pneumonia,LIP)等。间质性肺炎是自身免疫疾病患者预后差的重要因素,特别是UIP表现者[15]。HRCT表现为UIP的疾病最多见为RA、系统性血管炎,也可见于SSc、SS和IPAF等[16]。初诊时诊断为特发性间质性肺炎的患者,约有3%~19%在随访中会逐渐出现免疫表现或自身抗体指标阳性,进而诊断为AIDs[17,18]。AIDs-UIP与IPF患者的临床检验指标、肺功能结果、BALF细胞学分类等无明显差别[18,19,20],与本研究结果一致。若缺乏血清免疫抗体指标的阳性提示,临床上初诊时鉴别AIDs-UIP与IPF是一大难点。使用免疫抑制治疗后,AIDs-UIP患者的预后可优于IPF[18],因此,尽早区分鉴别AIDs-UIP与IPF很重要,可利于AIDs-UIP患者及早得到治疗,改善预后。
本研究结果显示,AIDs-UIP患者的炎性指标、ESR及超敏C反应蛋白明显高于IPF患者,但是常见的炎性指标与BAFF及AIDs-UIP患者的肺功能指标无明显相关性,考虑不除外自身免疫疾病的病情活动影响,而并非与UIP相关,故难以依据非特异度炎症指标来协助鉴别诊断UIP的病因。对比IPF患者,AIDs-UIP患者肺部的病理表现更易出现生发中心及淋巴细胞聚集[18],但是常需要有创操作才能获得病理组织,不易方便推广。目前随着全基因组测序技术的开展,已经探索出AIDs引起间质性肺炎与IPF患者分别具有不同的基因位点突变或基因多态性的表达[21],但是在临床中应用鉴别UIP的病因仍需要进一步的研究及工作。血清Ⅱ型肺泡细胞表面抗原(kerbs vonden lungen 6,KL-6)、肺泡表面活性物质相关蛋白(pulmonary surfatcant associated protein D,SP-D)、乳酸脱氢酶、基质金属蛋白酶-7或骨桥蛋白(osteopontin)等均不能很好区分AIDs-UIP与IPF患者[18,20],目前尚无有效的血清标志物可以在早期协助区分两者。
BAFF也被称为B细胞刺激因子,是于1999年被发现的肿瘤坏死因子家族的新成员,不仅促进B细胞的成熟、存活、增殖和分化,还参与T细胞的活化和应答,在免疫反应中发挥着重要作用[22]。BAFF基因敲除小鼠的免疫能力被抑制,表现为B细胞成熟受限,免疫球蛋白水平减低,T细胞相关的免疫功能减弱[6]。而BAFF高表达小鼠的体内B细胞数量增多,产生自身免疫抗体,与体内组织抗原结合形成免疫复合物,促进中性粒细胞的趋化。BAFF的升高与多种自身免疫疾病患者的病情密切相关,如与SLE患者的抗dsDNA抗体滴度呈正相关[23],与SS患者的γ球蛋白、IgG有相关性[24],与RA患者的类风湿因子呈正相关[25]。同时,B细胞功能异常也参与IPF的致病过程,在IPF患者肺组织内存在免疫复合物聚集[26],并伴有外周血、BALF中BAFF水平明显增高[7]。这提示BAFF不仅在自身免疫疾病中发挥作用,也参与间质性肺炎的发生及发展进程[27],我们推测血清BAFF可作为AIDs-UIP患者的一项炎性标志物。本研究结果表明,AIDs-UIP患者血浆中的BAFF水平明显高于IPF患者及对照组,且BAFF水平与AIDs-UIP患者的肺功能指标呈负相关,与文献报道结果一致[27]。因此,血浆BAFF水平可为UIP患者的鉴别诊断提供有利依据。文献报道BAFF在鉴别CTD-ILD与慢性纤维化性间质性肺炎(包括IPF与特发性NSIP)两类患者的临界值为1.7 ng/ml,敏感度及特异度分别为67.6%和94.7%,其受试者工作特征曲线下面积最大为0.823,高于血清KL-6(曲线下面积为0.566)和SP-D(曲线下面积为0.643)。此研究对于CTD-ILD患者未行进一步肺间质病变分类,且对照组除了IPF患者,还包括了特发性NSIP患者。本研究结果显示,BAFF的临界值取1.5 ng/ml时,其鉴别AIDs-UIP与IPF的敏感度为64.5% ,特异度为90.0%,受试者工作特征曲线下面积最大为0.784,本研究的研究对象是影像学呈UIP表现的AIDs-UIP与IPF患者,是对国外既往研究对象的细化和BAFF作用的进一步探索。
当自身免疫疾病对激素反应不好或容易复发时,可考虑使用血浆置换去除自身抗体或者使用利妥昔单抗针对性地去除B细胞治疗[7],也有报道显示在IPF患者中也有效[28]。Belimumab是针对BAFF的单克隆抗体,可以用来治疗SLE[29]、系统性血管炎[30]和RA[31]。也有动物实验研究提出通过阻断使用BAFF抗体或敲除BAFF基因,可减轻小鼠肺纤维化程度[32],为IPF以及AIDs-UIP患者提供了潜在治疗靶点。
本研究初步分析了血浆BAFF在鉴别IPF与AIDs-UIP中的作用。但是,本研究存在一定的局限性,本研究在单中心开展,研究各组的样本量偏小,还需要开展多中心的RCT研究并扩大样本量以明确BAFF在UIP患者中的鉴别诊断意义;目前缺乏对患者预后的长期随访,需要定期随访患者以探讨BAFF对UIP患者预后的提示意义,也需要进一步开展基础研究明确BAFF参与AIDs-UIP与IPF的具体作用机制。
[1] Bellaye PS, Kolb M. Why do patients get idiopathic pulmonary fibrosis? Current concepts in the pathogenesis of pulmonary fibrosis[J]. BMC Med, 2015,13:176.
[2] Raghu G, Collard HR, Egan JJ, et al. An official ATS/ERS/JRS/ALAT statement: idiopathic pulmonary fibrosis: evidence-based guidelines for diagnosis and management[J]. Am J Respir Crit Care Med, 2011,183(6):788-824.
[3] Wuyts WA, Cavazza A, Rossi G, et al. Differential diagnosis of usual interstitial pneumonia: when is it truly idiopathic?[J]. Eur Respir Rev, 2014,23(133):308-319.
[4] Sumikawa H, Johkoh T, Fujimoto K, et al. Pathologically proved nonspecific interstitial pneumonia: CT pattern analysis as compared with usual interstitial pneumonia CT pattern[J]. Radiology, 2014,272(2):549-556.
[5] Flaherty KR, Colby TV, Travis WD, et al. Fibroblastic foci in usual interstitial pneumonia: idiopathic versus collagen vascular disease[J]. Am J Respir Crit Care Med, 2003,167(10):1410-1415.
[6] Mackay F, Schneider P, Rennert P, et al. BAFF AND APRIL: a tutorial on B cell survival[J]. Annu Rev Immunol, 2003,21:231-264.
[7] Xue J, Kass DJ, Bon J, et al. Plasma B lymphocyte stimulator and B cell differentiation in idiopathic pulmonary fibrosis patients[J]. J Immunol, 2013,191(5):2089-2095.
[8] Drew PA, Takezawa K. Pulmonary cryptococcosis and pituitary Cushing′s disease[J]. Diagn Cytopathol, 1998,18(5):365-367.
[9] Arnett FC, Edworthy SM, Bloch DA, et al. The American Rheumatism Association 1987 revised criteria for the classification of rheumatoid arthritis[J]. Arthritis Rheum, 1988,31(3):315-324.
[10] Jennette JC, Falk RJ, Bacon PA, et al. 2012 revised International Chapel Hill Consensus Conference Nomenclature of Vasculitides[J]. Arthritis Rheum, 2013,65(1):1-11.
[11] Vitali C, Bombardieri S, Jonsson R, et al. Classification criteria for Sj?gren′s syndrome: a revised version of the European criteria proposed by the American-European Consensus Group[J]. Ann Rheum Dis, 2002,61(6):554-558.
[12] Preliminary criteria for the classification of systemic sclerosis (scleroderma). Subcommittee for scleroderma criteria of the American Rheumatism Association Diagnostic and Therapeutic Criteria Committee[J]. Arthritis Rheum, 1980,23(5):581-590.
[13] Fischer A, Antoniou KM, Brown KK, et al. An official European Respiratory Society/American Thoracic Society research statement: interstitial pneumonia with autoimmune features[J]. Eur Respir J, 2015,46(4):976-987.
[14] Loomis-King H, Flaherty KR, Moore BB. Pathogenesis, current treatments and future directions for idiopathic pulmonary fibrosis[J]. Curr Opin Pharmacol, 2013,13(3):377-385.
[15] Kim EJ, Elicker BM, Maldonado F, et al. Usual interstitial pneumonia in rheumatoid arthritis-associated interstitial lung disease[J]. Eur Respir J, 2010,35(6):1322-1328.
[16] Wallace B, Vummidi D, Khanna D. Management of connective tissue diseases associated interstitial lung disease: a review of the published literature[J]. Curr Opin Rheumatol, 2016,28(3):236-245.
[17] Romagnoli M, Nannini C, Piciucchi S, et al. Idiopathic nonspecific interstitial pneumonia: an interstitial lung disease associated with autoimmune disorders?[J]. Eur Respir J, 2011,38(2):384-391.
[18] Kono M, Nakamura Y, Enomoto N, et al. Usual interstitial pneumonia preceding collagen vascular disease: a retrospective case control study of patients initially diagnosed with idiopathic pulmonary fibrosis[J]. PLoS One, 2014,9(4):e94775.
[19] Hosoda C, Baba T, Hagiwara E, et al. Clinical features of usual interstitial pneumonia with anti-neutrophil cytoplasmic antibody in comparison with idiopathic pulmonary fibrosis[J]. Respirology, 2016,21(5):920-926.
[20] White ES, Xia M, Murray S, et al. Plasma Surfactant Protein-D, Matrix Metalloproteinase-7, and Osteopontin Index Distinguishes Idiopathic Pulmonary Fibrosis from Other Idiopathic Interstitial Pneumonias[J]. Am J Respir Crit Care Med, 2016,194(10):1242-1251.
[21] Furukawa H, Oka S, Shimada K, et al. Genetics of Interstitial Lung Disease: Vol de Nuit (Night Flight)[J]. Clin Med Insights Circ Respir Pulm Med, 2015,9(
[22] Bossen C, Schneider P. BAFF, APRIL and their receptors: structure, function and signaling[J]. Semin Immunol, 2006,18(5):263-275.
[23] Cancro MP, D′Cruz DP, Khamashta MA. The role of B lymphocyte stimulator (BLyS) in systemic lupus erythematosus[J]. J Clin Invest, 2009,119(5):1066-1073.
[24] Groom J, Kalled SL, Cutler AH, et al. Association of BAFF/BLyS overexpression and altered B cell differentiation with Sj?gren′s syndrome[J]. J Clin Invest, 2002,109(1):59-68.
[25] Cheema GS, Roschke V, Hilbert DM, et al. Elevated serum B lymphocyte stimulator levels in patients with systemic immune-based rheumatic diseases[J]. Arthritis Rheum, 2001,44(6):1313-1319.
[26] Hoyne GF, Elliott H, Mutsaers SE, et al. Idiopathic pulmonary fibrosis and a role for autoimmunity[J]. Immunol Cell Biol, 2017,95(7):577-583.
[27] Hamada T, Samukawa T, Kumamoto T, et al. Serum B cell-activating factor (BAFF) level in connective tissue disease associated interstitial lung disease[J]. BMC Pulm Med, 2015,15:110.
[28] Donahoe M, Valentine VG, Chien N, et al. Autoantibody-Targeted Treatments for Acute Exacerbations of Idiopathic Pulmonary Fibrosis[J]. PLoS One, 2015,10(6):e0127771.
[29] Furie R, Petri M, Zamani O, et al. A phase Ⅲ,randomized, placebo-controlled study of belimumab, a monoclonal antibody that inhibits B lymphocyte stimulator, in patients with systemic lupus erythematosus[J]. Arthritis Rheum, 2011,63(12):3918-3930.
[30] Lenert A, Lenert P. Current and emerging treatment options for ANCA-associated vasculitis: potential role of belimumab and other BAFF/APRIL targeting agents[J]. Drug Des Devel Ther, 2015,9:333-347.
[31] Stohl W, Merrill JT, McKay JD, et al. Efficacy and safety of belimumab in patients with rheumatoid arthritis: a phase Ⅱ,randomized, double-blind, placebo-controlled, dose-ranging Study[J]. J Rheumatol, 2013,40(5):579-589.
[32] Fran?ois A, Gombault A, Villeret B, et al. B cell activating factor is central to bleomycin- and IL-17-mediated experimental pulmonary fibrosis[J]. J Autoimmun, 2015,56:1-11.