烧伤患儿的能量需求及营养支持特点
2017年1月
中华内分泌代谢杂志,第24卷第1期 第1页-第4页
高恒妙
随着经济的发展和预防儿童意外伤害知识的普及,西方发达国家烧伤的发病率在逐渐下降,但在发展中国家,烧伤依然是危及儿童生命和生活质量的重要问题。自上世纪90年代对烧伤患者复苏治疗的研究大幅提高了急性期生存率后,近年来对烧伤患者治疗的研究主要集中在调节烧伤后的代谢反应及适当的营养支持治疗方面[1]。烧伤会导致与一般严重创伤相似的代谢反应,但程度更加严重。这些严重的代谢反应会最终导致患儿出现营养不良,降低机体抵抗力,增加感染机会,增加病死率。对重度烧伤患儿而言,营养支持治疗可降低病死率,是经过复苏、紧急烧伤局部处理后最重要的支持治疗措施之一。本文仅就这一方面的研究进展做一综述。
虽然蛋白质、碳水化合物以及脂肪的分解代谢反应是所有危重症的共同表现,但严重烧伤患儿的代谢改变有其特点,而且往往其反应强度更高,持续时间更长,对患儿的康复有着重要的影响。烧伤引起的代谢改变需要充分的营养支持[2]。
尽管对烧伤后的代谢反应进行了多年研究,但关于烧伤所致高代谢反应的根本原因仍知之甚少。据推测,大量的儿茶酚胺、糖皮质激素、胰高血糖素和多巴胺启动了该反应,这些物质会激发很多复杂的媒介级联反应。内毒素、肿瘤坏死因子、白细胞介素-1和白细胞介素-6、血小板活化因子、通过环氧合酶和脂氧合酶通路形成的花生四烯酸代谢产物、活性氧簇、中性粒细胞黏附复合物、一氧化氮、补体和凝血级联反应都可能在调节高代谢反应过程中起重要作用[3]。
烧伤后的代谢反应与一般创伤类似,可分为3个阶段[4]:
第1阶段:发生在烧伤后即刻,由于血流动力学不稳定,会出现组织低灌注,儿茶酚胺大量释放,其特征为低代谢率和总耗氧量降低,其程度和持续时间取决于烧伤的严重程度和复苏措施是否及时。这一阶段持续时间往往极短,仅有数小时。
第2阶段:发生在第1阶段后,表现为总耗氧量和静息能量消耗逐渐增高,代谢底物需求增加,出现氮和钾的负平衡。此期内脏血流增多,氧消耗量增加,心输出量增加,患者常有体温增高。上世纪80年代的研究表明,此阶段能量消耗大幅增加,与烧伤的严重程度和范围相关,峰值出现在烧伤后1周内,可达静息能量消耗的150%~200%。近年来对烧伤患者治疗的进步,特别是针对降低代谢率的治疗措施,已经使此期的能量消耗大幅降低。在此阶段,大量的蛋白质丢失致使蛋白分解代谢增加,特别是骨骼肌的蛋白质分解大幅增加,合成代谢受到抑制,出现负氮平衡。此期合理的营养支持可降低负氮平衡,抑制分解代谢。
第3阶段:为恢复期。此期烧伤创面开始恢复,需要较高的能量供应以满足康复需求,完成创面愈合,通常需2~6周,严重烧伤患者可长达2年。
烧伤患者体内的这些生物化学改变可产生重要的临床后果,包括静息能量消耗以及肌肉和骨骼的分解代谢增加、胰岛素抵抗。即便给予积极治疗,大面积严重烧伤患者的营养不良和体重下降仍较为常见。未经治疗的烧伤患者会出现瘦体重严重消耗。过度的瘦体重消耗与病死率增加相关。
欧洲临床营养与代谢协会(The European Society for Clinical Nutrition and Metabolism,ESPEN)基于对1979年至2011年在PUBMED上发表的相关文献分析结果,结合法国麻醉复苏协会和法国临床营养和代谢协会的烧伤营养支持指南,于2013年发表了《ESPEN支持推荐意见:严重烧伤患者的营养治疗》[5],对重症烧伤患者的营养支持治疗提出了8项推荐意见,其内容要点见

在烧伤患者的早期复苏阶段,烧伤导致的严重应激反应以及为挽救生命所采取的治疗措施,均对胃肠道有不良影响。早期的大量毛细血管渗漏导致低血容量性休克,与其他入住ICU的危重症患者相比,烧伤患者肠黏膜通透性增加更加严重。为维持血压和循环稳定,在烧伤后24~48 h内常需大量输入晶体液,其结果会导致全身水肿,当然也包括胃肠道水肿,这些是出现麻痹性肠梗阻的重要原因之一。在烧伤后极早期(6~12 h)内开始肠内营养,可降低应激性激素和高代谢反应的水平,促进免疫球蛋白的生成,降低应激性溃疡发生率,同时减少营养不良和能量不足的风险[6],缩短住院时间,降低病死率[7]。大多数烧伤患儿能耐受早期肠内营养,但早期肠内营养可引起一些严重并发症,如肠坏死。有研究表明,肠坏死可能与烧伤的面积、液体复苏的量和正性肌力药物的需求等相关[8]。早期肠内营养的禁忌证包括血流动力学不稳定、需要大剂量血管加压素或严重腹胀的患者。肠内营养通路首选经胃喂养。对严重烧伤存在幽门功能失调的患者,可经鼻放置或实施经皮内窥镜胃造瘘放置幽门后喂养管,行幽门后喂养。肠内营养制剂的选择与其他危重症相似,优先选择富含蛋白质的高能量密度制剂。由于严重烧伤患者的液体再分布及需要使用镇静镇痛药物,特别是阿片类药物,发生便秘的风险较高,推荐自肠内营养开始即使用含纤维素的营养制剂。
当有肠内营养禁忌证,或由于烧伤患儿需反复多次手术治疗,导致肠内营养不能满足能量供给目标时,有必要改变营养供给方式,开始肠外营养,以预防营养摄入不足所带来的不良后果。虽然既往有研究显示肠外营养可增加烧伤患者的病死率,但最近的研究显示,审慎地给予肠外营养,尤其是控制葡萄糖输注速度,使其与碳水化合物氧化速率保持一致,对于单独使用肠内营养不能满足机体能量摄入的患者而言,肠外营养是一种安全的选择[9]。
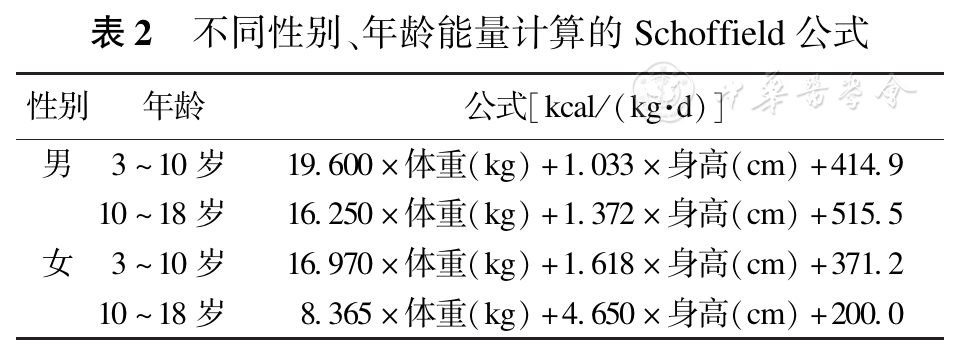
由于烧伤后强烈的代谢反应以及这种代谢反应随时间变化的特征,导致患儿的能量需求随烧伤后的时间、烧伤的严重程度及年龄等因素发生巨大的变化,因而间接测热法是测定患儿能量需求的金标准。实际供给的能量应在所测值基础上增加20%~30%,以补充因日常活动所消耗的能量(如体位变化,更换衣服以及物理治疗等)。连续的间接能量测定可早期警示喂养过多或不足。在无条件进行间接测热法测定时,对儿童烧伤患者推荐使用Schoffield公式,见
烧伤时外源性蛋白的供给不能抵消蛋白的分解。严重烧伤后骨骼肌分解代谢产生氨基酸,用于创面愈合、维持免疫功能、合成急性时相蛋白和糖异生,蛋白质摄入不足可影响这些重要功能。烧伤患者蛋白治疗的目标是通过增进蛋白质合成、促进创面愈合并改善免疫功能。ESPEN指南推荐烧伤患儿蛋白质的供给量为1.5~3.0 g/(kg·d),认为高于3.0 g/(kg·d)并没有更大的益处[5]。最近的研究显示,尽管2.0 g/(kg·d)的蛋白质供给可实现蛋白质的正平衡,超过2.5 g/(kg·d)虽不能增加蛋白质的合成代谢,但却可抑制其分解代谢,能更好地维持蛋白质正平衡[10]。谷氨酰胺可促进成人烧伤患者创面愈合、减少感染。虽然理论上给烧伤患儿补充谷氨酰胺也能获得类似成人的效果,但目前没有证据支持该假设。因此,目前尚无对烧伤患儿使用谷氨酰胺的推荐意见。
高血糖增加烧伤患儿感染及脓毒症的发病率和病死率,纠正高血糖可减少这些合并症。但安全、理想的血糖水平仍未确定。最近的多项研究均表明烧伤患者的碳水化合物需求受限,对儿童和成人烧伤患者,碳水化合物所提供的能量占总能量的55%~60%为宜。在计算葡萄糖的摄入量和提供的热量时,必须将所有的葡萄糖均计算在内,包括各种补液或静脉输入药物使用的葡萄糖。输入葡萄糖的速度不应超过5 mg/(kg·min)。血糖控制的合理目标是4.5~8.0 mmol/L,必要时可予持续胰岛素静脉输入以控制血糖在合理范围内,但需避免低血糖[11]。由于强化胰岛素治疗存在低血糖风险,目前推荐采用更为自由的方式控制血糖。
对烧伤患者脂肪需求量的研究极少。有两项研究显示,限制严重烧伤患者的脂肪摄入可能是有益的,脂肪供能超过总能量的35%会导致住院时间延长、感染机会增加[12,13]。因此,目前推荐脂肪供能应小于总能量的35%。ω-3多不饱和脂肪酸和其他单或多不饱和脂肪酸在烧伤患者中的作用尚不明确,虽然理论上这些脂肪酸可降低炎症反应,有可能会对烧伤患者有利,但目前尚缺乏其实际效果的证据,因而没有推荐意见。
维生素和矿物质在伤口愈合和免疫功能方面发挥着重要作用,烧伤后会有一些维生素和矿物质的损耗。但烧伤急性时相反应期微量营养素的血浆水平较为复杂,因此明确烧伤后微量营养素的缺乏的确是一项挑战。同时由于许多微量营养素需要蛋白载体,而炎症反应时蛋白载体水平常出现下调。针对烧伤患者补充微量营养素的研究很少。仅有的少量数据并不能阐明患儿对特定营养素的需求。研究提示,经静脉通道补充微量矿物质混合制剂(包括硒、铜和锌)可减少烧伤成人患者的感染发生率和移植物失活的发生,但缺乏儿科相关的数据。一项小型的关于儿童烧伤的随机对照研究提示,加入维生素C、维生素E和锌的肠内营养混合制剂可促进伤口愈合。因此,尚无基于循证医学的、关于烧伤患者补充维生素和矿物质的指南。
减轻或对抗烧伤后代谢反应的措施包括:充分的营养摄入、药物干预(包括使用镇静镇痛剂、β-受体阻滞剂、氧雄龙和控制感染)、环境控制和外科干预[14]。以理想蛋白摄入为重点的持续营养支持目的是补偿肌肉分解代谢并保持瘦体重。理想的无菌技术有助于将感染并发症的发生最小化。脓毒症会增加烧伤患者蛋白质分解代谢并使代谢率增加40%左右。蒸发失水和伴随的散热也会增加代谢率。细菌控制护理单元为烧伤总体表面积>30%的患者提供一个温暖的隔离环境,可减少细菌交叉定植。总的来说,外科干预是减少烧伤患者高动力效应的最有效手段。早期清创并对伤口进行全层皮肤移植能显著降低机体代谢率。
减轻烧伤后代谢反应的药物治疗主要包括镇静镇痛、β-受体阻滞剂和氧雄龙。适度的镇痛镇静可减轻患儿因疼痛和焦虑等造成的代谢率增高,使用镇静镇痛治疗中需特别注意的是,丙泊酚是含脂肪的制剂,因使用丙泊酚增加的脂肪摄入必须计入每日总的脂肪摄入量,以避免脂肪摄入过高。普萘洛尔是一种非选择性β-肾上腺素受体拮抗剂,用于治疗烧伤的理由是它能对抗烧伤后高代谢反应所引起的儿茶酚胺激增的效应。调节普萘洛尔剂量,使心率降低20%,可明显减少心脏做功和静息能量消耗[15],而且普萘洛尔不良反应较少,费用较低。氧雄龙是一种合成类固醇,可以促进蛋白质的合成来对抗高代谢反应。有研究显示氧雄龙治疗[0.2 mg/(kg·d)]可以增加烧伤患儿的总体重和瘦体重,缩短住院时间[16]。氧雄龙的不良反应主要包括肝损伤、脂质异常、肝脏肿瘤等。正是由于氧雄龙存在潜在的严重并发症,因此儿童用药应谨慎。
[1] Berger MM, Pantet O.Nutrition in burn injury:any recent changes?[J].Curr Opin Crit Care,2016,22(4):285-291.
[2] Dylewski ML, Prelack K, Weber JM,et al.Malnutrition among pediatric burn patients:A consequence of delayed admissions[J].Burns,2010,36(8):1185-1189.
[3] Sheridan RL.A great constitutional disturbance[J].N Engl J Med,2001,345(17):1271-1272.
[4] Berger M.Basics in clinical nutrition:Nutritional support in burn patients[J].e-SPEN,2009:e308-e312.
[5] Rousseau AF, Losser MR, Ichai C,et al.ESPEN endorsed recommendations:nutritional therapy in major burns[J].Clin Nutr,2013,32(4):497-502.
[6] Venter M, Rode H, Sive A,et al.Enteral resuscitation and early enteral feeding in children with major burns--effect on McFarlane response to stress[J].Burns,2007,33(4):464-471.
[7] Khorasani EN, Mansouri F.Effect of early enteral nutrition on morbidity and mortality in children with burns[J].Burns,2010,36(7):1067-1071.
[8] Gottschlich MM, Jenkins ME, Mayes T,et al.The 2002 Clinical Research Award.An evaluation of the safety of early vs delayed enteral support and effects on clinical,nutritional,and endocrine outcomes after severe burns[J].J Burn Care Rehabil,2002,23(6):401-415.
[9] Dylewksi ML, Baker M, Prelack K,et al.The safety and efficacy of parenteral nutrition among pediatric patients with burn injuries[J].Pediatr Crit Care Med,2013,14(3):e120-125.
[10] Prelack K, Yu YM, Dylewski M,et al.The contribution of muscle to whole-body protein turnover throughout the course of burn injury in children[J].J Burn Care Res,2010,31(6):942-948.
[11] Jeschke MG, Kraft R, Emdad F,et al.Glucose control in severely thermally injured pediatric patients:what glucose range should be the target? [J].Ann Surg,2010,252(3):521-527;
[12] Bernier J, Jobin N, Emptoz-Bonneton A,et al.Decreased corticosteroid-binding globulin in burn patients:relationship with interleukin-6 and fat in nutritional support[J].Crit Care Med,1998,26(3):452-460.
[13] Garrel DR, Razi M, Larivière F,et al.Improved clinical status and length of care with low-fat nutrition support in burn patients[J].JPEN J Parenter Enteral Nutr,1995,19(6):482-491.
[14] Rojas Y, Finnerty CC, Radhakrishnan RS,et al.Burns:an update on current pharmacotherapy[J].Expert Opin Pharmacother,2012,13(17):2485-2494.
[15] Herndon DN, Hart DW, Wolf SE,et al.Reversal of catabolism by beta-blockade after severe burns[J].N Engl J Med,2001,345(17):1223-1229.
[16] Jeschke MG, Finnerty CC, Suman OE,et al.The effect of oxandrolone on the endocrinologic,inflammatory,and hypermetabolic responses during the acute phase postburn[J].Ann Surg,2007,246(3):351-360;
