GLP-1激动剂通过PI3K/Akt信号通路减轻心肌细胞缺氧复氧损伤的实验研究
2018年1月
中华内分泌代谢杂志,第34卷第1期 第61页-第66页
易志刚,陈津瀚,李津,郭文安,吴娟,黄上萌
急性心肌梗死是一类对人类生命健康造成严重危害的心血管系统疾病,通过溶栓、介入等手段再通冠状动脉、恢复心肌血流灌注是临床救治的关键。但是,缺血缺氧和再灌注复氧的过程会加重心肌细胞损伤,缺血再灌注损伤是目前影响再灌注治疗效果的重要病理因素[1,2,3]。胰升糖素样肽1(Glucagon-like peptide-1,GLP-1)是由肠道L细胞分泌的一类肠促胰素,与GLP-1受体结合后能够促进胰岛β细胞分泌胰岛素,进而发挥降血糖的生物学作用[4,5]。近年来,越来越多的研究证实,GLP-1信号通路激活不仅具有降糖作用,同时还具有细胞保护作用,能够减轻高糖所致的心肌细胞和内皮细胞损伤[6,7]。尽管如此,关于GLP-1激动剂对缺血缺氧以及缺氧复氧所引起的心肌损伤是否具有保护作用仍未明确。本研究通过离体心肌细胞缺氧复氧(hypoxia/re-oxygenation,H/R)损伤来模拟在体心肌细胞缺血再灌注损伤,分析GLP-1激动剂对心肌细胞缺氧复氧损伤的影响及具体的分子机制。
H9C2细胞株购买于中国科学院上海生科院细胞资源中心,GLP-1激动剂为利拉鲁肽、购买于诺和诺德中国制药公司,细胞培养用DMEM培养基、胎牛血清、胰蛋白酶购买于Gibco公司,LY294002购买于Sigma公司,MTS试剂盒购买于Promega公司,TUNEL染色试剂盒购买于Roche公司,BCA试剂盒购买于上海碧云天公司,Bax、Bcl-2、半胱氨酸蛋白酶-3(Caspase-3)、磷酸化磷脂酰肌醇3-激酶(p-PI3K)、磷酸化蛋白激酶B(p-Akt)单克隆抗体购买于Abcam公司,p-PI3K、p-Akt荧光抗体购买于Santa-cruz公司。
H9C2细胞株复苏后用含有10%胎牛血清的DMEM培养基进行培养,每2天更换1次培养基并观察细胞生长状态,待细胞密度生长至85%~90%后用0.125%的胰蛋白酶进行消化传代,消化后的细胞接种在培养板中并用于后续处理。根据处理条件不同,将培养板中的细胞分为4组:(1)对照组:用不含药物及血清的DMEM培养基、在常规培养箱中处理;(2)H/R组:用不含药物及血清的DMEM培养基清洗2次,更换为不含药物及血清的DMEM培养基继续培养24 h,再次更换不含药物及血清的DMEM培养基并在缺氧培养箱(1% O2、5% CO2、37℃)中培养12h,而后放回常规培养箱继续培养4 h,建立H/R模型;(3)H/R+GLP-1组:参照H/R组建立H/R模型,用不含药物及血清的DMEM培养基清洗2次,更换为不含药物及血清的DMEM培养基继续培养24h,而后更换为含有200 nmol/L利拉鲁肽的无血清DMEM培养基并在缺氧培养箱(1% O2、5% CO2、37℃)中培养12h,而后放回常规培养箱继续培养4 h;(4)H/R+GLP-1+LY组:在H/R+GLP-1组的基础上加2 μmol/L LY294002。
按照下列方法建立心肌缺血再灌注(I/R)损伤大鼠模型:10%水合氯醛腹腔注射麻醉后摆放仰卧位,做颈正中切口并显露气管,做气管插管并进行机械通气;在左侧第三四肋间做切口,分离肌肉并进入胸腔,分离冠状动脉左前降支并在左心耳下方约3 mm处打一活结、结扎冠脉,缺血30 min后打开线结使心肌获得再灌注。对照组仅进行麻醉和开胸操作,不结扎冠脉。再灌注后120 min,处死大鼠并采集外周血及心肌组织。I/R+GLP-1组大鼠在造模前连续给予0.07 mg/kg的利拉鲁肽皮下注射,连续7 d;I/R+GLP-1+LY组大鼠在造模前连续给予0.07 mg/kg的利拉鲁肽、1 mg/kg LY294002皮下注射,连续7 d;对照组和I/R组给予等剂量生理盐水皮下注射。
将细胞接种在96孔培养板中,不同条件处理并缺氧12 h、复氧4 h后,向培养孔内加入MTS检测液20 μl,在培养箱中继续孵育4 h;取出培养板充分震荡,而后在酶标仪上测定450 nm波长处的吸光值,以该吸光值作为细胞的增殖活力值。
用于TUNEL和免疫荧光染色的细胞接种在24孔培养板中,不同条件处理并缺氧12 h、复氧4 h后,PBS洗涤细胞并用4%多聚甲醛进行固定,而后分别使用TUNEL试剂盒和免疫荧光染色试剂盒对细胞进行染色。TUNEL染色后在荧光显微镜下随机观察5个高倍视野,对阳性染色的细胞进行计数并计算5个高倍视野下阳性细胞的平均数及细胞总数,计算细胞凋亡率;免疫荧光染色后在荧光显微镜下随机观察5个高倍视野,计算p-PI3K、p-Akt的平均荧光强度。
用于心肌酶含量检测的细胞接种在12孔培养板中,不同条件处理并缺氧12h、复氧4h后,直接吸取细胞培养基,用BCA试剂盒测定培养基中的总蛋白含量,用电化学发光试剂盒测定培养基中肌酸激酶(CK)、肌酸激酶同工酶(CK-MB)、乳酸脱氢酶(LDH)的含量,计算每毫克总蛋白中CK、CK-MB、LDH的含量。另取动物血清,用电化学发光试剂盒测定血清中CK、CK-MB、LDH的含量。
经不同条件处理的细胞加入含有1 mmol/L PMSF的RIPA裂解液,用细胞刮刀刮取贴壁生长的细胞并使细胞充分破碎,而后在4℃、12 000转/min离心20 min,分离上层澄清的蛋白样本。心肌组织加入RIPA裂解液,充分匀浆后在4℃、12 000转/min离心20 min,分离上层澄清的蛋白样本。蛋白样本与上样缓冲液混匀后加入SDS-PAGE凝胶的点样孔中,垂直电泳后转移至PVDF膜,5%脱脂牛奶封闭2 h后加入Bax、Bcl-2、Caspase-3、p-PI3K、p-Akt以及GAPDH的单克隆抗体,4℃孵育过夜后在室温孵育二抗2 h,加入ECL显影液并在显影仪中曝光、得到蛋白条带,用Image J软件扫描得到条带的灰度值,最后以GAPDH为内参照、计算目的蛋白的相对表达量。
采用SPSS 21.0软件录入数据并进行分析,多组间的数据经方差齐性分析后符合正态分布,多组间的比较采用方差分析、两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
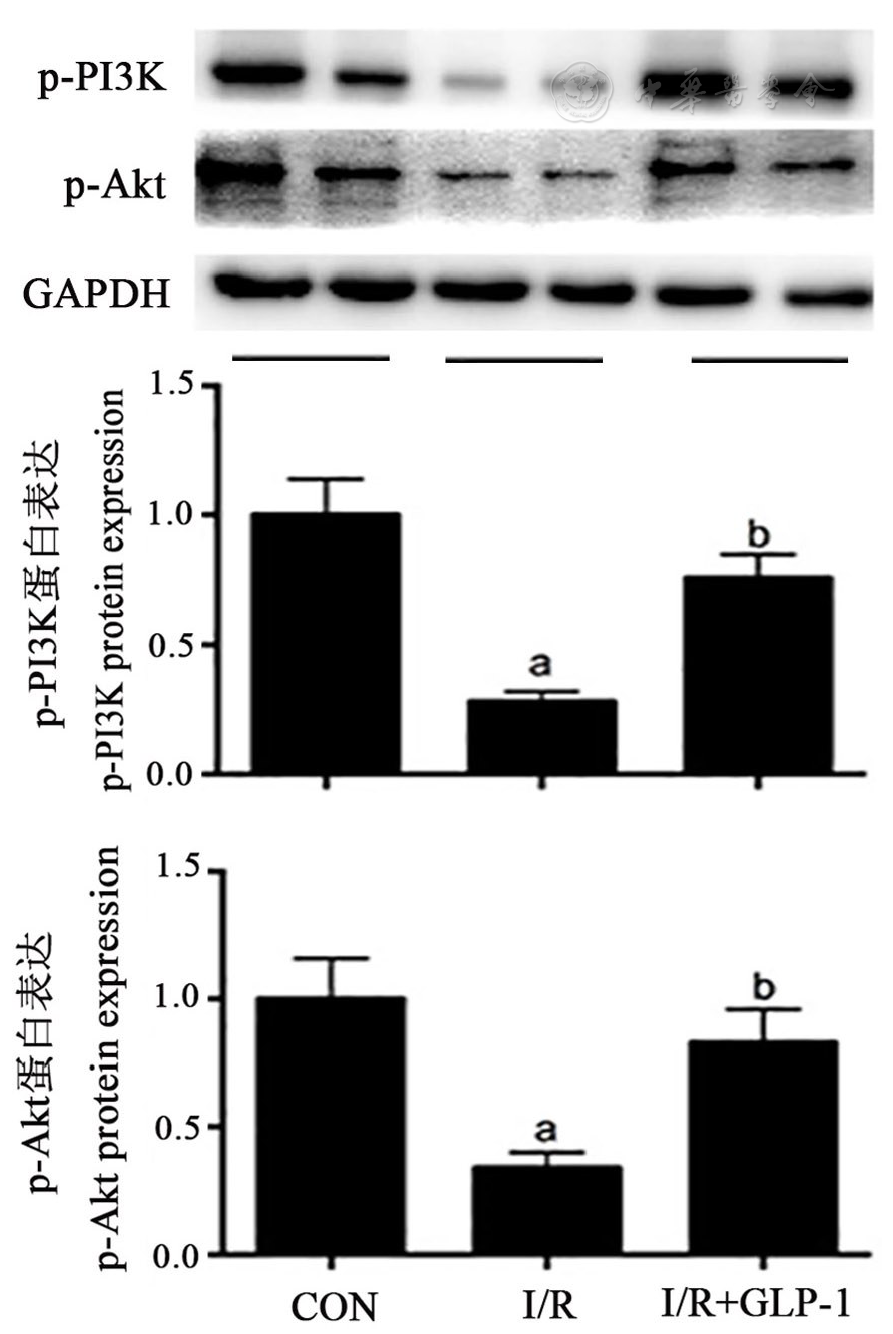
H/R组心肌细胞中p-PI3K、p-Akt的蛋白表达量均显著低于对照组,H/R+GLP-1组心肌细胞中p-PI3K、p-Akt的蛋白表达量均显著高于H/R组(均P<0.05,
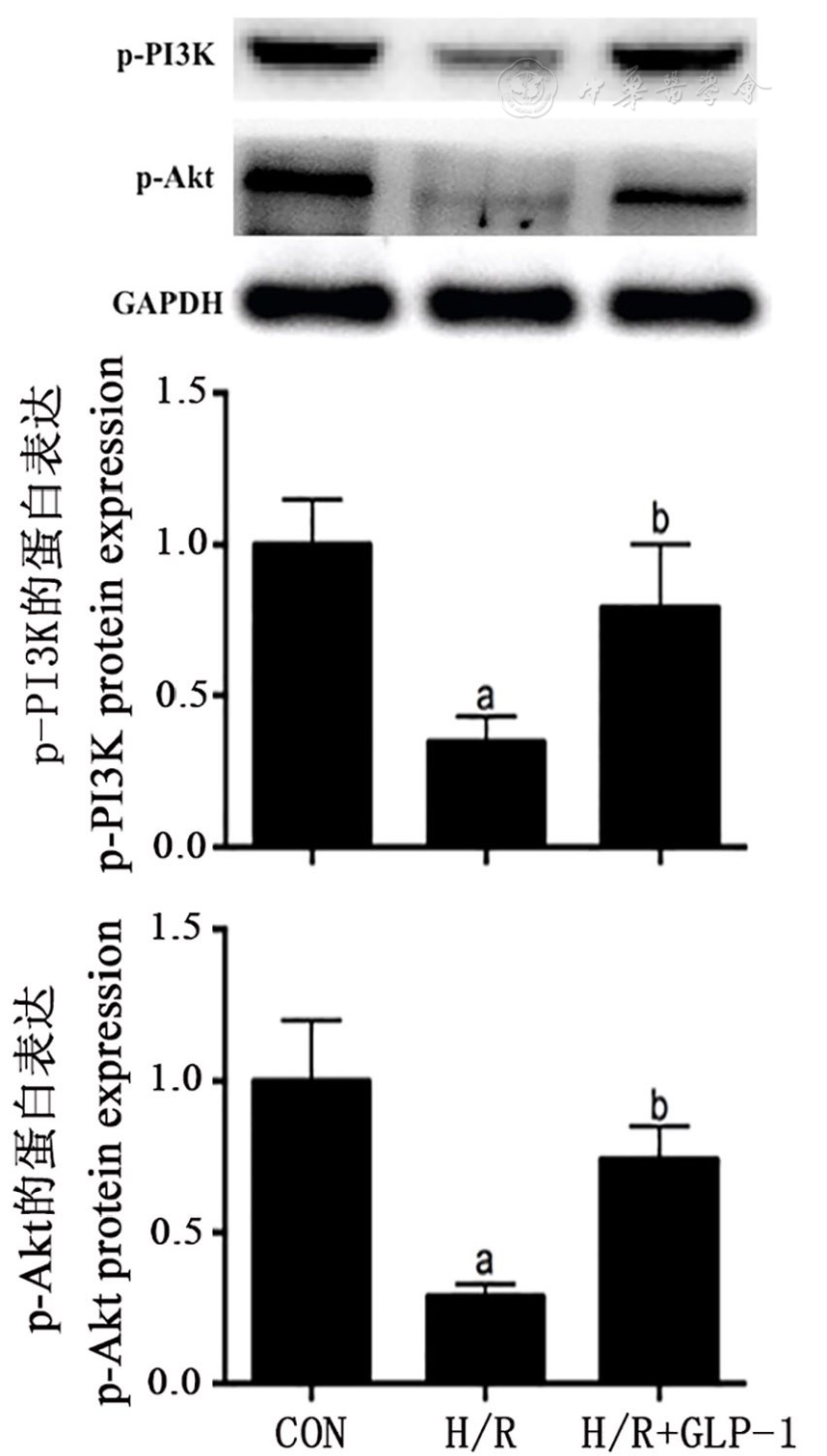
注:p-PI3K :磷酸化的磷脂酰肌醇3-激酶Phosphorylated phosphoinositide 3-kinase;p-Akt:磷酸化的蛋白激酶B Phosphorylated protein kinase B; CON:对照组Control group;H/R:缺氧复氧Hypoxia/re-oxygenation;GLP-1:胰升糖素样肽1 Glucagon-like peptide-1;与CON组比较vs CON group,aP<0.05;与H/R组比较vs H/R group,bP<0.05
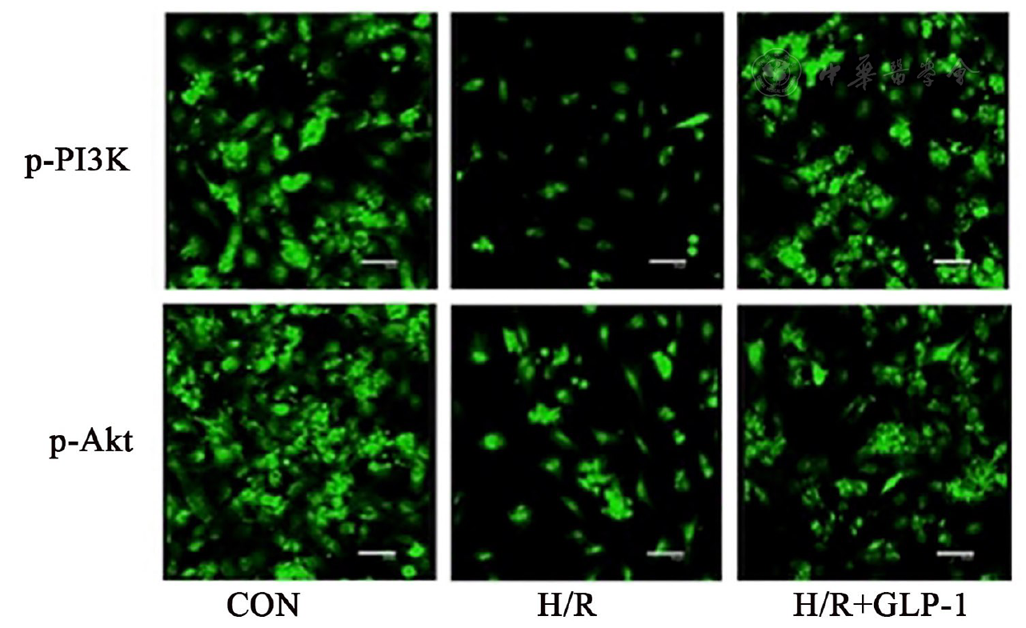
注:略语同图1 The abbreviations are the same as Fig 1
H/R组心肌细胞的增殖活力显著低于对照组,细胞凋亡率显著高于对照组;H/R+GLP-1组心肌细胞的增殖活力显著高于H/R组,细胞凋亡率显著低于H/R组;H/R+GLP-1+LY组心肌细胞的增殖活力显著低H/R+GLP-1组,细胞凋亡率显著高于H/R+GLP-1组(P<0.05,
H/R组心肌细胞培养基中CK、CK-MB、LDH的含量显著高于对照组和H/R+GLP-1组;H/R+GLP-1+LY组心肌细胞培养基中CK、CK-MB、LDH的含量显著高于H/R+GLP-1组(均P<0.05,
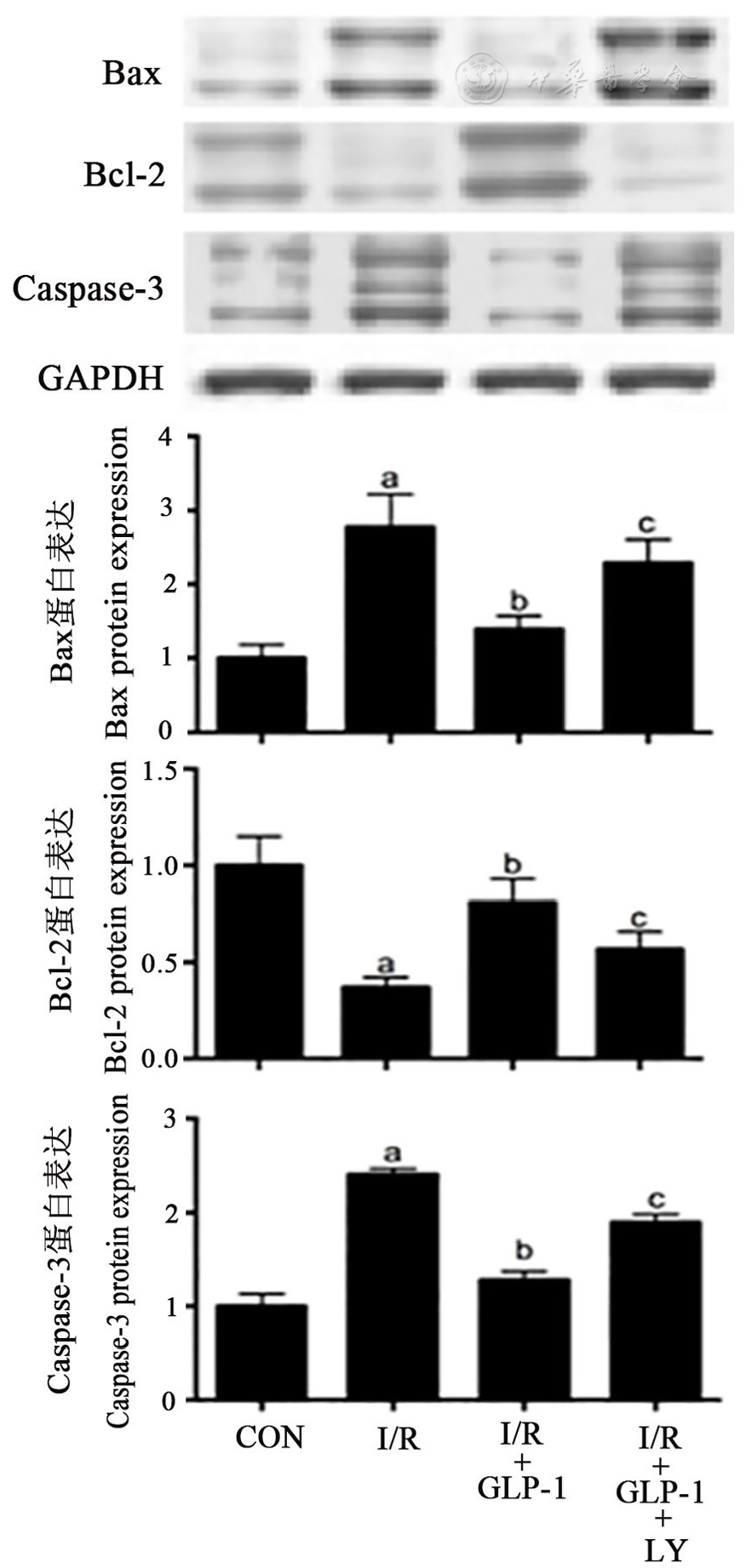
H/R组心肌细胞中Bax、Caspase-3的蛋白表达量显著高于对照组,Bcl-2的蛋白表达量显著低于对照组;H/R+GLP-1组心肌细胞中Bax、Caspase-3的蛋白表达量显著低于H/R组,Bcl-2的蛋白表达量显著高于H/R组;而H/R+GLP-1+LY组心肌细胞中Bax、Caspase-3的蛋白表达量显著高于H/R+GLP-1组,Bcl-2的蛋白表达量显著低于H/R+GLP-1组(均P<0.05,
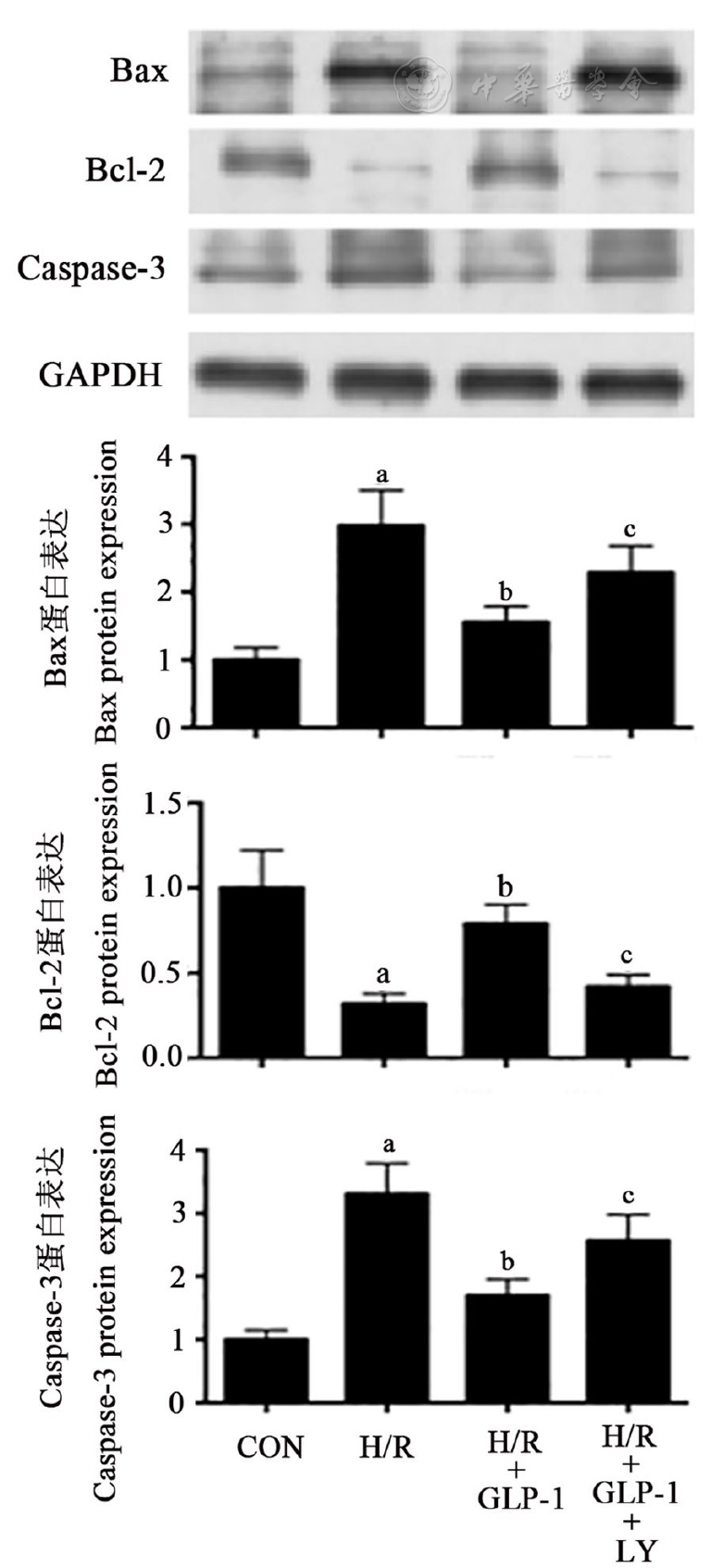
注:Caspase-3:半胱氨酸蛋白酶-3;余略语同图1 The other abbreviations are the same as Fig 1;与CON组比较vs CON group,aP<0.05;与H/R组比较vs H/R group,bP<0.05;与H/R+GLP-1组比较vs H/R+GLP-1 group,cP<0.05
I/R组大鼠血清中CK、CK-MB、LDH的含量显著高于对照组;I/R+GLP-1组大鼠血清中CK、CK-MB、LDH的含量显著低于I/R组;I/R+GLP-1+LY组大鼠血清中CK、CK-MB、LDH的含量显著高于I/R+GLP-1组(均P<0.05,
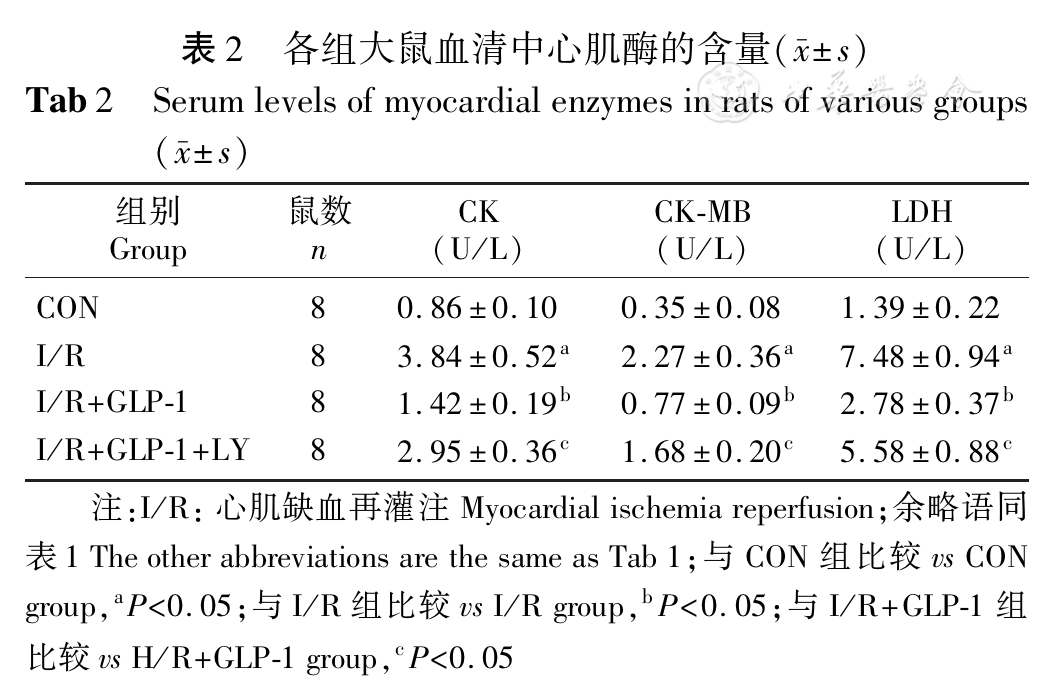
I/R组大鼠心肌组织中p-PI3K、p-Akt、Bcl-2的蛋白表达量显著低于对照组,Bax、Caspase-3的蛋白表达量显著高于对照组;I/R+GLP-1组心肌组织中p-PI3K、p-Akt、Bcl-2的蛋白表达量显著高于I/R组(均P<0.05,
注:略语同图1和表2 The abbreviations are the same as Fig 1 and Tab 2;与CON组比较vs CON group,aP<0.05;与I/R组比较vs I/R group, bP<0.05
注:略语同图1和表2 The abbreviations are the same as Fig 1 and Tab 2;与CON组比较vs CON group,aP<0.05;与I/R组比较vs I/R group,bP<0.05;与I/R+GLP-1组比较vs I/R+GLP-1 group,cP<0.05
心肌缺血再灌注损伤是造成心肌梗死再灌注治疗预后不良的重要原因,如何减轻心肌缺血再灌注损伤是心血管领域的研究热点。GLP-1是具有多种生物学效应的内分泌激素,已有研究报道了GLP-1激动剂对高糖所致的心肌细胞和内皮细胞损伤具有保护作用[6,7],但关于该药物对心肌细胞H/R损伤是否具有保护作用并不明确。在上述研究中,为了明确GLP-1激动剂对心肌细胞H/R损伤的影响,我们首先对H/R条件下心肌细胞的增殖活力和细胞凋亡率进行了分析,结果显示H/R组心肌细胞的增殖活力显著降低、细胞凋亡率显著增多。进一步分析GLP-1激动剂处理对H/R所致心肌细胞损伤的影响发现,H/R+GLP-1组心肌细胞的增殖活力值显著高于H/R组,细胞凋亡率显著低于H/R组,表明GLP-1激动剂对H/R所致心肌细胞损伤具有保护作用。
心肌细胞中含有CK、CK-MB、LDH等多种代谢酶,参与细胞能量和物质代谢过程的调控。在离体培养条件下,H/R所致心肌细胞损伤会导致细胞破裂、胞浆中的代谢酶释放进入细胞外[8,9,10]。为了进一步验证GLP-1激动剂对H/R所致心肌细胞损伤的保护作用,本研究分析了细胞培养基中上述代谢酶的含量,结果显示H/R组心肌细胞培养基中CK、CK-MB、LDH的含量显著高于对照组;而H/R+GLP-1组心肌细胞培养基中CK、CK-MB、LDH的含量显著低于H/R组。这就说明H/R条件会造成心肌细胞破裂、代谢酶释放进入培养基,GLP-1激动剂则能减轻H/R所引起心肌细胞损伤的程度,释放进入培养基的代谢酶含量显著降低。
线粒体凋亡途径是目前研究最为广泛的心肌细胞凋亡机制之一,线粒体凋亡途径过度激活是在心肌细胞H/R损伤过程中发挥重要作用的病理环节。Bax和Bcl-2是调节线粒体途径细胞凋亡的重要分子,缺氧以及缺氧复氧能够增加Bax的表达并使Bax转位到线粒体表面,增加线粒体膜对细胞色素C的通透性,由线粒体进入胞浆的细胞色素C能够启动Caspase级联反应并最终激活Caspase-3、执行细胞凋亡过程[11,12];Bcl-2能够与Bax形成异源二聚体并阻碍Bax向线粒体表面的转位,进而抑制线粒体途径的细胞凋亡[13,14]。本研究的结果显示,H/R组心肌细胞中Bax、Caspase-3的蛋白表达量显著高于对照组,Bcl-2的蛋白表达量显著低于对照组;而H/R+GLP-1组心肌细胞中Bax、Caspase-3的蛋白表达量显著低于H/R组,Bcl-2的蛋白表达量显著高于H/R组,表明GLP-1激动剂能够抑制H/R所引起的心肌细胞线粒体途径凋亡。
PI3K/Akt信号通路是调节细胞凋亡、存活、增殖等生物学过程的重要通路,PI3K以磷酸化的形式激活后能够作用于Akt并使其也发生磷酸化,磷酸化的Akt能够调节靶基因的表达并促进细胞增殖、抑制细胞凋亡[15,16]。本研究H/R组心肌细胞中p-PI3K、p-Akt的表达量显著降低,而H/R+GLP-1组心肌细胞中p-PI3K、p-Akt的表达量显著升高,表明缺氧复氧能够抑制PI3K/Akt信号通路,而GLP-1激动剂则能激活PI3K/Akt信号通路,进而通过该信号通路来实现对心肌细胞的保护作用。为了明确GLP-1激动剂对心肌细胞H/R损伤的保护作用是否通过激活PI3K/Akt信号通路来实现,我们采用PI3K特异性抑制剂LY294002与GLP-1激动剂共同处理心肌细胞并对H/R所致心肌细胞损伤的程度进行了观察,结果显示,H/R+GLP-1+LY组心肌细胞的增殖活力以及细胞中Bcl-2的表达量均显著低于H/R+GLP-1组,细胞凋亡率、培养基中CK、CK-MB、LDH的含量以及细胞中Bax、Caspase-3的表达量均显著高于H/R+GLP-1组,提示GLP-1激动剂通过PI3K/Akt信号通路阻止H/R所致的心肌细胞损伤。最后,我们还通过心肌缺血再灌注损伤的动物模型证实,GLP-1能够减轻心肌组织的缺血再灌注损伤,而PI3K的特异性抑制剂能够削弱GLP-1这一作用。
综上所述,缺氧复氧可抑制PI3K/Akt信号通路并造成心肌细胞损伤,GLP-1激动剂通过激活PI3K/Akt信号通路来减轻缺氧复氧所造成的心肌细胞损伤。
[1] Spath NB, Mills NL, Cruden NL. Novel cardioprotective and regenerative therapies in acute myocardial infarction: a review of recent and ongoing clinical trials[J]. Future Cardiol, 2016,12(6):655-672.
[2] Hollander MR, de Waard GA, Konijnenberg LS, et al. Dissecting the effects of ischemia and reperfusion on the coronary microcirculation in a rat model of acute myocardial infarction[J]. PLoS One, 2016,11(7):e0157233.
[3] Lakota J. Molecular mechanism of ischemia-reperfusion injury after myocardial infarction and its possible targeted treatment[J]. Int J Cardiol, 2016,1(220):571-572.
[4] Rizzo M, Abate N, Chandalia M, et al. Liraglutide reduces oxidative stress and restores heme oxygenase-1 and ghrelin levels in patients with type 2 diabetes: a prospective pilot study[J]. J Clin Endocrinol Metab, 2015,100(2):603-606.
[5] Okada K, Kotani K, Yagyu H, et al. Effects of treatment with liraglutide on oxidative stress and cardiac natriuretic peptide levels in patients with type 2 diabetes mellitus[J]. Endocrine, 2014,47(3):962-964.
[6] 张军,谷翔,黄问银,等. GLP-1对AGEs诱导H9C2心肌细胞凋亡的保护作用研究[J]. 中国药理学通报,2017,33(1):120-126.
[7] Jiang YQ, Chang GL, Wang Y, et al. Geniposide prevents hypoxia/reoxygenation-induced apoptosis in H9c2 cells: Improvement of mitochondrial dysfunction and activation of GLP-1R and the PI3K/AKT signaling pathway[J]. Cell Physiol Biochem, 2016,39(1):407-421.
[8] Engblom H, Heiberg E, Erlinge D, et al. Sample size in clinical cardioprotection trials using myocardial salvage index, infarct size, or biochemical markers as endpoint[J]. J Am Heart Assoc, 2016,5(3):e002708.
[9] Bagale KR, Ingle AS, Choudhary R. Contribution of various lipid profile parameters in determining creatine kinase-MB levels in unstable angina patients[J]. Int J Appl Basic Med Res, 2016,6(2):106-110.
[10] Danese E, Montagnana M. An historical approach to the diagnostic biomarkers of acute coronary syndrome[J]. Ann Transl Med, 2016,4(10):194.
[11] Schubert C, Raparelli V, Westphal C, et al. Reduction of apoptosis and preservation of mitochondrial integrity under ischemia/reperfusion injury is mediated by estrogen receptor β[J].Biol Sex Differ, 2016,7:53.
[12] Dong Y, VVR U, Przyklenk K. Inhibition of mitochondrial fission as a molecular target for cardioprotection: critical importance of the timing of treatment[J]. Basic Res Cardiol, 2016,111(5):59.
[13] Su F, Myers VD, Knezevic T, et al. Bcl-2-associated athanogene 3 protects the heart from ischemia/reperfusion injury[J]. JCI Insight, 2016,1(19):e90931.
[14] Wang Y, Zhang H, Chai F, et al. The effects of escitalopram on myocardial apoptosis and the expression of Bax and Bcl-2 during myocardial ischemia/reperfusion in a model of rats with depression[J]. BMC Psychiatry, 2014,14:349.
[15] Thomas CJ, Lim NR, Kedikaetswe A, et al. Evidence that the MEK/ERK but not the PI3K/Akt pathway is required for protection from myocardial ischemia-reperfusion injury by 3′,4′-dihydroxyflavonol[J]. Eur J Pharmacol, 2015,758:53-59.
[16] Tobisawa T, Yano T, Tanno M, et al. Insufficient activation of Akt upon reperfusion because of its novel modification by reduced PP2A-B55α contributes to enlargement of infarct size by chronic kidney disease[J]. Basic Res Cardiol, 2017,112(3):31.
