氧化应激在波动性高糖诱导MC3T3-E1成骨细胞凋亡中的作用
2018年1月
中华内分泌代谢杂志,第34卷第1期 第67页-第71页
张培,冯正平
随着人口老龄化,糖尿病和骨质疏松均成为当今常见的慢性代谢性疾病。波动性高糖较持续性高糖可能在糖尿病慢性并发症的发生发展中发挥着更重要的作用[1]。目前研究显示,波动性高糖可升高氧化应激水平,而氧化应激在糖尿病所引起的各种并发症中均有重要的作用[2,3,4,5,6]。本课题组前期研究显示,持续高糖状态可升高氧化应激水平,从而影响成骨细胞功能[7]。因此,本研究以MC3T3-E1成骨细胞为研究对象,探讨波动性高糖对细胞内氧化应激水平及对细胞凋亡和增殖的影响,为糖尿病性骨代谢异常的发病机制提供理论基础。
小鼠MC3T3-E1成骨细胞购自中国科学院上海细胞库,α-MEM培养基购于HyClone;胎牛血清由德国PAN公司生产;N-乙酰半胱氨酸(N-acetyl-L-cysteine,NAC)购于碧云天公司;CCK-8试剂盒购于日本同仁化学研究所;DCFH-DA试剂盒购于中国上海贝博公司;Bax和Bcl-2兔源多克隆抗体均购自CST,辣根过氧化物酶(HRP)标记山羊抗兔IgG二抗购自北京中杉金桥公司。
小鼠MC3T3-E1成骨细胞培养于含10%胎牛血清、1%丙酮酸钠和1%青霉素/链霉素的α-MEM培养基中。体外培养的MC3T3-E1成骨细胞随机分为正常对照组(5.5 mmol/L葡萄糖)、NAC组(5.5 mmol/L葡萄糖+NAC)、持续性高糖组(25 mmol/L葡萄糖)、持续高糖+NAC组、波动性高糖组(5.5/25 mmol/L葡萄糖)和波动性高糖+NAC组。波动性高糖组每8 h更换5.5 mmol/L和25 mmol/L葡萄糖的培养基,其余组均与波动性高糖组同样每8 h更换培养基,共作用48 h。
采用CCK-8试剂盒检测细胞增殖。96孔板内细胞干预结束后,弃掉各孔中旧培养基,每孔加入100 μl新鲜培养基和10 μl CCK-8溶液,37℃、5% CO2孵育1~4 h,酶标仪测定450 nm处的吸光度。
12孔板内细胞干预结束后,去除细胞培养基,按1∶1 000比例装载DCFH-DA探针,37℃、5% CO2孵育45 min。孵育结束后无血清培养基洗涤3次,于避光条件下用倒置荧光显微镜观察各组细胞绿色荧光强度。
各处理组干预结束后,分别对每组细胞消化、离心并用PBS洗涤3次后收集各组细胞,用Annexin-FITC/PI对各组细胞进行染色,并用流式细胞仪检测及计算各组细胞凋亡率。
提取各处理组细胞蛋白,BCA法测定各组蛋白浓度。采用SDS-PAGE凝胶进行蛋白电泳,转膜至PVDF膜,5%脱脂奶粉室温封闭2 h以上,4℃敷育一抗过夜,室温敷育二抗1h,用ECL显影剂在避光环境下于图像采集仪内曝光成像。用Fusion软件计算各组蛋白的相对表达量。
全文所有统计分析均采用Spss 22软件完成,数据用
与正常对照组相比,持续性高糖组和波动性高糖组MC3T3-E1成骨细胞增殖均显著下降(均P<0.01)。与持续性高糖组相比,波动性高糖组细胞增殖下降更明显,差异有统计学意义(P<0.05,

注:CON:对照组Control group;HG:高糖组High glucose group;GF:波动性高糖组Glucose fluctuation group;与CON组相比vs CON group,aP<0.01;与HG组相比vs HG group,bP<0.05
与正常对照组相比,持续性高糖组和波动性高糖组细胞凋亡率均升高(P<0.05或P<0.01)。与持续性高糖组相比,波动性高糖组细胞凋亡显著增多(P<0.01)。应用抗氧化剂NAC后,持续性高糖及波动性高糖所导致的细胞凋亡均明显减少(均P<0.01,
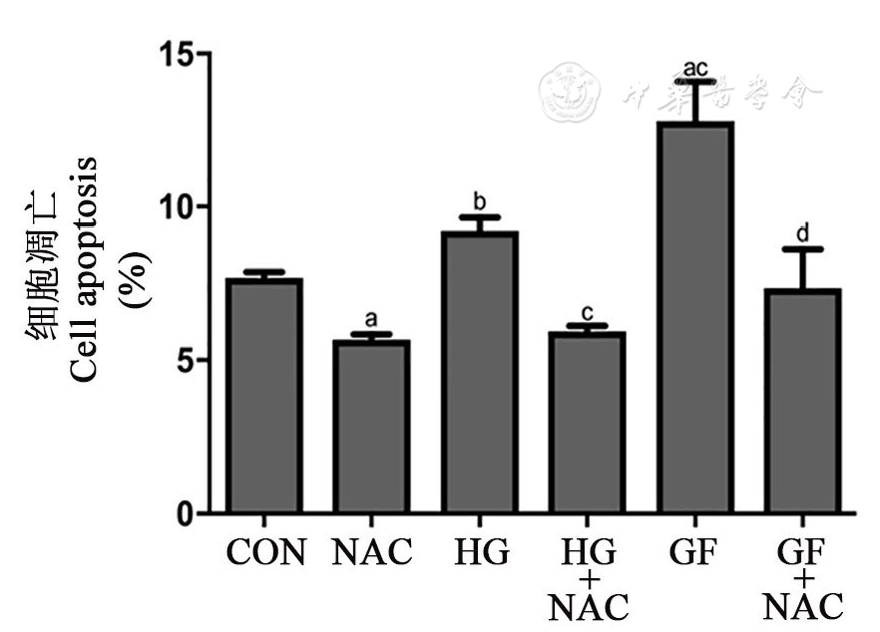
注:NAC: N-乙酰半胱氨酸N-acetyl-L-cysteine;余略语同图1 The other abbreviations are the same as Fig 1;与CON组相比vs CON group,aP<0.01,bP<0.05;与HG组相比vs HG group,cP<0.01;与GF组相比vs GF group,dP<0.01
Western印迹结果显示,与正常对照组相比,持续性高糖组和波动性高糖组Bcl-2蛋白表达均明显减少(P<0.01),Bax表达增加(P<0.05或P<0.01)。与持续性高糖组比较,波动性高糖组Bcl-2表达显著减少(P<0.05),Bax表达显著增多(P<0.05)。加入抗氧化剂后,持续性高糖组和波动性高糖组Bcl-2表达均升高(P<0.05或P<0.01),Bax表达量减少(P<0.05或P<0.01,

注:略语同图1和图2 The abbreviations are the same as Fig 1 and Fig 2;与CON组相比vs CON group,aP<0.05, bP<0.01;与HG组相比vs HG group,cP<0.05;与GF组相比vs GF group,dP<0.01
荧光显微镜下观察可见持续高糖组和波动性高糖组DCFH-DA探针荧光强度较正常对照组均增强,波动性高糖组增强程度更为明显。说明,持续高糖组和波动性高糖组细胞内ROS产生量均增多,其中,波动性高糖组上升幅度更大。荧光结果表示,波动性高糖加重了持续性高糖引起的细胞内氧化应激水平的升高(
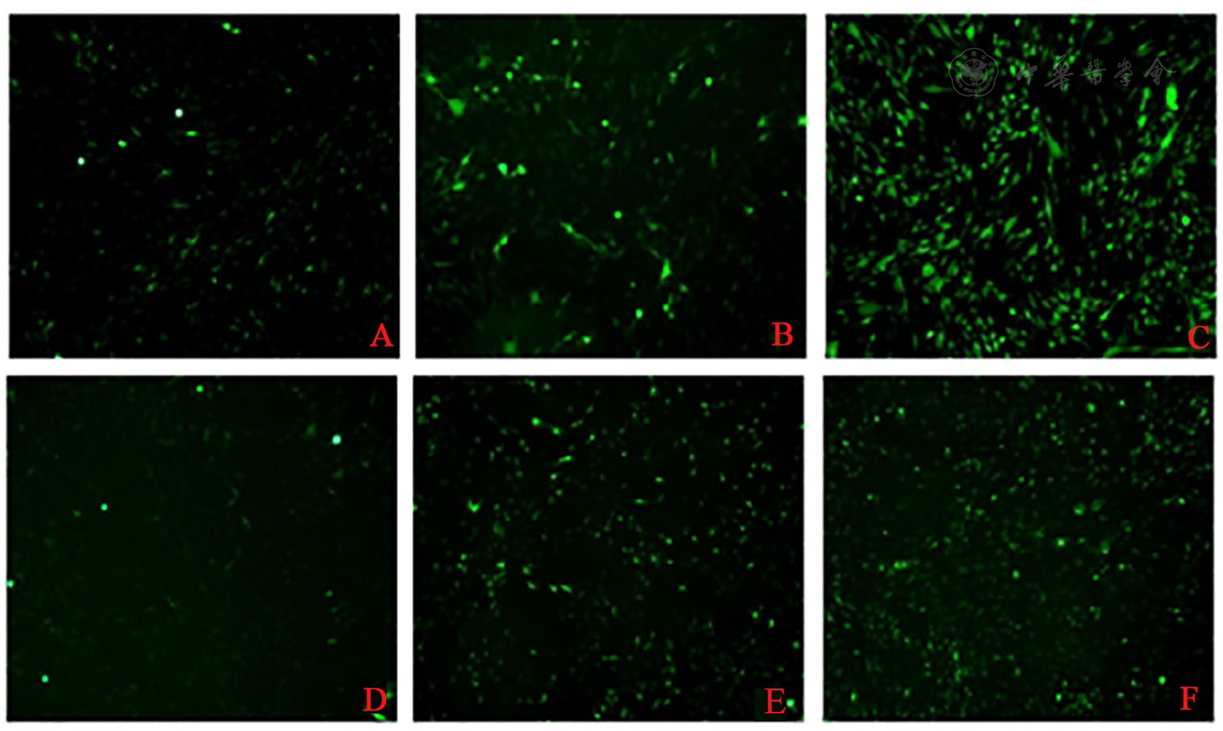
注:ROS:活性氧簇Reactive oxygen species;A:CON组CON group;B: HG组HG group;C: GF组GF group;D: NAC组NAC group;E: HG+NAC组HG+NAC group;F:GF+NAC组GF+NAC group;余略语同图1和图2 The other abbreviations are the same as Fig 1 and Fig 2
近年研究表明,波动性高糖在糖尿病引起的各种慢性并发症中均具有重要的作用[3,4,5,6,7,8,9,10,11]。1型与2型糖尿病患者体内,波动性高糖与氧化应激呈现出高度相关性;并且,相比持续性高糖,波动性高糖可引起更高的氧化应激水平[8,9]。此外,波动性高糖可引起猪体内多项氧化应激及炎症标志物的升高,引起细胞凋亡增多[10];在波动性高糖下,也可引起兔体内氧化应激和炎症因子水平的上升,并导致内皮细胞凋亡增多及胰岛素信号的损害[11]。波动性高糖可增加胰岛β细胞的凋亡,并减少胰岛素的分泌[4]。此外,波动性高糖还可引起内皮细胞和Schwann细胞氧化应激水平的升高,导致细胞凋亡率增加,从而引起严重的心血管损伤及糖尿病性外周神经病变[5,6]。说明波动性高糖所引起的氧化应激在多种糖尿病并发症中均有十分重要的作用。
骨稳态的维持依赖成骨细胞与破骨细胞功能的稳定[12]。而在高糖环境下,主要以成骨细胞功能障碍为主[13]。体外实验表明,氧化应激会抑制成骨细胞分化,促进成骨细胞凋亡[14,15]。本课题组前期研究也表明,持续性高糖可引起成骨细胞内氧化应激水平增高,从而导致细胞的凋亡率增加,影响细胞功能[16]。可见,氧化应激也影响着成骨细胞的状态及功能。
本研究以MC3T3-E1成骨细胞为研究对象,设定持续性高糖及波动性高糖组的葡萄糖浓度分别为25 mmol/L和5.5/25 mmol/L,观察持续性高糖及波动性高糖对成骨细胞的影响及其可能机制。结果显示,持续性高糖及波动性高糖均可导致成骨细胞增殖能力下降及细胞凋亡增加,且在波动性高糖状态下影响更加显著,这与周玮等[17]在MG63成骨细胞系中所取得的研究结果相似。运用流式细胞术检测到波动性高糖加重了持续性高糖引起的细胞凋亡,且抑制了细胞的增殖能力。进一步检测了各组Bcl-2及Bax蛋白表达,发现持续性高糖和波动性高糖可导致Bcl-2表达减少,Bax表达增多,且在波动性高糖下更明显。陆正平等[18]的研究显示,持续性高糖及波动性高糖阻滞MG63细胞周期,可使G1期细胞的比例增加,S期细胞比例减少,诱导细胞凋亡。此外,本研究应用DCFH-DA荧光探针检测了不同状态下细胞内ROS水平。结果显示,持续性高糖及波动性高糖均引起细胞内氧化应激水平增高,且在波动性高糖下更为显著。细胞内ROS的增多与成骨细胞功能以及骨质疏松的发生与发展均有着密切的联系[19,20,21]。加入抗氧化剂NAC后,发现NAC可以明显拮抗ROS的生成并改善由持续性高糖及波动性高糖所引起的MC3T3-E1成骨细胞凋亡率的增加。同时,国内多项研究[21,22,23]发现,丹参素及硫辛酸等均可通过降低细胞内氧化应激水平,从而抑制成骨细胞凋亡,并促进其增殖。以上研究结果均显示,氧化应激水平的升高在MC3T3-E1成骨细胞的凋亡中有着重要的作用。ROS在细胞内可引起细胞内的钙超载[24],影响细胞内的自噬水平[16],并且可以激活多种信号通路。波动性高糖通过氧化应激对成骨细胞产生影响的下游具体分子机制仍不清楚,有待进一步的研究。
综上所述,波动性高糖可通过升高MC3T3-E1成骨细胞内氧化应激水平,从而导致细胞增殖能力下降及细胞凋亡率升高。因此,氧化应激可能在糖尿病性骨代谢异常的发病机制中发挥重要作用。
[1] Oud L, Spellman C. The association of glucose variability and home discharge among survivors of critical illness managed with a computerized decision-support tool for glycemic control [J]. J Diabetes Sci Technol, 2014,8(2):277-285.
[2] Giacco F, Brownlee M. Oxidative stress and diabetic complications[J]. Circ Res, 2010,107(9):1058-1070.
[3] Yamagishi S. Role of advanced glycation end products(AGEs)in osteoporosis in diabetes[J]. Curr Drug Targets, 2011,12(14):2096-2102.
[4] Kim MK, Jung HS, Yoon CS, et al. The effect of glucose fluctuation on apoptosis and fluctuation of INS-1 pancreatic beta cells[J]. Korean Diabetes J, 2010,34(1):47-54.
[5] Wu N, Shen H, Liu H, et al. Acute blood glucose fluctuation enhances rat aorta endothelial cell apoptosis, oxidative stress and pro-inflammatory cytokine expression in vivo[J]. Cardiovasc Diabetol, 2016,15(1):109.
[6] Sun LQ, Xue B, Lin XJ, et al. Inhibitory effects of salvianolic acid B on apoptosis of Schwann cells and its mechanism induced by intermittent high glucose[J]. Life Sci, 2012,90(3-4):99-108.
[7] 王小菊,冯正平,李济伶,等. 氧化应激在高糖诱导成骨细胞凋亡中的作用[J]. 重庆医科大学学报,2015,40(7):960-964.
[8] Monnier L, Mas E, Ginet C, et al. Activation of oxidative stress by acute glucose fluctuations compared with sustained chronic hyperglycemia in patients with type 2 diabetes[J]. JAMA, 2006,295(14):1681-1687.
[9] Meng X, Gong C, Cao B, et al. Glucose fluctuations in association with oxidative stress among children with T1DM: comparison of different phases[J]. J Clin Endocrinol Metab, 2015,100(5):1828-1836.
[10] Xia J, Qu Y, Yin C, et al. Optical coherence tomography assessment of glucose fluctuation impact on the neointimal proliferation after stent implantation in a diabetic/hypercholesterolemic swine model[J]. Int Heart J, 2017,58(4):608-614.
[11] Wu N, Shen H, Wang Y, et al. Role of the PKCβII/JNK signaling pathway in acute glucose fluctuation-induced apoptosis of rat vascular endothelial cells[J]. Acta diabetologica, 2017,54(8):727-736.
[12] Ducy P, Schinke T, Karsenty G. The osteoblast: a sophisticated fibroblast under central surveillance[J]. Science, 2000,289(5484):1501-1504.
[13] Massé PG, Pacifique MB, Tranchant CC, et al. Bone metabolic abnormalities associated with well-controlled type 1 diabetes(IDDM)in young adult women: a disease complication often ignored or neglected[J]. J Am Coll Nutr, 2010,29(4):419-429.
[14] Bai XC, Lu D, Bai J, et al. Oxidative stress inhibits osteoblastic differentiation of bone cells by ERK and NF-kappaB[J]. Biochem Biophys Res Commun, 2004,314(1):197-207.
[15] Fatokun AA, Stone TW, Smith RA. Hydrogen peroxide-induced oxidative stress in MC3T3-E1 cells: The effects of glutamate and protection by purines[J]. Bone, 2006,39(3):542-551.
[16] Wang X, Feng Z, Li J, et al. High glucose induces autophagy of MC3T3-E1 cells via ROS-AKT-mTOR axis[J]. Mol Cell Endocrinol, 2016,429:62-72.
[17] 周玮,万利,张勇,等. 高糖及高糖波动对MG63细胞株氧化应激的影响[J]. 中国骨质疏松杂志,2011,12(4):1048-1051.
[18] 陆卫平,周玮. 不同浓度葡萄糖对MG63细胞增殖和细胞周期的影响[J]. 南京医科大学学报(自然科学版), 2010,30(9):1255-1257.
[19] Feng YL, Tang XL. Effect of glucocorticoid-induced oxidative stress on the expression of Cbfa1[J]. Chem Biol Interact, 2014,207:26-31.
[20] Wauquier F, Leotoing L, Coxam V, et al. Oxidative stress in bone remodeling and disease[J]. Trends Mol Med, 2009,15(10):468-477.
[21] Liang D, Xiang L, Yang M, et al. ZnT7 can protect MC3T3-E1 cells from oxidative stress-induced apoptosis via PI3K/Akt and MAPK/ ERK signaling pathways[J].Cell Signal, 2013,25(5):1126-1135.
[22] 王秉义,潘剑. 丹参素拮抗氧化应激所致骨质疏松并通过PI3k/Akt通路减少成骨细胞的凋亡[J]. 中国骨质疏松杂志,2017,23(1):1-5.
[23] 付卓栋,付超,孙慧君,等. 硫辛酸对体外培养的MC3T3-E1成骨细胞骨形成的影响[J]. 中华骨质疏松与骨矿盐疾病杂志,2016,9(1):43-51.
[24] 郭宝磊,杨茂伟,梁单,等. 高糖通过提高ROS水平和钙超载诱导小鼠MC3T3-E1成骨细胞凋亡[J]. 中国病理生理杂志,2012,28(2):292-297.
