中老年人群中肝酶学指标与糖耐量受损发病率关系的队列随访研究
2018年1月
中华内分泌代谢杂志,第34卷第1期 第16页-第23页
张淼,张巧,肖芳芳,彭年春,胡颖,时立新
肝脏是脂肪和胰岛素代谢的重要器官,肝脏酶学的改变,包括丙氨酸氨基转移酶(ALT)、γ-谷氨酰转移酶(GGT)、天门冬氨酸氨基转移酶(AST)的改变,既是肝细胞在脂代谢紊乱时受损的表现,也是胰岛素抵抗的标志[1,2]。已有研究表明肝酶学的变化与代谢综合征[3]和糖代谢异常密切相关[4]。最近的横断面及纵向研究表明在不同的人种中血清ALT和GGT水平的变化与2型糖尿病的发生有关[5,6,7,8]。然而肝酶水平与糖尿病前期[包括空腹血糖调节受损(IFG)和糖耐量受损(IGT)]关系的研究报道较少,且多为探讨肝酶学指标与IFG患病率关系的横断面研究[9,10],与IGT关系的研究不多,且结论并不一致。中国上海关于肝酶水平与糖尿病前期的横断面研究[11]显示ALT、GGT升高均与IGT患病率增加有关。Nannipieri等[12]关于墨西哥城糖尿病的纵向研究却显示ALT、AST均与IGT发生无关,基线GGT水平升高者发生IGT的风险增加。Bogalusa心脏研究[13]中回归分析却显示ALT、GGT与IGT的发生无直接联系。在中国人群中肝脏酶学指标与IGT发病风险的关系需要更多的研究进行明确。
本研究基于一个大样本量社区中老年人群调查,对肝酶学指标与糖尿病前期发病率的关系进行队列研究,以明确肝酶学指标对IGT发病风险的影响。
1.本研究经贵州医科大学附属医院伦理委员会批准,所有参加调查的居民均签署了知情同意书。研究对象来自REACTION研究[14],这是在中国20个社区进行的2型糖尿病与肿瘤风险的流行病学研究,其研究目的、研究对象和研究设计等已有文章详细描述。
本研究是REACTION研究的一部分。采用整群随机抽样方法调查2011年3月至8月贵阳市云岩区居住5年以上的40岁及以上中老年人群,共10 140人,除去调查表登记不全等因素的数据后,共计10 019人。研究排除基线有以下情况的受试者:(1)糖代谢异常者(包括糖尿病及糖尿病前期);(2)有肝脏疾病史(包括肝炎、肝硬化等)及丙氨酸氨基转移酶升高(ALT>55 IU/L),或恶性肿瘤病史者;(3)每日酒精摄入量超过30 g/d者;(4)充血性心力衰竭、慢性肾功能不全、严重的精神疾病(包括抑郁症、癫痫、精神分裂症)及妊娠者;(5)正在服用调脂药、糖皮质激素治疗者。最终有4 228人进入研究。
2.2014年7月至10月对上述人群进行了再次调查,基线中符合纳入标准的患者共4 228人,其中3 223人进行了追踪随访(随访率76%),其中死亡35人,最终完成随访3 188人。随访人群中新诊断糖尿病61人,正常糖耐量(NGT)者2 400人,IFG者91人,IGT者636人。随访人群再次进行了与基线同样的问卷调查和实验室检查。
由经过培训的调查人员对被调査者进行详细指导后进行问卷填写。问卷内容包括:人口学信息(性别、年龄、民族、文化程度等);疾病状况(疾病的家族史、患病史、诊治情况等);女性月经生育情况(包括初潮年龄、绝经年龄、生育次数、流产次数、是否使用过避孕药物等);生活习惯(吸烟、饮酒情况等),吸烟状况定义为不吸烟组、偶尔吸烟组(少于每天1次,或每周7支)及经常吸烟组(每天或几乎每天),饮酒状况定义为不饮酒组、偶尔饮酒组(不是每周)和经常饮酒组(每周或几乎每周)。有规律运动定义为中等或剧烈运动每周至少3次,且每次0.5 h以上。
包括身高、体重、腰围的测量。血压测量采用欧姆龙电子血压计,取3次读数的平均值。体重指数(BMI)=体重(kg)/身高2(m)2。
(1)所有调查对象均隔夜空腹10 h以上,行口服葡萄糖耐量试验(OGTT)分别抽取空腹及2 h静脉血用于血糖检测。空腹静脉血离心后取血清-70℃保存,分批干冰运至研究中心统一检测其他生化指标(ARCHITECT ci16200,Abbott Laboratories,USA)。(2)血浆葡萄糖浓度采用己糖激酶法测定;高密度脂蛋白胆固醇(HDL-C)用加速选择性溶解剂法,低密度脂蛋白胆固醇(LDL-C)用均相酶测定法,三酰甘油(TG)用磷酸甘油氧化酶法,总胆固醇(TC)用酶试剂法测定。胰岛素测定用化学发光法测定。
糖代谢异常诊断按世界卫生组织2006年标准,IFG定义为空腹血糖(FPG)在6.1~6.9 mmol/L,OGTT 2 h血糖(2hPG)<7.8 mmol/L;IGT定义为FPG<7.0 mmol/L,2hPG≥7.8且<11.1 mmol/L;糖尿病定义为FPG≥7.0 mmol/L,或2hPG≥11.1 mmol/L。稳态模型评估的胰岛素抵抗指数(HOMA-IR)计算方法为空腹胰岛素(FINS, mIU/L)×FPG(mmol/L)/22.5。
由Excel建立数据库录入相应数据,应用SPSS 17.0软件统计分析。正态分布数据以
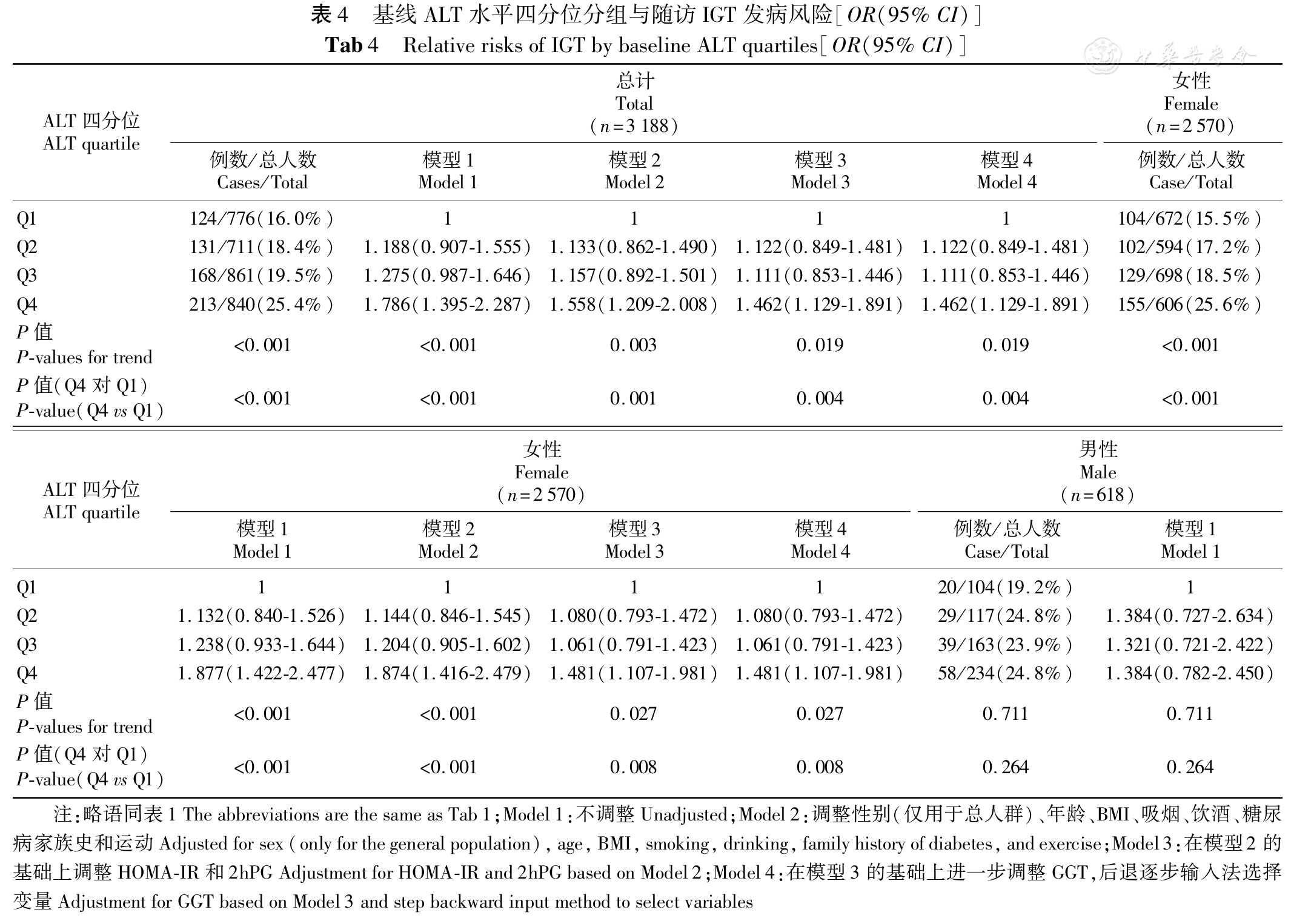
研究人群根据肝酶学各指标水平四分位法分为4组,分组比较随访3年后IGT发病率。线性回归分析各组IGT风险,以四分位法第1组(肝脏酶学指标最低组)作为对照,并分析年龄、性别、职业、收入、吸烟史、饮酒史、是否规律运动、BMI、HOMA-IR、ALT、AST和GGT等因素的影响,其中HOMA-IR、ALT、AST和GGT等非正态分布,取其自然对数进行统计。Logistic回归模型比较各组IGT发生风险。
对总人群随访3年,有636人进展为IGT,91人进展为IFG,61人进展为2型糖尿病,2 400人为NGT。与NGT组比较,糖代谢异常各组基线年龄、BMI、腰围、收缩压、舒张压、FPG、2hPG、FINS、HOMA-IR、TG、ALT、GGT及有糖尿病家族史比例均较高(P<0.05),而基线HDL-C水平较低(P<0.05);基线AST水平各组无明显差异(
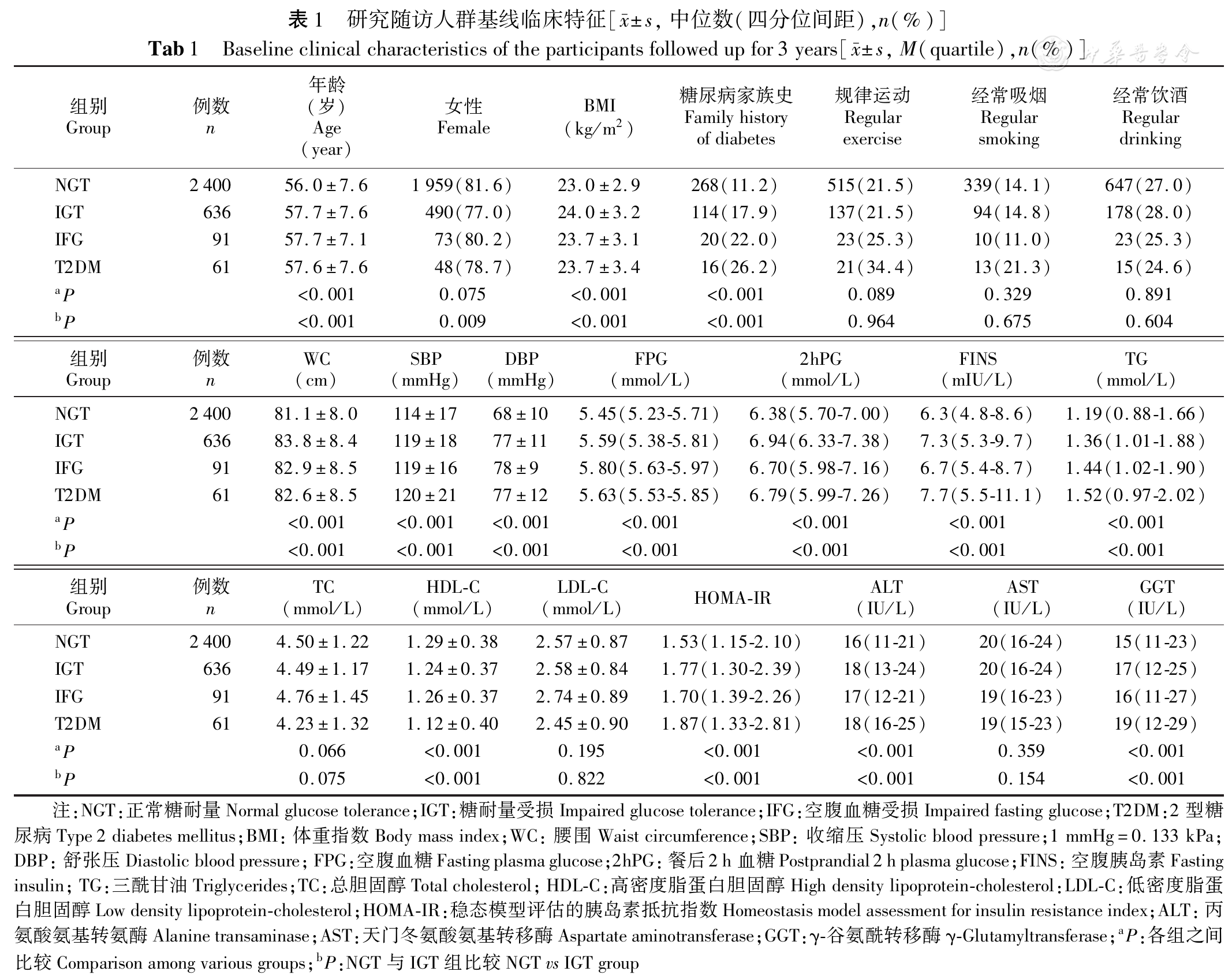
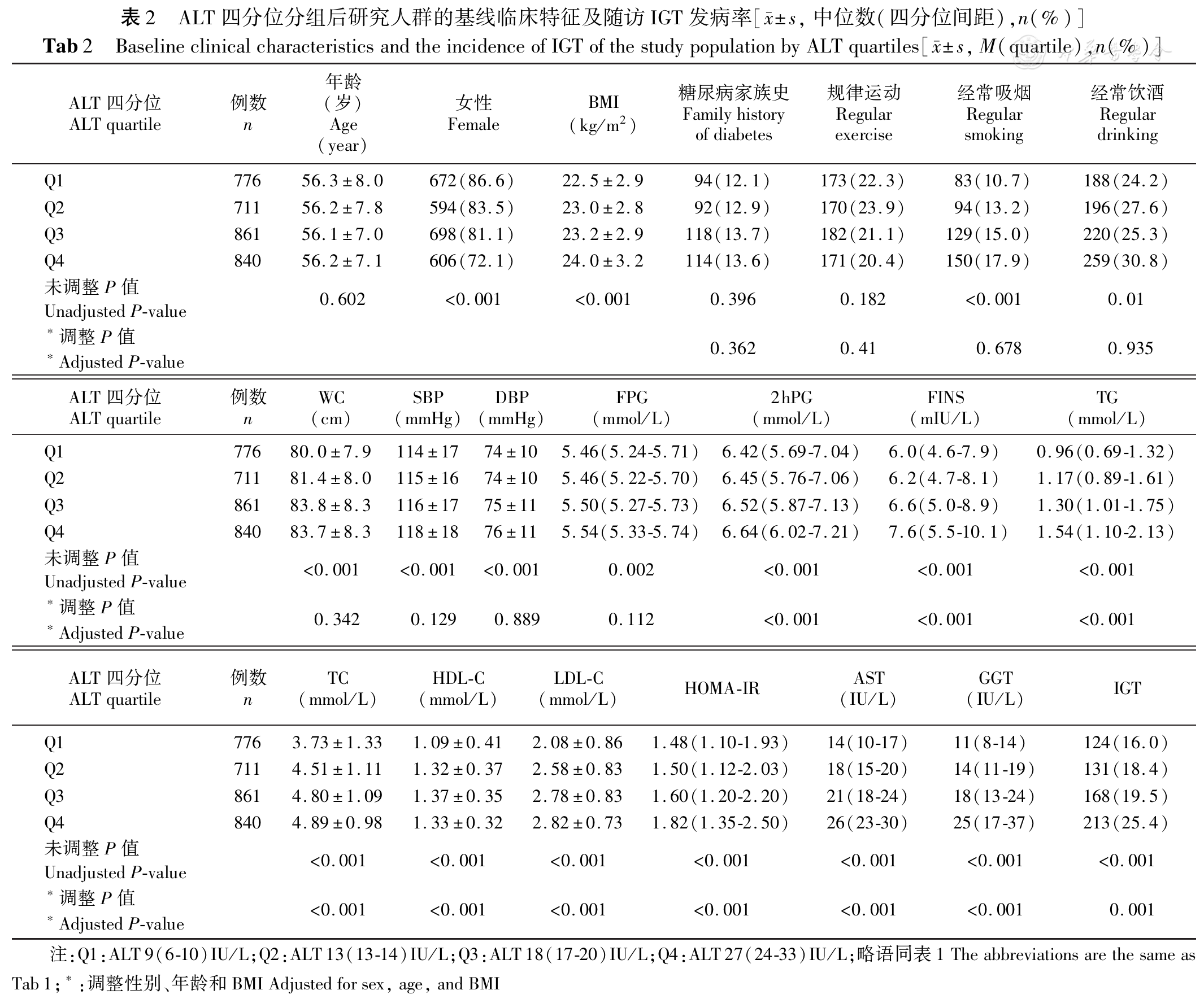
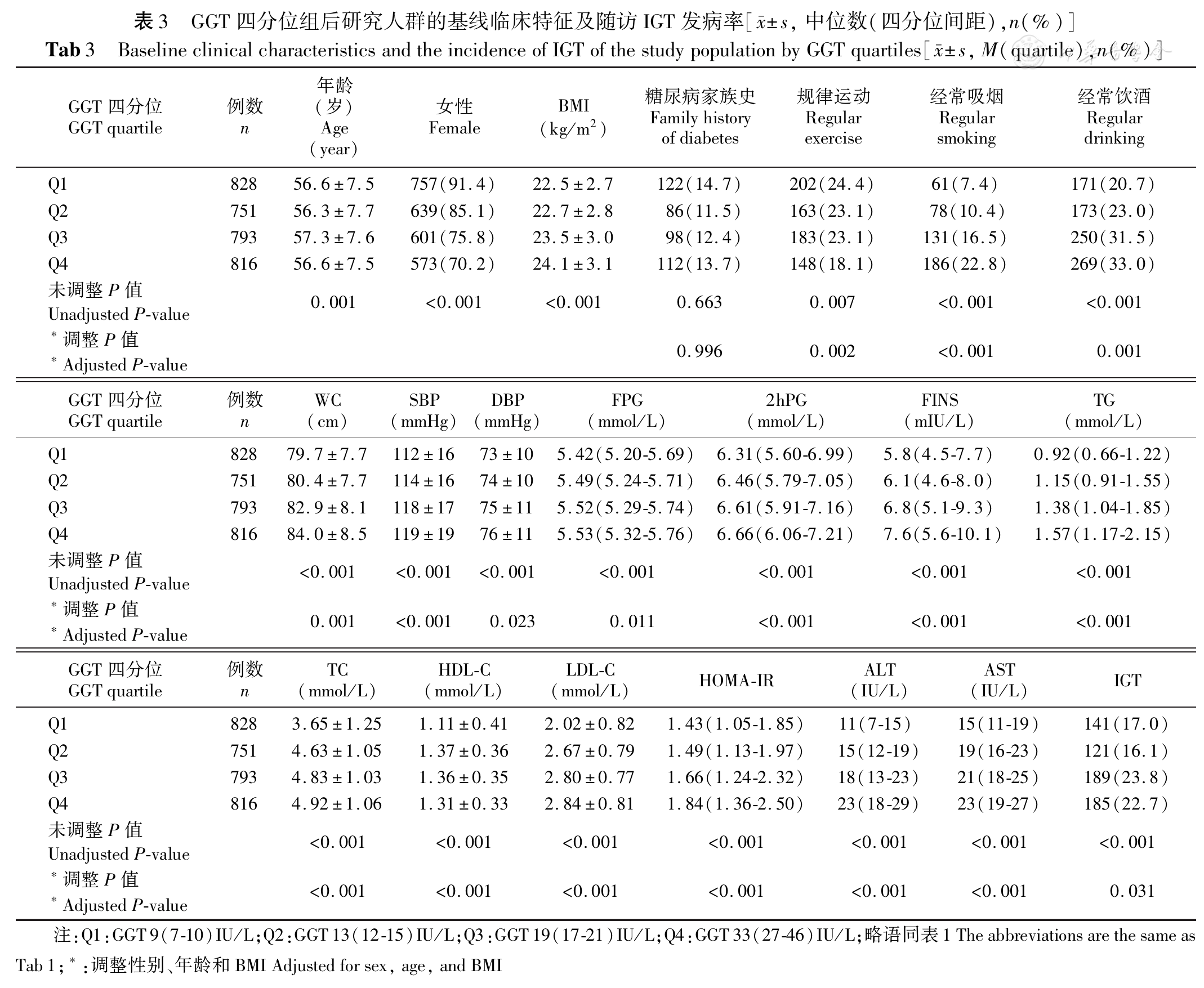
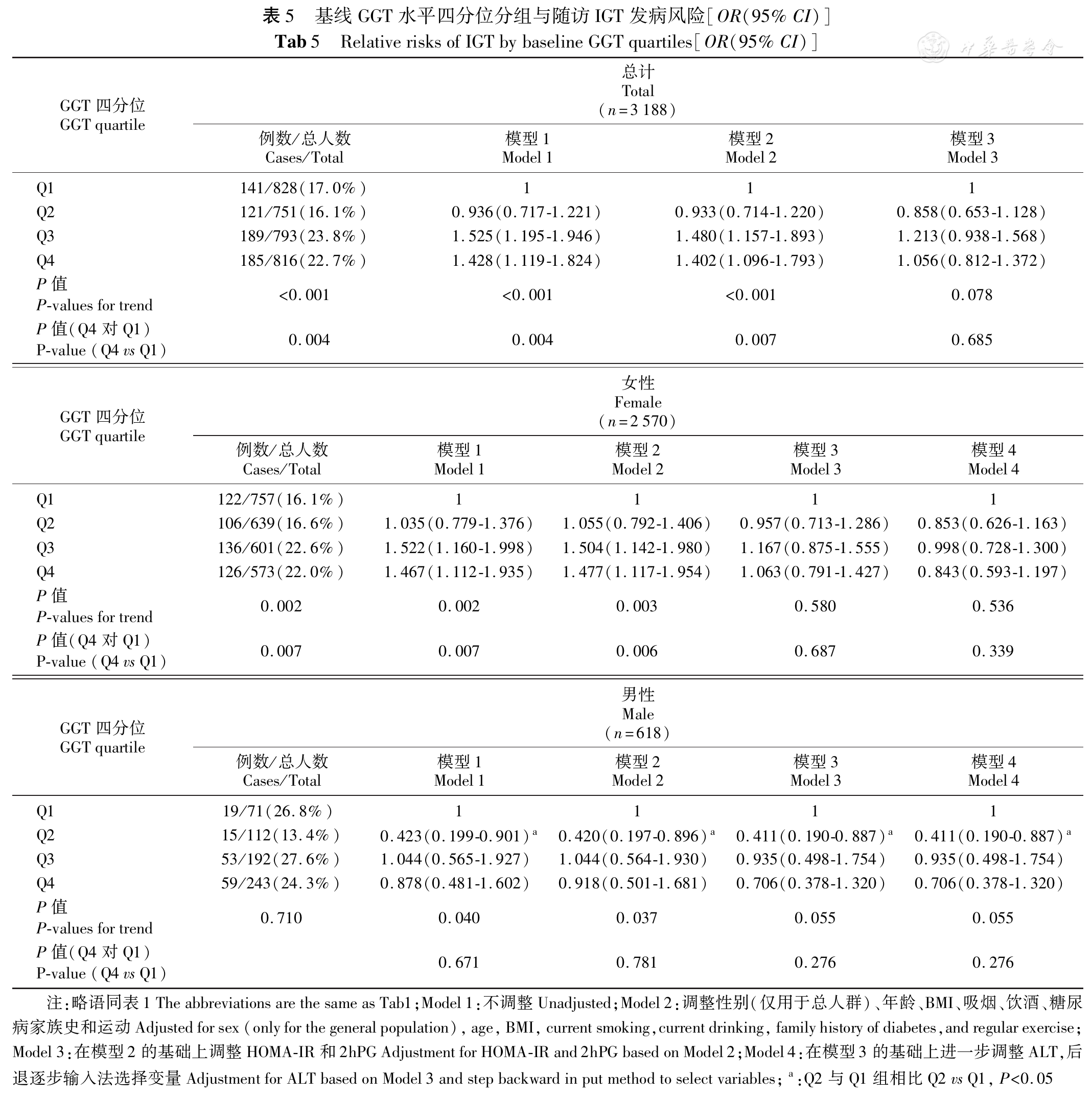
根据血清ALT、GGT四分位水平分别分为4组。
在2型糖尿病的进展过程中,病理生理学改变往往始于糖尿病前期[15]。研究发现糖尿病前期不仅仅有进展为糖尿病的风险,也可以导致心血管不良事件[16]。一项关于糖尿病的预防计划发现糖尿病视网膜病变可出现在IGT患者中[17]。故早期发现IGT并给予一定的干预措施有重要意义。
近期的多项前瞻性研究表明肝酶水平升高,尤其是GGT和ALT的升高可以预测糖尿病的发生,独立于糖尿病的常规危险因素如BMI、基线血糖水平和胰岛素抵抗[5,6,8]。本研究扩展了之前的研究,对基线肝酶水平与IGT发病风险的相关性进行了探讨。
目前,国内关于肝酶水平与糖尿病前期关系的研究主要集中在横断面研究。贾伟平课题组[11]对上海市3 756名长住居民进行横断面调查,发现随着ALT和GGT水平的增加,患糖尿病前期及糖尿病的人数相应增加。谢君辉等[18]对来自于湖北省天门市部分乡村的10 800名中年人进行横断面研究,结果发现不管在男性人群还是在女性人群中更高的GGT可预测IGT的发生,而ALT与糖尿病前期的相关性只在女性IGT患者有重要意义。而国内暂无关于肝酶水平与糖尿病前期关系的大样本量队列研究。
本研究对基线人群长达3年的随访,结果显示糖代谢异常组患者血清ALT和GGT水平均显著高于NGT组,且2型糖尿病及IGT患者血清ALT和GGT水平高于IFG患者。说明血清ALT和GGT水平与2型糖尿病和IGT关系更密切。
此外,血清ALT和GGT水平与BMI、腰围、血压、FPG、2hPG、FINS、HOMA-IR、LDL-C、TC、TG、经常吸烟人数比例、经常饮酒人数比例均呈正相关,而糖尿病家族史、规律运动与ALT、GGT水平无相关性。调整性别、年龄、BMI的影响后,腰围、血压、FPG、经常吸烟人数比例及经常饮酒人数比例与血清ALT的相关性消失。说明血清ALT水平与性别、年龄、BMI的关系密切。一项关于韩国非糖尿病成人研究[19]表明BMI是ALT升高的危险因素,这可能说明了ALT升高与内脏脂肪堆积有关。
而本研究对性别分组分析后发现仅女性患者ALT水平的升高是IGT的危险因素,这与谢君辉等[18]的横断面研究相吻合。但最近的一项关于日本男性肝酶水平与IGT关系的前瞻性研究表明ALT水平的升高与IGT关系密切[20]。可能与本研究中纳入男性人群较少有关。
本研究最终发现,中老年女性人群基线ALT水平与IGT的发病率有明显相关性,即随着ALT水平的增加IGT的发病率逐渐增加。即使调整了混杂因素,包括年龄、BMI、经常吸烟、经常饮酒、糖尿病家族史、规律运动、HOMA-IR、基线2hPG、GGT,这种相关性仍然存在。结果表明,肝酶水平的升高,尤其是ALT水平的升高可能是糖代谢异常早期的一个改变。
关于ALT与IGT相关性的机制可能原因如下:(1)ALT是转氨酶中与肝脏脂肪含量关系最密切的一种酶,动物实验和人体试验的研究表明肝脏的脂肪浸润和胰岛素抵抗会导致骨骼肌的胰岛素抵抗,而骨骼肌是IGT胰岛素抵抗主要发生场所[21]。(2)最近的一项研究发现血清二肽基肽酶的活性与非酒精性脂肪肝患者血清ALT呈正相关性,而血清二肽基肽酶活性会随着肠-胰岛素功能轴的障碍而增加[22]。在这个结果的基础上,Oka等[20]提出ALT可能不仅反映胰岛素抵抗状态,也可反映肠-胰岛轴的功能障碍,这可能导致糖耐量异常的发病机制。(3)一项关于胰岛素抵抗的动脉粥样硬化的研究显示血清ALT水平与胰岛素敏感性呈负相关,高水平的ALT可能降低胰岛素的敏感性,从而导致糖代谢异常[23]。
同时本研究发现GGT与IGT的发生无明显相关性。本研究根据ALT四分位水平来研究ALT与IGT相关性时发现进一步调整GGT,并没有减弱ALT与IGT的相关性;而且单独研究GGT水平与IGT相关性时调整相关混杂因素发现两者之间无有意义的联系。这与之前的前瞻性研究不同,这种研究的差异可能与研究人口种族的不同、研究方法的不同及试验设计的不同有关。但新近报道的关于白人一项孟德尔随机化研究[24]显示较高的GGT不是糖尿病前期的危险因素,降低GGT水平不可能预防糖尿病的发生。关于GGT是否可以预测IGT的发生还需要进一步研究。
本研究是一个大样本的前瞻性队列研究,所有的受试者都进行了OGTT试验,避免了错误的诊断,排除标准较严格。研究的人群为中老年,而这部分人群有较高的心血管风险,有重要的研究意义。
但是本研究也有一些不足,研究人群中男性居民相对较少,未能对受试者进行常规病毒性肝炎的筛查,如乙肝表面抗原及丙肝表面抗体检测。但Spradling等[25]对人群长达20年的研究显示乙型肝炎病毒感染对糖尿病的发展没有影响。最近的一项关于美国人口丙型肝炎病毒感染与糖尿病的关系研究显示丙型肝炎病毒感染与糖尿病也没有相关性[26]。
综上所述,ALT水平在正常范围内的升高,人群患IGT的风险越大,且这种相关性可能不受糖尿病家族史、胰岛素抵抗、肥胖等影响。故ALT可作为IGT的一个预测指标,对这部分人群进一步行口服葡萄糖耐量试验,若明确为IGT,尽早进行干预,可能会避免其发展为2型糖尿病及减少大血管并发症的风险。
[1] Hsiao JY, Wang CL, Hsia PJ, et al. Decreased insulin secretion and insulin sensitivity are associated with liver function in subjects with fasting glucose between 100 and 109 mg/dL in Taiwanese population [J]. Pancreas, 2007,35(4):343-347.
[2] Bonnet F, Ducluzeau PH, Gastaldelli A, et al. Liver enzymes are associated with hepatic insulin resistance, insulin secretion, and glucagon concentration in healthy men and women [J]. Diabetes, 2011, 60(6):1660-1667.
[3] Xu Y, Bi YF, Xu M, et al. Cross-sectional and longitudinal association of serum alanine aminotransaminase and γ-glutamyltransferase with metabolic syndrome in middle-aged and elderly Chinese people[J].J Diabetes, 2011,3(1):38-47.
[4] Jeon CY, Roberts CK, Crespi CM, et al. Elevated liver enzymes in individuals with undiagnosed diabetes in the U.S [J]. J Diabetes Complications, 2013,27(4):333-339.
[5] Ahn HR, Shin MH, Nam HS, et al.The association between liver enzymes and risk of type 2 diabetes: the Namwon Study [J]. Diabetol Metab Syndr, 2014,6(1):14.
[6] Cho NH, Jang HC, Choi SH, et al. Abnormal liver function test predicts type 2 diabetes: a community-based prospective study [J]. Diabetes Care, 2007,30(10):2566-2568.
[7] Ko SH, Baeg MK, Han KD, et al.Increased liver markers are associated with higher risk of type 2 diabetes [J].World J Gastroenterol, 2015,21(24):7478-7487.
[8] Kim CH, Park JY, Lee KU, et al. Association of serum gamma-glutamyltransferase and alanine aminotransferase activities with risk of type 2 diabetes mellitus independent of fatty liver [J]. Diabetes Metab Res Rev, 2009,25(1):64-69.
[9] Qin G, Lu L, Xiao Y, et al. A cross-sectional study of the relationship between serum liver enzymes level and the incidence of impaired fasting glucose in males and females[J]. Med Sci Monit, 2014,20(8):1319-1325.
[10] Nakanishi N, Nishina K, LI W, et al. Serum γ-glutamyltransferase and development of impaired fasting glucose or type 2diabetes in middle-aged Japanese men [J]. J Intern Med, 2003,254(3):287-295.
[11] Gao F, Pan JM, HouXH, et al. Liver enzymes concentrations are closely related to prediabetes: findings of the Shanghai Diabetes Study II(SHDS II)[J].Biomed Environ Sci, 2012,25(1):30-37.
[12] Nannipieri M, Gonzales C, Baldi S, et al. Liver enzymes, the metabolic syndrome and incident diabetes: the Mexico City diabetes study [J]. Diabetes Care, 2005,28(7):1757-1762.
[13] Nguyen QM, Srinivasan SR, Xu JH, et al.Elevated liver function enzymes are related to the development of prediabetes and type 2 diabetes in younger adults: the Bogalusa Heart Study [J]. Diabetes Care, 2011,34(12):2603-2607.
[14] Ning G, Reaction Study Group. Risk evaluation of cancers in Chinese diabetic individuals: a longitudinal(REACTION)study [J]. J Diabetes, 2012,4(2):172-173.
[15] Tabak AG, Herder C, Rathmann W, et al. Prediabetes: a high-risk state for diabetes development[J]. Lancet, 2012,379(9833):2279-2290.
[16] Lee M, Saver JL, Hong KS, et al. Effect of pre-diabetes on future risk of stroke: meta-analysis[J]. BMJ, 2012,344(7861):e3564.
[17] Diabetes Prerention Program Research Group. The prevalence of retinopathy in impaired glucose tolerance and recent-onset diabetes in the Diabetes Prevention Program [J]. Diabet Med, 2007, 24(2):137-144.
[18] Xie JH, Liu Q, Yang Y, et al. Correlation of liver enzymes with diabetes and pre-diabetes in middle-aged rural population in China[J]. J Huazhong Univ Sci Technolog Med Sci, 2016,36(1): 53-58.
[19] Kim J, Jo I. Relationship between body mass index and alanine aminotransferase concen- tration in non-diabetic Korean adults[J]. Eur J Clin Nutr, 2010,64(2):169-175.
[20] Oka R, Aizawa T, Yagi K, et al. Elevated liver enzymes are related to progression to impaired glucose tolerance in Japanes men [J]. Diabet Med, 2014,31(5):552-558.
[21] Nathan DM, Davidson MB, DeFronzo RA, et al. Impaired fasting glucose and impaired glucose tolerance: implications for care [J]. Diabetes Care, 2007,30(3):753-759.
[22] Firneisz G, Varga T, Lengyel G,et al. Serum dipeptidyl peptidase-4 activity in insulin resistant patients with non-alcoholic fatty liver disease: a novel liver disease biomarker [J].PLoS One, 2010,5(8):e12226.
[23] Hanley AJ, Wagenknecht LE, Festa A, et al. Alanine aminotransferase and directly measured insulin sensitivity in a multiethnic cohort: the Insulin Resistance Atherosclerosis Study [J]. Diabetes Care, 2007,30(7):1819-1827.
[24] Nano J, Muka T, Ligthart S, et al. Gamma-glutamyltransferase levels, prediabetes and type2 diabetes: a Mendelian Randomization study [J]. Int J Epidemiol, 2017,46(5):1400-1409.
[25] Spradling PR, Simons B, Narayanan M, et al.Incidence of diabetes mellitus in a population-based cohort of persons with chronic hepatitis B virus infection [J]. J Viral Hepat, 2013,20(7):510-513.
[26] Ruhl CE, Menke A, Cowie CC,et al.Relationship of hepatitis C virus infection with diabetes in the U.S. population [J].Hepatology, 2014,60(4):1139-1149.
