继发性甲状旁腺功能亢进患者术后持续性严重低钙血症的相关因素分析
2018年1月
中华内分泌代谢杂志,第34卷第1期 第57页-第60页
顾恒,耿小平,陈江明,谢胜学
低钙血症是甲状旁腺切除术(PTX)后最常见并发症,其发病率达50%~90%[1]。文献表明,年龄、切除甲状旁腺的数量、术前全段甲状旁腺素(iPTH)、术前血钙及术前碱性磷酸酶(ALP)是术后低血钙的危险因素,但术后低血钙大多在术后1周内恢复正常[2]。关于术后持续性严重低钙血症的相关因素尚无文献报道。本文回顾性分析87例患者PTX术后的临床病例资料,探寻PTX后持续性严重低钙血症的相关因素,初步建立PTX术后持续性严重低钙血症的防治策略。
收集2015年9月至2016年9月在安徽医科大学第二附属医院因慢性肾功能衰竭继发甲状旁腺功能亢进(SHPT)而行PTX的患者102例,其中13例失随访,2例死亡,1例术后1周死于严重低钙导致的呼吸肌痉挛,1例术后半年死于急性胰腺炎,均排除在外。所有患者围术手期管理均由同一组医生管理,收集患者术前、术中、术后、随访3个月的资料。
手术指征:国内外对SHPT的手术指征尚无统一标准。结合本科治疗经验、我国SHPT患者特征和国内外文献,确定了本科手术治疗的手术指征:(1)甲状旁腺素(PTH)>800 pg/ml;(2)高血钙和(或)高血磷;(3)严重的临床表现,如骨痛、骨骼畸形、肌无力、皮肤瘙痒等;(4)内科药物治疗无效;(5)术前影像学证实有一个或以上的甲状旁腺直径大于10 mm。
术前准备:均于肾脏内科完善术前常规化验,包括血常规、电解质、肝肾功能、出凝血、iPTH、免疫指标、心电图、超声心动图、腰椎及骨盆X线片、甲状腺及甲状旁腺超声,进行术前甲状旁腺定位及功能测定。有肺部疾病或胸廓畸形者需肺功能检查,超声检查未完全发现4枚甲状旁腺者可行99m锝-甲氧异腈双时相扫描,并评估患者术前声带功能及手术麻醉风险等。麻醉科评估患者无手术禁忌后,转入本科完善术前准备。调整透析方案,血透患者于术前1 d、术后1 d分别透析1次(腹透正常进行)。
手术方法:本科患者均采取甲状旁腺全切除+自体移植术(totalparathyroidectomywithup+autograft, TPTX+AT)和甲状旁腺全切除术(totalparathyroidectomywithup, TPTX)治疗继发性甲状旁腺功能亢进患者。自体移植时,选取术中冰冻证实为弥漫性增生的甲状旁腺,切成4个体积为1mm3组织,移植到前臂皮下(非造瘘侧)。
术后:术后第1天每4 h测血电解质1次,术后第1天查血常规、PTH,术后第2天起每天测血电解质1次。当血钙值低于1.8 mmol/L,或有肢体麻木、肌肉抽搐等临床表现时,静脉补钙(5%葡萄糖30 ml+葡萄糖酸钙30 ml),根据血钙水平调整给药速度。血钙值达到2.0 mmol/L后改口服碳酸钙及骨化三醇,当血钙浓度稳定2.0 mmol/L,且患者无肢体麻木、肌肉抽搐等低钙表现后出院。术后1个月、3个月、半年、1年对患者进行随访,统一记录数据。
持续性严重低钙血症定义:根据肾脏病预后质量(K/DOQI)指南本研究采用血清总钙低于1.8 mmol/L称为严重低钙血症[3](血钙正常值2.15~2.58 mmol/L)。术后3个月血钙值仍低于1.8 mmol/L或有肢体麻木等低血钙的临床表现则为持续性严重低钙血症。血钙值低于1.8 mmol/L或有临床表现者为A组。剩余患者为B组。对A组和B组进行统计分析。
应用SPSS 16.0统计软件对数据进行分析,计量资料采用t检验;计数资料采用卡方检验(χ2)或费舍尔确切概率法(Fisher)进行统计;多因素分析采用logistic回归模型进行统计分析。计量指标行受试者工作特征曲线(ROC)分析确定其准确性,以P<0.05为差异有统计学意义。
本科自2015年9月至2016年9月共102例SHPT患者行PTX,其中13例失随访;另有2例死亡,1例术后1周死于严重低钙导致的呼吸肌痉挛,1例术后半年死于急性胰腺炎,均排除在外,共87例患者(男性59例,女性28例)纳入统计。PTX术后持续性严重低钙血症(A组)27例(31.03%);非持续性严重低钙血症60例(68.97%)。平均年龄(44.91±11.43)岁;体重(61.30±10.00)kg;血透71例,腹透16例。全部患者均采取手术治疗(TPTX+AT,46例;TPTX,41例)。手术共切除甲状旁腺339个,平均3.89个。手术切除率97.41%。患者术后血钙、血磷、PTH值均明显下降(
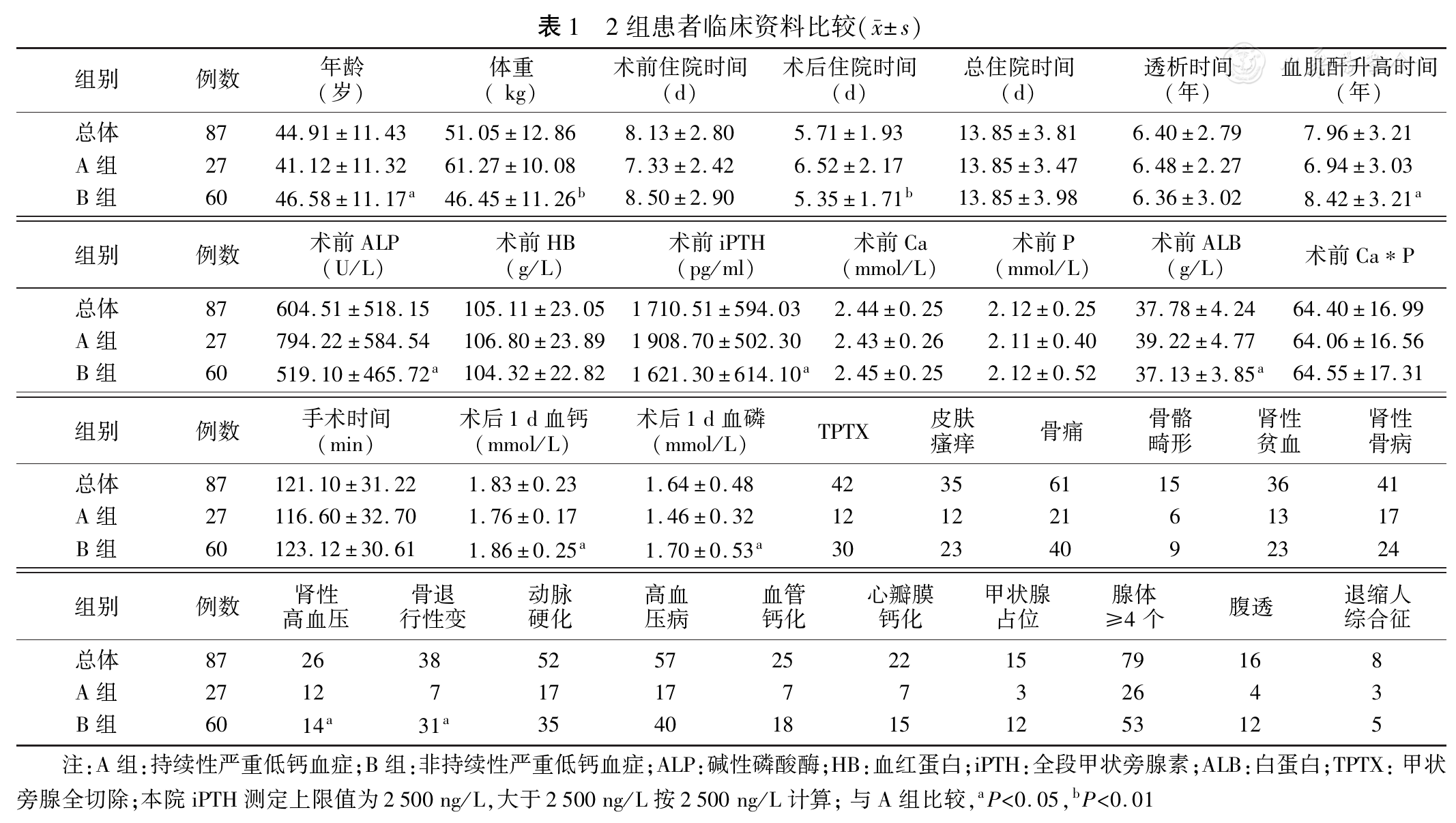
通过对本组资料进行分析,定义为手术成功80例(术后iPTH值较术前下降率大于80%为手术成功),手术成功率91.95%。手术后患者骨痛、皮肤瘙痒等症状均于术后得到缓解,骨骼畸形患者骨骼停止变形,退缩人综合征患者身高停止下降,不宁腿综合征患者症状消失。术后83例出现一过性低血钙(血钙值<2.15 mmol/l),表现为肢体麻木27例,肌肉抽搐5例;声音嘶哑12例,饮水呛咳3例;皮下积液3例;术区疼痛7例;咳嗽咳痰4例;另有1例表现为术后头晕,1例表现为恶心呕吐,考虑麻醉后反应所致。术后低钙并发症为术后并发症的50.79%。
对术后3个月随访资料进行统计分析,共31例患者出现术后并发症。其中低钙并发症22例:四肢麻木15例,口周麻木2例,腰背部麻木1例,肌肉抽搐4例。其他并发症:皮肤瘙痒4例,骨痛2例,切口疼痛3例。术后持续性低钙血症所致并发症为术后3个月全部并发症的70.91%。复发8例(以PTH>300 pg/ml定义为术后复发),复发率为11.49%。持续性严重低钙血症患者27例中,9例曾因严重低钙血症再次入院,27例患者均需长期静脉联合口服补钙。
将2组患者的一般资料、术前实验室检查、术后实验室检查、术后随访、临床表现及术前影像学检查结果用t检验、χ2或Fisher检验(
选择年龄、体重、术后住院时间、肌酐升高年数、术前ALP、术前PTH、术前白蛋白、术后1 d血钙、术后1 d血磷、肾性高血压、骨退行性病变,分别进行logistic回归分析(

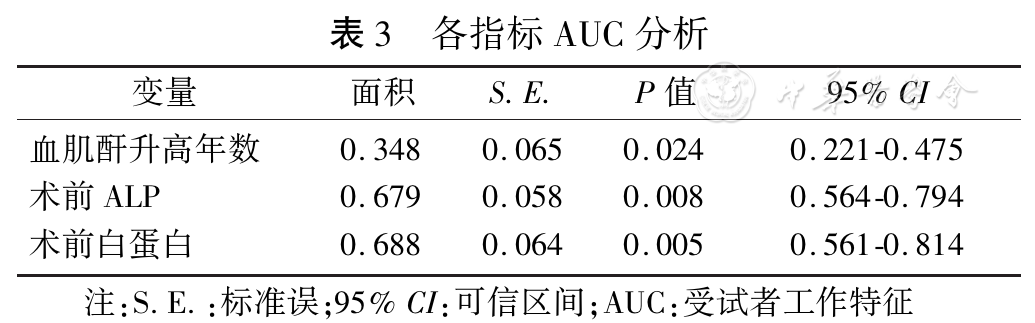
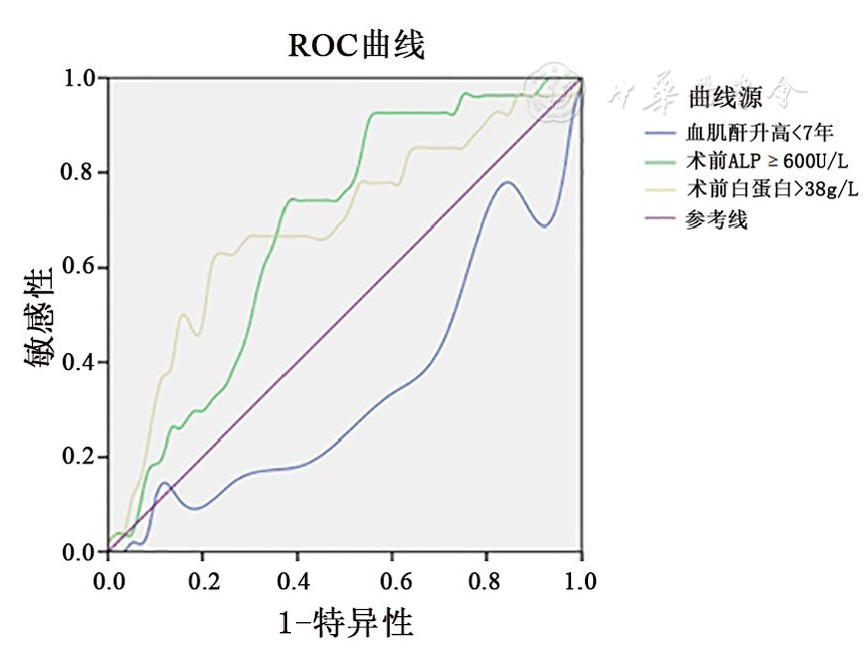
对血肌酐升高年数、术前ALP、术前白蛋白进行ROC分析,其结果提示。术前ALP、术前白蛋白有低度准确性(
慢性肾脏病(chronic kidney disease,CKD)在我国发病较高,我国成年人CKD患病率约为10.8%,慢性肾脏病及终末期肾脏病(end stage renal disease,ESRD)的患病率逐年上升[4],随着血液净化技术的不断发展,ESRD患者生存时间不断延长,SHPT的发病率明显升高。文献报道我国ESRD合并SHPT的发病率可高达80%[5]。通过低磷饮食,使用磷结合剂、活性维生素D、充分透析可使多数患者的临床症状得到改善;实验室检测指标控制在合理范围。但是,肾功能衰竭持续刺激甲状旁腺细胞增生,维生素D受体和钙敏感受体不断减少,成纤维细胞生长因子-23进行性升高,患者对药物治疗的抵抗越来越大。部分患者经过一段时间的药物治疗后血磷、PTH仍不断升高;临床表现不断加重。钙敏感激动剂西那卡塞几乎能达到甲状旁腺切除术的疗效,因此也被称为"药物性甲状旁腺切除"。但最新研究提出,对于难治性SHPT的治疗,手术治疗在疗效、费用上要优于西那卡塞,应用西那卡塞9个月或者帕立骨化醇12个月后,药物治疗费用就超过了手术治疗费用[6,7],另有文献报道,西那卡塞的疗效只能维持2~3年[8]。美国肾脏病基金会改善全球肾脏病预后(KDIGO)指南及日本透析医学会指南均推荐甲状旁腺切除术作为药物治疗无效的SHPT治疗方法。
PTX的手术方式主要有以下3种:甲状旁腺次全切除术(SPTX)、TPTX+AT和TPTX,以上3种术式都已经被证明在治疗SHPT是安全有效的。但是由于慢性肾功能不全持续刺激残余甲状旁腺不断增生,文献报道SPTX的术后复发率为12%~21%[9,10],且术中无法判断保留的甲状旁腺组织有无结节增生,术中对甲状旁腺腺体的切割有可能导致增生甲状旁腺细胞播散;日后复发再次手术时易损伤喉返神经及喉上神经,且会有气管血肿压迫等并发症。本科常规采取TPTX+AT和TPTX治疗SPTX患者。低钙血症是PTX术后最常见并发症。文献报道的PTX术后低血钙在50%~90%之间,即使是PTX术后严重低血钙的发生率也在30%~60%[11,12,13,14]。虽然术后低钙血症大部分在术后1周以内恢复正常,但部分患者在PTX术后很长一段时间内血钙值持续严重降低。严重的低血钙会导致低血压、心律失常、抽搐、骨折等,甚至危及生命。目前,国内外尚缺乏对于持续性低血钙的研究。因此,我们设计了本研究以明确SHPT患者PTX后重度持续性低血钙的相关因素,为预防提供策略。
统计病例资料,本研究确定的SHPT患者PTX后持续性严重低钙血症的独立影响因素为术前血肌酐升高年数、术前ALP、术前白蛋白。本研究发现,术前血肌酐升高年数是术后持续性严重低钙血症的危险因素。术前血肌酐短时间内明显升高,表明患者肾功能衰竭进展较快,PTH升高迅速,骨代谢明显增强,术后骨重建、矿化作用增强[15],术后持续性严重低钙血症发生率增高。
有文献报道[16],术前ALP>340 U/L,PTX术后易发生低钙血症。本组研究结果显示,术前ALP≥600 U/L是持续性严重低钙血症独立危险因素,与之前报道一致。应用ROC曲线计算曲线下面积,术前ALP≥600 U/L的AUC为0.679,有较低准确性(AUC在0.5~0.7时有较低准确性)。SHPT患者术前ALP升高,主要来源于成骨细胞,反映成骨细胞活性和骨形成。其升高与高转换性骨病的严重程度相关。但有文献表明[17],ALP术后的增加量与术后低钙血症的严重程度有相关性,而不是术前ALP水平。
本研究结果提示术前白蛋白大于38 g/L患者持续性严重低钙血症的发生率是非持续性严重低钙血症患者的3倍。术前白蛋白的AUC为0.688,准确性较低。虽然术前白蛋白有统计学意义,但其对预测术后持续性严重低钙血症的临床意义不大,仍需进一步讨论。
有文献报道[18],术前iPTH是术后低钙血症的危险因素,但本院检验iPTH上限值为2 500 ng/L,可能对统计分析有影响,不排除术前iPTH值与术后持续性严重低钙血症有关的可能性。术前iPTH水平越高,甲状旁腺功能亢进越严重,肾性骨饥饿越严重,术前骨吸收越多,术后骨形成时骨组织中需要的钙、磷沉积越多,进而容易发生低钙血症。但就其是否与持续性严重低钙血症相关,仍需进一步研究。
有文献报道,年龄与术后低钙血症有关[19],年龄<45岁患者发生低钙血症的危险性增加。本研究显示年龄在单因素分析中有统计学意义,但并不是独立危险因素。
本研究结果可初步建立SHPT患者PTX后持续性严重低钙血症的防治策略。术前血白蛋白大于38 g/L,术前血肌酐升高年数≤7年且术前ALP≥600 U/L的患者为术后持续性严重低钙血症的高危险人群,为预防术后持续性严重低钙血症的发生,应早期手术治疗。PTX术后需长期监测血钙,并静脉联合口服补钙,其手术方式可选择SPTX,或行TPTX+AT。但行自体移植时,移植的甲状旁腺腺体量应大于常规移植量,有条件的医院可低温贮存切除的甲状旁腺。术后发生持续性严重低钙血症可行延期自体移植,文献表明,延时自体移植可改善患者低钙症状[20]。
PTX术后持续性低钙血症患者,仅通过口服补钙血钙值难以达到正常范围。需长期静脉补钙,会加重经济负担,降低患者生活质量,对患者危害较大,甚至会危及患者生命。本研究提示术前血肌酐升高年数、术前ALP、术前白蛋白是术后持续性严重低钙血症的独立危险因素,需加强高危因素人群的监控,高度重视防治。
由于我们病例选择和治疗手段仅限于一所教学医院,病例数有限,不具广泛的代表性,尚不足以说明其他手术方式及其他医院的持续性严重低钙血症患者的发生情况。但与先前文献相比较,有意义的危险因素大体是一致的。较之其前的文献报道,我们更加注重患者临床表现,术前患者的实验室指标与持续性严重低钙血症的关系,从中找寻更特异、敏感、简便易行的独立危险因素。缺点是相关因素太多,病例数有限。目前我们正收集更多病例资料,并将上述独立影响因素应用临床作前瞻性研究加以验证。
[1] Mittendorf EA, Merlino JI, McHenry CR. Post-parathyroidectomy hypocalcemia: incidence, risk factors, and management[J]. Am Surg, 2004,70(2):114-119;
[2] 张凌. 慢性肾脏病患者甲状旁腺切除术后低钙血症的处理[J]. 中国中西医结合肾病杂志,2014,15(11):941-943.
[3] Kopple JD. National Kidney foundation K/DOQI clinical practice guidelines for nutrition in chronic renal failure [J]. Am J Kidney Dis, 2001,37(
[4] Zhang L, Wang F, Wang L, et al. Prevalence of chronic kidney disease in China: a cross-sectional survey[J]. Lancet, 2012,379(9818):815-822.
[5] Sailba W, ElHaddad B.Secondary hyperparathyroidism: pathophysiology and treatment[J]. J Am Bosrd Fam Med, 2009,22(5):574-581.
[6] Yamanouchi M, Ubara Y, Hayami N, et al. Bone mineral density 5 years after parathyroidectomy in hemodialysis patients with secondary hyperparathyroidism[J]. Clin Nephrol, 2013,79(5):380-386.
[7] Schneider R, Kolios G, Koch BM, et al. An economic comparison of surgical and medical therapy in patients with secondary hyperparathymidism the German perspective[J]. Surgery, 2010,148:1091-1099.
[8] Yousaf F, Charytan C. Review of cinacalcet hydrochloride in the management of secondary hyperparathyroidism [J]. Ren Fail, 2014,36(1):131-138.
[9] Lorenz K, Bartsch DK, Sancho JJ, et al. Surgical management of secondary hyperparathyroidism in chronic kidney disease-a consensus report of the European Society of Endocrine Surgeons[J]. Langenbecks Arch Surg, 2015,400(8):907-927.
[10] Tominaga Y, Matsuoka S, Sato T. Surgical indications and procedures of parathyroidectomy in patients with chronic kidney disease[J]. Ther Apher Dial, 2005,9(1):44-47.
[11] Tartaglia F, Blasi S, Giuliani A, et al. Parathyroid autotransplantation during total thyroidectomy. Results of a retrospective study[J]. Int J Surg, 2016,28(
[12] Mittendorf EA, Merlino JI, McHenry CR. Post-parathyroidectomy hypocalcemia: incidence, risk factors, and management[J]. Am Surg, 2004,70(2):114-119;
[13] Lorenz K, Ukkat J, Sekulla C, et al. Total parathyroidectomy without autotransplantation for renal hyperparathyroidism:experience with a qPTH-controlled protocol [J]. World J Surg, 2006,30(5):743-751.
[14] Davenport A, Stearns MP. Administration of pamidronate helps prevent immediate postparathyroidectomy hungry bone syndrome[J]. Nephrology(Carlton), 2007,12(4):386-390.
[15] Merchant R, Udani A, Puri V, et al. Evaluation of osteopathy in thalassemia by bone mineral densitometry and biochemical indices [J]. Indian J Pediatr, 2010,77(9):987-991.
[16] Loke SC, Tan AW, Dalan R, et al. Pre-operative serum alkaline phosphatase as a predictor for hypocalcemia post-parathyroid adenectomy[J]. Int J Med Sci, 2012,9(7):611-616.
[17] Chandran PK, Ulahannan TJ, Skiles M. Biochemical changes following parathyroidectomy[J]. Int J Artif Organs, 1993,16(10):700-703.
[18] 艾向南,金昌国,欧阳才国,等. 继发性甲状旁腺功能亢进患者甲状旁腺切除术后重度低钙血症相关因素分析[J]. 滨州医学院学报,2015,(4):257-259.
[19] Goldfarb M, Gondek SS, Lim SM, et al. Postoperative hungry bone syndrome in patients with secondary hyperparathyroidism of renal origin[J]. World J Surg, 2012,36(6):1314-1319.
[20] Schneider R, Ramaswamy A, Slater EP, et al.Cryopreservation of parathyroid tissue after parathyroid surgery for renal hyperparathyr-oidism: does it really make sense [J]. World J Surg, 2012,36(11):2598-2604.
