不合格静脉血标本管理中国专家共识
2020年10月
中华内分泌代谢杂志,第43卷第10期 第956页-第963页
随着医学的发展与科技进步,临床诊疗工作愈来愈依赖于实验室检测数据。静脉血液含有丰富的病理信息,是临床最常用的标本类型之一,其检验结果是否正确与患者的诊断和治疗密切相关。不合格静脉血标本不仅影响医疗质量和医院运营效率,带来较严重的经济损失,同时也是发生医疗纠纷重要的原因之一。不合格静脉血标本发生率约为0.50%[1, 2],其中约70%发生在分析前阶段[3],因此,加强分析前阶段管理至关重要。然而分析前阶段过程复杂,涉及患者准备,耗材质量,标本采集、运送、储存等众多环节,且处于实验室管理之外,质量控制难以实施。
随着自动化设备的应用和计算机技术的引入,质量指标作为评价检验过程各关键步骤性能满足要求的一种新兴管理工具,成为分析前阶段的标本有效管理措施[4]。美国病理学家学会分别于1989年及1998年开展质量探索(Q-probes)[5]及质量追踪(Q-tracks)计划[6],通过对质量指标的监测,使参与实验室的标本质量及检验质量得到有效改善[7]。国际临床化学和实验室医学联盟“实验室差错与患者安全”工作组在2016年确立了包括不合格标本质量指标在内的27项质量指标[8]。目前,该指标已在国际上得到广泛应用,2017年公布了首批质量指标基准值[9]。针对影响静脉血标本质量的关键分析前因素出台了一系列标准控制文件[10, 11, 12, 13]。同时,近十几年,多个国家都纷纷开展实验室质量指标相关项目[14, 15, 16, 17, 18]。
相对而言,我国质量指标的发展起步较晚。2015年,国家卫生和计划生育委员会首次发布《临床检验专业医疗质量控制指标》,要求实验室利用质量指标对检验全过程进行内部监测和管理[19]。2016年,国家卫生健康委员会正式颁布我国首个质量指标卫生行业标准《临床实验室质量指标》(WS/T 496-2017)[20]。标准制定了包括代表标本质量在内的28项关键质量指标,为我国质量指标的研究及开展奠定了基础。从2018年中国临床实验室标本可接受性质量指标室间质量调查数据来看,我国分析前的几项指标如标本类型错误率、标本容器错误率、标本采集量错误率和抗凝标本凝集率的控制水平与国际相似。但由于当前分析前质量指标无法完全涵盖影响静脉血标本质量的关键因素,难以全面实施质量监督,不能满足我国静脉血标本检验质量提升的需求[21];针对影响静脉血标本质量的分析前关键因素,亟待制定相应的质量控制指标,进行数据收集与监控,进一步完善评价系统,明确改进措施。为此,中华医学会检验医学分会联合中华护理学会组织专家撰写了“不合格静脉血标本管理中国专家共识”。
不合格静脉血标本指静脉血标本质量无法满足检测要求,需要重新采集或做让步检验。
1.患者识别错误:送检标本患者身份信息与申请信息不符。
2.标本采集时机不正确:需要在特定时间采集或满足特定条件下采集,但实际采血时间不正确或条件不满足。如需空腹采血的项目,受试者未空腹;糖耐量试验未按规定时间采血等。
3.标本类型错误:标本类型与检测项目不匹配,如凝血检测使用血清标本。
4.标本采集量错误:送检标本的量过多或过少,不能满足要求标本量。例如血培养标本采集量没有达到规定要求,导致结果假阴性[22]。
5.标本-抗凝剂比例不当:送检标本中的血液量与抗凝剂比例不符合规定要求。如血常规管中抗凝剂浓度没有达到规定要求、血凝管中抗凝剂与血液体积比例不符合1∶9。
6.标本标识错误:送检标本标签缺失、标签粘贴错误、标签信息错误、标签信息不完整、标签无法识别、标签在系统中已登记使用等情况。如标签将采血管全部环绕无法进行信息读取等。
7.标本运输途中损坏:标本从采集地点送至实验室途中发生损坏,如标本溶血、标本溢出等。
8.标本运输时间过长:标本运输时间超过规定要求,如急诊心肌酶检测标本运输时间超过实验室要求。
9.标本运输温度不适当:对运输温度有特定要求的标本,在运输过程中温度过高或过低,如氨、乳酸、甲状旁腺激素相关蛋白、胃泌素等检测项目需要冷藏运输,但却未冷藏运输,冷球蛋白检测标本运输过程中温度未保持在37 ℃[23]。
10.抗凝标本凝集:应使用抗凝剂抗凝的标本由于某种原因完全或不完全凝固[19]。
11.标本溶血:标本采集、运输过程中操作不当,造成红细胞破坏,血红蛋白及细胞内容物释放入血清或血浆,当标本中游离血红蛋白含量>0.5 g/L时称为溶血,超过10 g/L时为严重溶血,可通过标本溶血比色卡肉眼判断或使用仪器判断[24]。
12.血培养污染:临床实验室应按照自身情况制定标准。如标准可为一系列血培养标本中仅有一瓶鉴定出以下菌株:凝固酶阴性的葡萄球菌、痤疮丙酸杆菌、微球菌、草绿色链球菌、棒状杆菌或者芽孢杆菌属。一系列血培养标准指的是24 h内连续采集的用于检测菌血症的1或1个以上标本[19]。
13.标本丢失:各种原因导致的实验室没有接收到患者血液标本。
不符合实验室标本接收条件且不属于让步标本。
不符合实验室标本接收条件且不属于拒收标本。
影响静脉血标本质量的因素较为复杂,根据因素能否控制,分为标本采集及运输因素、患者生理及治疗药物相关因素两大类。其中标本采集及运输因素的特点可通过实验室对相关医护人员的培训、先进设备的引入等措施加以规范,而患者生理及治疗药物相关因素的影响则大多难以识别和控制。
1.患者识别及标本标识:尽管国内外均建立了患者身份识别护理安全规范,但由于护理工作量大、参与人员多、衔接环节复杂等原因,患者身份识别错误仍时有发生。尤其在急诊及门诊,一旦发生将会导致一系列严重的后果。身份识别错误的发生与多种因素有关,如临床医生开具手工检验申请单时,书写潦草难以辨认;患者文化程度低,年龄较大,存在听力、语言、视觉障碍等无法进行有效沟通;执行电子检验申请单时,采血人员未进行有效身份确认。除上述原因外,标本标识错误(无标签或标签粘贴错误等)也是导致患者识别错误的重要原因,国外有研究显示高达56%的患者身份识别错误由标本标识错误导致[11]。为保证患者安全,预防患者身份识别错误的发生,需要与临床医生沟通、确保检验申请单书写工整,使用新型识别技术替代传统识别方式,加强采血人员责任心及采血相关培训等综合措施。
2.采血时机:采血时机不当也会对部分检测项目结果造成影响,如应空腹采血的项目没有空腹或空腹时间不够、输液的同时采血等。医嘱信息不明确、采血人员对一些特殊状态和时间点的标本采集缺乏认识是导致标本采集时机不当的原因。建议临床医生在下达医嘱时应明确医嘱信息,特殊检验项目需有明确医嘱条目,对采血人员应依据相关指南进行采血操作培训及考核。一般建议采血前应至少禁食8 h,以12~14 h为宜,但不宜超过16 h, 7∶00—9∶00采血较为适宜(急诊项目及部分特殊项目除外)。常规情况下,应避免在输液时采血。如必须采集,应在输液的对侧肢体采集,并加以注明。
3.采血姿势:从仰卧位改变至坐位,成人血浆容积降低约10%(600~700 ml),可导致血液浓缩及血压降低,影响多种血液中成分及与血压调节相关的活性物质浓度。研究显示,从仰卧位转换为坐位后,多种血液学、生化学指标升高5%~15%,尤其肾素、肾上腺素、去甲肾上腺素升高可达50%~70%[25]。因此,患者在采血前应保持同一体位至少15 min,且每次采血尽量保持相同体位[13]。门诊患者建议采用坐位采血,病房患者如采用卧位采血,结果解释时需考虑到两种采血体位间的检测结果差异。
4.穿刺部位皮肤消毒:消毒对静脉血标本质量的影响,主要是穿刺部位消毒不彻底引起的血培养污染,通常与消毒剂选择不当或消毒操作不规范有关。临床上血培养标本污染引起的结果假阳性问题较突出[26]。因此,采集血培养标本前,应按照相关规定选择适当的消毒剂,严格执行三步消毒法。建议待75%的乙醇溶液自然干后进行采血,以避免穿刺后乙醇进入血管带来烧灼感[13]。
5.止血带的使用及采血针规格:静脉穿刺时,止血带的使用有利于定位血管,但长时间绑扎常常导致血液浓缩,影响检验结果。研究显示,即使止血带使用时间<1 min,总蛋白、白蛋白、钾离子、钙离子的检测结果偏差也超过生物学变异[27]。建议血管条件好的患者,穿刺前可不使用止血带;对于血管条件差的患者,止血带绑扎时间不要超过1 min,同时避免反复握拳[13]。采血针过粗或过细均可引起溶血,应根据患者血管情况选择适宜大小的采血针,建议成人患者使用21~23 G的采血针,儿童及血管条件差的患者使用23~25 G的采血针。此外,对于采血针选择,建议门诊患者使用直针;儿童、老人等血管条件差的患者使用蝶翼针,尤其是具有穿刺成功视觉确认的采血针;存在感染风险的患者使用安全型采血针;优先选用具备薄壁大腔针体的采血针。
6.采血管质量:采血管质量对静脉血标本的影响常被忽略,事实上由于各采血管生产企业的产品标准不尽相同,不同品牌的采血管质量差异较大。例如,负压过大的采血管,容易引起标本溶血;普通PET材质的采血管,无法有效阻止液体抗凝剂蒸发,容易引起标本-抗凝剂比例不当;采血管中抗凝剂添加不足或分布不均,容易引起抗凝标本凝集等。为避免采血管质量对静脉血标本质量的影响,建议医疗机构在选购采血管时,应选择高质量的产品,如具有双层管壁设计的血凝管、使用冻干喷雾技术进行添加剂喷涂的血常规管等。
7.采血顺序:采血顺序不当可导致抗凝剂交叉污染及发生潜在的化学反应,影响离子、碱性磷酸酶及凝血功能的检测结果[10]。如血常规管在血浆管前采集,血浆管中引入的乙二胺四乙酸(EDTA)可与血液中钙、镁、铁等二价离子直接螯合,并释放出钾离子,导致血清中游离的钙、镁、铁等离子的检测结果被低估[28],相反钾离子浓度会假性增高,可能掩盖真实的低钾血症[29];含促凝剂的血清管在血凝管前采集,血凝管中引入的促凝剂可干扰标本凝固,影响凝血检测结果。因此,多管采血时应按规定顺序留取标本。此外,应依据条形码上的信息正确选择与检测项目相匹配的真空采血管,避免因采血管选用不当而引起的标本类型错误。
8.标本混匀:抗凝标本混匀不充分可导致凝集,影响血常规等检测结果的准确性[30, 31]。为保证添加剂与标本充分混匀,标本采集完成后应立即以180°颠倒混匀(混匀次数根据说明书要求),以避免纤维蛋白丝、微小凝块及血凝块的形成[32],同时应避免混匀力度过大造成的血细胞损伤/溶血、血小板激活或凝血的发生[33]。混匀手法见
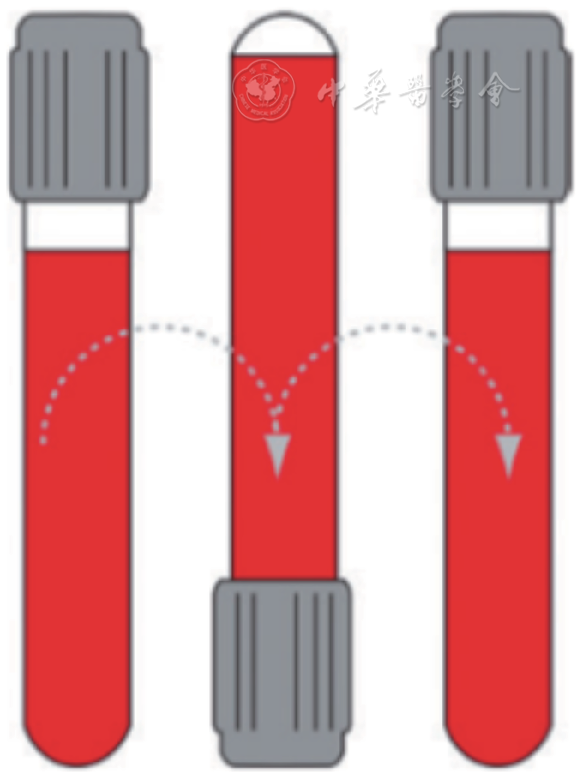
注:轻轻的上下颠倒,为1次混匀
9.标本运输:运输对标本质量的影响较为复杂,与容器选择、运输时间、运输温度、管理制度等都有一定关系。例如,人工运输时运输箱选择不当或气动运输参数设置不合理,导致标本运输途中损坏;一些对运输时间较敏感的检测指标,如总胆固醇、总睾酮、游离睾酮、碱性磷酸酶、总胆红素等,标本采集后没有在规定时间内将标本运送至实验室[34, 35];氨、乳酸、丙酮酸盐、胃泌素、同型半胱氨酸、甲状旁腺素、冷凝集素、冷球蛋白等指标对运输温度有特殊要求,标本在运输过程中没有做好温度控制[36];标本管理制度不健全或标本接收人员疏忽大意,导致标本丢失等。预防运输相关因素对标本质量的影响,需要采取综合措施,包括人工运输时需选用具有防水、防漏、防震作用的运输箱;采用气动物流运输时,必须定期评估标本的完整性;制定或完善标本运输相关控制标准,配置带有温度控制装置的标本运输设备;实施标本电子化全程交接管理,实时监控标本状态;运输人员定期接受培训、考核等。
1.运动及情绪激动:运动可引起人体代谢及血液组分变化,导致部分检测项目结果升高或降低。如肾上腺素、去甲肾上腺素、生长激素、促肾上腺皮质激素、肌酸激酶、丙酮酸激酶、皮质醇、胰高血糖素、天门冬氨酸氨基转移酶、碱性磷酸酶、红细胞计数、胆红素、肌酐、葡糖糖、磷酸盐、白蛋白、钠离子、钙离子、D-二聚体、肌红蛋白、B型利钠肽、缺血性修饰白蛋白等在剧烈运动后会显著升高,其中肾上腺素、去甲肾上腺素、生长激素、促肾上腺皮质激素的升高幅度均超过300%,皮质醇升高幅度在50%~250%。球蛋白、胰岛素、镁离子、氯化物等在剧烈运动后下降,胰岛素受影响较大,下降幅度达60%[25, 37]。2018版欧洲临床化学和实验室医学联盟静脉血收集指南指出,采血前24 h应避免剧烈运动(超过日常活动量)[13],当天避免情绪激动,采血前应有15 min的休息时间。
2.不良生活习惯:吸烟导致检测结果改变的具体机制尚不明确。目前已发现脂肪酸、肾上腺素、胆固醇、皮质醇、脂蛋白、白细胞数及一些酶类、激素、维生素、肿瘤标志物、重金属等均受烟草摄入的影响,且与吸烟量及烟龄有关。饮酒可对实验室检测造成短期及长期影响,影响的严重程度取决于饮用量和持续时间。短期影响发生于饮酒后2~4 h、与乙醇代谢有关,受影响的项目包括醛固酮、甘油三酯、骨钙素、抗利尿激素、皮质醇等。长期影响是由乙醇引起的肝脏损伤导致,受影响的项目主要包括γ-谷氨酰转肽酶、天门冬氨酸氨基转移酶、丙氨酸氨基转移酶、总胆固醇、甘油三酯、低密度脂蛋白胆固醇、雌二醇、皮质醇、红细胞平均体积等[38]。因此,建议饮酒者24 h内应避免饮酒,于次日7∶00—9∶00采集为佳,采集前避免吸烟[13]。
3.节律性变化:昼夜节律主要影响激素类检测项目,如生长激素、促肾上腺皮质激素、皮质醇、睾酮、促甲状腺激素、甲状腺激素、醛固酮、肾素、肾上腺素、去甲肾上腺素等。月经周期主要对性激素(雌二醇、黄体酮等)产生影响[25]。在采集此类检测标本时,需根据其节律变化,尽量保持采集时间恒定。
4.精神因素:精神紧张可导致醛固酮、血管紧张素、儿茶酚胺、皮质醇、肾素、抗利尿激素、白蛋白、纤维蛋白原、葡萄糖、胰岛素、乳酸等水平升高[38],采血前采血人员应指导患者保持放松状态。
5.生理差别的影响:不同年龄组的个体及妇女在妊娠期和月经期,血液成分等有一定的差异,应注意与病理情况区别。
6.治疗药物相关因素:12%的住院患者实验室检测结果可受到药物干扰[39]。药物对检测的干扰可分两大类:一是药物对生理功能发挥作用,如药物性肝、肾损伤引起的肝、肾功能实验室检测异常;抑制骨髓造血而使血细胞减少及红细胞损伤引发的溶血等;应用糖皮质激素和抗肿瘤药物导致的免疫系统功能的抑制,肾上腺、甲状腺激素引起的血糖升高等。二是药物本身及其代谢产物对检测的影响,如具有还原性或氧化性的药物常造成采用氧化还原方法的检测项目误差;使用利尿剂导致血液浓缩,使检测结果升高[25]。遇到此类情况时,应停药后采样或在用药前采集。如必须采集,实验室应记录患者所服用药物种类和剂量,便于后期结果解读及纠正[13]。
不合格静脉血标本的管理应遵循客观真实、科学系统的原则,通过既定管理方法和管理流程在实践中不断发现问题、解决问题,实现标本质量持续改进。
检验科应联合护理部等部门制定不合格静脉血标本的管理制度或操作流程,明确管理目标,制定管理计划。管理措施包括以下几个方面。
1.转运流程:明确医院的标本转运流程,监控标本转运全过程。
2.不合格标本的识别:标本接收人员应评估接收标本,并仔细检查标本的标识、容器、抗凝剂、标本量、标本状态(如凝块、溶血等)是否符合相关检测要求,以及标本是否与检验申请相符。
3.拒收标本处理:识别不合格标本后,与护士站或采血者确认不属于让步标本后,将该标本作为不合格标本处理,并利用LIS系统将标本信息退回,便于重新采集标本。在登记本、工作单、计算机或其他类似系统中填写不合格原因。标本保留检验科,并做好醒目的不合格标记。
4.让步标本处理:识别不合格标本后,如果为珍贵标本、不可再次获取的标本、或由于患者本身因素引起的不合格标本(病理性溶血、脂血、黄疸等),应与医生或护士确认后,将标本不合格相关信息登记在记录本、工作单、计算机或其他类似系统中备注,以备报告审核人员查看。如果必要,在解释结果时也应说明,并在报告中提示,供临床医生参考。
5.定期对不合格标本进行分析并及时反馈,多部门研究完善静脉血标本采集与转运标准操作规程,严把标本采集容器质量关。加强医护人员专业教育与技能培训,建立不合格静脉血标本不良事件上报系统及标本信息化管理系统,逐渐提升标本质量。
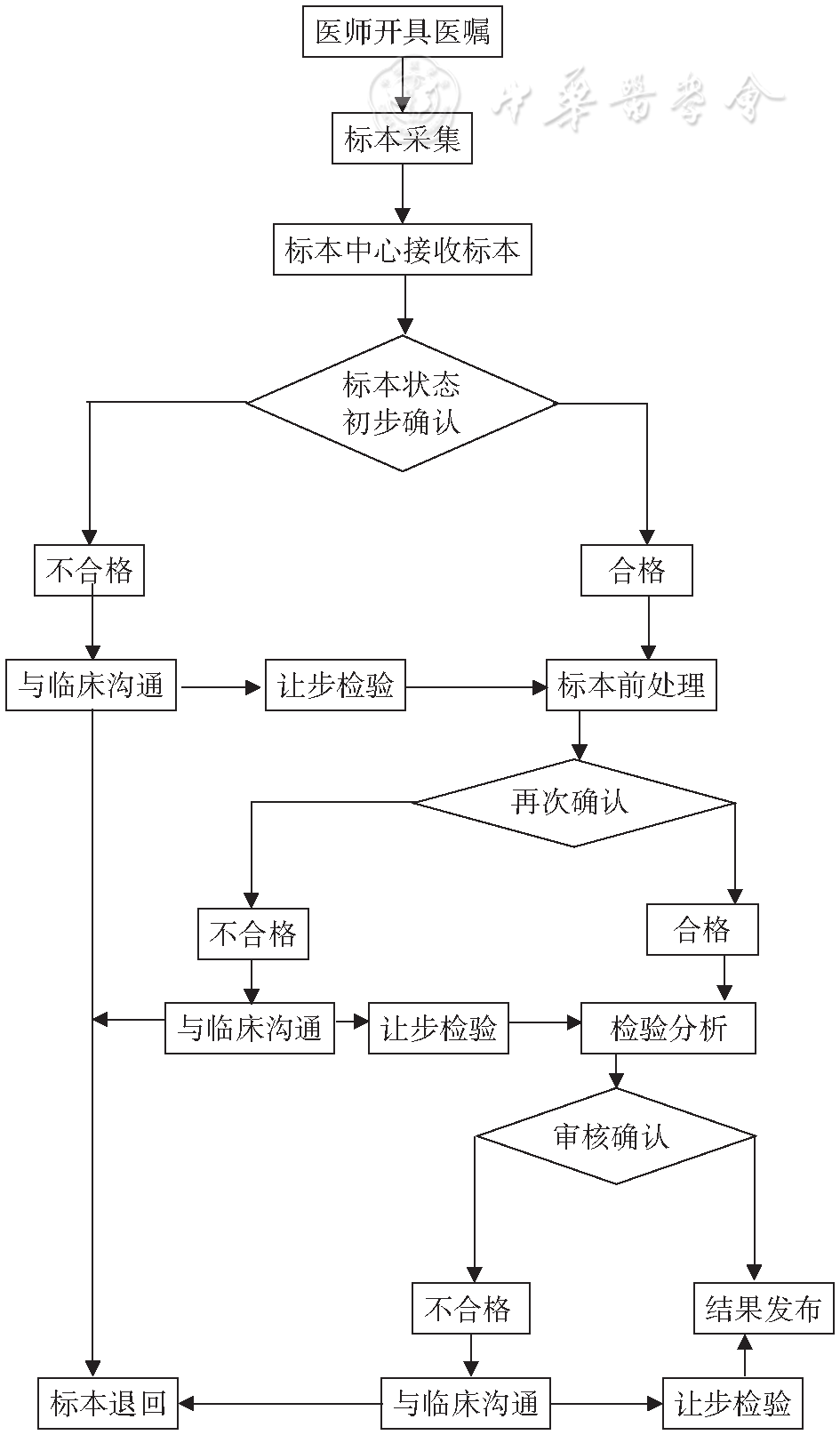
不合格静脉血标本从临床医师申请检验到各个节点的退回管理见
静脉血标本分析前质量指标包括患者信息识别错误率、标本采集时机不正确率、标本类型错误率、标本采集量错误率等13项指标,其计算公式见

1.不合格静脉血标本的记录:检验全程中的任何环节发现不合格标本时,应在第一时间与临床沟通,分析其原因并按不合格标本管理流程处理,在登记本、工作单、计算机或其他类似系统中登记,登记内容包括不合格标本接收的日期、时间、标本识别号、检测项目、患者信息、采血管的类型、不合格原因、处理方法、上报接收人和上报人等信息。记录时应保证数据的真实性、完整性、安全性和保密性。
2.不合格静脉血标本的分析方法:定期汇总和统计不合格标本数据,分析不合格标本的发生率或西格玛水平,将发生率或西格玛水平绘制于“质控图”中,长期观察失控/在控情况及其变化趋势。利用鱼骨图、柏拉图、因果矩阵图、5WHY分析法和团队导向问题解决方法(8D问题解决法)等统计方法分析产生不合格标本的根本原因。联合医院职能部门、护理部、临床、后勤等科室,制定切实可行的质量指标的质量规范和质量要求,完善标本采集的操作流程,加强人员培训,增强责任心,有效提高标本合格率。
医院应成立专门管理小组,指派专人进行管理。定期(如每月)对不合格标本数据进行整理,统计出发生率较高的临床科室,并帮助分析产生不合格标本的原因。运用质量管理工具,“计划-执行-检查-处理”品质管理循环,针对产生不合格静脉血液标本的风险进行识别、评估、分析、处理和监控。通过循环改进,不断降低不合格标本发生率,持续提升标本质量。
护理部和检验科应定期(如每季度、每半年或每年)组织不合格标本管理沟通会议。通过回顾在标本质量管理中的进展和成果分享,向全体人员进一步强调标本质量管理的重要性,重申规章制度和岗位职责,不断提高医疗质量与安全。
定期(如每季度、每半年或每年)进行一次标准化的信息收集和风险评估,对分析前的耗材储存、血液采集、标本运输、预处理和标本质量等各环节进行临床追踪,比较与标准规范及参比实验室之间的差距,并关注重大风险因素。
利用全球室间质评系统,参考国家标准、国家行业标准等国内标准,国际标准化组织、世界卫生组织等国际标准或美国临床和实验室标准协会、美国病理学家学会等国外标准,比较自身实验室与其他实验室间的差距,提高不合格标本管理水平。
基于分析前的耗材储存、血液采集、标本运输、预处理和标本质量等各环节存在难发现及难量化的问题,可以采用静脉血液标本管理量化评估系统,进行对各个环节的现场观察,采集数据,量化分析,最后给出建设性报告。
先进的物联网技术所包含的信息传感设备如射频识别技术,能支持医院实现标本从采集到废弃的全方位追踪与实时监控,同时支持标本备管、交接、分拣环节的批量、自动化完成,进而有效避免了人为差错的产生。通过大数据分析,可为管理者提供针对性的风险预警和改善建议,提高不合格标本管理水平。
执笔人:陶志华(浙江大学医学院附属第二医院),蒋黎(四川省人民医院),马燕兰(解放军总医院第一医学中心),黄晶(吉林大学第一医院),吴文苑(深圳市人民医院),郭玮(复旦大学附属中山医院),黄宪章(广东省中医院)
专家组成员(按姓氏笔画排序):丁小容(北京大学深圳医院),马萍(徐州医科大学附属医院),王成彬(解放军总医院第一医学中心),王传新(山东大学第二医院),王昌敏(新疆维吾尔自治区人民医院),李一荣(武汉大学中南医院),李士军(大连医科大学附属第一医院),李永军(河北医科大学第二医院),李庆印(中国医学科学院阜外医院),李海霞(北京大学第一医院),任丽(天津市肿瘤医院),关秀茹(哈尔滨医科大学附属第一医院),关明(复旦大学附属华山医院),江咏梅(四川大学华西第二医院),张义(山东大学齐鲁医院),陈鸣(陆军军医大学西南医院检验科),邱玲(中国医学科学院北京协和医院),陈葳(西安交通大学第一附属医院),明亮(郑州大学第一附属医院),周铁丽(温州医科大学附属第一医院),郑磊(南方医科大学南方医院),郝晓柯(解放军空军军医大学西京医院),俞颖(浙江中医院大学附属第一医院),韩艳秋(内蒙古医学院附属医院),潘世扬(江苏省人民医院)
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
26
27
28
29
30
31
32
33
34
35
36
37
38
39
