全血细胞计数指标监测大动脉炎疾病活动性中的作用
2020年10月
中华内分泌代谢杂志,第43卷第10期 第1032页-第1038页
栾海霞,陈思,曾小莉,袁慧
大动脉炎(takayasuarteritis, TA)是一种病因不明的系统性自身免疫性大血管炎,它主要以主动脉及其分支的慢性炎症为特征。目前TA患者的发病率很低,相关的文献报道其发病率约在1~30/106[1, 2, 3]。TA的病理特征主要是炎性细胞浸润、肉芽肿形成以及过量的炎性细胞因子的产生[4]。
目前常用的判断TA患者疾病活动度的炎症标志物主要有红细胞沉降率(erythrocyte sedimentation rate, ESR)和高敏C反应蛋白(high sensitivity-C reactive protein, hs-CRP)。虽然在TA患者的随访中hs-CRP和ESR指标经常被用到,但有些患者在没有hs-CRP和/或ESR增高的情况下发生严重的血管恶化,显然hs-CRP和ESR这两种炎性标志物并不总是与血管壁的炎症活动呈正相关[5]。近几年,很多研究表明全血细胞计数指标与自身免疫病的疾病活动度相关[6, 7, 8, 9, 10]。
本研究通过评估全血细胞计数指标与TA之间的相关性,探讨中性粒细胞/淋巴细胞(neutrophil-to-lymphocyte ratio, NLR)、红细胞分布宽度(red blood cell distribution width, RDW)、血小板/淋巴细胞(platelet-to-lymphocyte ratio, PLR)、血小板平均体积(mean platelet volume, MPV)、血小板压积(platelet crit, PCT)和血小板分布宽度(platelet volume distribution width, PDW)与TA疾病活动性的关系。
回顾性分析2017年1月至2019年6月北京安贞医院86例TA患者(TA组),其中男性15例,女性为71例,年龄为(37.9±12.0)岁;同时从健康体检中心选取年龄和性别与TA相匹配的健康对照者85例(对照组),其中女性为71例(83.53%),平均年龄为(39.9±12.2)岁。所有入选的TA患者均符合1990年美国风湿病学会分类标准[11]。TA患者的排除标准为:(1)其他自身免疫性血管炎:巨细胞动脉炎、白塞病及结节性多动脉炎等;(2)其他原因导致的大血管病变:感染后的心脏和/或大血管病变,外伤所致的心脏和/或大血管病变,先天性心脏和/或大血管病变;(3)合并其他自身免疫性疾病;(4)合并感染及肿瘤;(5)合并肝、肾功能不全;(6)合并过敏性疾病。TA患者疾病活动度的判断根据美国国立研究院(national institutes of health, NIH)的评分标准[12]及2010年印度TA临床活动性评分(ITAS2010)标准[13]。根据Numano血管分型,将TA分为6型[14]。Ⅰ型,累及主动脉弓的分支;Ⅱa型,累及升主动脉和/或主动脉弓,主动脉弓及其分支可同时受累,主动脉的其余部分没有受累;Ⅱb型,累及胸降主动脉,升主动脉、主动脉弓及其分支可同时受累,但腹主动脉不受累;Ⅲ型,累及胸降主动脉、腹主动脉和/或肾动脉,但升主动脉、主动脉弓及其分支没有受累;Ⅳ型,累及腹主动脉和/或肾动脉;Ⅴ型,广泛型,Ⅱb型和Ⅳ型的合并型,广泛累及主动脉弓、降主动脉、腹主动脉及其分支。入选的TA患者临床资料见

采集所有研究对象的临床资料,研究对象空腹12 h后抽取肘静脉血4 ml,采用美国Beckman Coulter AU5400全自动生化仪检测肝功能和肾功能,全血细胞计数指标采用SysmexXE-2100全自动血细胞分析仪电阻抗法进行测定。
所有数据均采用SPSS 22.0统计软件进行统计学分析。计量资料先进行正态性检验,正态分布资料以均数±标准差表示,采用独立样本t检验进行分析;偏态分布的计量资料数据以中位数和四分位数表示,采用非参数检验进行分析。相关性分析采用Spearman相关分析,采用受试者工作特征(receiver operating characteristic, ROC)曲线确定判断TA患者疾病活动性的界值,以 P<0.05为检验水准。
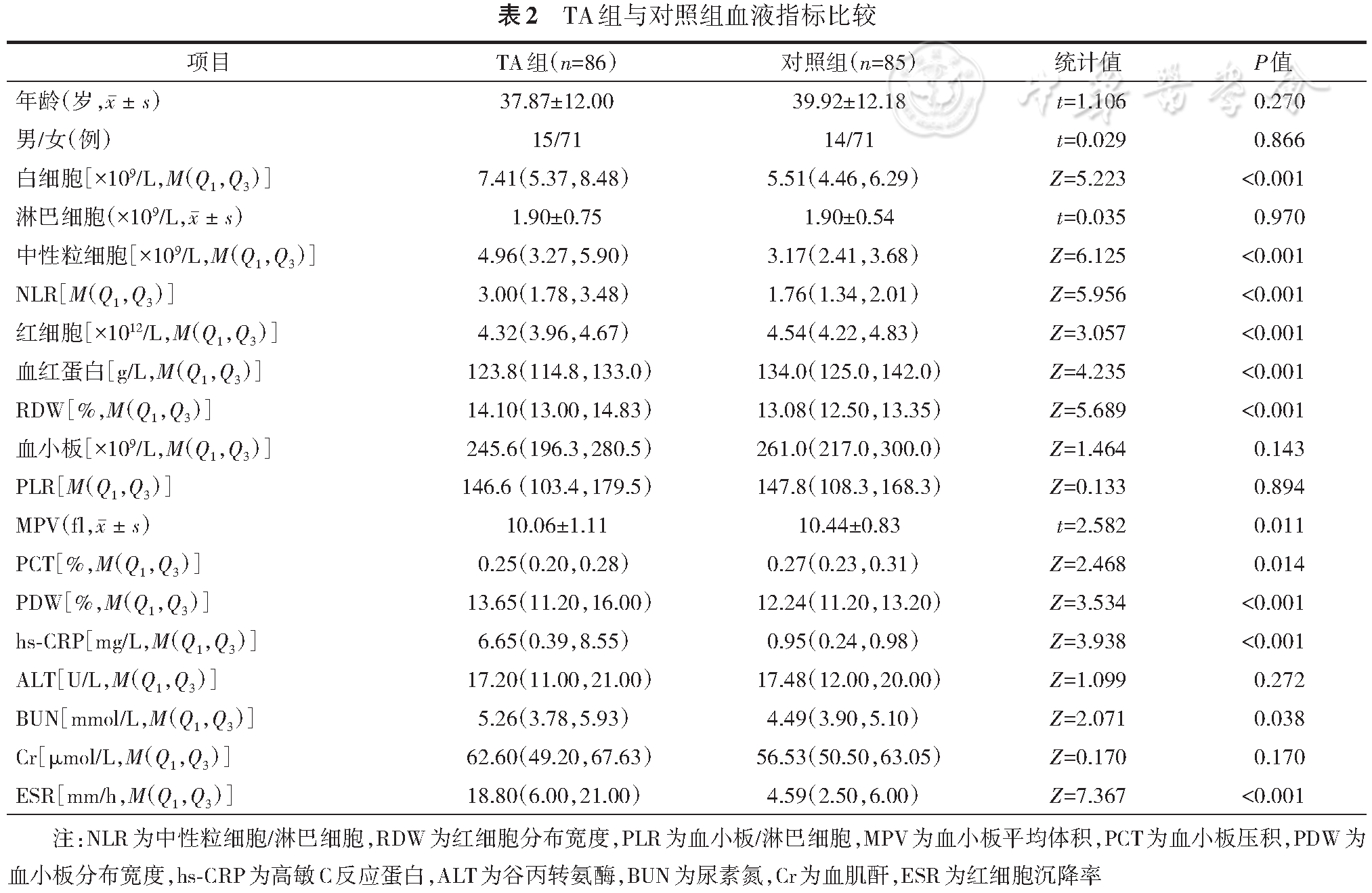
TA组的白细胞、中性粒细胞、NLR、RDW、PDW、hs-CRP、尿素氮和红细胞沉降率均高于对照组,差异均有统计学意义(P<0.05);TA组的红细胞、血红蛋白、MPV和PCT均低于对照组,差异均有统计学意义(P<0.05),见
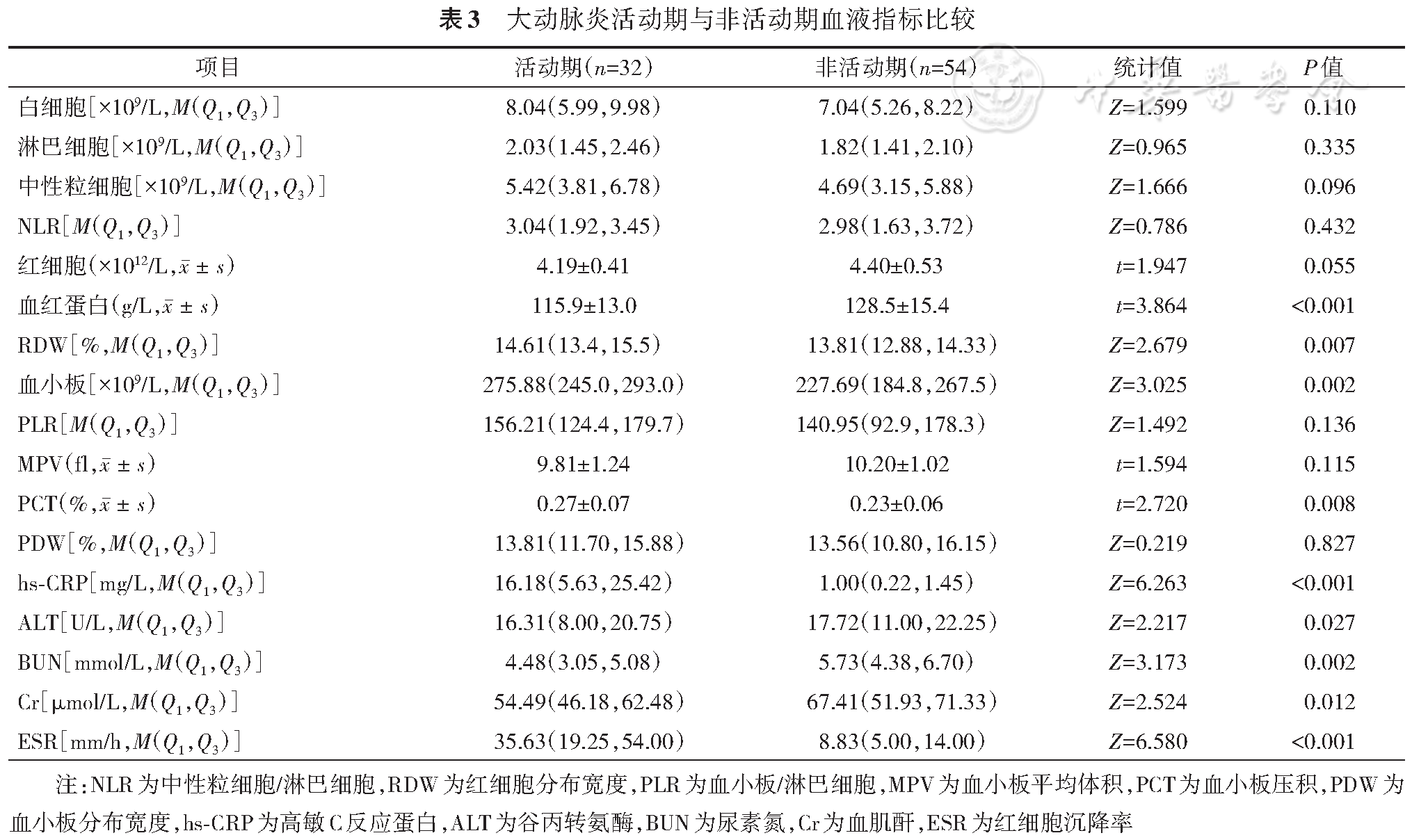
TA患者活动期的RDW、血小板、PCT、hs-CRP和红细胞沉降率均高于非活动期,差异有统计学意义(P<0.05),见
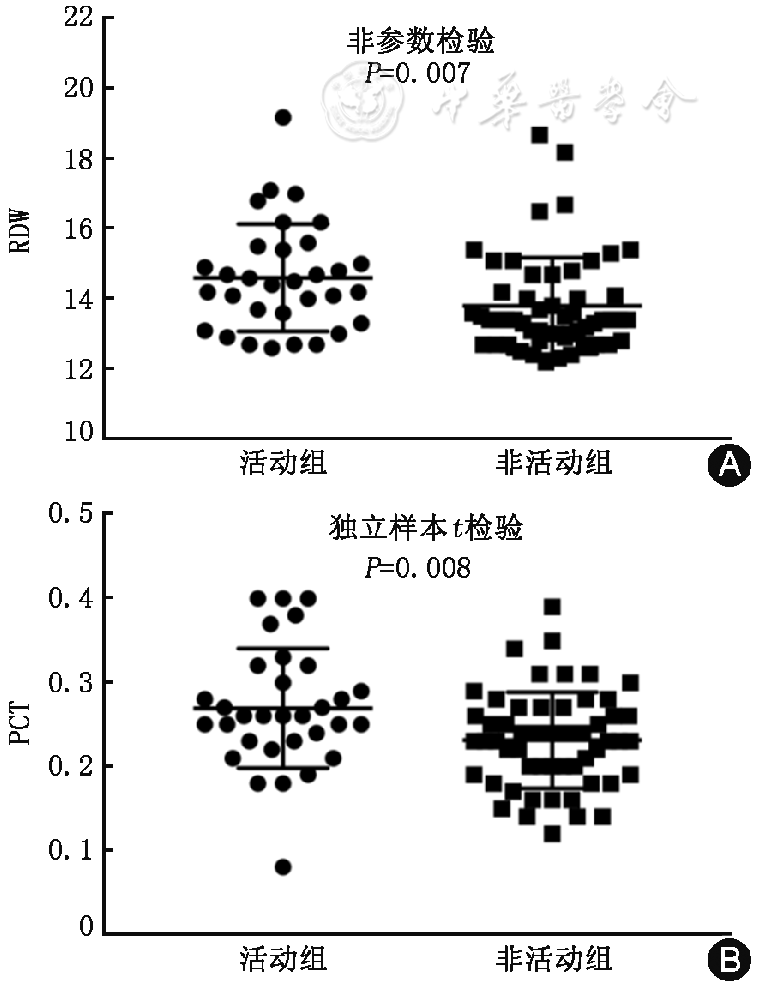
注:A为TA患者活动期与非活动期RDW比较,B为TA患者活动期与非活动期PCT比较
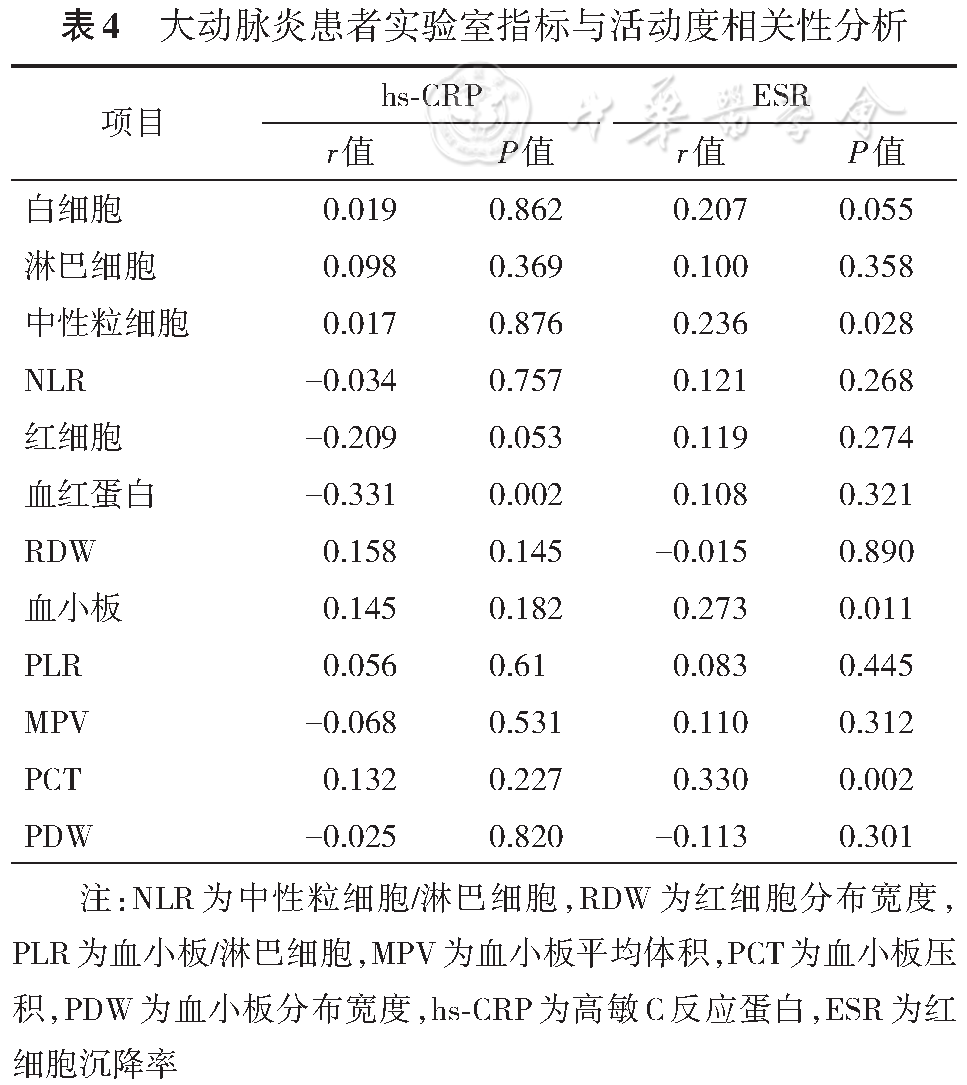
采用Spearman相关分析显示血沉与中性粒细胞(r=0.236,P=0.028)、血小板(r=0.273,P=0.011)和PCT(r=0.330,P=0.002)均呈正相关;而hs-CRP与血红蛋白(r=-0.331,P=0.002)呈负相关(
RDW判断TA疾病活动性的最佳界值为14.150(敏感度为55.0%,特异度为100.0%,ROC曲线下面积为0.802);PCT判断TA疾病活动性的最佳界值为0.245(敏感度为66.7%,特异度为92.3%,ROC曲线下面积为0.840);PLR判断TA疾病活动性的最佳界值为131.257(敏感度为71.7%,特异度为76.9%,ROC曲线下面积为0.714)。ROC曲线见
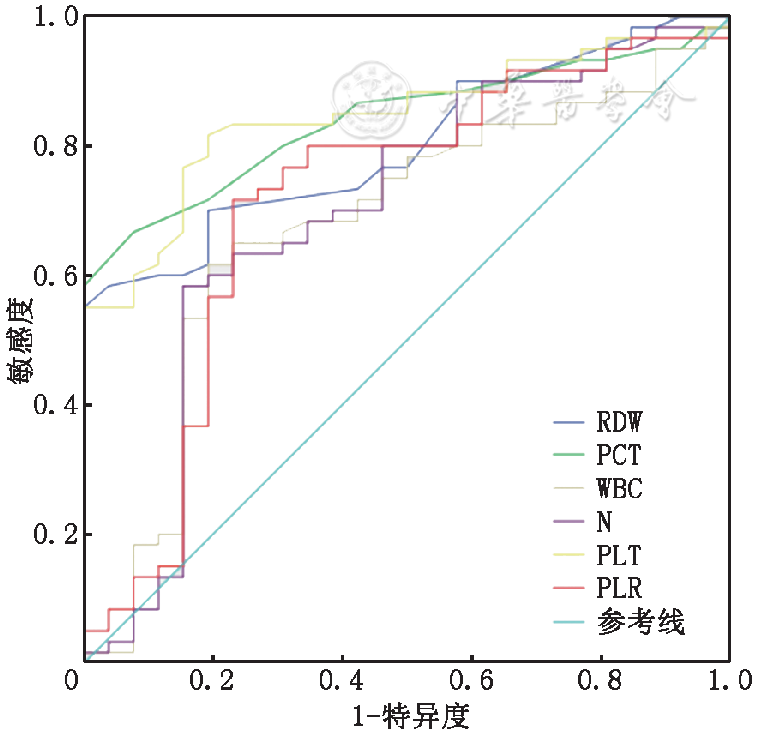
TA是主要累及主动脉及其一级分支的慢性非特异性大血管炎,发病年龄以青年患者为主,通常在10~40岁,其男女发病比例约在1︰3~1︰8之间[15, 16]。TA的发病机制目前尚不清楚,但是有研究表明可能的发病机理为免疫细胞紊乱导致炎症因子产生、进而引起TA患者的免疫损伤。而处于疾病活动期的TA患者,其体内会产生大量的炎症因子和细胞因子,这对患者的治疗和转归带来很大的困难[17]。因此,判断TA患者的疾病活动度对于疾病的临床诊治及预后有重要意义。
目前常用的判断TA活动度的炎症标志物主要有ESR和hs-CRP。但是近年来研究表明,一些新的血液指标比如NLR、PLR和RDW等与自身免疫病的疾病活动度呈正相关[6, 7, 8, 9, 10]。本实验系统研究了全血细胞指标(包括NLR、RDW、PLR、MPV、PCT和PDW)与TA之间的相关性,发现TA患者组的NLR、RDW和PDW均高于健康对照组,而MPV和PCT均低于健康对照组。TA患者活动期的RDW和PCT均高于非活动期。TA患者活动期的PCT与ESR呈正相关。ROC曲线分析表明RDW判断TA疾病活动性的最佳界值为14.150,PCT判断TA疾病活动性的最佳界值为0.245。因此,本研究表明RDW和PCT可能有助于判断大动脉炎疾病活动性。
RDW是反映红细胞体积大小异质性的参数,其一直用于探讨贫血的病因[18]。2007年,Felker等[19]报道RDW可以反映心衰患者的预后。随后更多的研究表明,RDW是多种心血管疾病的诊断标志物、危险和预后因素[20]。虽然许多研究已经揭示了RDW与心血管疾病之间的关系,但这种关系背后的机制目前尚不清楚。2009年,Lippi等[21]报道RDW与炎症标志物(CRP和ESR)呈正相关。2015年发表的另一项研究发现,在健康人群中RDW与炎症标志物呈正相关[22]。这两项研究明确表明RDW是一种炎症相关标志物,并且RDW与心血管疾病的关系很大程度上是通过炎症反应介导的。许多研究证明RDW在自身免疫性疾病中升高,可以作为评估各种自身免疫性疾病活动性的有用指标[7, 8, 9]。本研究TA患者组的RDW高于对照组,TA活动期的RDW高于非活动期,表明RDW可能有助于判断大动脉炎疾病活动性。RDW作为新的一种炎性标志物具有一定的优势。首先,RDW可以通过常规血液学检查获得,不需要任何额外的费用。其次,CRP和ESR等传统标志物对感染事件敏感,而RDW仅受红细胞大小的影响。由于红细胞的半衰期约为120 d,RDW对感染事件不敏感。故认为RDW代表长期炎症状态,而CRP和ESR代表短期炎症状态。目前关于RDW作为炎症标志物的研究几乎都是横截面研究。虽然这些研究已经证明RDW是评估自身免疫病活动性的指标,但RDW的预后价值仍然未知。因此,需要进一步的前瞻性队列研究来阐明RDW与自身免疫病预后之间的关系。
血小板计数、PCT、PDW和MPV被认为是血小板活化的标志[23]。这些指标是血小板体积(血小板减少)变化的血液学参数。研究表明血小板的活化可参与炎症反应的发生与发展[24, 25]。许多研究报道了血小板结合内皮细胞的能力,并作为连接白细胞的桥梁,从而增强炎症。这可能是因为黏附分子在内皮细胞表面的表达很少,而血小板黏附内皮细胞后可以表达更多的黏附配体,包括P-选择素和各种整合素配体。因此,血小板可以通过增加中性粒细胞、单核细胞和其他细胞,而促进炎症的发生与发展[26, 27, 28]。在自身免疫的发展过程中血小板会浸润炎症组织,进而参与自身免疫的发展过程。研究者推测可溶性CD40L作为血管炎症的标志物,可能参与了狼疮的发展,而血小板是可溶性CD40L的主要来源,因此研究者认为血小板与狼疮的发生有关[29]。在许多炎症模型中,抑制CD40或CD40L可减少炎症[30, 31, 32]。此外,血小板的降低提高了狼疮易感小鼠的存活率,这表明血小板衍生因子在炎症性疾病中起着关键作用[29]。目前血小板参数与多种自身免疫病存在相关性[8, 33, 34]。PCT是血小板计数和平均血小板体积的测量值。临床医生对PCT的重视程度低于血小板计数、PDW和MPV。PCT在疾病的研究中相对较少,主要有子痫前期和炎性肠病[35, 36]。本研究首次探索PCT与TA患者及其活动度之间的相关性,结果发现TA患者组PCT低于对照组,TA患者活动期的PCT高于非活动期,TA患者活动期的PCT与ESR呈正相关,表明PCT可能有助于判断大动脉炎疾病活动性。
终上所述,RDW作为外周血红细胞体积异质性参数,与炎性疾病的发生和发展存在相关性。而PCT作为血小板参数指标,也参与炎症的发生和发展。本研究探索了全血细胞计数指标与TA患者疾病活动性的关系,发现 RDW和PCT可能有助于判断大动脉炎疾病活动性。本研究纳入的TA患者病例数有限,因此需要进一步的实验探讨RDW和PCT在TA患者疾病活动性中的临床意义。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
26
27
28
29
30
31
32
33
34
35
36
