2019新型冠状病毒感染患者外周血淋巴细胞及其亚群分析
2020年11月
中华内分泌代谢杂志,第43卷第11期 第1093页-第1099页
王婷,侯红艳,汪峰,黄敏,张闵霞,吴士及
新型冠状病毒肺炎(COVID-19)主要通过呼吸道飞沫和密切接触传播,已在全球蔓延,导致200多个国家/地区的大流行,感染了600多万人,造成39万多人死亡(截至2020年6月6日)[1]。该病毒具有高度传染性,但有的患者没有异常的影像学表现,甚至没有发烧等临床症状,这加大了疫情防疫的难度[2, 3]。但在我国政府采取的一系列强有力措施干预下,使得此疫情的控制在国内取得显著成效。新型冠状病毒(2019-nCoV)属于正冠状病毒亚科的sarbecovirus亚属中的一个分支,与中东呼吸综合征冠状病毒和严重急性呼吸道综合征(SARS)冠状病毒不同,是感染人类的冠状病毒家族的第7个成员[4]。COVID-19的临床特点表明,轻度患者表现有发热、干咳、乏力等症状,胸部CT表现异常,但多预后良好。然而,部分患者可发展为重症肺炎、急性期呼吸窘迫综合征或多器官衰竭甚至死亡[5, 6],病死率为4.3%~15.0%[5,7]。
淋巴细胞及其亚群在维持机体免疫功能中发挥着重要的作用,特别是在病毒感染后,淋巴细胞及亚群的数量会随着病毒的不同发生改变。最近的研究指出COVID-19患者淋巴细胞明显降低[3],但亚群的变化尚不清楚。本研究通过分析武汉地区179例COVID-19患者淋巴细胞亚群的计数等实验室检测结果,探讨患者预后与淋巴细胞亚群等指标的关系。
回顾性分析2020年2月8日至18日华中科技大学同济医学院附属同济医院光谷院区和中法院区定点收治的179例COVID-19患者资料,除外恶性肿瘤患者。入院后,收集患者临床资料包括年龄、性别、既往史、症状等,入院时检测血常规与淋巴细胞亚群,入院10 d后复查。COVID-19患者临床分型按照《新型冠状病毒肺炎诊疗方案(试行第八版)》[8],其中普通型84例,重型58例,危重型37例。分型标准:(1)普通型:有发热、呼吸道等症状,影像学可见肺炎表现;(2)重型(成人符合下列任何1条):①出现气促,呼吸频率≥30次/min;②静息状态下手指氧饱和度≤93%;③动脉血氧分压/吸氧浓度≤300 mmHg (1 mmHg=0.133 kPa);(3)危重型(符合以下情况之一者):①出现呼吸衰竭,且需要机械通气;②出现休克; ③合并其他器官衰竭需要重症监护病房(intensive care unit,ICU)监护和治疗。本研究得到华中科技大学同济医学院附属同济医院伦理委员会批准(TJ-C20200128)。
日本Sysmex XN-9000血液分析仪,原装配套试剂及配套质控品,检测入院时与住院10 d后患者外周血常规。美国BD公司 FACSC CANTOⅡ型流式分析仪,试剂为BD公司配套的CD3FITC,CD16CD56PE,CD45PerCP-Cy5.5,CD4PE-CY7,CD19APC,CD8APC-Cy7标记的6色荧光单克隆抗体,采集患者外周静脉血3 ml,肝素抗凝,室温放置,24 h内检测。在含有已知数量标准微球的Trucount专用试管内加入抗凝全血50 μl及上述荧光标记抗体20 μl,振荡混匀后在室温下避光孵育20 min,加450 μl溶血素(FACS,BD),上机检测。
使用GraphPad Prism6和SPSS 19.0统计软件进行数据分析。计量资料进行正态性检验,符合正态性资料以
179例COVID-19患者入院时基本信息见
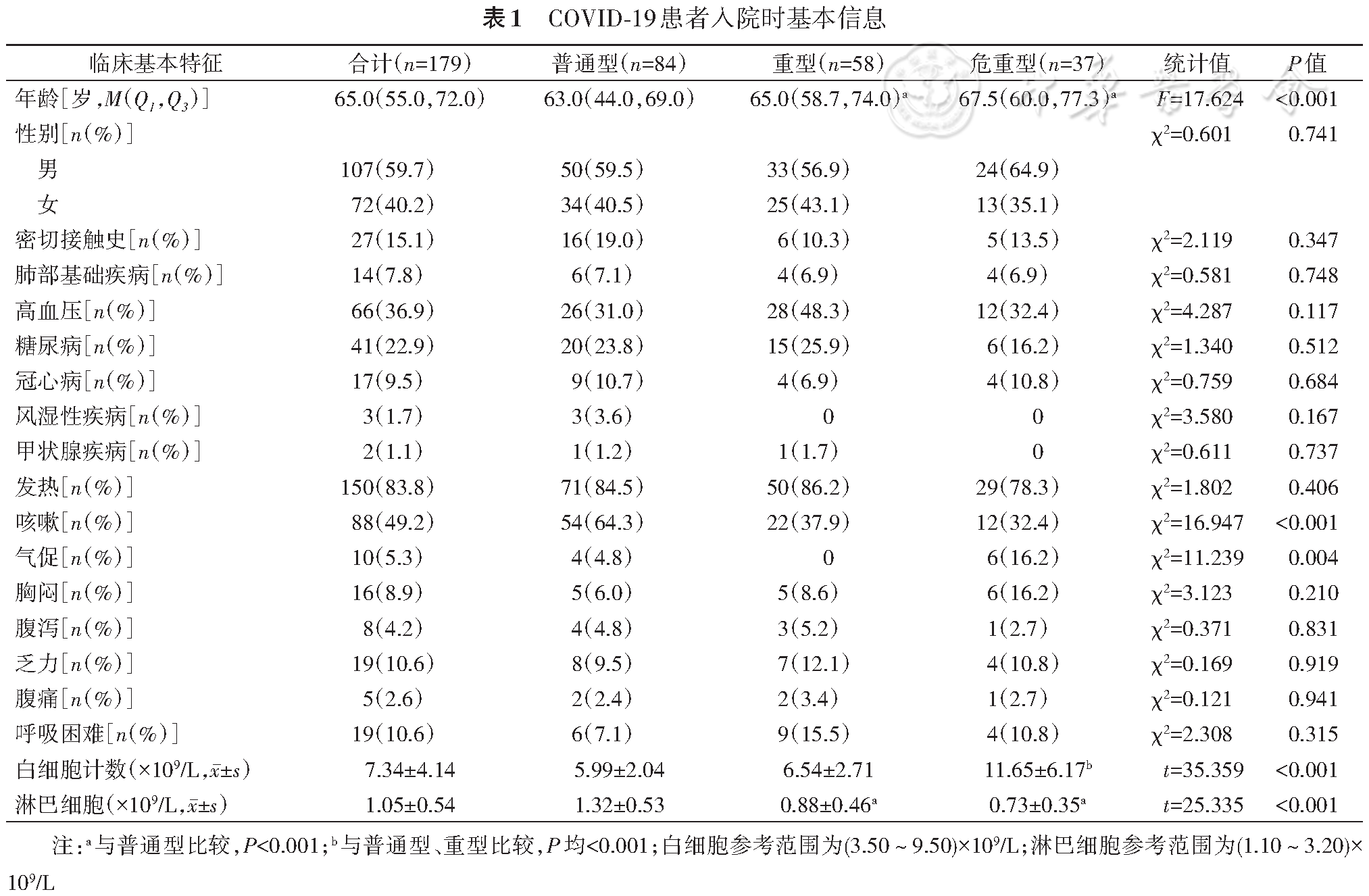
普通型T+B+NK、CD3、CD4、CD8、NK细胞数显著高于重型和危重型(P值均<0.001),重型T+B+NK、CD3、CD4、CD8、NK细胞数显著高于危重型(P值<0.001),见
注:A~G分别为3组患者T+B+NK、CD3、 CD4、CD8、CD19、NK细胞、CD4/CD8比值比较结果,红色的T形图表示的是
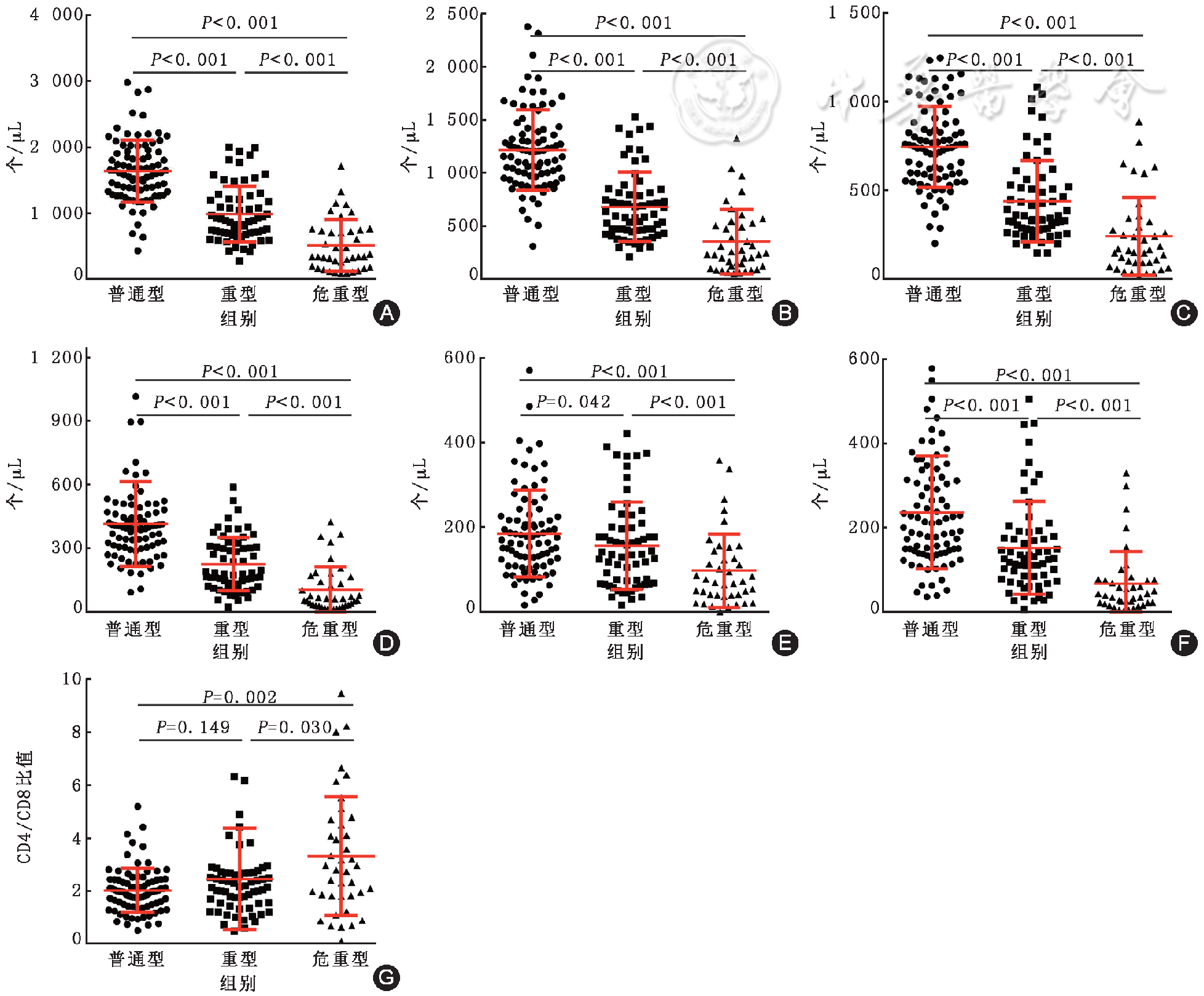
应用CD3在判断普通型和重型患者分型曲线下面积最大,AUC为0.865(95%CI为0.801~0.929),在CD3<854个/μl时,CD3在区分普通型和重型的敏感度为79.69%,特异度为89.41%。应用T+B+NK在判断普通型和危重型患者、重型和危重型患者分型曲线下面积最大,AUC分别为0.961(95%CI为0.925~0.998)、0.803(95%CI为0.711~0.896),在T+B+NK<1169个/μl时,T+B+NK在区分普通型和危重型的敏感度为95.00%,特异度为90.59%,在T+B+NK<484个/μl时,T+B+NK在区分重型和危重型的敏感度为60.00%,特异度为93.75%,见
注:A为普通型比重型,B为普通型比危重型,C为重型比危重型
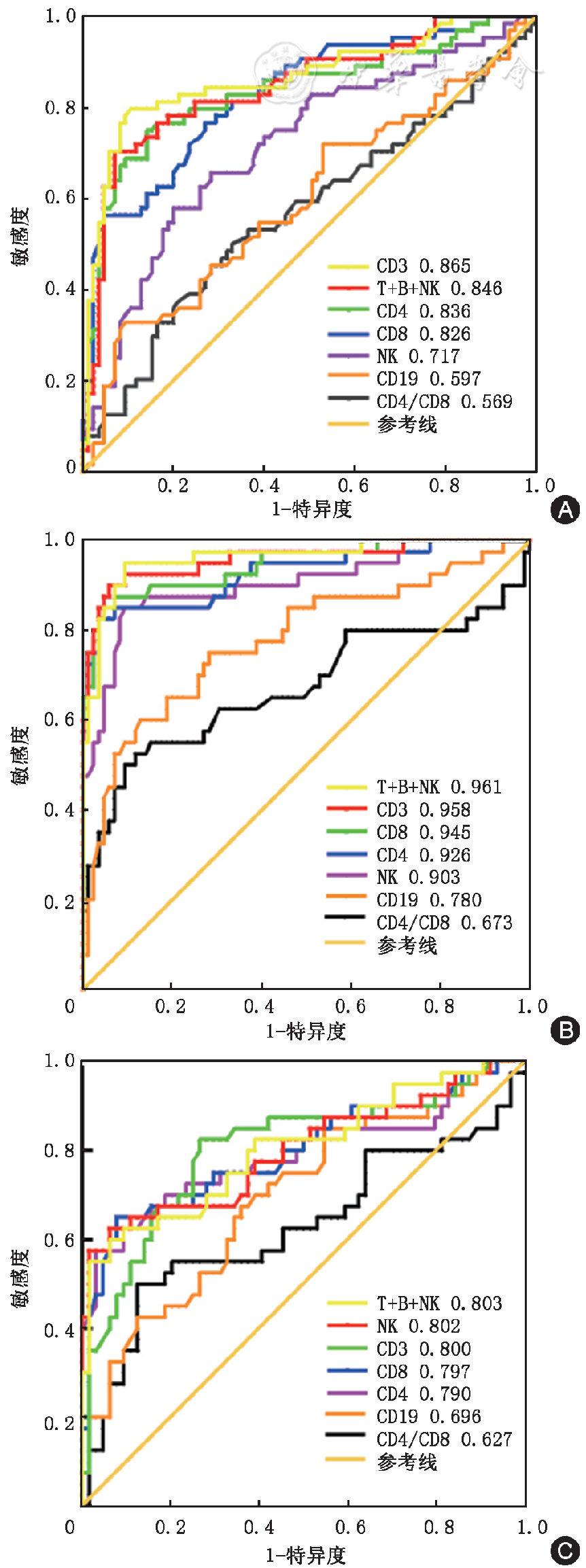
将普通型和重型患者数据合并后与危重症组比较显示如
注:A为淋巴细胞亚群,B为中性粒细胞及其与亚群比值
应用中性粒细胞/淋巴细胞比值(NLR)在判断COVID-19患者分型曲线下面积最大AUC为0.958(95%CI为0929~0.987),在NLR>6.913时,NLR在区分COVID-19患者分型的敏感度为95.00%,特异度为84.56%,见
各组患者入院时与住院10 d后淋巴细胞总数的动态变化与预后的关系显示,普通型患者[(1 314.8±529.0)个/μl比(1 450.8±434.6)个/μl,P<0.001]、重型患者[(875.9±451.7)个/μl比(990.8±410.5)个/μl,P<0.001]住院时淋巴细胞总数均高于入院10 d后,患者病情好转;危重型患者入院时淋巴细胞总数低于入院10 d后[(747.0±380.1)个/μl比(483.4±436.4)个/μl,P=0.040],患者病情加重,预后差。因此,入院后淋巴细胞升高提示预后良好,入院后淋巴细胞降低时提示预后较差。
本研究分析了COVID-19患者的临床特征,比如男性偏多;年龄越高,病情越重;大部分合并有一种或多种基础疾病。Guan等[9]分析全国31个省近1 600例COVID-19患者数据,同样提示男性、年龄均是COVID-19感染的危险因素,同时合并多种基础疾病与患者的预后密切相关。本研究危重症患者病死率为78.4%。Guan等[9]研究称该疾病危重症患者病死率高达61.5%,金银潭医院ICU患者的病死率达38%~62%,超过10%的患者需要体外膜肺氧合,Yang等[10, 11]报道需要ICU护理的患者28 d病死率为62%,在SARS患者中,28 d病死率为74%,甚至更高。
本研究发现普通型、重型、危重型COVID-19患者T+B+NK、CD3、CD4、CD8、CD19、NK细胞数逐渐减少。在患者住院10 d后,普通型、重型患者入院后淋巴细胞数量升高,病情好转,危重型患者淋巴细胞数量进一步降低,预后差。3组患者治疗方案对淋巴细胞及亚群前后的变化影响不大。COVID-19新型冠状病毒肺炎诊疗方案中提到,3型患者的一般治疗为支持治疗、吸氧治疗、抗病毒治疗等,重型危重型治疗对于机体炎症反应过度激活状态的患者,酌情短期内使用糖皮质激素,挽救治疗可考虑体外膜肺等。值得提出的是,由于患者治疗后未全部进行亚群的检测,因此未分析亚群的治疗前后改变,这也是需要更进一步研究的方向。有研究分析了452例COVID-19患者数据表明[12],患者淋巴细胞、T细胞计数下降(尤其是 CD4 细胞的下降)明显,且危重症患者改变更明显。因此,我们猜测COVID-19患者的免疫系统受到了损害,使得淋巴细胞,尤其是T淋巴细胞的减少。这些都与SARS类似,SARS患者淋巴细胞及亚群绝对计数重型明显低于普通型,大部分患者的淋巴细胞及亚群均受到破坏,CD4、CD8同时降低,以T淋巴细胞功能减低最为显著[13],但是COVID-19比SARS更具有传染性,潜伏期更长[2]。
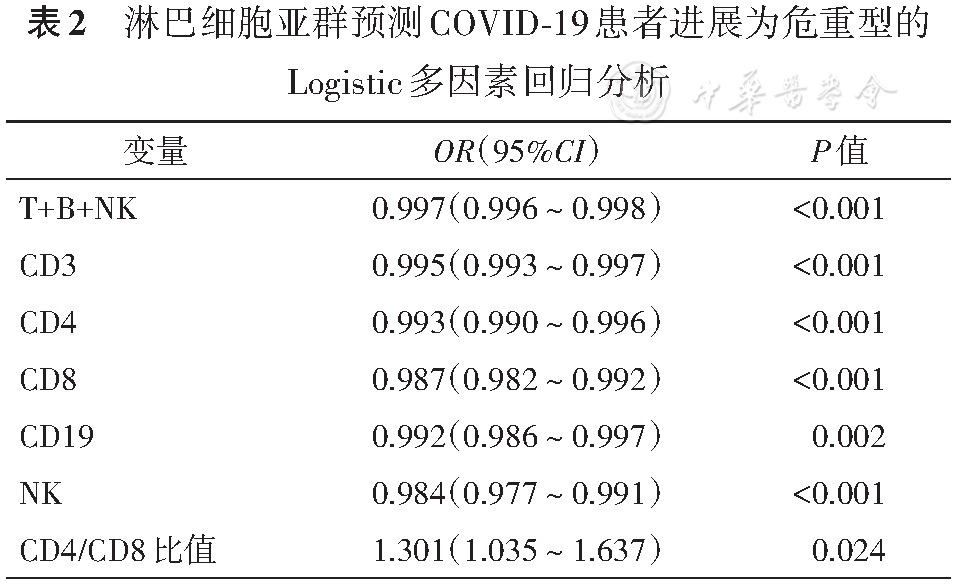
因为危重型COVID-19患者病死率很高,所以对其要尤为重视,为了探讨亚群与危重型的相关性,我们将普通型和重型合并与危重型比较,发现单用CD3对COVID-19患者分型特异性不高,当联合CD3和CD4/CD8比值时,COVID-19患者分型特异度高达96.64%。此时,需要引起临床高度注意患者可能为危重型患者,预后极差。
本研究可见NLR用于患者分型诊断效果最好,危重症患者入院白细胞升高、淋巴细胞降低。其他的研究也指出,重型相较于普通型患者,NLR明显增高[11, 12]。NLR是全身炎症和感染的一个众所周知的标志物,已被研究作为细菌感染的预测因子,包括肺炎[14],除此之外,低蛋白血症,乳酸脱氢酶和D-二聚体水平升高、促炎细胞因子和趋化因子的升高等均被认为在病毒感染的免疫和免疫病理过程中起着重要的作用。因此,NLR可能是反映COVID-19患者炎症和免疫反应不平衡程度的一个有用因素。
值得一提的是,淋巴细胞亚群变化可能与年龄分段、性别、基础疾病有一定关系,Qin等[15]发表的一项针对1 068名健康成年人的研究表明,T+B+K、CD3、CD8数量随着年龄的增加逐渐减少,而CD4无此趋势。性别可能也与某些T细胞亚群显著相关。也有研究指出,CD4、CD8T细胞与性别差异无统计学意义[16]。低蛋白血症、肝功能衰竭等免疫抑制状态下,CD4、CD8、NK细胞的数量均低于健康对照组[16]。本研究危重组年龄较高、男性比例更高,同时可能伴有多器官衰竭等,这些都可能是造成危重组T+B+K、CD3等数量降低的原因之一,多因素分析结果提示亚群是进展为危重型的关键风险因素。
综上所述,T+B+NK与CD3减少、CD4/CD8比值升高、NLR升高在COVID-19患者疾病分型诊断上具有重要意义,淋巴细胞总数的动态监测能有助于预后判断。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
