肺炎支原体抗体滴度和RNA检测在儿童肺炎支原体肺炎诊疗中的应用价值
2020年11月
中华内分泌代谢杂志,第43卷第11期 第1106页-第1111页
葛梦蕾,殷芳,赵汉青,宋秦伟,郭文卉,马丽娟
肺炎支原体(Mycoplasma pneumonia, Mp)感染是儿童肺炎常见的致病原因之一[1],可占儿童社区获得性肺炎(community-acquired pneumonia,CAP)的10%~30%,流行高峰年或地区性暴发流行时可高达50%~80%[2, 3]。近年来,由Mp感染引起的重症和难治性肺炎患儿逐渐增多[4, 5, 6, 7],并且Mp与其他病原体引起的呼吸道感染在临床症状、体征、影像学上不易区分,因此早期的实验室病原诊断对儿童 Mp肺炎的诊治有重要意义。
肺炎支原体抗体滴度检测是目前临床最常用的诊断Mp感染的血清学检测方法,其诊断价值已在临床应用中得到证实[8],多份指南及专家共识指出,单次Mp抗体滴度≥1∶160可作为诊断Mp近期感染或急性期感染的参考标准;恢复期和急性期Mp抗体滴度呈4倍及以上增高或减低,可确诊Mp感染[9, 10, 11]。RNA实时荧光恒温扩增技术(RNA real-time fluorescence constant temperature amplification technology, SAT)是一种新型的病原学检测方法,较传统DNA检测方法在敏感度和准确度方面均有很大提高[12]。
本研究拟通过对肺炎患儿血清和咽拭子标本分别进行抗体滴度和Mp-RNA检测,探讨两种方法对于儿童Mp感染的诊断能力及在疾病诊疗过程中的应用价值。
收集首都儿科研究所附属儿童医院2019年6至11月,临床诊断为社区获得性肺炎的患者433例,诊断标准参考《儿童社区获得性肺炎管理指南(2013年修订版)》[9]和《诸福棠实用儿科学》第8版[13]。依据实验室检查结果将其分为支原体肺炎组(Mpp组)和非支原体肺炎组(非Mpp组)。
Mpp组患者入选标准:有呼吸道感染症状,以发热、干咳为主;单次血清抗体滴度≥1∶160或急性期/恢复期双份血清抗体滴度升高4倍及以上[9, 10, 11]。非Mpp组患者入选标准:临床诊断为非Mpp的其他类型肺炎,且住院期间复查血清Mp抗体滴度≤1∶80。
按上述入选标准Mpp组患者305例,其中2例患者首次抗体滴度为1∶160,复查无变化,且2次Mp-RNA结果均阴性,考虑支原体既往感染可能性大,剔出Mpp组,最终入组303例,年龄8个月~16(5.79±2.95)岁;其中男性163例,女性140例。患者病程天数计算从出现发热症状开始。评价入院前大环内酯类药物使用情况,患者分为未使用组(包含用药≤3 d者)和使用组(规律用药>3 d者)。非Mpp组患者共128例,年龄2个月~11岁(3.65±3.20)岁。本研究经首都儿科研究所附属儿童医院医学伦理委员会批准(批号:SHERLL2018006),涉及的检查征得患者监护人的知情同意。
1.Mp血清学抗体滴度检测:采用日本富士瑞必欧株式社(SERODIA-MycolI;珠海丽珠试剂股份有限公司)抗体检测试剂盒,检测原理为颗粒凝集法,结果报告为抗体滴度。滴度设置分别为<1∶40、1∶40、1∶80、1∶160、1∶320、1∶640和>1∶640。
2.Mp-RNA检测:采用Mp核酸检测试剂盒(购自上海仁度生物科技有限公司)。患者入院当天由住院医师采集咽拭子,融于生理盐水后,加入等量裂解液制成待测样本。样本加入内标后,采用磁珠法提取靶标RNA,配置扩增检测液转至核酸扩增仪,42 ℃ 1 min为1个循环,共40个循环,荧光通道为FAM(样本通道)和HEX(内标通道)。样本曲线与阈值曲线交叉点的横坐标读数(监测时间)为dt。阳性结果判读:无论 HEX 通道有或无数值,FAM 通道 dt≤35且熔解曲线在(64±5)℃区间有吸收峰的标本为阳性;FAM通道35<dt<40的标本重复检测后,检测结果dt<40且熔解曲线在59~69 ℃有吸收峰的标本为阳性。阴性结果判读:(1)HEX通道dt≤35,且FAM通道无数值或为40,同时熔解曲线在(64±5)℃区间有或无吸收峰的标本均为阴性。(2)无论HEX通道有或无数值,FAM通道dt<35但熔解曲线在59~69 ℃区间没有吸收峰的标本为阴性。
3.Mp-RNA 定量检测:采用上述同一公司提供的4支Mp-RNA标准品,测定后获得标准曲线,对待测样本进行定量分析。定量结果仅做患者治疗前后对比参考。
4.统计学分析:采用SPSS 19.0进行统计学分析。计量资料进行正态性检验,符合正态分布的资料以均值±标准差表示,组间比较采用t检验;不符合正态分布的资料以中位数(四分位数)表示,组间比较采用Wilcoxon秩和检验。计数资料以例数或百分比表示,采用χ?检验。以a=0.05作为检验水准,P<0.05为差异有统计学意义。
Mpp组抗体滴度阴性患者(<1∶160)62例,占20.5%,阳性(≥1∶160)241例,占79.5%。随平均病程天数增加,抗体滴度阳性率逐渐升高(
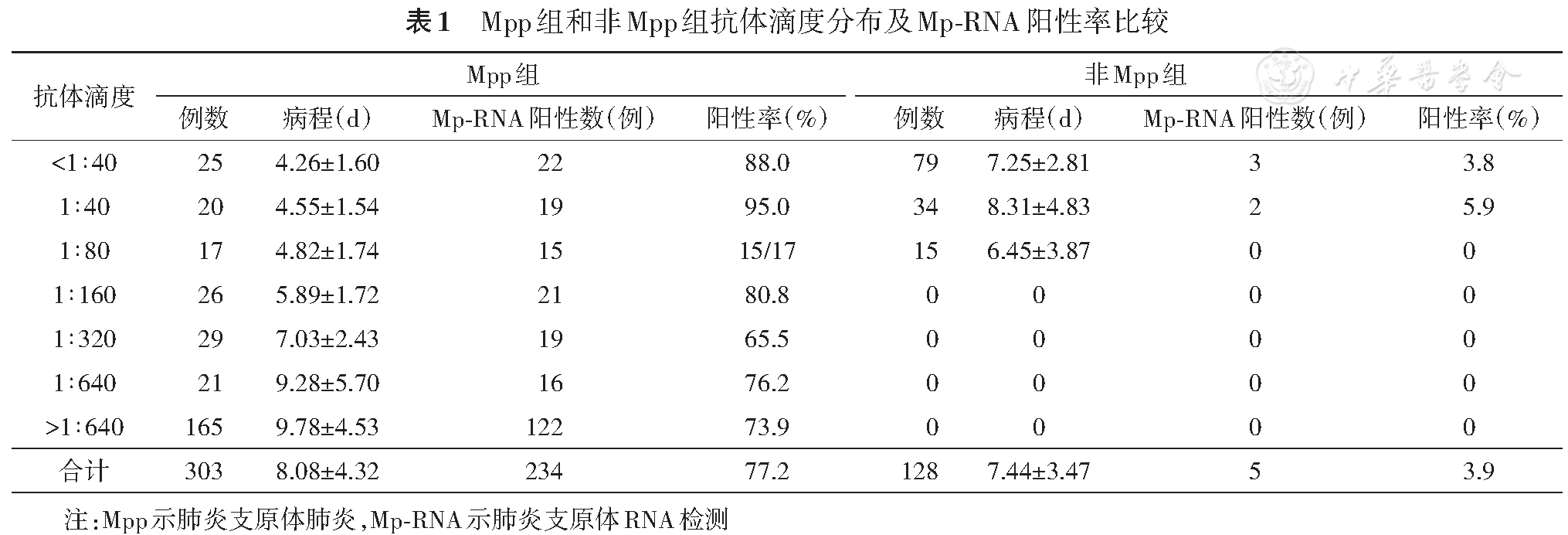
非Mpp组中49例抗体滴度≥1∶40的患者于4~6 d后复查,滴度仍≤1∶80。非Mpp组有5例患者Mp-RNA检测为阳性,阳性率为3.9%(5/128)。
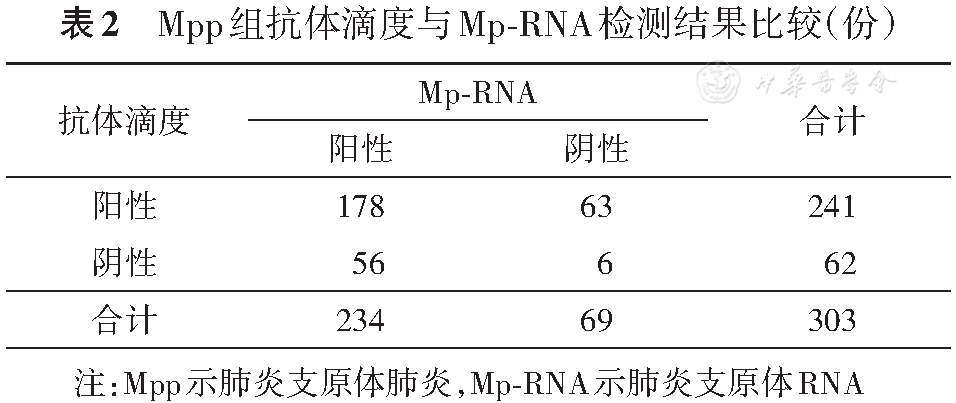
Mpp组患者抗体滴度阳性率(≥1∶160)79.5%(241/303),Mp-RNA阳性率77.2%(234/303),差异无统计学意义(χ?=0.477,P=0.554),诊断价值一致。两种方法阳性一致率58.7%(178/303),阴性一致率2.0%(6/303),见
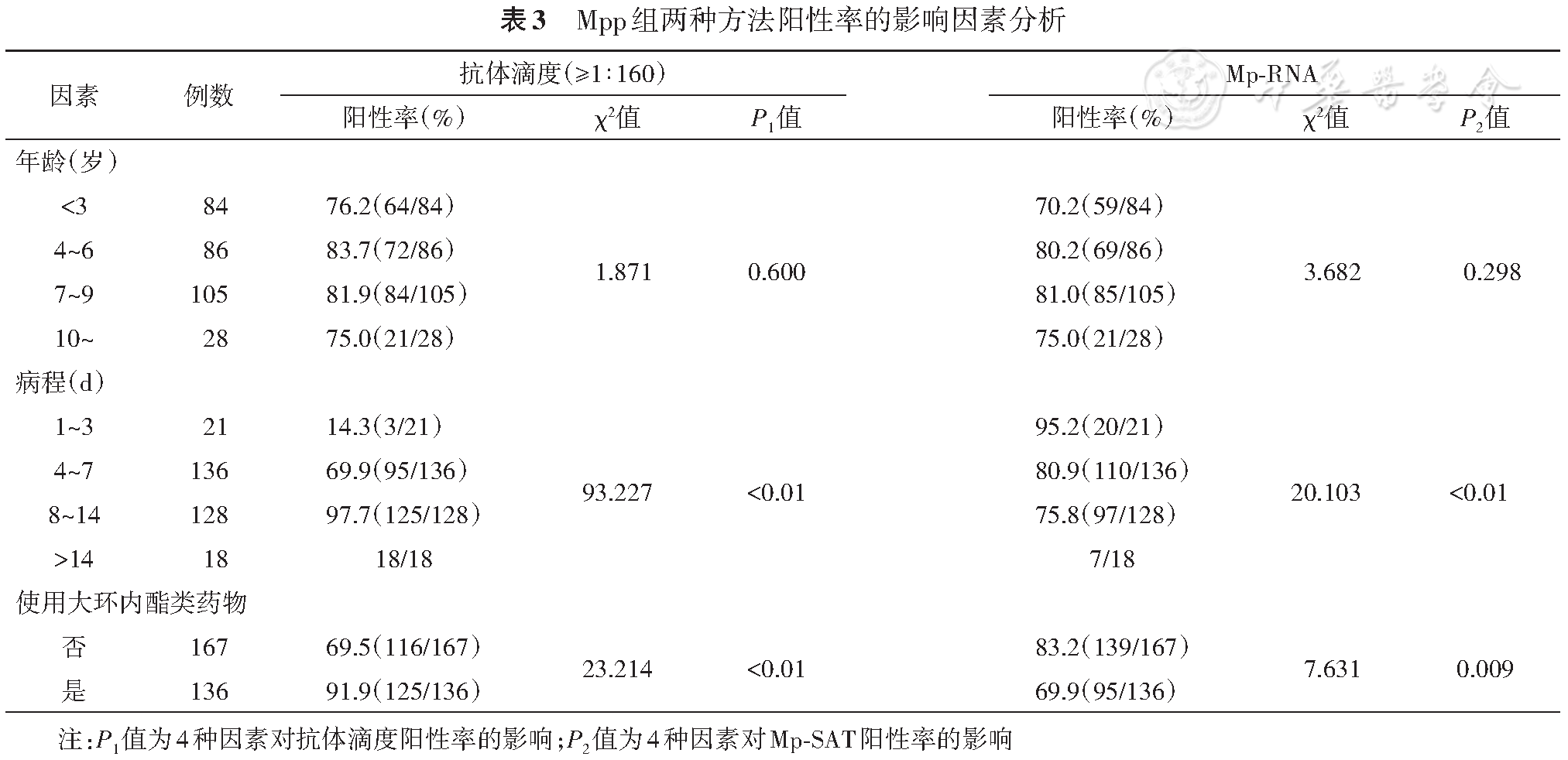
《儿童肺炎支原体呼吸道感染实验室诊断中国专家共识》中指出,抗体检测时间窗、患儿年龄致免疫状态的差异以及抗菌药物治疗情况可能对实验室检测结果产生影响[11],本研究中将上述3个因素进行分析,见
Mpp组共71例患者入院时Mp-RNA检测为阴性,其中14例患者3~7 d后复查,2例患者转阳,12例仍为阴性。
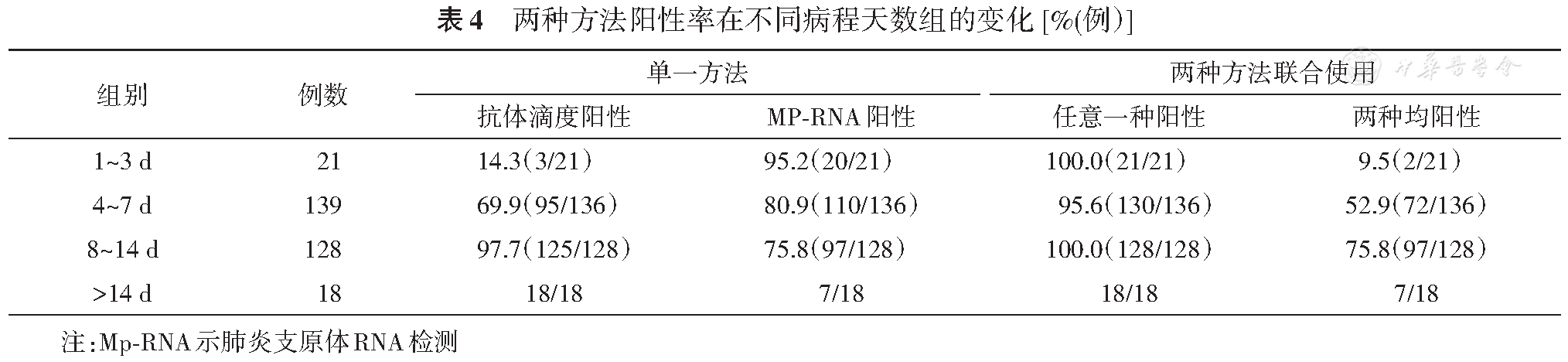
采用单一方法时,抗体滴度阳性率(≥1∶160)在病程较长组较高,而Mp-RNA方法阳性率在病程较短组较高。将两种方法联合使用,以任一阳性判定为感染,在各病程组均有很高的阳性率(100%),仅在发病4~7 d组为95.6%(120/136),有6例患者两种方法初测均阴性,复测血清抗体滴度4倍升高确诊。两种方法均阳性比例,在8~14 d组最高为75.8%(97/128),在1~3 d组和>14 d组均较低(
Mpp组中76例入院Mp-RNA为阳性的患者,平均住院天数为(6.63±2.35)d,期间规范使用阿奇霉素治疗,于出院当日复查。其中26例患者Mp-RNA转阴,转阴率34.2%(26/76),转阴患者入院前大环内酯类药物使用天数为(4.35±3.02)d。Mp-RNA定量结果显示,82.9%(63/76)患者复查呈现下降,拷贝数下降为原来的16.85%;50例未转阴患者首次检测RNA拷贝数均值高于转阴组(26例)37.9倍;42%(21/50)的患者首次检测拷贝数>106拷贝数/ml,而转阴组仅为26.9%(7/26)。
Mpp组中28例患者于出院后一月左右再次入院,再次入院距首次诊断Mpp天数为11~45(18.9±7.9)d。患者首次出院后,均继续口服阿奇霉素1~2个疗程,再次入院原因多为肺部炎症吸收不良或需再次行支气管镜介入治疗。28例患者首次入院时抗体阳性率为64.3%(18/28),Mp-RNA阳性率85.7%(24/28);再次入院时抗体阳性率为100%,且滴度均>1∶640,Mp-RNA阳性率仅为28.6%(8/28)。
儿童肺炎支原体肺炎诊治专家共识和规范中指出Mp抗体滴度单次≥1∶160,恢复期和急性期呈4倍及以上增高或减低均有明确的诊断意义[9, 10, 11]。本研究对抗体阳性出现时间、滴度变化以及与Mp-RNA结果的相关度进行了探讨。对于采用单一方法以及联合检测对Mp早期诊断、治疗和转归的研究均有新的价值。
本研究Mpp组抗体滴度阳性率和Mp-RNA阳性率均在75%以上,与冯雪莉等[14]报道的一致,表明两种方法单独使用的诊断效率一致。病程天数较长组抗体滴度阳性率显著高于较短组(χ?=93.227,P<0.01);抗体滴度1∶160的平均病程天数为5.89 d,因此对于发病1周内的患者,以单次抗体滴度1∶160作为诊断标准,可能存在假阴性[15],应结合病原检测进行诊断。首次检测抗体滴度≤1∶80的Mpp患者,4~6 d后抗体滴度即有4倍及以上升高,而非Mpp组患者抗体滴度未随病程延长转阳。可见在支原体急性感染后,免疫系统正常的儿童,短期内呈现抗体滴度的迅速升高,应用双份血清诊断儿童肺炎支原体感染的准确度均较高。本研究有2例患者,按照抗体滴度≥1∶160的诊断标准判定为Mpp,复查无变化,Mp-SAT两次检测结果均阴性,考虑可能为支原体既往感染,未入组。因此,对于首次检测抗体滴度较低的患者,可能为支原体急性感染早期,抗体尚未产生或处于上升期;或为Mp感染治疗后临床症状痊愈而抗体仍阳性的既往感染者,应结合临床症状、病原学检测结果、抗体滴度变化综合诊断。
SAT作为一种新型的分子生物学检测方法,敏感度和准确度与传统PCR检测方法相比都有很大提高[12, 16]。本研究显示Mp-SAT方法的特异度为96.1%(123/128)、阳性预测值为97.9%(234/239),且在病程早期较抗体检测方法有明显优势,对支原体感染诊断价值较高。尽早进行PCR病原学检测,对于医生正确决策及准确选择抗生素有重要价值[17]。本研究中,Mpp组有2例患者,入院首次Mp-RNA检测为阴性经复查为阳性,且Mp-RNA阳性率在年龄<3岁组最低为70.2%(59/84),考虑为低龄患儿取样难或早期病毒载量低造成的假阴性。推荐使用塑料柄的尼龙拭子、涤纶拭子、植绒拭子或人造棉拭子,多位点采样、规范采样操作[11]。本研究中不同病程天数组(χ?=20.103,P<0.01)和大环内酯类药物使用(χ?=7.631,P=0.009)对Mp-RNA阳性率有显著影响,有研究同样证明[15],Mp-RNA检测用于感染诊断时应在病程早期和大环内酯类抗生素前进行。
RNA只存在于活菌体中,用药及自身免疫等因素可导致病原体死亡或活性下降,RNA降解、载量降低,故Mp-RNA在评价Mp感染转归、药物疗效中的应用价值由此凸显[18]。由于多数Mpp患者住院时间较短,部分患者在出院前尚未达到转阴,通过Mp-RNA定量拷贝数下降进行治疗效果的评价更加敏感,本研究中82.9%患者通过复查监测到拷贝数的下降。另外,本研究中复入院患者抗体滴度均大于>1∶640,因抗体在体内以较高滴度可存在1~3个月,对于短期内重复出现的感染进行诊断时的意义较低,而Mp-RNA结果阳性则对确诊更有意义。因此Mp-RNA定量结果可作为疗效监测评估的重要补充手段,并对近期复感染的鉴别诊断同样具有重要价值。
PCR病原学检测结果可以作为疾病严重程度的风险预警。本研究显示,28例复入院患者多为炎症吸收不良需再次行支气管镜介入治疗的重症患者,其首次入院时Mp-RNA阳性率(85.7%)高于Mpp组平均阳性率(77.2%)。复查未转阴患者早期Mp-RNA定量结果也明显高于转阴组。有类似研究指出,在血清学检测为阳性的支原体感染患者中,支原体肺炎组MP-PCR阳性率高于支原体支气管炎组[19];早期Mp-DNA病原载量与下呼吸道感染的持续时间相关,且高病原载量(>107拷贝数/ml)和其在下呼吸道存在的时间与疾病的严重程度相关[20]。因此,PCR病原学检测早期阳性和早期载量较高与疾病严重程度相关,可作为重症病例预警判断的重要因素。
本研究中,两种方法联合使用以任一阳性判定为感染时的阳性率较高,两种检测方法各有优势,呈现互补。抗体方法不受抗菌药物使用和取材操作等因素的影响,特异性强,但机体产生时间和能力使得发病早期检测不具优势,要正确把握时间窗并做动态监测。在规范标准的取材操作前提下,在病程早期、未使用抗菌药物前检测Mp-RNA,对临床疗效评估、用药指导及短期内反复感染的病原诊断方面均具有较高的价值。
随着检测技术的发展和普及,联合应用抗体和病原学RNA两类检测方法,以取长补短、加强优势,为感染性疾病的临床确诊和治疗措施的调整提供最有效的实验室依据。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
