糖尿病神经病变诊治专家共识(2021年版)
2021年6月
中华内分泌代谢杂志,第37卷第6期 第499页-第515页
糖尿病神经病变是因不同病理生理机制所致、具有多样化表现的一组临床综合征,是糖尿病最常见的慢性并发症[1,2]。常见的糖尿病神经病变类型为远端对称性多发性神经病变(distal symmetric polyneuropathy,DSPN)和自主神经病变,其中DSPN是最常见的类型,约占糖尿病神经病变的75%,通常也被一些学者称为糖尿病周围神经病变[3]。
随着糖尿病神经病变在临床研究中的进展,国际上有关糖尿病神经病变的共识和指南也在更新。因此,有必要基于现有证据制定糖尿病神经病变规范化管理的指导原则。本共识主要依据国内外糖尿病神经病变的最新研究成果,由来自内分泌和神经病学领域的专家经过多次讨论,凝练而成。本共识介绍了糖尿病神经病变的流行病学、病因和发病机制、分型,重点介绍了DSPN和自主神经病变的临床表现、筛查与诊断和治疗,并介绍了糖尿病小纤维神经病变(small fiber neuropathy,SFN)的筛查和诊断;本共识中糖尿病神经病变分型与国内以往的分型有较大的更新,治疗纳入了国内应用比较广泛的针对糖尿病神经病变发病机制的常用药物及中药,也详细介绍了针对痛性DSPN的治疗。
此外,本共识在筛查与诊断及治疗部分还列出了要点提示,标注了证据级别(分为A、B、C、E)。证据级别A:证据基于多项随机对照试验或meta分析。证据级别B:证据基于单项随机对照试验或多项非随机对照研究。证据级别C:仅为专家共识意见和(或)基于小规模研究、回顾性研究和注册研究结果。证据级别E:没有临床试验证据、临床试验可能不切实际或者存在矛盾证据的专家意见。
本共识的制定旨在指导和帮助临床医师对糖尿病神经病变进行规范化的综合管理,早期防治糖尿病神经病变,延缓疾病进展。
糖尿病神经病变是1型糖尿病(type 1 diabetes mellitus,T1DM)和2型糖尿病(type 2 diabetes mellitus,T2DM)最为常见的慢性并发症,约50%的糖尿病患者最终会发生DSPN[1]。国外一项25年的队列研究显示,通过临床诊断的DSPN患病率约为45%,然而当采用更敏感的神经传导测定法诊断时,DSPN患病率则增加至60%~75%[4,5]。此外,DSPN在糖尿病前期即可发生[6,7]。一项关于糖尿病神经病变的全国多中心研究发现,我国DSPN患病率为53%[8]。中国台湾地区人群研究报道的T2DM患者DSPN的患病率为21.3%[9]。目前,关于自主神经病变的流行病学研究资料较少,一项纳入2 048例糖尿病患者的研究发现,中国人群心脏自主神经病变(cardiac autonomic neuropathy,CAN)在T1DM和T2DM患者中的患病率分别为61.6%和62.6%[10]。
糖尿病神经病变的病因和发病机制尚未完全阐明,目前认为主要与高血糖、脂代谢紊乱以及胰岛素信号通路异常所导致的一系列病理生理变化相关,其中包括多元醇途径、糖酵解途径、己糖胺途径、晚期糖基化终末产物途径、Toll样受体4信号转导通路、氧化低密度脂蛋白受体1信号通路等,单独或共同作用导致细胞Na+-K+-ATP酶表达下调、内质网应激、线粒体功能障碍、DNA损伤、炎症信号增强及炎症因子水平升高(

注:AGE:糖基化终末产物;LDL-C:低密度脂蛋白胆固醇;Ox-LDL-C:氧化低密度脂蛋白胆固醇;FFA:游离脂肪酸;GLUT:葡萄糖转运体;RAGE:晚期糖基化终产物受体;LOX1:氧化低密度脂蛋白受体1; TLR4:Toll样受体4; PI3K:磷脂酰肌醇-3激酶;Akt:蛋白激酶B; ROS:活性氧簇
外周和中枢神经元的改变是糖尿病神经病理性疼痛重要的发病机制。在高糖情况下,外周神经伤害感受器的离子通道激活导致神经元超兴奋性。有髓轴突钾离子通道Kv表达下调,同样也会引起神经元超兴奋性。神经元超兴奋性使刺激反应过度和异位神经元活动,从而导致脊髓疼痛传入信号异常增加。脊髓小胶质细胞活化可以促进脊髓层面神经元超兴奋性。一些与疼痛感受及情绪认知相关的上、下行传导束功能异常也参与糖尿病神经病理性疼痛的发生,包括上行传导束如脊髓丘脑通路、脊髓网状束等,以及抑制痛觉信号传入脊髓层面的下行传导束[12,15]。
糖尿病神经病变分为弥漫性神经病变、单神经病变、神经根或神经丛病变。而弥漫性神经病变又分为DSPN和自主神经病变。DSPN包括小纤维、大纤维和混合纤维神经病变,自主神经病变包括CAN、胃肠道自主神经病变和泌尿生殖道自主神经病变等。单神经病变可累及单颅神经或周围神经,同时累及多个单神经的神经病变为多发性单神经炎,需与多发性神经病变相鉴别。神经根或神经丛病变常见为神经丛神经病变和胸神经根病变。在上述类型中,DSPN为最常见的类型,其次为自主神经病变。糖尿病神经病变的分型详见
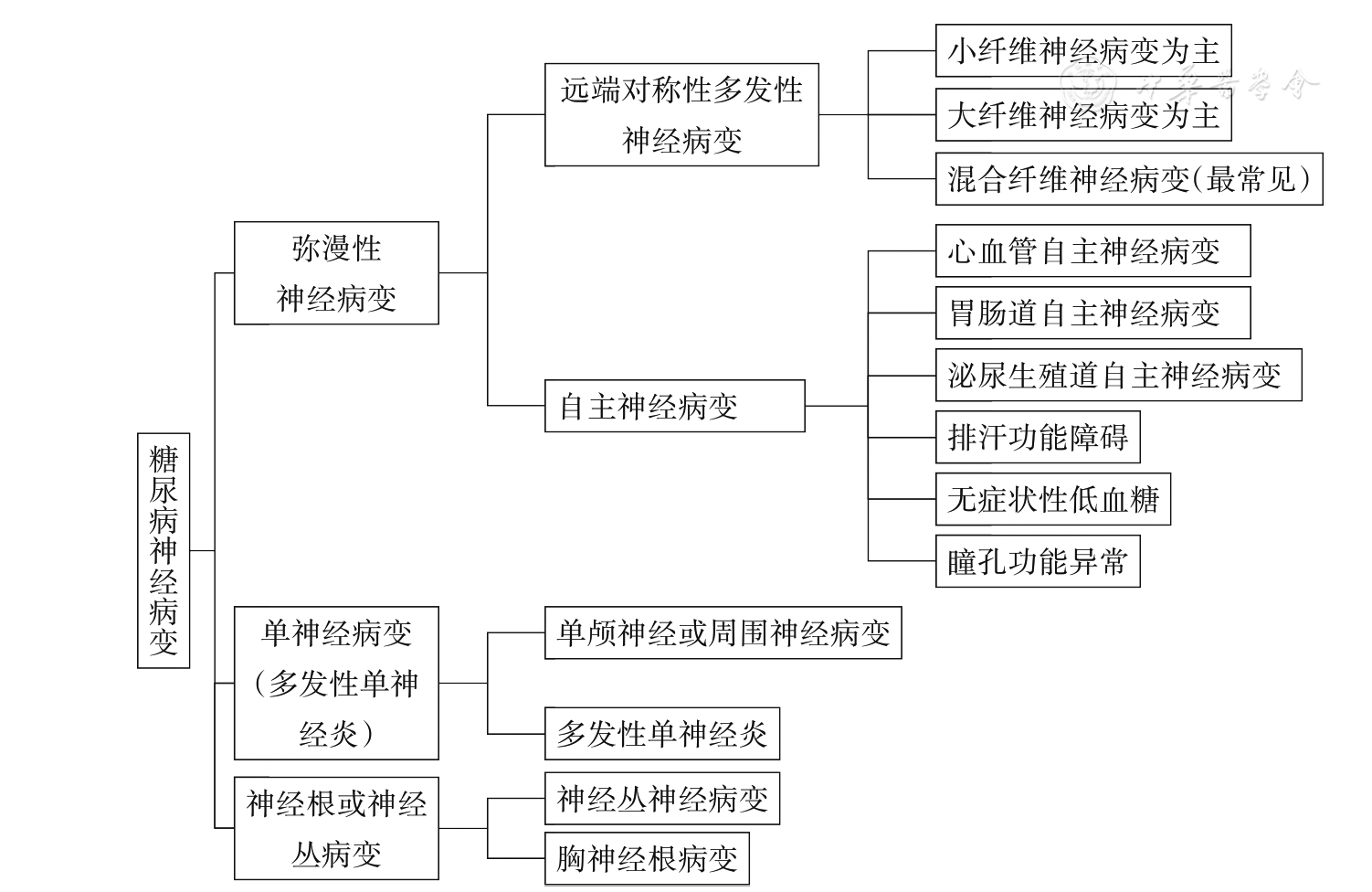
注:小纤维神经病变是一类主要累及小直径薄髓Aδ神经纤维和无髓C类神经纤维的周围神经病变,大神经纤维不受累,疼痛、感觉异常和(或)自主神经功能障碍是该类疾病最典型的临床表现[16];大纤维神经病变是一类主要累及大直径有髓神经纤维(Aα/β纤维),而小神经纤维不受累的周围神经病变,可表现为运动功能障碍和(或)触摸觉、振动觉、位置觉等感觉功能障碍,神经电生理检查提示运动或感觉神经传导异常[2];混合纤维神经病变指同时累及大小神经纤维的周围神经病变
除糖尿病神经病变外,糖尿病患者还容易合并非糖尿病性神经病变,包括压力性麻痹、慢性炎症性脱髓鞘性多发性神经病变、神经根神经病变及治疗导致的急性痛性SFN(通常由胰岛素治疗导致血糖下降过快所致),要注意鉴别。
DSPN的简单定义是排除其他原因后,糖尿病患者出现的周围神经功能障碍相关的症状和(或)体征[2]。DSPN一般表现为对称性多发性感觉神经病变,最开始影响下肢远端,随着疾病的进展,逐渐向上发展,形成典型的"袜套样"和"手套样"感觉。最常见的早期症状是由SFN引起的,表现为疼痛和感觉异常。50%的糖尿病患者会出现DSPN导致的疼痛(亦称为痛性DSPN),表现为灼痛、电击样痛和锐痛;其次是酸痛、瘙痒、冷痛和诱发性疼痛[17]。DSPN若累及大神经纤维则导致麻木以及位置觉异常;多达50%的DSPN可能是无症状的,如果未被识别且未实施预防性足部护理,则患者有足部受伤的危险[18]。详细询问病史对于诊断DSPN至关重要,有典型周围神经病变症状者易于诊断,症状不明显或无症状者需要通过体格检查或神经电生理检查作出诊断[2]。
DSPN的筛查评估包括详细的病史采集及5项筛查。T2DM患者在确诊时、T1DM患者在确诊5年后均应接受关于DSPN的筛查,此后至少每年接受一次筛查。除此之外,还应将有周围神经病变症状的糖尿病前期患者纳入筛查范围内。
128 Hz音叉检查振动觉、10 g尼龙丝试验检查压力觉和踝反射可用于评估大纤维神经功能,而温度觉或针刺痛觉可用于评估小纤维神经功能,10 g尼龙丝试验还可用于明确足溃疡和截肢的风险。需要注意的是,用于DSPN筛查和诊断的10 g尼龙丝压力觉试验与溃疡"高危足"的诊断不同[19,20]。在临床工作中联合应用踝反射、振动觉、压力觉、针刺痛觉及温度觉等5项检查来筛查DSPN,两种或以上检查相结合,可提高检测DSPN的灵敏度和特异度[21]。
DSPN大纤维神经病变和SFN的症状和体征见

DSPN 5项筛查方法如下所示。
(1)踝反射:患者仰卧位或俯卧位,屈膝90°;或跪于椅面上。检查者左手使其足背屈,右手持叩诊锤叩击跟腱,足不能跖屈,为踝反射消失;跖屈不明显,为减弱;轻触碰即有跖屈,则为亢进。当双侧踝反射同时出现减弱或消失时判断为阳性[22,23]。
(2)振动觉:将振动的128 Hz音叉柄置于双足拇趾近节趾骨背面的骨隆突处,在患者闭眼情况下询问能否感觉到音叉的振动,并注意持续的时间,检查时需与正常处对比。持续时间较正常缩短,为振动觉减退;未感觉到振动,为振动觉缺失。任意一侧振动觉消失,即判断为阳性[22,24]。
(3)压力觉:①用于DSPN筛查:将10 g单纤维尼龙丝置于双足拇趾背侧,加力使其弯曲,保持1~2 s,每侧重复4次,记录未感知到压力的总次数以评分,每次1分,若≥5分,认为异常[19]。②用于"高危足"的评估:将10 g尼龙单丝置于被检查位置(大拇趾足底面和第1、3、5跖骨头),加力使其弯曲,保持1~2 s,若有任一位置感知不到压力,即为"高危足"[20]。
(4)针刺痛觉:用大头针均匀轻刺患者足背皮肤,由远端向近端。如患者感觉不到疼痛(痛觉消失)或感觉异常疼痛(痛觉过敏)考虑为痛觉异常。任意一侧刺痛觉异常,即判断为阳性[22,25]。
(5)温度觉:在患者闭眼情况下,分别将检查仪两端(温度感觉为凉的金属端及温度感觉为热的聚酯端)置于足背部皮肤任意一点(避开胼胝、溃疡、瘢痕和坏死组织等部位)1~2 s进行检测,患者无法辨别两端温度差异则为异常,任意一侧温度感觉异常,则判断为阳性[22]。
通常情况下,DSPN的诊断主要是依据临床症状和体征;只有在临床表现不典型、诊断不明或疑有其他病因时,建议患者于神经内科专科就诊,或进行神经电生理检查评估。非典型临床表现包括:运动症状重于感觉症状,病情快速进展,病变呈非对称性。典型的DSPN神经电生理主要为神经传导的异常,表现为感觉神经动作电位波幅降低、感觉神经传导速度减慢;可有复合肌肉动作电位波幅降低及运动神经传导速度减慢。若患者存在以下不典型症状或体征时,也需进行神经电生理检查:(1)症状或体征不对称。(2)最初表现为肌无力,而不是感觉缺失。(3)近端的症状和体征比远端更明显。(4)疾病进展迅速。
常用的评估SFN的方法:(1)皮肤活检PGP 9.5免疫组织化学染色表皮神经纤维密度(intraepidermal nerve fiber density,IENFD)减少是诊断SFN的"金标准"。IENFD活检结果具有良好的稳定性和重复性[26]。不足之处是该检查是有创的。(2)定量感觉测定是评估SFN的可靠手段,可以定量评估深感觉和痛温觉的异常,评估参数包括热觉和冷觉阈值、热痛觉和冷痛觉阈值,定量感觉测定中的足部热觉和(或)冷觉阈值异常为诊断SFN的标准之一[27]。(3)角膜共聚焦显微镜可以通过检查角膜的神经支配,即时分析角膜神经密度和形态,被认为是目前研究SFN的重要工具[28,29]。(4)皮肤交感反应可以检测交感神经节后C类纤维功能状态,有助于发现交感神经通路的异常,表现为潜伏时延长、波幅降低或引不出波形。
(1)具有明确的糖尿病病史。(2)在确诊糖尿病时或确诊之后出现的神经病变。(3)出现神经病变的临床症状,如疼痛、麻木、感觉异常等,5项检查(踝反射、振动觉、压力觉、针刺痛觉、温度觉)任意1项异常;若无临床症状,则5项检查任意2项异常也可诊断。(4)除外其他原因所致神经病变,包括具有神经毒性的药物(如化疗药物)、维生素B12缺乏、颈腰椎疾病(压迫、狭窄、退行性变)、脑梗死、慢性炎症性脱髓鞘性神经病变、遗传性神经病变和血管炎、感染(如获得性免疫缺陷综合征)及肾功能不全引起的代谢毒物对神经的损伤。如根据以上检查仍不能确诊,需要进行鉴别诊断,可以进行神经电生理检查[2,30,31]。
(1)疑似:存在长度依赖性的小纤维损伤的症状和(或)临床体征。(2)临床诊断:存在长度依赖性的小纤维损伤的症状和临床体征,同时神经传导测定正常。(3)确诊:存在长度依赖性的小纤维损伤的症状和临床体征,踝部IENFD改变和(或)足部定量感觉测定温度觉阈值异常,同时神经传导测定正常。
(1)确诊:有DSPN的症状或体征,同时神经传导测定或小纤维神经功能检查异常。(2)临床诊断:有DSPN的症状和1项以上阳性体征,或无症状但有2项以上阳性体征。(3)疑似:有DSPN的症状或体征(任意1项)。(4)亚临床:无DSPN的症状和体征,仅神经传导测定或小纤维神经功能检查异常。
主要根据临床症状和体征,临床诊断有疑问时,可以进行神经电生理检查等。DSPN的诊断流程见
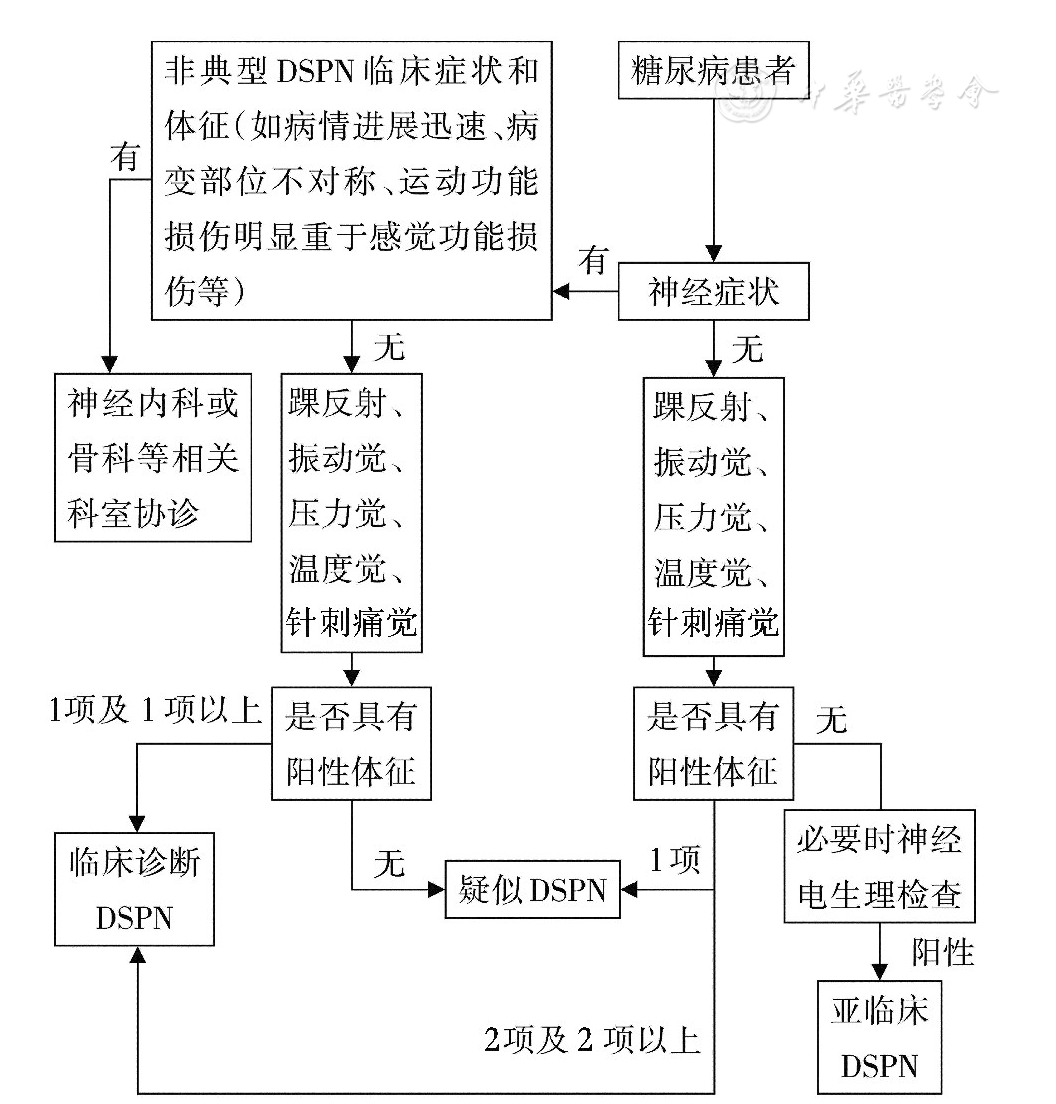
注:DSPN:远端对称性多发性神经病变
◆ T2DM患者在确诊时、T1DM患者在确诊5年后均应接受关于DSPN的筛查,此后至少每年接受一次筛查(证据级别B)。
◆应将有周围神经病变症状的糖尿病前期患者纳入筛查范围内(证据级别B)。
◆评估应包括详细的病史采集,温度觉、针刺痛觉测试(小纤维神经功能),以及128 Hz音叉振动觉测试(大纤维神经功能)。所有患者每年都应进行10 g单纤维尼龙丝检查,以评估是否存在足部溃疡及截肢的风险(证据级别B)。
◆在临床表现不典型、诊断不明或疑有其他病因时,建议患者于神经内科专科就诊,或进行神经电生理检查评估。非典型临床表现包括运动症状重于感觉症状,病情快速进展,病变呈非对称性(证据级别B)。
CAN早期可无症状,只有通过深呼吸降低心率变异性(heart rate variability,HRV)才能检测到。由于心脏迷走神经及交感神经功能紊乱,晚期可表现为静息状态下心动过速、直立性低血压。直立性低血压患者还可出现血压昼夜变化消失,夜间可出现仰卧位高血压以及餐后低血压表现,还可表现为运动不耐受、晕厥、无症状型心肌梗死、心搏骤停甚至猝死[33,34]。可以采用HRV及体位变化时血压测定、24 h动态血压监测等方法协助诊断[2,33]。应对有微血管和神经并发症的糖尿病患者及无症状低血糖的患者进行CAN症状和体征的评估;此外,若出现CAN的症状和体征时,应排除其他可能导致CAN症状的共病或药物影响。
1.筛查。
(1)卧立位血压试验:患者在仰卧位的1 min内行两次血压测量,从仰卧位转换至直立倾斜试验体位或站立位后3 min内,每30 s测量一次血压,收缩压降低≥20 mmHg(1 mmHg=0.133 kPa)或舒张压降低≥10 mmHg即为阳性,考虑为直立性低血压。
(2)有昼夜血压变化消失的患者,可行24 h动态血压监测。
(3)静息性心动过速:静息状态下心率>100次/min。
(4) HRV的检测[35,36,37]:①深呼吸HRV:在深呼吸1~2 min期间进行心电图记录,以呼气期间最长R-R间隔除以吸气期间最短R-R间隔(E/I比值)作为评估HRV的指标。②卧立位HRV:患者从卧位开始起身时即进行心电图记录,站立后第20次心跳和第40次心跳之间的最长R-R间隔除以站立后第5次心跳和第25次心跳之间的最短R-R间隔(30∶15比值)作为评估卧立位HRV的指标。正常人在深呼吸或体位改变时,心率会加快,HRV增高,而在CAN患者,其心率可能无变化,HRV下降。③Valsalva动作HRV:嘱患者行Valsalva吸气屏息动作,同时记录心电图,Valsalva比值=最大RR间期/最小RR间期。需要注意的是,Valsalva动作会增加胸腔内压、眼内压和颅内压,可能与眼内出血或晶状体脱位有关。在缺乏循证证据的情况下,至少应当避免增生性视网膜病变患者行Valsalva动作检查。
2.诊断:CAN的诊断依据临床症状和(或)体格检查,常见症状包括心悸、头晕、虚弱无力、视力障碍、晕厥等。异常体征包括静息性心动过速、直立性低血压及HRV下降。
(1)可能或早期CAN:1项HRV结果异常。
(2)确诊CAN:至少2项HRV结果异常。
(3)严重或晚期CAN:除HRV结果异常之外,还存在直立性低血压[35,36]。
◆应对有微血管病变和神经并发症的糖尿病患者进行CAN的症状和体征的评估(证据级别E)。
◆出现CAN的症状或体征时,应排除其他可能导致CAN症状的共病或药物影响(证据级别E)。
◆对于无症状低血糖的患者,应进行CAN症状或体征的评估(证据级别C)。
胃肠道自主神经病变的主要临床表现包括食管动力障碍、胃食管反流、胃轻瘫、腹泻、大便失禁和便秘等。胃轻瘫主要表现为恶心、呕吐、早饱、腹胀感及上腹疼痛[38,39]。在诊断胃轻瘫之前需排除胃排出道梗阻或其他器质性原因。胃电图、胃排空闪烁扫描(测定固体和液体食物排空的时间)等有助于诊断[2]。13C-辛酸呼气试验作为无创、简便和可靠的评价胃排空的手段,与核素法具有较好相关性。
1.筛查。
(1)在进行消化系统自主神经病变筛查前,首先应排除其他原因所致的消化系统疾病。对于有糖尿病神经病变、糖尿病视网膜病变和(或)糖尿病肾病的患者应进行胃轻瘫的评估,需要评估患者是否存在非预期的血糖波动、进食后的早期饱腹感、腹胀以及恶心呕吐等症状。在进行胃轻瘫测试之前,需要排除其他改变胃排空的原因,如使用阿片类药物,或胰升糖素样肽1(glucagon-like peptide-1,GLP-1)受体激动剂以及器质性病变造成的胃排出道梗阻等,后者需要特殊的检查。
(2)筛查方法:①上消化道内镜和食管24 h动态pH值监测评估:可用于诊断胃食管反流。②胃排空闪烁扫描:受检者在空腹状态下10 min内摄取标准的低脂肪放射性标记的食物,并在进食后4 h内每隔15 min进行一次显像扫描,延迟胃排空定义为2 h胃内容物>60%或4 h胃内容物>10%。③胃电图。④胃排空呼气试验:患者服用含13C的物质(常用13C-辛酸),4~6 h后测量通过呼气所产生的二氧化碳。有文献报道,胃排空呼气试验的准确度接近胃排空闪烁扫描[38,39]。
2.诊断。
(1)胃轻瘫:胃排空闪烁扫描为诊断胃轻瘫的"金标准"[40]。扫描前需要优化血糖水平,以避免假阳性结果。13C-辛酸呼气试验及胃电图也有助于诊断胃轻瘫[41]。
(2)其他消化道功能紊乱:①小肠功能障碍:没有特异性的诊断性试验,但测压法可以明确是否存在肠道动力异常。②大肠功能障碍:钡剂测压可辅助诊断。③胆囊功能障碍:功能超声可辅助诊断[42]。
◆对有糖尿病神经病变、糖尿病视网膜病变和(或)糖尿病肾病的患者应进行胃轻瘫的评估,需要评估上述患者是否存在非预期的血糖波动、进食后的早期饱腹感、腹胀以及恶心呕吐等症状(证据级别C)。
◆在进行专门的胃轻瘫测试之前,需要排除其他已知的改变胃排空的原因,如使用阿片类药物,或GLP-1受体激动剂以及器质性病变造成的胃排出道梗阻等,后者需要特殊的检查(证据级别C)。
◆胃轻瘫评估可用如下方法:进食可消化的固体食物后4 h内,每隔15 min用进行闪烁显像扫描检查,以评估胃排空;或者进行13C-辛酸呼气试验(证据级别B)。
泌尿生殖道自主神经病变表现为性功能障碍和膀胱功能障碍。性功能障碍在男性可导致勃起功能障碍(erectile dysfunction,ED)和(或)逆向射精,在女性表现为性欲降低、性交时疼痛增加、性唤起能力降低以及阴道润滑性下降。膀胱功能障碍表现为夜尿、尿频、尿急、尿流速降低、尿潴留及尿路感染等[2]。
1.筛查:针对糖尿病患者每年应询问患者的性欲以及达到和维持勃起的能力,以筛查是否存在男性ED。对于ED患者应进行性激素水平的测定以排除性腺机能减退,还应该排除药物及其他原因所导致的病变。超声检查可用于判定膀胱容量、膀胱残余尿量等以确定神经源性膀胱。对于患有复发性尿路感染、肾盂肾炎、尿失禁的患者,应评估是否存在诸如夜尿症、性交时疼痛等症状,以筛查是否存在下尿路刺激症状和女性性功能障碍等其他形式的糖尿病神经病变,并进行膀胱功能评估:即通过膀胱残余尿量评估糖尿病性膀胱功能障碍,若有必要,再通过全面尿动力学检查进一步评估[2,43]。尿动力学检查包括自由尿流率测定、膀胱压力容积测定术、排尿性尿道压力分布测定术、排尿性膀胱尿道造影术和影像尿动力学检查术等[44]。
2.诊断。
(1)ED:诊断应包括全面的病史询问,如性生活史、药物使用、危险因素评估和社会心理因素等,其他检查还包括评估夜间阴茎肿胀、阴茎多普勒超声、阴茎球-海绵体反射、阴茎背侧感觉神经传导、阴茎交感皮肤反应的振幅和潜伏期以及阴部神经体感诱发电位等[45]。应在确定ED的体征和症状并排除其他原因(如性腺机能减退)后作出诊断。
(2)膀胱功能障碍:亦称为神经源性膀胱,表现为尿失禁、夜尿多、尿频、尿急、尿潴留、排尿无力等。对于有反复下尿路感染、肾盂肾炎、尿失禁或尿潴留的糖尿病患者,建议进行膀胱功能评估[45]。膀胱测压(包括排尿前后膀胱容量评估)、尿动力学检查等可辅助诊断糖尿病膀胱自主神经病变[42]。超声检查可判定膀胱容量、残余尿量,有助于诊断糖尿病神经源性膀胱[31]。
◆针对糖尿病患者应每年询问患者的性欲以及达到和维持勃起的能力,以筛查是否存在男性ED(证据级别C)。
◆针对反复尿路感染的糖尿病患者应评估是否存在诸如夜尿症、性交时疼痛等症状,以筛查是否存在下尿路刺激症状和女性性功能障碍等其他形式的糖尿病神经病变(证据级别E)。
泌汗功能障碍主要表现为多汗症或无汗症,出汗减少可导致患者皮肤干燥、龟裂,增加发生感染的风险。泌汗功能障碍是远端SFN中最早可检测到的神经生理异常表现之一,传统的检测手段有定量泌汗轴突反射检测和皮肤交感反应。近年来,有一些新型设备在临床上被证明有良好的实用性,如Sudoscan电导分析仪、神经贴片(Neuropad)等。Sudoscan电导分析仪是一种新型简单、迅速、无创且重复性好的评估泌汗功能的手段[46,47]。其原理是基于汗液氯化物浓度测量手和脚上的电化学皮肤电导,并根据汗液氯化物和镍电极之间的电化学反应对汗腺功能进行精确评估。神经贴片是一种测量脚底表面汗液产生的简单易行的测试工具[48,49]。其工作原理基于钴化合物的颜色变化,对DSPN也具有一定的诊断能力。
对低血糖感知异常,当支配内分泌腺体的自主神经发生病变时,糖尿病患者在低血糖时应激激素如儿茶酚胺、生长激素等分泌常延迟或减少,造成患者对低血糖感知减退或无反应,低血糖恢复的过程延长,严重时可危及生命。因此,应加强血糖监测,及时处理[31]。
研究发现,CAN患者的瞳孔反应显著下降,主要表现为瞳孔直径减小、对可卡因和磷脂酰胆碱测试的反应减弱、使用滴眼液后瞳孔大小不均等[50]。
糖尿病患者比非糖尿病患者更容易发生单神经病变[51]。糖尿病单神经病变常累及正中神经、尺神经、桡神经和腓总神经[52]。颅神经病变较罕见,一般为急性发作,最容易累及动眼神经,表现为上睑下垂,累及其他颅神经(包括Ⅳ、Ⅵ和Ⅶ)时表现为面瘫、面部疼痛、眼球固定等,通常会在几个月内自行缓解[52]。同时累及多个单神经的神经病变为多发性单神经炎,需与多发性神经病变相鉴别。
糖尿病神经根神经病变,又称糖尿病性肌萎缩症或糖尿病性多神经根神经病变,通常累及腰骶神经丛,主要发生在T2DM患者中[53,54,55]。患者通常表现为大腿单侧剧烈疼痛和体重减轻,然后是运动无力、肌萎缩,该疾病通常是自限性的[54,55]。
糖尿病神经病变的危害巨大,但目前尚无针对糖尿病神经损伤的特殊治疗手段。此外,糖尿病神经病变早期的临床表现常较隐匿、易被忽略,待临床作出诊断时,其往往已处于不可逆阶段[56]。因此,积极预防和早期干预糖尿病神经病变尤为重要。
糖尿病神经病变的发病率和严重程度与高血糖的持续时间和血糖水平呈正相关[57]。高血糖所诱导的微血管病变及表观修饰改变在后期血糖控制良好的情况下依然存在,并且该损害不可逆[58]。因此,早期控制血糖具有重要意义。
强化血糖控制对降低T1DM患者发生神经病变的作用是肯定的,血糖控制越严格,患者受益越多[59,60]。研究表明,良好的血糖控制不仅能降低T1DM患者DSPN发生率,也能减少糖尿病自主神经病变的发生[61,62]。T1DM患者早期血糖控制接近正常,可以有效地预防DSPN和CAN的发展[63,64]。
然而,血糖控制在T2DM中所起的作用尚存在争议。在包括控制糖尿病患者心血管疾病风险性行动(Action to Control Cardiovascular Risk in Diabetes,ACCORD)研究等在内的多个针对T2DM患者的研究结果显示,控制血糖并不能明显减少神经病变的发生或仅具有一定的延缓神经病变进展的作用[65,66]。虽然T2DM血糖控制接近正常使神经病变的获益证据没有T1DM强,但是一些研究证实可以轻度延缓神经病变的进展[65,67]。存在于T1DM和T2DM之间的这种差异,除了与研究设计不同有关,还提示T2DM神经病变的发病机制可能较T1DM复杂,其临床评估及治疗更加困难。在控制血糖的同时,要平衡血糖控制的益处与所致的不良风险,寻求最佳的血糖控制水平。针对有多种危险因素的T2DM患者,建议制定综合管理的血糖控制目标以预防CAN的发生发展。
健康的生活方式可以降低糖尿病神经病变的发病风险,延缓危险因素发展的进程,这也是糖尿病神经病变的一级预防策略。在糖尿病前期、代谢综合征以及T2DM患者中,推荐进行生活方式干预以预防DSPN的发生。对于患有CAN的糖尿病前期患者,考虑改变生活方式以改善症状。
英国的一项前瞻性研究表明,除了血糖控制外,神经病变的发生率与潜在的心血管危险因素有关,包括三酰甘油水平升高、体重指数增加、吸烟和高血压等[57]。长期规律、合理的运动可减轻体重,改善脂质代谢,控制血糖、血压,降低糖尿病神经病变的发病率[68,69]。除此之外,运动还可以促进神经纤维的再生,有助于糖尿病神经病变的防治[68]。因此,倡导在糖尿病人群中积极开展健康教育,以帮助其确立科学和理性的防治观念与目标,提高对神经病变的预防意识,使患者保持健康的生活方式。
◆ T1DM患者应尽早积极控制血糖以预防或延缓DSPN及CAN的发生发展(证据级别A)。
◆ T2DM患者应积极控制血糖以预防和延缓DSPN的发生发展(证据级别B)。
◆对于病情较晚期、有多种危险因素和共病的T2DM患者,单一强化血糖控制对预防DSPN的效果有限,目标应为以患者为中心的综合管理(证据级别B)。
◆针对有多种危险因素的T2DM患者应制定综合管理的血糖控制目标以预防CAN发生发展(证据级别C)。
◆在糖尿病前期、代谢综合征以及T2DM患者中,推荐生活方式干预用于预防DSPN的发生(证据级别B)。
◆可以考虑改变生活方式以改善糖尿病前期患者的CAN(证据级别C)。
目前,针对糖尿病神经病变的病因和发病机制治疗包括控制血糖、营养神经、抗氧化应激、抑制醛糖还原酶活性、改善微循环等;一些中药也可以用于糖尿病神经病变的治疗。
1.营养神经药物。
甲钴胺:作为活性维生素B12制剂,较非活性维生素B12更易进入神经细胞内,可以促进神经元内核酸和蛋白质的合成,对髓鞘形成和轴突再生具有显著的促进作用,能够修复损伤的神经细胞,改善神经传导速度。甲钴胺可明显改善糖尿病神经病变患者的临床症状、体征以及神经传导速度[70,71]。推荐用法:甲钴胺针剂500~1 000 μg/d肌内注射或静脉滴注2~4周,其后给予甲钴胺片500 μg,每日3次口服,疗程至少3个月。该类药物安全性好,无明显不良反应。
2.抗氧化应激药物。
α-硫辛酸(简称硫辛酸):是一种强有力的抗氧化因子,能够通过抑制脂质过氧化,增加神经营养血管的血流量,提高神经Na+-K+-ATP酶活性,直接清除活性氧簇和自由基,保护血管内皮功能。α-硫辛酸600 mg/d静脉滴注3周,可改善神经感觉症状(神经病变主觉症状问卷评分)和神经传导速度[72,73]。600 mg/d长期口服亦可改善神经电生理改变,减轻及延缓神经损害的发展,建议早期给予治疗[74]。Meta分析表明口服α-硫辛酸与注射剂型的临床疗效相当[75]。此外,硫辛酸在改善糖尿病患者胃轻瘫、男性ED方面也有一定的疗效[76,77,78,79]。推荐用法:α-硫辛酸600 mg/d,疗程3个月;症状明显者先采用α-硫辛酸针剂600 mg/d静脉滴注2~4周,其后600 mg/d口服序贯治疗,该药安全性良好。
3.抑制醛糖还原酶活性药物。
依帕司他:是一种醛糖还原酶抑制剂,能抑制多元醇通路异常、改善代谢紊乱,有效改善糖尿病神经病变的主观症状和神经传导速度。依帕司他单药长期治疗可以有效改善糖尿病神经病变的症状,并延缓疾病的进展,尤其是对血糖控制良好、微血管病变轻微的患者[80]。依帕司他联合α-硫辛酸(600 mg/d)或甲钴胺治疗糖尿病神经病变,均优于单药治疗[81]。此外,依帕司他还可以改善糖尿病CAN、糖尿病胃轻瘫、糖尿病ED和瞳孔光反射减退[82,83,84,85]。推荐用法:成人剂量每次50 mg,每日3次,于餐前口服,疗程至少3个月。长期应用耐受性较好,不良反应较少。
4.改善微循环药物。
(1)前列腺素及前列腺素类似物:可增加血管平滑肌细胞内环磷酸腺苷(cyclic adenosine monophosphate,cAMP)含量、舒张血管平滑肌、降低血液黏度、改善微循环。前列腺素E1能改善DSPN症状、体征以及神经传导速度。口服贝前列腺素钠也有类似作用[86]。前列腺素E1联合甲钴胺或α-硫辛酸治疗,临床效果和神经传导速度的改善均优于单药治疗[87,88]。推荐用法:前列腺素E1脂微球载体制剂10 μg/d静脉滴注2周,然后序贯给予贝前列腺素钠20~40 μg,每日2~3次口服,连续治疗8周。该类药物安全性好,不良反应发生率低,主要是胃肠道反应,静脉制剂主要是静脉炎。
(2)己酮可可碱:通过抑制磷酸二酯酶活性使cAMP含量升高,扩张血管,改善微循环;并具有抗炎、抑制血小板黏附聚集和预防血栓生成作用。己酮可可碱400 mg/d使用2个月可明显加快DSPN患者神经传导速度,改善糖尿病神经病变的症状[89,90]。推荐用法:静脉注射或静脉缓慢滴注,一次0.1~0.2 g,每日1~2次,每日最大剂量不应超过0.4 g,连续使用8周;口服的缓释片每日1~2次,一次0.4 g,连续使用8周。该药无明显不良反应。
(3)胰激肽原酶:能够扩张小动脉增加毛细血管血流量、激活纤溶酶、降低血液黏度、改善血液流变学和组织灌注。还具有抑制血小板聚集、防止血栓形成、改善血液循环等作用,在改善DSPN症状及体征以及神经传导速度方面,与前列腺素E1脂微球载体制剂相似[42,91]。推荐用法:胰激肽原酶每日40 U,肌内注射,连续10 d,然后隔天肌内注射一次,连续20 d作为一个疗程。口服制剂为120~240 U/次,每日3次,疗程3个月。不良反应包括偶有皮疹、皮肤瘙痒等过敏现象及胃部不适和倦怠等感觉,停药后消失。
(4)巴曲酶:具有降解纤维蛋白原,改善高凝、高黏状态和微循环障碍的作用。首次剂量10 BU,以后隔日给予5 BU,30 BU为1个疗程,可有效改善麻木、冷感等症状及神经传导速度,安全性较好,偶见注射部位止血延迟[92]。
5.改善细胞能量代谢药物。
乙酰左卡尼汀:由肉碱乙酰转移酶催化生成,可促进细胞能量合成。其作用机制包括刺激脑内有氧代谢、减轻细胞氧化应激损伤、减轻细胞兴奋毒性作用等,并能通过减少突触的谷氨酸浓度起到减轻痛觉过敏的作用,与神经系统疾病关系紧密。乙酰左卡尼汀能有效缓解糖尿病神经病变患者的疼痛,还可以改善其神经纤维再生和振动知觉,改善糖尿病神经病变患者神经电生理参数[93,94]。推荐用法:口服250~500 mg,每日2~3次,疗程6个月。该药安全性较好,不良反应少。
6.中药:一些具有活血化瘀作用的植物药及中药制剂也常被用于糖尿病神经病变的治疗,如木丹颗粒、复方丹参滴丸。
(1)木丹颗粒:主要包含丹参、元胡、当归等,是益气活血、通络止痛的中药复方制剂,对糖尿病患者的神经损伤有修复作用。木丹颗粒在治疗DSPN方面与甲钴胺有同等疗效[95]。推荐用法:一次1袋(7 g),每日3次,饭后30 min服用,用温开水冲服。4周为一疗程,可连续服用两个疗程。
(2)复方丹参滴丸:由丹参、三七、冰片等药物组成,可提高机体抗凝和纤溶活性,抑制血小板聚集和血栓形成,并可以阻断羟自由基的产生和阻止脂质过氧化。复方丹参滴丸单用或者联合甲钴胺均可以改善DSPN患者的症状及神经传导速度[86,87]。用法用量:每次15丸,每日3次,3个月为一疗程,不良反应偶见胃肠道不适。
DSPN患者除了可以用上述针对病因和发病机制的药物治疗以外,在痛性DSPN患者还需要应用某些止痛药物治疗。
1.痛性DSPN的治疗。
严重的神经痛影响糖尿病患者的生活质量,包括活动受限、抑郁、社会功能受损[96]。目前,还没有强有力的证据支持血糖控制和生活方式干预能够改善糖尿病和糖尿病前期的神经痛,因此,针对这部分患者建议进行药物疼痛管理[97]。
出于对治疗神经痛药物有效性、安全性及不良反应的综合考量,治疗策略的剂量调整应考虑疼痛的缓解程度、治疗的依从性、药物的不良反应等多方面因素,以减轻疼痛、提高患者生活质量[98,99,100]。痛性DSPN的治疗以药物治疗为主,根据病情也可以酌情使用非药物治疗。
(1)药物治疗。
①抗惊厥类药:此类药物是γ-氨基丁酸的类似物或衍生物,为电压门控钙离子通道α2-δ亚基的配体。此类药物包括普瑞巴林、加巴喷丁和卡马西平等。普瑞巴林是研究最透彻的DSPN治疗药物,大多数研究证实普瑞巴林能够至少改善DSPN疼痛的30%~50%[101,102]。也有部分研究没有获得有效性的数据,尤其是那些有治疗抵抗的痛性神经病变患者[98,101]。在高龄患者中的药物不良反应更明显,可以通过减少起始剂量,逐渐递增剂量来缓解。初始剂量为25~75 mg,每日1~3次,推荐剂量为300~600 mg/d[2]。加巴喷丁能够有效地控制疼痛,且更经济实惠,但是美国食品和药品监督管理局(Food and Drug Administration,FDA)没有批准该适应证[103]。初始剂量为100~300 mg,每日1~3次,推荐剂量为900~3 600 mg/d。治疗糖尿病神经病理性疼痛,推荐首选普瑞巴林。考虑到患者的社会经济情况、共患病和潜在的药物相互作用,加巴喷丁也可以作为一种有效的初始治疗药物。
② 5-羟色胺-去甲肾上腺素再摄取抑制剂:此类药物主要的作用机制为抑制5-羟色胺和去甲肾上腺素的再摄取。其中,度洛西汀被认为是有效的痛性DSPN治疗药物。其是一种选择性去甲肾上腺素和5-羟色胺再摄取抑制剂。多项临床研究结果表明,度洛西汀在60~120 mg日剂量范围对痛性DSPN治疗有效[98,101,102]。此外,其还能提高与神经病变相关的生活质量[104]。初始剂量为20~30 mg/d,推荐剂量为60~120 mg/d。文拉法辛虽然对痛性DSPN有一定治疗效果,但目前并未获批。度洛西汀和普瑞巴林推荐级别相同,也是推荐的首选用药。
③三环类抗抑郁药:本类药物属于非选择性单胺摄取抑制剂,可以通过增加突触内单胺水平来直接影响下行性神经元的活性。尽管未经FDA批准,但阿米替林是最常用的三环类药物。大量随机对照试验和meta分析肯定了三环类抗抑郁药特别是阿米替林在治疗痛性DSPN的效果[105]。然而,因其具有较高的产生严重不良反应的风险,故应谨慎使用。特别在老年患者中,由于药物胆碱能的不良反应常常会限制其使用,所以应从小剂量开始,视病情酌情增加用量。推荐初始剂量为10~25 mg/d,维持剂量为25~100 mg/d。其主要不良反应为心律失常,因此在初次使用此类药物前应充分评估患者心血管情况。对于有心脏疾病或者高度怀疑心脏疾病的患者应谨慎使用。
④阿片类药物:阿片类激动剂是一种作用于中枢的麻醉镇痛药,常用于痛性DSPN治疗。此类药物包括他喷他多和曲马多。他喷他多通过激动阿片类受体和抑制去甲肾上腺素受体发挥止痛作用,其治疗痛性DSPN的有效性并不确定[101]。鉴于高成瘾性和安全问题,以及轻度缓解疼痛的特点,他喷他多不作为糖尿病神经痛治疗的一线或二线治疗用药。曲马多是一种阿片类受体弱激动剂,具有缓解疼痛的作用,同时可以抑制去甲肾上腺素和5-羟色胺的再摄取。尽管与其他阿片类药物相比,曲马多的滥用可能性较低,但仍存在一定的安全隐患,不建议将其作为一线或二线药物。
值得注意的是,三环类抗抑郁药去甲替林以及抗癫痫药卡马西平尽管并没有获批,但可能对治疗痛性DSPN有效[2,99,101]。
⑤局部用药:局部外用的8%辣椒素贴片Qutenza已经于2020年7月获得FDA批准,可以用于成人患者痛性DSPN的治疗。亦有研究证明,利多卡因贴剂可以显著减少疼痛,提高患者生活质量[106]。
(2)非药物治疗。
①针灸治疗:结合祖国医学的理论,针灸镇痛在临床上已被广泛接受。国内外均有研究证实,针灸对于痛性DSPN有一定的治疗效果[107,108]。
②电刺激治疗:包括经皮神经电刺激治疗、脊髓电刺激治疗和调频电磁神经刺激等。一项早期meta分析显示,绝大多数的电刺激治疗可以不同程度地缓解患者疼痛的症状[109]。
痛性DSPN的管理流程见
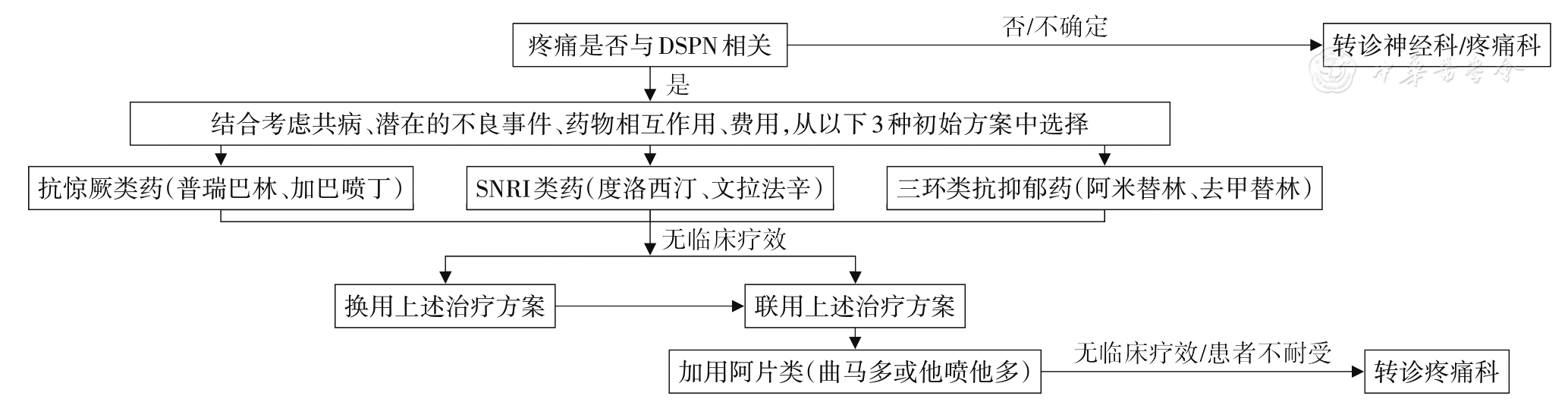
注:DSPN:远端对称性多发性神经病变;SNRI:5-羟色胺-去甲肾上腺素再摄取抑制剂
◆治疗糖尿病神经病理性疼痛,应考虑首先选用普瑞巴林或度洛西汀(证据级别A)。
◆考虑到患者的社会经济情况、共患病和潜在的药物相互作用,加巴喷丁也可以作为一种有效的初始治疗药物(证据级别B)。
◆三环类抗抑郁药也可有效减轻糖尿病患者的神经病理性疼痛,但其具有较高的发生严重不良反应的风险,故应谨慎使用(证据级别B)。
◆鉴于成瘾和其他并发症的高风险,阿片类药物,包括他喷他多和曲马多,不推荐作为治疗DSPN相关疼痛的一线或二线药物(证据级别E)。
2.DSPN相关其他并发症的防治。
(1)足部并发症:控制足部并发症的关键在于筛查高危人群,进行预防。特别是减轻足部压力,避免溃疡的发生[110]。对于合并有其他心血管风险因素的糖尿病"高危足"患者,给予降压、调脂及应用阿司匹林等综合管理措施,以预防心血管疾病的发生[111,112]。多学科协作的糖尿病足医疗护理专业团队可有效降低糖尿病截肢率和医疗费用,提高患者生活质量。
(2)预防跌倒:感觉丧失、虚弱、认知功能下降、联合用药都可能影响患者的平衡功能和日常活动[113]。治疗糖尿病神经病变的药物也可能影响认知功能,造成嗜睡、眩晕、视野和平衡障碍,年龄越大影响越明显[114]。因此,DSPN患者需要进行步态和平衡功能的检测,以评估跌倒的风险。
(3)心理治疗:DSPN可导致抑郁、焦虑,应用特定的量表可对患者生活质量和精神状态进行评估,以改善患者依从性和对神经性疼痛治疗的反应[115];考虑用度洛西汀、普瑞巴林和加巴喷丁治疗以改善神经性疼痛患者的生活质量。
目前,糖尿病自主神经病变仍然缺乏有效的病因学治疗,治疗的重点仍然在于改善临床症状,对于某些特定的异常临床表现需要特别加以关注。
严重CAN的患者主要表现为直立性低血压,对患者日常工作生活产生极大影响。因此,在此主要讨论直立性低血压的治疗。治疗目的在于减轻症状、延长站立时间、改善患者体能和增强日常活动能力,而非单纯地提高站立位血压。建议分4个步骤[116]:第一步,评估和调整目前用药,停用或减量使用可能加重直立性低血压症状的药物(包括多巴胺能药物、三环类抗抑郁药物、抗胆碱能药物及各种降压药物等);第二步,非药物治疗措施;第三步,单药治疗;第四步,联合用药。
在非药物治疗措施中,充分的饮水可提高直立位血压,改善症状[117]。高钠饮食有利于患者症状的改善,建议患者在每日正常饮食基础上增加2.3~4.6 g盐。对于合并有仰卧位高血压的患者,睡眠时床头楔形抬高15~23 cm可同时改善仰卧位高血压和清晨低血压。而对于有餐后低血压症状者,少食多餐、低升糖指数饮食有益于减轻症状。此外,适当强度的锻炼、避免体温升高、纠正贫血或维生素B12缺乏、穿着压力衣物等均为有效的治疗方法[116]。若非药物治疗措施无法达到满意的疗效,或患者正在发生晕厥、近期晕厥或跌倒,则须开始药物治疗。迄今为止,获得FDA批准的治疗直立性低血压的药物仅有米多君和屈昔多巴[118,119]。另外,推荐使用的药物为氟氢可的松和吡啶斯的明[120,121]。建议药物治疗首先从单药开始,逐渐加量至最大耐受剂量;如症状无改善,则考虑换用其他药物或添加第二种药物,同样从最低起始剂量开始逐渐加量。每次治疗变动后,2周内应对血压和心率进行监测和评估。
值得注意的是,约有50%的直立性低血压患者伴有仰卧位高血压[122]。而直立性低血压合并仰卧位高血压的患者,最常测量的坐位血压是正常的,这可能导致其识别延迟[123]。对于这类患者,治疗仰卧位高血压的目标是改善夜尿症,通过该机制改善早晨的直立性低血压症状,并防止内脏损伤和减轻心血管风险[124]。但部分学者认为,仰卧位高血压的潜在恶化可抵消治疗直立性低血压的任何潜在益处。因此,在治疗仰卧位高血压的同时,必须权衡这些潜在的益处与加剧体位性低血压和降压治疗的风险以及引起直立性低血压的基础疾病的总体预后。
糖尿病胃轻瘫的治疗是有难度的。改变饮食状态对改善症状有帮助,比如少食多餐,减少食物中纤维素的含量等。应当停用对胃动力有影响的药物,如阿片类药物、抗胆碱能药物、三环类抗抑郁药物、GLP-1受体激动剂、普兰林肽等[125]。对于严重的胃轻瘫患者,FDA目前仅批准了胃复安用于改善胃动力,但由于其严重的锥体外系不良反应,考虑短期使用[2]。另外,研究发现,静脉使用红霉素可改善糖尿病胃轻瘫患者的胃肠动力,但需要注意可能发生菌群失调的不良反应。
(1)ED:严格控制血糖能降低糖尿病患者ED的发生率,控制血压、血脂也有帮助。一线药物治疗包括磷酸二酯酶5型抑制剂,病情严重者可以采取经尿道前列腺素注射、海绵体内注射、真空装置、阴茎假体植入术等。(2)下尿路刺激症状和女性性功能障碍:控制血糖、治疗下尿路感染、穿着合适材料和松紧度的内衣有助于改善下尿路刺激症状。适当锻炼、心理治疗、局部治疗可能改善女性性功能障碍。(3)糖尿病神经源性膀胱:治疗目的包括保护肾脏功能,控制膀胱内压在安全范围内,提高控尿能力,减少残余尿量,预防尿路感染。治疗方法包括保守治疗、外科治疗、神经调节、神经电刺激等。保守治疗可以采用留置导尿、排尿意识训练、间歇导尿、手法治疗、药物治疗及肉毒素注射。治疗药物:胆碱能受体激动剂(氨甲酰胆碱)可用于逼尿肌无力患者,抗胆碱能药物(舍尼亭)可用于逼尿肌反射亢进患者。
有研究表明,外用抗毒蕈碱药物可以治疗味觉性出汗[126]。
目前,由于缺乏关于糖尿病神经病变预后的大样本、长期的观察研究,没有以糖尿病神经病变作为首要终点的大型降糖干预治疗的研究,而且以往糖尿病神经病变的评估方法差异很大,因此对糖尿病神经病变的预后缺乏统一认识。对CAN自然病程的研究也提示,CAN随着病程、年龄、血糖控制不佳而不断进展[127]。在以糖尿病神经病变为次要终点的大型降糖干预研究中,糖尿病控制与并发症试验/糖尿病干预及并发症流行病学(Diabetes Control and Complications Trial/Epidemiology of Diabetes Interventions and Complications,DCCT/EDIC)研究揭示,良好的血糖管理可以明显改善T1DM患者糖尿病神经病变的预后[59,63]。Steno-2研究提示,综合管理血糖可以改善T2DM患者CAN的预后[128]。但是英国前瞻性糖尿病研究(United Kingdom Prospective Diabetes Study,UKPDS)、ACCORD研究、退伍军人糖尿病试验研究(Veterans Affairs Diabetes Trial,VADT)、糖尿病治疗和血管保护行动:百普乐与达美康缓释片对照评估(Action in Diabetes and Vascular Disease:Preterax and Diamicron Modified Release Controlled Evaluation,ADVANCE)等研究却未发现强化血糖管理能够改变糖尿病神经病变预后[129,130,131]。少数研究提示,运动训练可以改变糖尿病神经病变的自然病程[132]。部分针对糖尿病神经病变病因治疗的药物可能改善糖尿病神经病变预后[133]。还有研究认为,SFN往往提示糖尿病神经病变预后更差[134]。目前,国内对SFN缺乏足够的认识和重视,需要加强对SFN的筛查和诊断。
糖尿病神经病变是糖尿病最常见的并发症,发病机制复杂,受累神经广泛,临床表现多样化,分型中以DSPN及自主神经病变最为常见。由于缺乏有效针对神经损伤的治疗方法,早期筛查、早期干预非常重要。对于糖尿病神经病变,仍需要大样本和长时间的多中心临床研究,以获得更加规范、有效的诊断治疗方法。
[1] Badiu C. Williams Textbook of Endocrinology-14th Revised Edition[J]. Acta Endocrinologica (Bucharest), 2019, 15: 416.
[2] Pop-Busui R, Boulton AJ, Feldman EL, et al. Diabetic neuropathy: a position statement by the American Diabetes Association[J]. Diabetes Care, 2017, 40(1): 136-154.
[3] Solomon T, Wu J. Diabetic neuropathy[M].
[4] Weisman A, Bril V, Ngo M, et al. Identification and prediction of diabetic sensorimotor polyneuropathy using individual and simple comb-inations of nerve conduction study parameters[J]. PLoS One, 2013, 8(3): e58783.
[5] Shabeeb D, Najafi M, Hasanzadeh G, et al. Electrophysiological measurements of diabetic peripheral neuropathy: A systematic review[J]. Diabetes Metab Syndr, 2018, 12(4): 591-600.
[6] Callaghan BC, Gao L, Li Y, et al. Diabetes and obesity are the main metabolic drivers of peripheral neuropathy[J]. Ann Clin Transl Neurol, 2018, 5(4): 397-405.
[7] Callaghan BC, Xia R, Reynolds E, et al. Association between metabolic syndrome components and polyneuropathy in an obese population[J]. JAMA Neurol, 2016, 73(12): 1468-1476.
[8] Zhao Z, Ji L, Zheng L, et al. Effectiveness of clinical alternatives to nerve conduction studies for screening for diabetic distal symmetrical polyneuropathy: A multi-center study[J]. Diabetes Res Clin Pract, 2016, 115: 150-156.
[9] Pai YW, Lin CH, Lee IT, et al. Prevalence and biochemical risk factors of diabetic peripheral neuropathy with or without neuropathic pain in Taiwanese adults with type 2 diabetes mellitus[J]. Diabetes Metab Syndr, 2018, 12(2): 111-116.
[10] Pan Q, Li Q, Deng W, et al. Prevalence and diagnosis of diabetic cardiovascular autonomic neuropathy in Beijing, China: a retrospective multicenter clinical study[J]. Front Neurosci, 2019, 13: 1144.
[11] Feldman EL, Nave KA, Jensen TS, et al. New horizons in diabetic neuropathy: mechanisms, bioenergetics, and pain[J]. Neuron, 2017, 93(6): 1296-1313.
[12] Feldman EL, Callaghan BC, Pop-Busui R, et al. Diabetic neuropathy[J]. Nat Rev Dis Primers, 2019, 5(1): 42.
[13] Calcutt NA. Diabetic neuropathy and neuropathic pain: a (con)fusion of pathogenic mechanisms?[J]. Pain, 2020, 161(
[14] Sloan G, Selvarajah D, Tesfaye S. Pathogenesis, diagnosis and clinical management of diabetic sensorimotor peripheral neuropathy[J]. Nat Rev Endocrinol, 2021.
[15] Tesfaye S, Boulton AJ, Dickenson AH. Mechanisms and management of diabetic painful distal symmetrical polyneuropathy[J]. Diabetes Care, 2013, 36(9): 2456-2465.
[16] Devigili G, Cazzato D, Lauria G. Clinical diagnosis and management of small fiber neuropathy: an update on best practice[J]. Expert Rev Neurother, 2020, 20(9): 967-980.
[17] Sloan G, Shillo P, Selvarajah D, et al. A new look at painful diabetic neuropathy[J]. Diabetes Res Clin Pract, 2018, 144: 177-191.
[18] Volmer-Thole M, Lobmann R. Neuropathy and diabetic foot syndrome[J]. Int J Mol Sci, 2016, 17(6): 917.
[19] Perkins BA, Olaleye D, Zinman B, et al. Simple screening tests for peripheral neuropathy in the diabetes clinic[J]. Diabetes Care, 2001, 24(2): 250-256.
[20] Tan LS. The clinical use of the 10g monofilament and its limitations: a review[J]. Diabetes Res Clin Pract, 2010, 90(1): 1-7.
[21] 蔡洁,董继宏,汪昕. 糖尿病性周围神经病常用评分量表比较与研究[J]. 中华临床医师杂志(电子版), 2009,3(1):12-17.
[22] 贾建平,陈生弟. 神经病学[M]. 第8版. 北京:人民卫生出版社,2018.115-116.
[23] Yasuda H, Sanada M, Kitada K, et al. Rationale and usefulness of newly devised abbreviated diagnostic criteria and staging for diabetic polyneuropathy[J]. Diabetes Res Clin Pract, 2007, 77(
[24] Oyer DS, Saxon D, Shah A. Quantitative assessment of diabetic peri-pheral neuropathy with use of the clanging tuning fork test[J]. Endocr Pract, 2007, 13(1): 5-10.
[25] Boulton AJ, Armstrong DG, Albert SF, et al. Comprehensive foot examination and risk assessment: a report of the task force of the foot care interest group of the American Diabetes Association, with endorsement by the American Association of Clinical Endocrinologists[J]. Diabetes Care, 2008, 31(8): 1679-1685.
[26] Lauria G, Dacci P, Lombardi R, et al. Side and time variability of intraepidermal nerve fiber density[J]. Neurology, 2015, 84(23): 2368-2371.
[27] Baron R, Maier C, Attal N, et al. Peripheral neuropathic pain: a mechanism-related organizing principle based on sensory profiles[J]. Pain, 2017, 158(2): 261-272.
[28] Ishibashi F, Kojima R, Taniguchi M, et al. The expanded bead size of corneal C-nerve fibers visualized by corneal confocal microscopy is associated with slow conduction velocity of the peripheral nerves in patients with type 2 diabetes mellitus[J]. J Diabetes Res, 2016, 2016: 3653459.
[29] Xiong Q, Lu B, Ye HY, et al. Corneal confocal microscopy as a non-invasive test to assess diabetic peripheral neuropathy[J]. Diabetes Res Clin Pract, 2018, 136: 85-92.
[30] American Diabetes Association. 2. Classification and diagnosis of diabetes: standards of medical care in diabetes-2020[J]. Diabetes Care, 2020, 43(
[31] 中华医学会糖尿病学分会. 中国2型糖尿病防治指南(2017年版)[J]. 中华糖尿病杂志,2018,10(1):4-67.
[32] Tesfaye S, Boulton AJ, Dyck PJ, et al. Diabetic neuropathies: update on definitions, diagnostic criteria, estimation of severity, and treatments[J]. Diabetes Care, 2010, 33(10): 2285-2293.
[33] Spallone V. Update on the Impact, Diagnosis and management of cardiovascular autonomic neuropathy in diabetes: what is defined, what is new, and what is unmet[J]. Diabetes Metab J, 2019, 43(1): 3-30.
[34] Yun JS, Park YM, Cha SA, et al. Progression of cardiovascular autonomic neuropathy and cardiovascular disease in type 2 diabetes[J]. Cardiovasc Diabetol, 2018, 17(1): 109.
[35] Spallone V, Ziegler D, Freeman R, et al. Cardiovascular autonomic neuropathy in diabetes: clinical impact, assessment, diagnosis, and management[J]. Diabetes Metab Res Rev, 2011, 27(7): 639-653.
[36] Ziegler D, Keller J, Maier C, et al. Diabetic neuropathy[J]. Exp Clin Endocrinol Diabetes, 2014, 122(7): 406-415.
[37] Pop-Busui R. Cardiac autonomic neuropathy in diabetes: a clinical perspective[J]. Diabetes Care, 2010, 33(2): 434-441.
[38] Kumar M, Chapman A, Javed S, et al. The investigation and treatment of diabetic gastroparesis[J]. Clin Ther, 2018, 40(6): 850-861.
[39] Bharucha AE, Kudva YC, Prichard DO. Diabetic gastroparesis[J]. Endocr Rev, 2019, 40(5): 1318-1352.
[40] Alipour Z, Khatib F, Tabib SM, et al. Assessment of the prevalence of diabetic gastroparesis and validation of gastric emptying scintigraphy for diagnosis[J]. Mol Imaging Radionucl Ther, 2017, 26(1): 17-23.
[41] Bradshaw LA, Cheng LK, Chung E, et al. Diabetic gastroparesis alters the biomagnetic signature of the gastric slow wave[J]. Neurogastroenterol Motil, 2016, 28(6): 837-848.
[42] 中华医学会糖尿病学分会,中华医学会感染病学分会,中华医学会组织修复与再生分会. 中国糖尿病足防治指南(2019版)(Ⅱ)[J]. 中华糖尿病杂志,2019,11(3):161-189.
[43] Amarenco G, Sheikh Isma?l S, Chesnel C, et al. Diagnosis and clinical evaluation of neurogenic bladder[J]. Eur J Phys Rehabil Med, 2017, 53(6): 975-980.
[44] Baines G, Da Silva AS, Araklitis G, et al. Recent advances in urodynamics in women[J]. F1000Res, 2020, 9: 606.
[45] Kempler P, Amarenco G, Freeman R, et al. Management strategies for gastrointestinal, erectile, bladder, and sudomotor dysfunction in patients with diabetes[J]. Diabetes Metab Res Rev, 2011, 27(7): 665-677.
[46] Lim LL, Fu A, Lau E, et al. Sudomotor dysfunction independently predicts incident cardiovascular-renal events and all-cause death in type 2 diabetes: the Joint Asia Diabetes Evaluation register[J]. Nephrol Dial Transplant, 2019, 34(8): 1320-1328.
[47] Mao F, Liu S, Qiao X, et al. Sudoscan is an effective screening method for asymptomatic diabetic neuropathy in Chinese type 2 diabetes mellitus patients[J]. J Diabetes Investig, 2017, 8(3): 363-368.
[48] Tentolouris N, Achtsidis V, Marinou K, et al. Evaluation of the self-administered indicator plaster neuropad for the diagnosis of neuropathy in diabetes[J]. Diabetes Care, 2008, 31(2): 236-237.
[49] 沈洁,曹瑛,陈志,等. 排汗神经功能检测在2型糖尿病患者自主神经病变评估中的作用[J]. 中华糖尿病杂志,2011,3(1):46-49.
[50] Pittasch D, Lobmann R, Behrens-Baumann W, et al. Pupil signs of sympathetic autonomic neuropathy in patients with type 1 diabetes[J]. Diabetes Care, 2002, 25(9): 1545-1550.
[51] Albers JW, Pop-Busui R. Diabetic neuropathy: mechanisms, emerging treatments, and subtypes[J]. Curr Neurol Neurosci Rep, 2014, 14(8): 473.
[52] Smith BE. Focal and entrapment neuropathies[J]. Handb Clin Neurol, 2014, 126: 31-43.
[53] Laughlin RS, Dyck PJ. Electrodiagnostic testing in lumbosacral plexopathies[J]. Phys Med Rehabil Clin N Am, 2013, 24(1): 93-105.
[54] Massie R, Mauermann ML, Staff NP, et al. Diabetic cervical radiculo-plexus neuropathy: a distinct syndrome expanding the spectrum of diabetic radiculoplexus neuropathies[J]. Brain, 2012, 135(
[55] Dyck PJ, Windebank AJ. Diabetic and nondiabetic lumbosacral radiculoplexus neuropathies: new insights into pathophysiology and treatment[J]. Muscle Nerve, 2002, 25(4): 477-491.
[56] Selvarajah D, Kar D, Khunti K, et al. Diabetic peripheral neuropathy: advances in diagnosis and strategies for screening and early intervention[J]. Lancet Diabetes Endocrinol, 2019, 7(12): 938-948.
[57] Tesfaye S, Chaturvedi N, Eaton SE, et al. Vascular risk factors and diabetic neuropathy[J]. N Engl J Med, 2005, 352(4): 341-350.
[58] Zochodne DW. The challenges of diabetic polyneuropathy: a brief update[J]. Curr Opin Neurol, 2019, 32(5): 666-675.
[59] Diabetes Control and Complications Trial Research Group, Nathan DM, Genuth S, et al. The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus[J]. N Engl J Med, 1993, 329(14): 977-986.
[60] Callaghan BC, Cheng HT, Stables CL, et al. Diabetic neuropathy: clinical manifestations and current treatments[J]. Lancet Neurol, 2012, 11(6): 521-534.
[61] Martin CL, Albers JW, Pop-Busui R, et al. Neuropathy and related findings in the diabetes control and complications trial/epidemiology of diabetes interventions and complications study[J]. Diabetes Care, 2014, 37(1): 31-38.
[62] Ang L, Jaiswal M, Martin C, et al. Glucose control and diabetic neuropathy: lessons from recent large clinical trials[J]. Curr Diab Rep, 2014, 14(9): 528.
[63] Albers JW, Herman WH, Pop-Busui R, et al. Effect of prior intensive insulin treatment during the Diabetes Control and Complications Trial (DCCT) on peripheral neuropathy in type 1 diabetes during the Epidemiology of Diabetes Interventions and Complications (EDIC) Study[J]. Diabetes Care, 2010, 33(5): 1090-1096.
[64] Pop-Busui R, Low PA, Waberski BH, et al. Effects of prior intensive insulin therapy on cardiac autonomic nervous system function in type 1 diabetes mellitus: the Diabetes Control and Complications Trial/Epidemiology of Diabetes Interventions and Complications study (DCCT/EDIC)[J]. Circulation, 2009, 119(22): 2886-2893.
[65] Ismail-Beigi F, Craven T, Banerji MA, et al. Effect of intensive treatment of hyperglycaemia on microvascular outcomes in type 2 diabetes: an analysis of the ACCORD randomised trial[J]. Lancet, 2010, 376(9739): 419-430.
[66] Charles M, Ejskjaer N, Witte DR, et al. Prevalence of neuropathy and peripheral arterial disease and the impact of treatment in people with screen-detected type 2 diabetes: the ADDITION-Denmark study[J]. Diabetes Care, 2011, 34(10): 2244-2249.
[67] Callaghan BC, Little AA, Feldman EL, et al. Enhanced glucose control for preventing and treating diabetic neuropathy[J]. Cochrane Database Syst Rev, 2012, 6(6): CD007543.
[68] Singleton JR, Marcus RL, Jackson JE, et al. Exercise increases cutan-eous nerve density in diabetic patients without neuropathy[J]. Ann Clin Transl Neurol, 2014, 1(10): 844-849.
[69] Smith AG, Russell J, Feldman EL, et al. Lifestyle intervention for pre-diabetic neuropathy[J]. Diabetes Care, 2006, 29(6): 1294-1299.
[70] Sawangjit R, Thongphui S, Chaichompu W, et al. Efficacy and safety of mecobalamin on peripheral neuropathy: a systematic review and meta-analysis of randomized controlled trials[J]. J Altern Complement Med, 2020, 26(12): 1117-1129.
[71] 唐静,刘琛,闫素英. 甲钴胺对比α-硫辛酸治疗糖尿病周围神经病变疗效的Meta分析[J]. 中国药房,2015,26(27):3800-3802.
[72] Han T, Bai J, Liu W, et al. A systematic review and meta-analysis of α-lipoic acid in the treatment of diabetic peripheral neuropathy[J]. Eur J Endocrinol, 2012, 167(4): 465-471.
[73] 谷伟军,陆菊明,关小宏,等. α-硫辛酸注射液对2型糖尿病患者周围神经病变的疗效和安全性[J]. 中华糖尿病杂志,2012,4(7):412-415.
[74] Ziegler D, Low PA, Litchy WJ, et al. Efficacy and safety of antioxidant treatment with α-lipoic acid over 4 years in diabetic polyneuropathy: the NATHAN 1 trial[J]. Diabetes Care, 2011, 34(9): 2054-2060.
[75] ?akici N, Fakkel TM, van Neck JW, et al. Systematic review of treatments for diabetic peripheral neuropathy[J]. Diabet Med, 2016, 33(11): 1466-1476.
[76] 潘颖颖. α-硫辛酸联合莫沙必利治疗糖尿病胃轻瘫的临床疗效[J]. 中华内分泌外科杂志,2015,9(6):497-500.
[77] 江冬莲,石贵文. α-硫辛酸联合莫沙必利对糖尿病性胃轻瘫患者的临床疗效和不良反应的观察[J]. 世界华人消化杂志,2018,26(1):26-30.
[78] Zhang L, Zhang HY, Huang FC, et al. Study on the clinical value of alprostadil combined with α-lipoic acid in treatment of type 2 diabetes mellitus patients with erectile dysfunction[J]. Eur Rev Med Pharmacol Sci, 2016, 20(18): 3930-3933.
[79] 唐松喜,陈书申,周辉良,等. 单用他达拉非及联用硫辛酸治疗2型糖尿病性ED的比较[J]. 中国男科学杂志,2020,34(1):31-35.
[80] 李平,马建华,高佳麟,等. 依帕司他治疗糖尿病周围神经病变安全性和有效性的随机、对照、多中心临床研究[J]. 中华内分泌代谢杂志,2015,31(9):743-747.
[81] Wang X, Lin H, Xu S, et al. Alpha lipoic acid combined with epalrestat: a therapeutic option for patients with diabetic peripheral neuropathy[J]. Drug Des Devel Ther, 2018, 12: 2827-2840.
[82] Hu X, Li S, Yang G, et al. Efficacy and safety of aldose reductase inhibitor for the treatment of diabetic cardiovascular autonomic neur-opathy: systematic review and meta-analysis[J]. PLoS One, 2014, 9(2): e87096.
[83] Okamoto H, Nomura M, Nakaya Y, et al. Effects of epalrestat, an aldose reductase inhibitor, on diabetic neuropathy and gastroparesis[J]. Intern Med, 2003, 42(8): 655-664.
[84] Yang BB, Hong ZW, Zhang Z, et al. Epalrestat, an aldose reductase Inhibitor, restores erectile function in streptozocin-induced diabetic rats[J]. Int J Impot Res, 2019, 31(2): 97-104.
[85] Nakayama M, Nakamura J, Hamada Y, et al. Aldose reductase inhibition ameliorates pupillary light reflex and F-wave latency in patients with mild diabetic neuropathy[J]. Diabetes Care, 2001, 24(6): 1093-1098.
[86] Shin S, Kim KJ, Chang HJ, et al. The effect of oral prostaglandin analogue on painful diabetic neuropathy: a double-blind, randomized, controlled trial[J]. Diabetes Obes Metab, 2013, 15(2): 185-188.
[87] Deng H, Yin J, Zhang J, et al. Meta-analysis of methylcobalamin alone and in combination with prostaglandin E1 in the treatment of diabetic peripheral neuropathy[J]. Endocrine, 2014, 46(3): 445-454.
[88] Jiang DQ, Li MX, Ma YJ, et al. Efficacy and safety of prostaglandin E1 plus lipoic acid combination therapy versus monotherapy for patients with diabetic peripheral neuropathy[J]. J Clin Neurosci, 2016, 27: 8-16.
[89] 仇艳玲,姜秀芳,陈淑峰,等. 己酮可可碱联合甲钴胺治疗糖尿病周围神经病变的临床研究[J]. 现代中西医结合杂志,2020,29(3):264-267.
[90] Hosseini F, Mohammadbeigi A, Aghaali M, et al. Effect of pentoxifylline on diabetic distal polyneuropathy in type 2 diabetic patients: a rando-mized trial[J]. J Res Med Sci, 2019, 24: 89.
[91] Jin YP, Su XF, Li HQ, et al. The therapeutic effect of pancreatic kininogenase on treatment of diabetic peripheral neuropathy in patients with type 2 diabetes[J]. Exp Clin Endocrinol Diabetes, 2016, 124(10): 618-621.
[92] 王滨,赵立伟. 巴曲酶治疗糖尿病性周围神经病变疗效观察[J]. 中国临床医学,2006,13(6):898-899.
[93] Li S, Li Q, Li Y, et al. Acetyl-L-carnitine in the treatment of peripheral neuropathic pain: a systematic review and meta-analysis of randomized controlled trials[J]. PLoS One, 2015, 10(3): e0119479.
[94] 赵紫楠,吕俊玲,李超,等. 乙酰左卡尼汀预防和治疗糖尿病周围神经病变的快速卫生技术评估[J]. 临床药物治疗杂志,2019,17(6):
[95] 李兰生. 对比木丹颗粒与弥可保治疗糖尿病周围神经病变的临床效果[J]. 中国现代药物应用,2015,9(16):30-31.
[96] Sadosky A, Schaefer C, Mann R, et al. Burden of illness associated with painful diabetic peripheral neuropathy among adults seeking treatment in the US: results from a retrospective chart review and cross-sectional survey[J]. Diabetes Metab Syndr Obes, 2013, 6: 79-92.
[97] Waldfogel JM, Nesbit SA, Dy SM, et al. Pharmacotherapy for diabetic peripheral neuropathy pain and quality of life: A systematic review[J]. Neurology, 2017, 88(20): 1958-1967.
[98] Bril V, England J, Franklin GM, et al. Evidence-based guideline: Treatment of painful diabetic neuropathy: report of the American Academy of Neurology, the American Association of Neuromuscular and Electro- diagnostic Medicine, and the American Academy of Physical Medicine and Rehabilitation[J]. Neurology, 2011, 76(20): 1758-1765.
[99] Griebeler ML, Morey-Vargas OL, Brito JP, et al. Pharmacologic interventions for painful diabetic neuropathy: An umbrella systematic review and comparative effectiveness network meta-analysis[J]. Ann Intern Med, 2014, 161(9): 639-649.
[100] Ziegler D, Fonseca V. From guideline to patient: a review of recent recommendations for pharmacotherapy of painful diabetic neuropathy[J]. J Diabetes Complications, 2015, 29(1): 146-156.
[101] Finnerup NB, Attal N, Haroutounian S, et al. Pharmacotherapy for neuropathic pain in adults: a systematic review and meta-analysis[J]. Lancet Neurol, 2015, 14(2): 162-173.
[102] Tesfaye S, Wilhelm S, Lledo A, et al. Duloxetine and pregabalin: high-dose monotherapy or their combination? The "COMBO-DN study" —a multinational, randomized, double-blind, parallel-group study in patients with diabetic peripheral neuropathic pain[J]. Pain, 2013, 154(12): 2616-2625.
[103] Wiffen PJ, Derry S, Bell RF, et al. Gabapentin for chronic neuro-pathic pain in adults[J]. Cochrane Database Syst Rev, 2017, 6(6): CD007938.
[104] Wernicke JF, Pritchett YL, D′Souza DN, et al. A randomized controlled trial of duloxetine in diabetic peripheral neuropathic pain[J]. Neurology, 2006, 67(8): 1411-1420.
[105] Tesfaye S, Vileikyte L, Rayman G, et al. Painful diabetic peripheral neuropathy: consensus recommendations on diagnosis, assessment and management[J]. Diabetes Metab Res Rev, 2011, 27(7): 629-638.
[106] Baron R, Mayoral V, Leijon G, et al. 5% lidocaine medicated plaster versus pregabalin in post-herpetic neuralgia and diabetic polyneuro-pathy: an open-label, non-inferiority two-stage RCT study[J]. Curr Med Res Opin, 2009, 25(7): 1663-1676.
[107] Tong Y, Guo H, Han B. Fifteen-day acupuncture treatment relieves diabetic peripheral neuropathy[J]. J Acupunct Meridian Stud, 2010, 3(2): 95-103.
[108] Garrow AP, Xing M, Vere J, et al. Role of acupuncture in the management of diabetic painful neuropathy (DPN): a pilot RCT[J]. Acupunct Med, 2014, 32(3): 242-249.
[109] Thakral G, Kim PJ, LaFontaine J, et al. Electrical stimulation as an adjunctive treatment of painful and sensory diabetic neuropathy[J]. J Diabetes Sci Technol, 2013, 7(5): 1202-1209.
[110] Boulton AJ. Diabetic neuropathy and foot complications[J]. Handb Clin Neurol, 2014, 126: 97-107.
[111] Jiang Y, Wang X, Xia L, et al. A cohort study of diabetic patients and diabetic foot ulceration patients in China[J]. Wound Repair Regen, 2015, 23(2): 222-230.
[112] Zhao J, Deng W, Zhang Y, et al. Association between serum cystatin C and diabetic foot ulceration in patients with type 2 diabetes: a cross-sectional study[J]. J Diabetes Res, 2016, 2016: 8029340.
[113] Brown SJ, Handsaker JC, Bowling FL, et al. Diabetic peripheral neuropathy compromises balance during daily activities[J]. Diabetes Care, 2015, 38(6): 1116-1122.
[114] Dworkin RH, Jensen MP, Gammaitoni AR, et al. Symptom profiles differ in patients with neuropathic versus non-neuropathic pain[J]. J Pain, 2007, 8(2): 118-126.
[115] Vileikyte L, Peyrot M, Gonzalez JS, et al. Predictors of depressive symptoms in persons with diabetic peripheral neuropathy: a longitudinal study[J]. Diabetologia, 2009, 52(7): 1265-1273.
[116] Gibbons CH, Schmidt P, Biaggioni I, et al. The recommendations of a consensus panel for the screening, diagnosis, and treatment of neurogenic orthostatic hypotension and associated supine hypertension[J]. J Neurol, 2017, 264(8): 1567-1582.
[117] Jordan J, Shannon JR, Black BK, et al. The pressor response to water drinking in humans: a sympathetic reflex?[J]. Circulation, 2000, 101(5): 504-509.
[118] Parsaik AK, Singh B, Altayar O, et al. Midodrine for orthostatic hypotension: a systematic review and meta-analysis of clinical trials[J]. J Gen Intern Med, 2013, 28(11): 1496-1503.
[119] Elgebaly A, Abdelazeim B, Mattar O, et al. Meta-analysis of the safety and efficacy of droxidopa for neurogenic orthostatic hypotension[J]. Clin Auton Res, 2016, 26(3): 171-180.
[120] van Lieshout JJ, ten Harkel AD, Wieling W. Fludrocortisone and sleeping in the head-up position limit the postural decrease in cardiac output in autonomic failure[J]. Clin Auton Res, 2000, 10(1): 35-42.
[121] Singer W, Sandroni P, Opfer-Gehrking TL, et al. Pyridostigmine treatment trial in neurogenic orthostatic hypotension[J]. Arch Neurol, 2006, 63(4): 513-518.
[122] Fanciulli A, G?bel G, Ndayisaba JP, et al. Supine hypertension in Parkinson′s disease and multiple system atrophy[J]. Clin Auton Res, 2016, 26(2): 97-105.
[123] Jordan J, Fanciulli A, Tank J, et al. Management of supine hypertension in patients with neurogenic orthostatic hypotension: scientific statement of the American Autonomic Society, European Federation of Autonomic Societies, and the European Society of Hypertension[J]. J Hypertens, 2019, 37(8): 1541-1546.
[124] Okamoto LE, Gamboa A, Shibao C, et al. Nocturnal blood pressure dipping in the hypertension of autonomic failure[J]. Hypertension, 2009, 53(2): 363-369.
[125] Camilleri M, Parkman HP, Shafi MA, et al. Clinical guideline: management of gastroparesis[J]. Am J Gastroenterol, 2013, 108(1):
[126] Shaw JE, Abbott CA, Tindle K, et al. A randomised controlled trial of topical glycopyrrolate, the first specific treatment for diabetic gustatory sweating[J]. Diabetologia, 1997, 40(3): 299-301.
[127] Abd El Dayem SM, Battah AA, Soliman RA. Natural progression of cardiac autonomic neuropathy in patients with type 1 diabetes: a four-year follow-up study[J]. Anadolu Kardiyol Derg, 2011, 11(3): 224-231.
[128] Gaede P, Lund-Andersen H, Parving HH, et al. Effect of a multifac-torial intervention on mortality in type 2 diabetes[J]. N Engl J Med, 2008, 358(6): 580-591.
[129] Action to Control Cardiovascular Risk in Diabetes Study Group, Gerstein HC, Miller ME, et al. Effects of intensive glucose lowering in type 2 diabetes[J]. N Engl J Med, 2008, 358(24): 2545-2559.
[130] Duckworth W, Abraira C, Moritz T, et al. Glucose control and vascular complications in veterans with type 2 diabetes[J]. N Engl J Med, 2009, 360(2): 129-139.
[131] ADVANCE Collaborative Group, Patel A, MacMahon S, et al. Intensive blood glucose control and vascular outcomes in patients with type 2 diabetes[J]. N Engl J Med, 2008, 358(24): 2560-2572.
[132] Balducci S, Iacobellis G, Parisi L, et al. Exercise training can modify the natural history of diabetic peripheral neuropathy[J]. J Diabetes Complications, 2006, 20(4): 216-223.
[133] Ziegler D, Nowak H, Kempler P, et al. Treatment of symptomatic diabetic polyneuropathy with the antioxidant alpha-lipoic acid: a meta-analysis[J]. Diabet Med, 2004, 21(2): 114-121.
[134] K?rei AE, Istenes I, Papanas N, et al. Small-fiber neuropathy: a diabetic microvascular complication of special clinical, diagnostic, and prognostic importance[J]. Angiology, 2016, 67(1): 49-57.
