化学遗传学技术调控GLP-1神经元兴奋性及其对食欲的影响
2022年4月
中华内分泌代谢杂志,第38卷第4期 第322页-第329页
杨亚南,邵雨薇,田峻,赵娟,祝叶,舒晴
胰升糖素样肽1(glucagon like peptide-1, GLP-1)为胰升糖素原的裂解产物,是一种主要由远端回肠、直肠和结肠的L细胞分泌的多肽激素。机体进食后,肠腔内的营养物质如葡萄糖、脂肪等能直接刺激GLP-1的释放。在外周,GLP-1的主要生理功能是通过作用于胰腺的胰升糖素样肽1受体(glucagon-like peptide 1 receptor, GLP-1R)引起葡萄糖依赖的胰岛素释放,从而调节机体的能量代谢。而在中枢,脑干孤束核(nucleus of the solitary tract, NTS)中有部分神经元也能够分泌GLP-1,称为GLP-1神经元。这些神经元通过与下丘脑、中脑边缘系统、海马等区域的直接突触连接对能量代谢、情绪、认知功能具有重要的调节作用[1,2,3]。目前有大量研究证明,应用中枢给药的方式注射GLP-1类似物或抑制剂(如利拉鲁肽、Exendin 9-39等)能够发挥调控摄食、能量代谢和胰岛素敏感性的作用。然而,当前大多数针对GLP-1进行研究的应用中枢药物均是作用于GLP-1受体,而非GLP-1神经元本身[4]。且中枢持续给药需要进行脑室置管的手术操作,术后大鼠的日常饲养存在较大难度。
近年来,化学遗传学技术在神经生物学领域的应用越来越多。特殊设计的激活受体DREADDs(designer receptors exclusively activated by designer drugs)是一类用于激活或抑制神经元的化学遗传学工具。hM3D(Gq)和hM4D(Gi)是DREADDs中最具代表性的两种化学遗传学工具。hM3D(Gq)表达在神经元膜表面后,腹腔注射外源性的N-氧化氯氮平(clozapine N-oxide, CNO)后,会介导表达hM3D(Gq)的神经元内质网钙离子外流,从而触发了神经元细胞膜上的电压敏感钠离子通道,进而诱发神经元动作电位的形成。与之相反,hM4D(Gi)可以影响细胞内原本Gi蛋白的下游,使得钾离子通道打开,介导神经元的超级化,从而抑制神经元电活动[5]。
腺相关病毒(adeno-associated virus,AAV)属于细小病毒科,是一种单链DNA病毒。通过将外源性基因表达元件替换AAV的编码基因,仅保留了病毒复制和包装所需的ITR序列,可以生产出重组腺相关病毒(recombinant adeno-associated virus, rAAV)。rAAV具有安全性高、免疫原性低、宿主范围广、能介导基因在动物体内长期稳定表达等特点。rAAV9属于rAAV众多血清型中的一种,对神经元具有强烈的嗜性,能够直接进入宿主细胞核而改变其基因序列,是一种重要的携带外源基因的病毒工具[6]。携带特定基因启动子和携带化学遗传学工具的两种rAAV在神经核团联合注射后,可以精准地调控神经元的兴奋性[5]。通过化学遗传学病毒标记的神经元,能够通过腹腔注射药物的方式调控其兴奋性。进而深入研究该神经元的功能。本研究通过在孤束核内注射包含GLP-1启动子的rAAV,标记孤束核的GLP-1神经元,初步探索了中枢GLP-1在动物摄食行为和能量调节中的作用。
6周龄SPF级雄性Wistar大鼠15只,体重180~220 g,由北京维通利华实验动物技术有限公司提供[SCXK(京)2019-0010]。实验操作在武汉大学中南医院实验动物中心[SYXK(鄂)2015-0025]进行,非进食量测量时间自由进食饮水,12 h明暗周期,动物房温度20℃~22℃,相对湿度40%~60%,每天更换垫料、饮水、清洗大鼠饮水器。动物处理及饲养条件按照实验动物使用3R原则给予人道主义关怀,并遵照《中华人民共和国实验动物管理条例》和《实验动物质量管理办法》实施。本实验经武汉大学实验动物中心经伦理审查后施行(AUP Number: WP2020-08085)。
小动物麻醉用异氟烷(分析纯,深圳市瑞沃德生命科技有限公司,批号:20160218),4%多聚甲醛(国药集团,中国),驴血清(SL050,北京索莱宝科技有限公司,中国),山羊血清(SL038,北京索莱宝科技有限公司,中国),柠檬酸钠抗原修复液(P0083,碧云天生物,中国),免疫染色一抗稀释液(P0262,碧云天生物,中国),免疫组化染色二抗稀释液(P0267,碧云天生物,中国),抗荧光淬灭封片液(S2110,北京索莱宝科技有限公司,中国),绿色荧光蛋白(GFP)抗体(ab5450,Abcam公司,美国)、GLP-1抗体(ab23447,Abcam公司,美国)、DsRed抗体(632496,TAKARA公司,日本),Alexa Fluor?488/594标记荧光二抗(ab150077/ab150132,Abcam公司,美国),CoraLite488/594标记荧光二抗(SA00013-1/SA00013-3,三鹰生物公司,中国)。
本实验所应用的腺相关病毒由武汉枢密脑科学技术有限公司提供。通过查找基因数据库及已发表的相关文献检索出GLP-1蛋白的启动子序列[7,8]。基因重组采用cre-loxp基因重组系统,cre重组酶能够精准识别2组序列相反的loxp和lox2722(简称DIO),并能够将相反序列之间的基因序列进行逆转[9]。基于这一基因重组策略,我们同时将GLP-1启动子和cre 2种基因元件组装入rAAV的基因组序列中制备出rAAV-GLP-1,与另外3种携带DIO元件和荧光蛋白的rAAV进行组合注射。其中rAAV-GLP-1和rAAV-GFP同时在NTS注射能够将GLP-1神经元用绿色荧光标记,rAAV-GLP-1和rAAV-3D/4D同时在NTS注射能够将GLP-1神经元用红色荧光标记,并能够在腹腔注射CNO后兴奋或抑制GLP-1神经元。具体腺相关病毒的基因序列及组合策略如
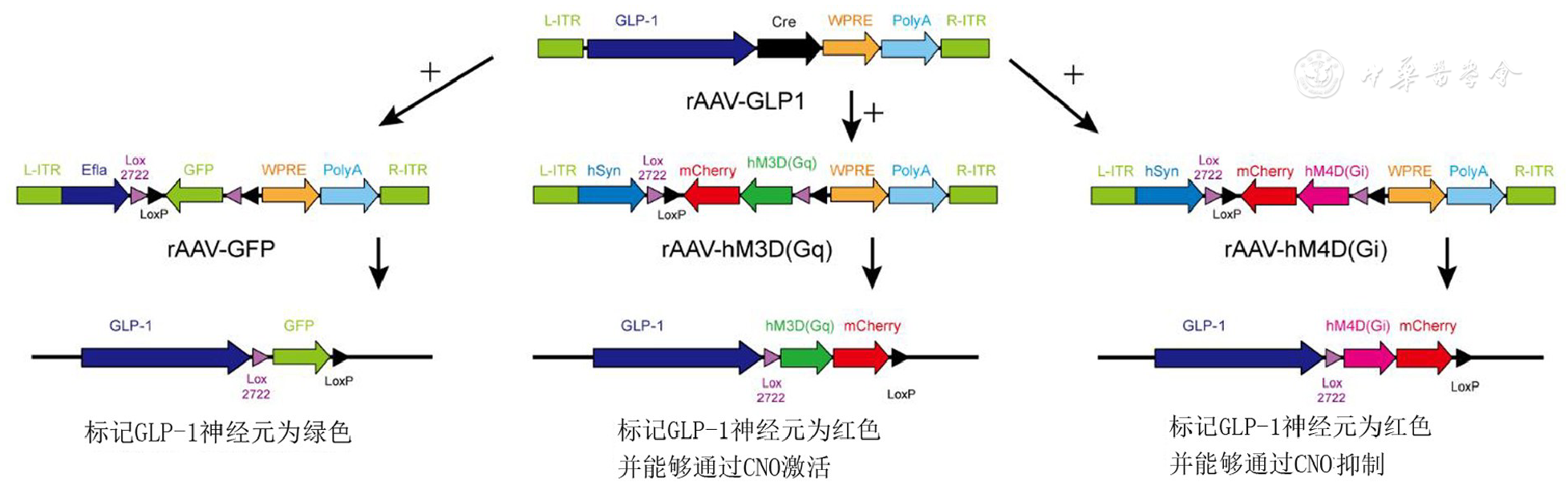
所有大鼠适应性喂养1周后,按照体重大小进行编号,通过分层随机的方式将15只大鼠分入GFP组(n=5)、HM3D(n=5)组和HM4D组(n=5)。当各组大鼠体重达到或接近400 g时进行孤束核的脑立体定位注射,注射参数为:进针点位于Lambda-3.2 mm、中线双侧旁开0.5~0.7 mm,进针斜刺角度向后24°、斜刺深度9.6 mm后进行注射,详细操作方法见前期发表的相关文献[10]。各组大鼠注射腺病毒如下:(1)GFP组均在双侧孤束核注射rAAV-GLP-1和rAAV-GFP,每种病毒注射260 nL;HM3D组均在双侧孤束核注射rAAV-GLP-1和rAAV-3D,每种病毒注射260 nL;HM4D组均在双侧孤束核注射rAAV-GLP-1和rAAV-4D,每种病毒注射260 nL。注射的时间顺序以大鼠体重为依据,体重首先达到400 g左右的大鼠先进行注射,最终5 d左右时间完成所有大鼠的孤束核病毒注射。所有大鼠在注射完成后观察1周,观察期间保持自由进食水。最后一只大鼠注射完成3周后进行相关行为学数据的采集。
(1)进食量检测:大鼠完成病毒注射3周后开始。分别给予3组大鼠腹腔注射不同剂量(0.5、1和3 mg/kg)的CNO。记录注射完成后0.5、1、2、3、15、24和48 h各组大鼠的累计进食量及注射后24~48 h的累计进食量。所有大鼠在每个剂量注射后进食监测的间隔期自由饲养2 d,不进行注射及进食量监测等操作。以第1次注射CNO(0.5 mg/kg)的日期为实验开始的第1天。3个浓度的CNO注射完毕后,所有大鼠均正常喂养5 d。选择HM3D组和HM4D组大鼠进行CNO的最优浓度注射,并与生理盐水注射进行比较,收集分别注射CNO和生理盐水后24 h的进食量,2组大鼠均是先注射生理盐水,观察24 h后再注射CNO观察。(2)体重:从实验第1天起,采集CNO注射前、注射后1~2 d及3次注射全部完成5 d后各组大鼠的体重数据,共采集10次体重数据。
(1)大鼠取材、切片:行为学试验完成后,每组选择3只大鼠行4%多聚甲醛心脏灌注后取全脑,每只大鼠在灌注前30 min行CNO(1 mg/kg)腹腔注射。全脑于4%多聚甲醛溶液中固定72 h后,分别放入20%和25%蔗糖溶液中梯度脱水。全脑组织脱水完成后,取大鼠孤束核所在冠状面行10 μm和30 μm冰冻切片。(2)GLP-1神经元形态学观察:选择30 μm厚度NTS区域脑片,自然梯度解冻后,给予DAPI染色液进行细胞核染色,抗荧光淬灭封片液封片,荧光显微镜下观察。(3)GLP-1神经元的鉴定:选择GFP组10 μm厚度NTS区域脑片,自然梯度解冻后,10%驴血清或山羊血清封闭,应用柠檬酸钠抗原修复液进行高温高压修复后,病毒荧光被破坏。GFP组脑片应用GFP抗体(1∶2 000)复染神经元,绿色荧光二抗(1∶500)标记一抗;应用GLP-1抗体(1∶200)孵育脑片,红色荧光二抗(1∶200)标记一抗。HM3D和HM4D组脑片应用DsRed复染神经元,红色荧光二抗(1∶200)标记一抗;应用GLP-1抗体(1∶200)孵育脑片,绿色荧光二抗(1∶200)标记一抗。DAPI染核,封片后荧光显微镜下观察,若GLP-1抗体标记的荧光和GFP抗体标记重合,则提示腺相关病毒成功标记了GLP-1神经元。(4)孤束核GLP-1神经元激活水平检测:选择10 μm厚度NTS区域脑片,自然梯度解冻后,封闭及抗原修复同上,3组脑片均以c-fos一抗孵育脑片,GFP组应用抗GFP+绿色荧光二抗标记GLP-1神经元,应用抗c-fos+红色荧光二抗标记激活的神经元,HM3D组和HM4D组应用抗DsRed+红色荧光二抗标记GLP-1神经元,应用抗c-fos+绿色荧光二抗标记激活的神经元。DAPI染核,封片后荧光显微镜下观察,以GLP-1和c-fos在神经元胞体内共表达说明GLP-1神经元被激活。对各组大鼠NTS区域内激活的GLP-1神经元进行计数后行统计学分析。(5)下丘脑POMC神经元的表达:选择10 μm厚度下丘脑区域脑片,解冻、封闭、抗原修复同上,3组脑片均应用POMC一抗孵育脑片,GFP组应用绿色荧光二抗标记POMC,HM3D组和HM4D组应用红色荧光二抗标记POMC。DAPI染核,封片后荧光显微镜下观察。对各组大鼠下丘脑弓状核区域内激活的POMC阳性神经元进行计数后行统计学分析。
采用SPSS 25.0软件包进行统计学分析,结果以
如
如
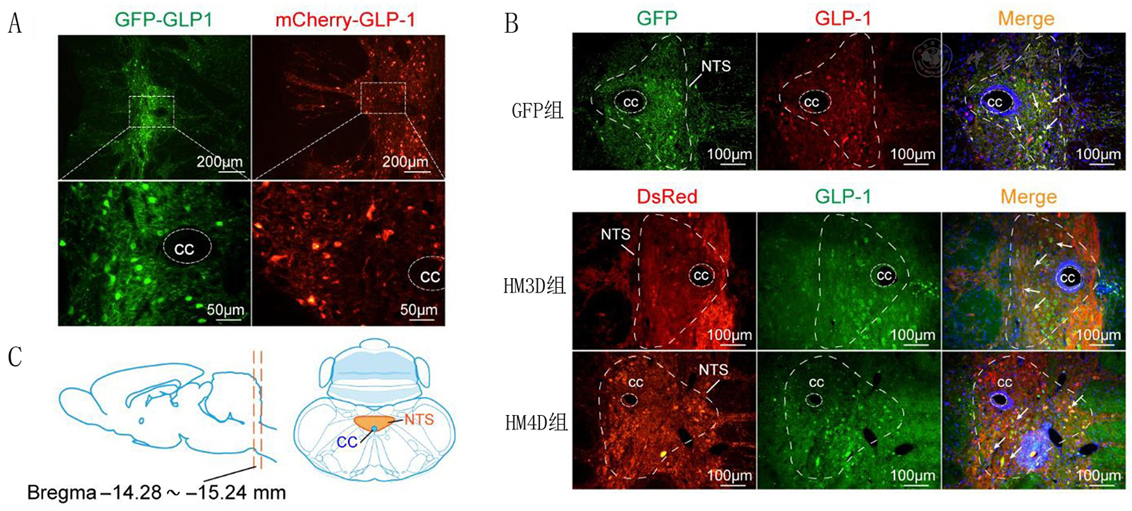
注:A:大鼠冠状面切片,胰升糖素样肽1(GLP-1)神经元的病毒标记荧光,绿色荧光蛋白(GFP)标记的是GFP组的GLP-1神经元,红色mCherry标记的是HM3D和HM4D组的GLP-1神经元;B:大鼠冠状面切片,GLP-1神经元应用抗体行荧光染色进行验证。GFP和DsRed复染抗原修复后淬灭的病毒荧光,GLP-1神经元应用GLP-1一抗和荧光二抗进行染色;C:孤束核所在冠状面的切片范围及定位模式图;cc:中央水管;NTS:孤束核;组别同图1
如
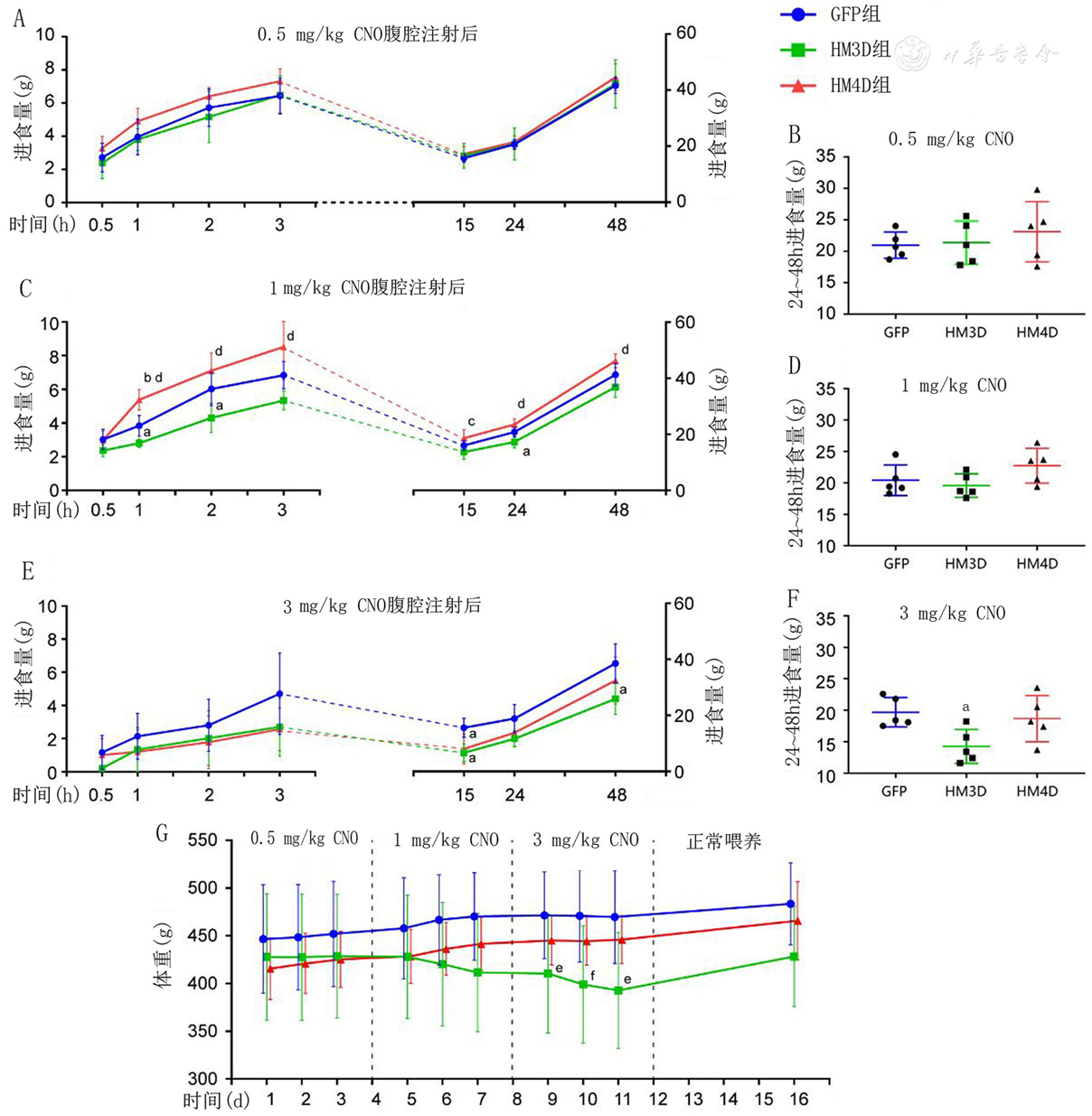
注:A、B:注射0.5 mg/kg N-氧化氯氮平(CNO)后各组大鼠48 h内的进食量变化及24~28 h的总进食量比较;C、D:注射1 mg/kg CNO后各组大鼠48 h内的体重变化及24~28 h的总进食量比较;E、F:注射3 mg/kg CNO后各组大鼠48 h内的体重变化及24~28 h的总进食量比较;G:注射不同剂量CNO各组大鼠体重变化;组别同图1;与GFP组相比,aP<0.05, bP<0.01;与HM3D组相比,cP<0.05, dP<0.01;与实验第1天相比,eP<0.05, fP<0.01
如
在本部分实验中,我们测试了不同浓度CNO腹腔注射对大鼠进食行为的影响,发现CNO注射剂量为0.5 mg/kg的各组大鼠进食量比较虽然出现了差异性的趋势,但并无统计学意义。当CNO注射剂量为1 mg/kg时,各组大鼠的进食量出现了统计学差异,且在注射24 h后无明显后遗效应。而注射3 mg/kg CNO浓度的HM3D和HM4D组大鼠均表现出明显的进食减少,且在注射后24至48 h仍存在进食减少的后遗效应。考虑可能与药物的腹腔浓度过大有关。最终确定CNO注射剂量为1 mg/kg,既能较好地激活或抑制GLP-1神经元,也不会产生明显不良反应。
如
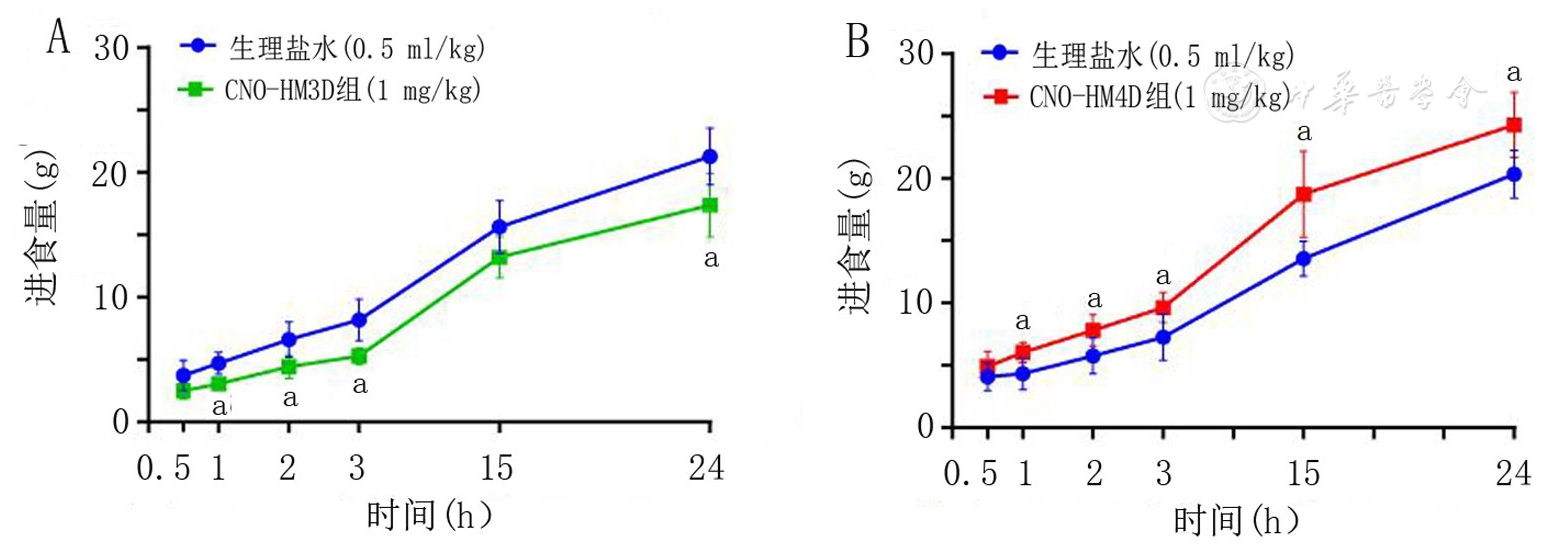
注:A:HM3D组大鼠注射N-氧化氯氮平(CNO)和生理盐水后进食量变化;B:HM4D组大鼠注射CNO和生理盐水后进食量变化;组别同图1;与注射生理盐水相比,aP<0.05
如
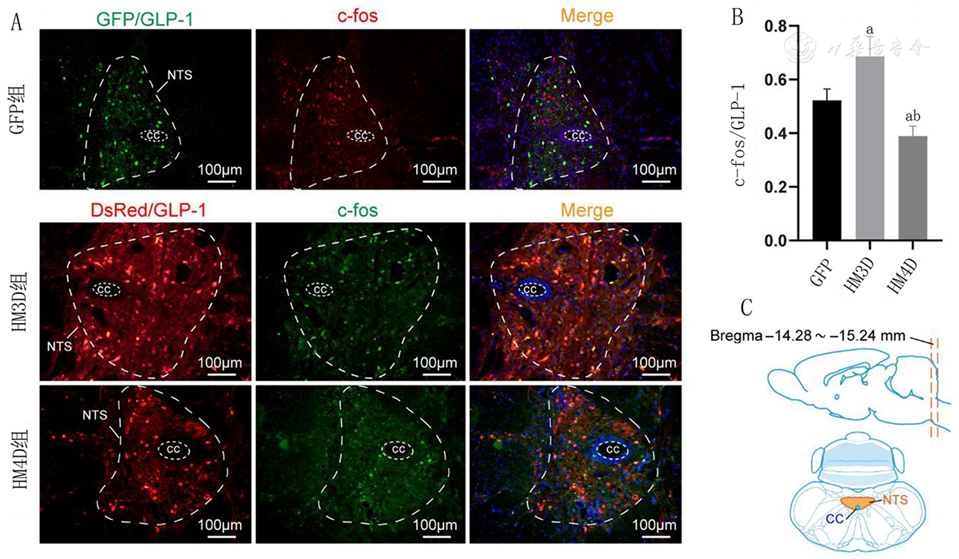
注:A:各组大鼠NTS区域GLP-1神经元激活数量对比的代表性图片;B:各组大鼠NTS区域内GLP-1神经元激活数量比较;C:孤束核所在冠状面的切片范围及定位模式图;CNO:N-氧化氯氮平;cc:中央水管;NTS:孤束核;组别同图1;与GFP组比较,aP<0.05;与HM3D组比较,bP<0.001
如
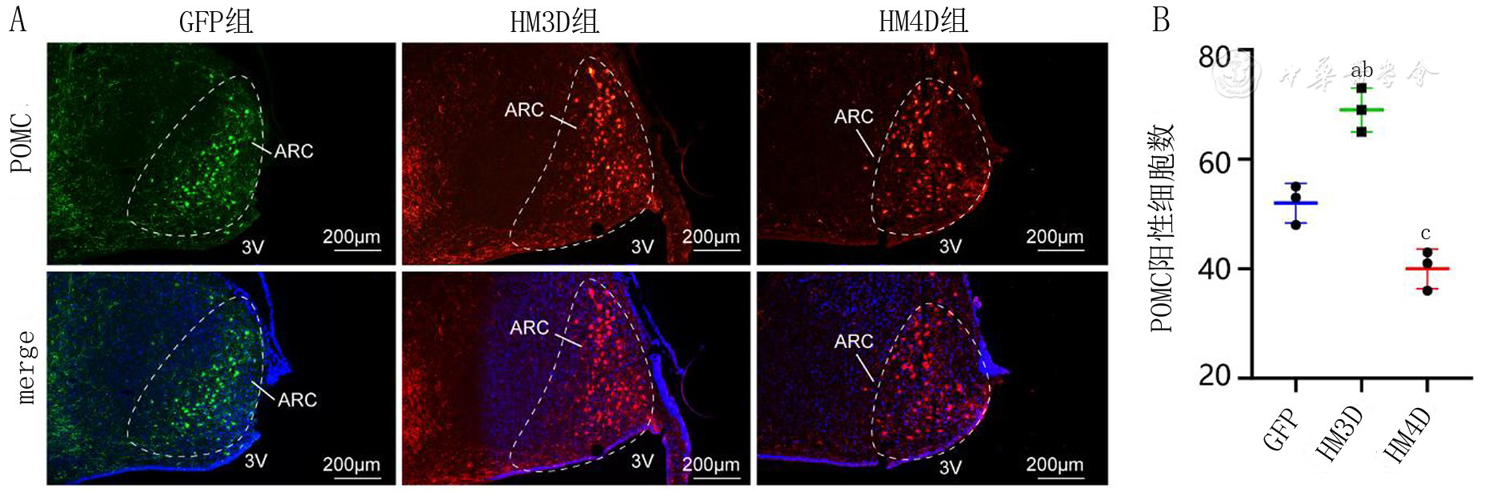
注:A:各组大鼠弓状核(ARC)区域POMC神经元激活数量对比的代表性图片;B:各组大鼠ARC区域内POMC神经元激活数量比较;CNO:N-氧化氯氮平;POMC:前阿黑皮素;3V:第三脑室;组别同图1;与GFP组比较,aP<0.05, bP<0.01;与HM3D组比较,cP<0.001
中枢来源的GLP-1由孤束核尾部一些不含儿茶酚胺的神经元产生,而且这些神经元是大脑中唯一可以合成GLP-1的区域[11]。NTS内的GLP-1神经元在调控摄食、能量代谢方面发挥着重要作用。孤束核位于迷走神经背核的背外侧,是迷走神经传入纤维的终止核团。能够接受来自心脏、肺、胃肠道的迷走神经感觉纤维,并与脑内的很多核团和区域有着密切的联系[12]。NTS内的GLP-1神经元主要通过迷走神经介导的神经内分泌通路进而影响机体的能量代谢。食物进入消化道后对胃、小肠产生机械和化学刺激,肠道在接受营养物质后肠腔神经内分泌细胞会释放相应的神经递质,产生饱腹信号。这些信号均由胃肠迷走神经传入纤维进入脑干终止于NTS[13]。
在整合外周的饱腹信号之后,孤束核的神经元可投射到其他脑区,如脑桥臂旁核及能量代谢中枢下丘脑的相关核团。孤束核中的胆囊收缩素(CCK)和多巴胺β羟化酶(dopamine β-hydroxylase, DBH)阳性神经元能够直接参与臂旁核中降钙素相关肽(calcitonin gene-related protein, CGRP)神经元的抑食欲作用[14]。孤束核的GLP-1神经元能够通过投射分泌GLP-1与下丘脑腹内侧核神经元上的GLP-1R结合并传递饱腹信号来调节食欲[15]。肠道细胞分泌的酪酪肽(PYY)能够兴奋迷走神经传入纤维,促进饱腹信号传入孤束核,进而激活弓状核的POMC神经元,抑制神经肽Y(NPY)神经元达到抑制摄食的目的[16]。下丘脑区域的GLP-1R的激活能够促进白色脂肪组织的褐色化,而这一过程可能与下丘脑室旁核的AMP活化的蛋白激酶(AMPK)通路被上调有关[17]。中枢GLP-1R的激活还可以通过迷走神经调节肝脏的脂肪代谢和胰岛素敏感性[18]。孤束核的GLP-1神经元能够通过投射分泌GLP-1与腹侧被盖区(ventral tegmental area, VTA)和伏隔核(nucleus accumbens, NAc)神经元上的GLP-1R结合,传递饱腹信号来调节食欲[19],其作用机制可能与抑制VTA-NAc奖赏环路中的多巴胺信号转导有关[20,21]。以上研究均说明,中枢GLP-1的激活具有抑制食欲、促进白色脂肪褐化、减少脂质合成、改善胰岛素敏感性等重要作用,也是治疗肥胖、非酒精性脂肪肝、2型糖尿病的重要靶点。
本研究首先确认了GLP-1神经元能够被rAAV成功标记。随后测试了CNO的最佳注射剂量。最后,本研究发现注射CNO 30 min后各组大鼠NTS区域GLP-1神经元的兴奋性呈现不同表现。HM3D组大鼠的GLP-1神经元c-fos表达明显高于GFP组和HM4D组,说明CNO注射能够有效调控GLP-1神经元的兴奋性。通过观察3组大鼠下丘脑食欲抑制肽POMC的表达发现,HM3D组大鼠下丘脑POMC表达量最大,GFP组次之,HM4D组表达量最少。说明GLP-1神经元兴奋性的增加能够增加下丘脑食欲抑制肽POMC的表达,这可能是GLP-1神经元调控摄食改善肥胖的重要机制之一。
综上,本研究结果证明了通过化学遗传学的方法将带有GLP-1启动子和cre的rAAV与带有荧光标记、DREADDs和dio的rAAV结合,并成功标记了GLP-1神经元,并能够通过腹腔注射的方式调控GLP-1神经元的兴奋性。而兴奋GLP-1神经元能够减少大鼠的进食量,抑制大鼠的体重增长,而抑制GLP-1神经元能够使大鼠的进食量增加,促进大鼠的体重增长。而GLP-1神经元调控摄食的机制可能与其影响下丘脑POMC神经元的表达有关。已有大量研究证明以GLP-1R为靶点的肥胖治疗药物是有效的,同时也在逐步推广应用于临床[22]。最新研究也证实,暴饮暴食后大鼠脑干GLP-1的含量是下降的[23],但这一现象是否表现在肥胖大鼠中尚未深入展开研究。未来是否能够通过直接调控GLP-1神经元发挥抑制摄食、改善肥胖的作用尚未可知。本研究从GLP-1神经元本身兴奋性调节为切入点,证明了在大鼠上应用化学遗传学技术调控GLP-1神经元的可行性,也为后期进一步开展GLP-1神经元的相关神经环路研究奠定了基础。
[1] Ghosal S, Myers B, Herman JP. Role of central glucagon-like peptide-1 in stress regulation[J]. Physiol Behav, 2013,122:201-207.
[2] H?lscher C. Central effects of GLP-1: new opportunities for treatments of neurodegenerative diseases[J]. J Endocrinol, 2014,221(1):T31-T41.
[3] Liu J, Pang ZP. Glucagon-like peptide-1 drives energy metabolism on the synaptic highway[J]. FEBS J, 2016,283(24):4413-4423.
[4] 吴梦洁,卢婷婷,王馥婕(综述), 等. 胰高血糖素样肽1在中枢神经系统中的作用研究进展[J]. 医学综述,2016,22(5):886-889.
[5] Roth BL. DREADDs for Neuroscientists[J]. Neuron, 2016,89(4):683-694.
[6] Aponte-Ubillus JJ, Barajas D, Peltier J, et al. Molecular design for recombinant adeno-associated virus(rAAV)vector production[J]. Appl Microbiol Biotechnol, 2018,102(3):1045-1054.
[7] Rasouli M, Ahmad Z, Omar AR, et al. Engineering an L-cell line that expresses insulin under the control of the glucagon-like peptide-1 promoter for diabetes treatment[J]. BMC Biotechnol, 2011,11:99.
[8] Shi X, Chacko S, Li F, et al. Acute activation of GLP-1-expressing neurons promotes glucose homeostasis and insulin sensitivity[J]. Mol Metab, 2017,6(11):1350-1359.
[9] Atasoy D, Aponte Y, Su HH, et al. A FLEX switch targets Channelr-hodopsin-2 to multiple cell types for imaging and long-range circuit mapping[J]. J Neurosci, 2008,28(28):7025-7030.
[10] 舒晴,邵雨薇,田峻,等. 大鼠孤束核微量注射的定位初探[J]. 中国实验动物学报,2020,28(4):429-435.
[11] Larsen PJ, Tang-Christensen M, Holst JJ, et al. Distribution of glucagon-like peptide-1 and other preproglucagon-derived peptides in the rat hypothalamus and brainstem[J]. Neuroscience, 1997,77(1):257-270.
[12] Rinaman L. Ascending projections from the caudal visceral nucleus of the solitary tract to brain regions involved in food intake and energy expenditure[J]. Brain Res, 2010,1350:18-34.
[13] Schwartz MW, Woods SC, Porte D
[14] Roman CW, Derkach VA, Palmiter RD. Genetically and functionally defined NTS to PBN brain circuits mediating anorexia[J]. Nat Commun, 2016,7:11905.
[15] Renner E, Puskás N, Dobolyi A, et al. Glucagon-like peptide-1 of brainstem origin activates dorsomedial hypothalamic neurons in satiated rats[J]. Peptides, 2012,35(1):14-22.
[16] Blevins JE, Chelikani PK, Haver AC, et al. PYY(3-36)induces Fos in the arcuate nucleus and in both catecholaminergic and non-catechola-minergic neurons in the nucleus tractus solitarius of rats[J]. Peptides, 2008,29(1):112-119.
[17] Desjardins EM, Steinberg GR. Emerging role of AMPK in brown and beige adipose tissue(BAT): implications for obesity, insulin resistance, and type 2 diabetes[J]. Curr Diab Rep, 2018,18(10):80.
[18] Taher J, Baker CL, Cuizon C, et al. GLP-1 receptor agonism amelio-rates hepatic VLDL overproduction and de novo lipogenesis in insulin resistance[J]. Mol Metab, 2014,3(9):823-833.
[19] Howell E, Baumgartner HM, Zallar LJ, et al. Glucagon-like peptide-1(GLP-1)and 5-hydroxytryptamine 2c(5-HT2c)receptor agonists in the ventral tegmental area(VTA)inhibit ghrelin-stimulated appetitive reward[J]. Int J Mol Sci, 2019,20(4):889.
[20] Ong ZY, Liu JJ, Pang ZP, et al. Paraventricular thalamic control of food intake and reward: role of glucagon-like peptide-1 receptor signaling[J]. Neuropsychopharmacology, 2017,42(12):2387-2397.
[21] Wang XF, Liu JJ, Xia J, et al. Endogenous glucagon-like peptide-1 suppresses high-fat food intake by reducing synaptic drive onto mesolimbic dopamine neurons[J]. Cell Rep, 2015,12(5):726-733.
[22] Trapp S, Brierley DI. Brain GLP-1 and the regulation of food intake: GLP-1 action in the brain and its implications for GLP-1 receptor agonists in obesity treatment[J]. Br J Pharmacol, 2022,179(4):557-570.
[23] Mukherjee A, Hum A, Gustafson TJ, et al. Binge-like palatable food intake in rats reduces preproglucagon in the nucleus tractus solitarius[J]. Physiol Behav, 2020, 219:112830.
