FBN1基因杂合突变导致轻型Geleophysic发育不良2型/Acromicric发育不良中国家系及促生长治疗的探讨
2023年6月
中华内分泌代谢杂志,第39卷第6期 第492页-第498页
黄梦甜,陈秋莉,马华梅,李燕虹,张军,郭松
Geleophysic发育不良[Geleophysic dysplasia, GD;人类孟德尔遗传数据库(MIM)号231050、614185、617809]与Acromicric发育不良(Acromicric dysplasia, AD;MIM号102370)均属2019版遗传性骨骼疾病分类的肢端发育不良(acromelic dysplasias)组,是一组非常罕见的先天性结缔组织疾病,具有共同的肌肉骨骼特征表现,如身材矮小、短指(趾)、关节僵硬、假性肌肉发达、皮肤厚而纤维化等[1,2]。Geleophysic发育不良2型(Geleophysic dysplasia type 2, GD2)和AD均可由呈常染色体显性遗传的原纤维蛋白1(fibrillin 1, FBN1)基因突变引起,可通过各自特异性的临床特征来区分[3]:GD患者面颊丰满、微笑面容,眼间距宽、鼻小、鼻孔前倾、人中长而扁、上唇薄、肝肿大和踮起脚尖行走、进行性心脏瓣膜增厚;AD患者圆脸、轮廓分明的眉毛、长睫毛、球形鼻鼻孔前倾、人中长而突出、小嘴厚唇、股骨头内切迹、第二掌骨内切迹、第五掌骨外切迹。因GD常合并肝肿大、心脏瓣膜异常、气道狭窄等多系统损害,早期死亡率较高[4];表现类似GD但没有心脏瓣膜异常的患者往往被归为AD,临床表现程度较轻,系统损害较小,预后较好[4]。本研究报道1个在本院就诊并行全外显子基因测序确诊FBN1基因杂合突变致不同表型肢端发育不良的家系,并对5例儿童患者进行促生长治疗。
2017年8月至2022年5月就诊于中山大学附属第一医院儿科内分泌专科的1个家族性矮小家系。该家系三代13名成员中共有7例患者,其中6例经全外显子测序和Sanger测序验证为FBN1基因杂合突变。本研究通过中山大学附属第一医院医学伦理委员会批准[批件号:伦审(2021)634号]。
回顾性分析该家系的临床资料。收集该家系5例患儿就诊时的病史、既往史、个人史及家族史,每次就诊时的身高、体重、骨龄及性征,实验室检查[初诊时及启动治疗后每3个月复查血糖、肝酶、血脂、空腹胰岛素、甲状腺功能、皮质醇(晨8:00)和胰岛素样生长因子Ⅰ(insulin like growth factor-Ⅰ,IGF-Ⅰ);对青春期患者或治疗中进入青春期者每半年复查骨龄;青春未发育者每年复查骨龄;对部分患儿行生长激素激发(左旋多巴+溴吡斯的明联合)试验及简易曲普瑞林激发试验],并对部分患者进行全外显子组基因测序和Sanger测序验证[5,6]。5例儿童患者确诊后均进行促生长治疗:重组人生长激素(recombinant human growth hormone, rhGH)、司坦唑醇(Stanazolol)[7,8]。其中2例青春中后期的女性患儿非常规加用促性腺激素释放激素类似物(gonadotropin releasing hormone analogue, GnRHa)[8,9]。
身高标准参照2005年九市儿童生长体格发育调查数据研究,分别计算按年龄的身高标准差分值(height standard deviation score for chronological age, HtSDSCA)及按骨龄的身高标准差分值(height standard deviation score for bone age, HtSDSBA)[10],身材的匀称性通过坐高/身高和坐高/腿长比值来判断[11,12]。
血IGF-Ⅰ按性别及年龄计算标准差分值[13]。骨龄评定使用GreulichPyle(GP)法。青春发育评价使用Tanner法,女性以乳房发育达到Tanner Ⅱ期、男性以睾丸容积达4 mL作为青春期启动的标志[14,15]。女性成年身高定义为身高年增长速率<1 cm,或骨龄≥15岁时的身高。
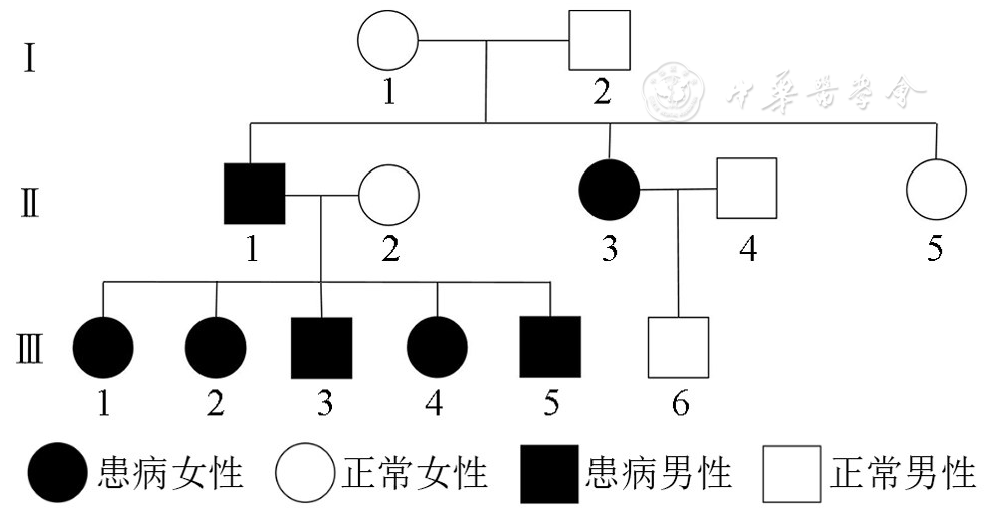
本家系三代共13人,其中有7例患者:2例为未经治疗的成年患者,5例为儿童患者。
临床特征:先证者Ⅲ-1~Ⅲ-5为同胞患者,是Ⅱ-1和Ⅱ-2的全部子女,均因"出生后进行性生长衰竭"分别在14岁6个月(女性)、12岁7个月(女性)、7岁3个月(男性)、4岁9个月(女性)和3岁11个月(男性)来诊。既往史、个人史无特殊,语言发育、运动发育及智力发育正常。家族史:先证者父母非近亲婚配,父亲(Ⅱ-1)、母亲(Ⅱ-2)身高分别为139 cm、160 cm;先证者祖父(Ⅰ-1)、祖母(Ⅰ-2)身高分别为162 cm、155 cm;先证者父亲的成年大妹(Ⅱ-3)面容与其哥(Ⅱ-1)极为相像,身高为139 cm,其丈夫(Ⅱ-4)身高为160 cm,其儿子(Ⅲ-6)18岁时身高为165 cm;先证者父亲的成年小妹(Ⅱ-5)身高为160 cm(
注:FBN1:原纤维蛋白1
体格检查:5例患者均呈重度不匀称矮小(身高<-3 SD,坐高/身高和坐高/腿长比值均显著增加),眉毛浓密,睫毛长,手足稍短小,余无明显面容异常。皮肤厚度正常,心肺腹未见异常,四肢、脊柱无畸形,无假性肌肉发达、关节活动受限,步态正常。Ⅲ-1(女性)已乳房发育2年,Ⅲ-2(女性)已乳房发育1年余,均未现初潮;Ⅲ-3(男性)、Ⅲ-4(女性)和Ⅲ-5(男性)均未青春期发育,外生殖器均无异常(
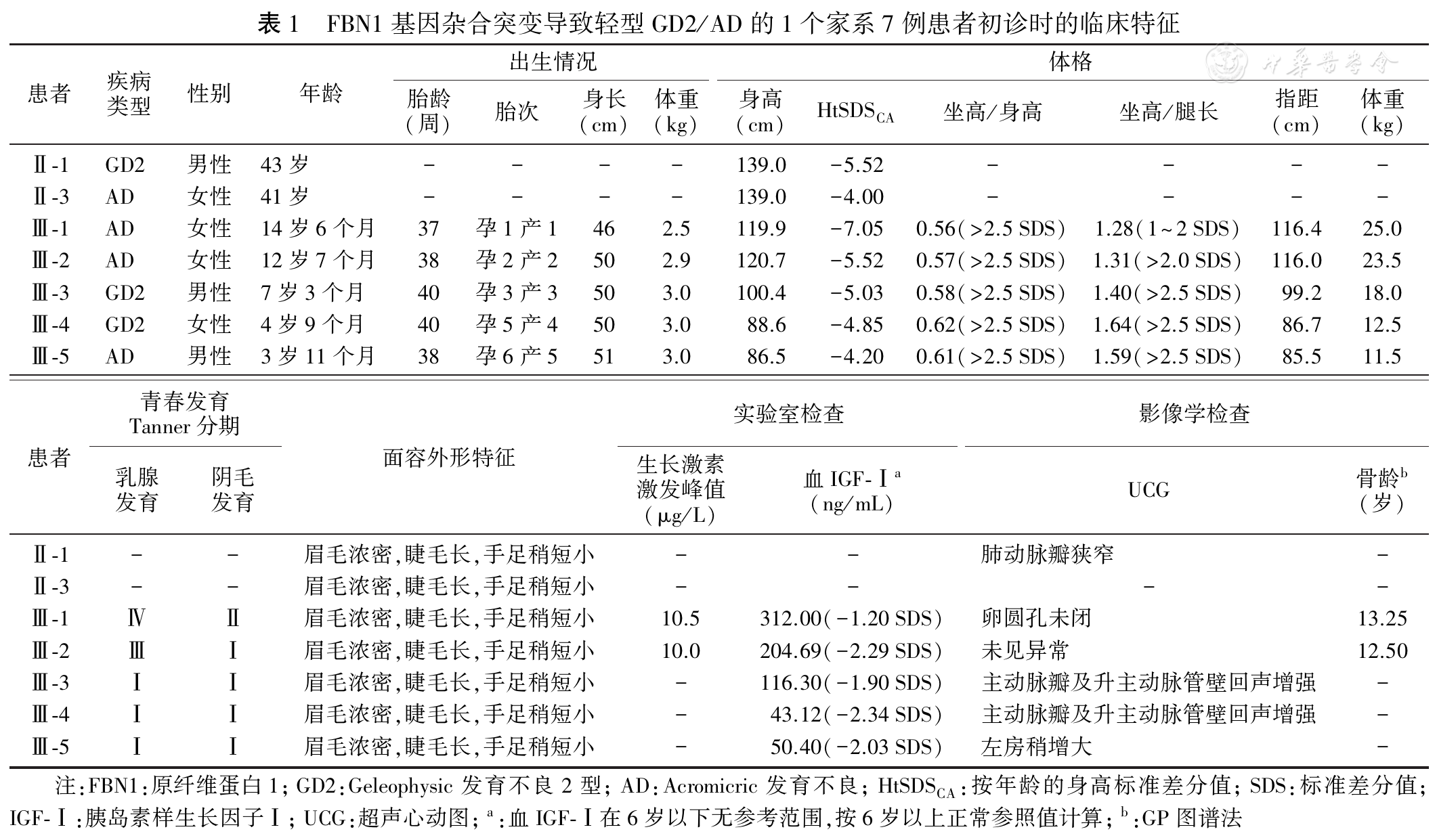
辅助检查:病例Ⅲ-1~Ⅲ-5血常规正常,电解质、肝功能、肾功能、血脂正常,甲状腺功能和甲状旁腺素正常,促肾上腺皮质激素、皮质醇正常,血IGF-Ⅰ浓度均偏低至低下(-2.34~-1.20 SD)。病例Ⅲ-1和Ⅲ-2行生长激素激发试验提示均非生长激素缺乏症,简易曲普瑞林激发试验结果提示下丘脑-垂体-性腺轴均已启动。病例Ⅲ-1染色体核型46,XX。病例Ⅲ-1~Ⅲ-5的掌骨、股骨、脊柱X线检查均无异常,肝胆胰脾及双肾输尿管膀胱超声未见异常,垂体磁共振成像(MRI)平扫未见异常。超声心动图Ⅲ-1示"卵圆孔未闭",Ⅲ-3、Ⅲ-4示"主动脉瓣及升主动脉管壁回声增强",Ⅲ-2、Ⅲ-5均正常(
临床诊断:家族性不匀称矮小(遗传性骨病可能)。
经患儿父母知情同意后,对先证者Ⅲ-1进行全外显子组基因测序和Sanger测序验证(广州金域医学检验中心)。结果显示,FBN1基因在第42号外显子处存在杂合的碱基突变c.5099A>G p.(Tyr1700Cys),序列分析表明该突变可导致第1 700位的氨基酸由酪氨酸变成半胱氨酸,为致病突变(
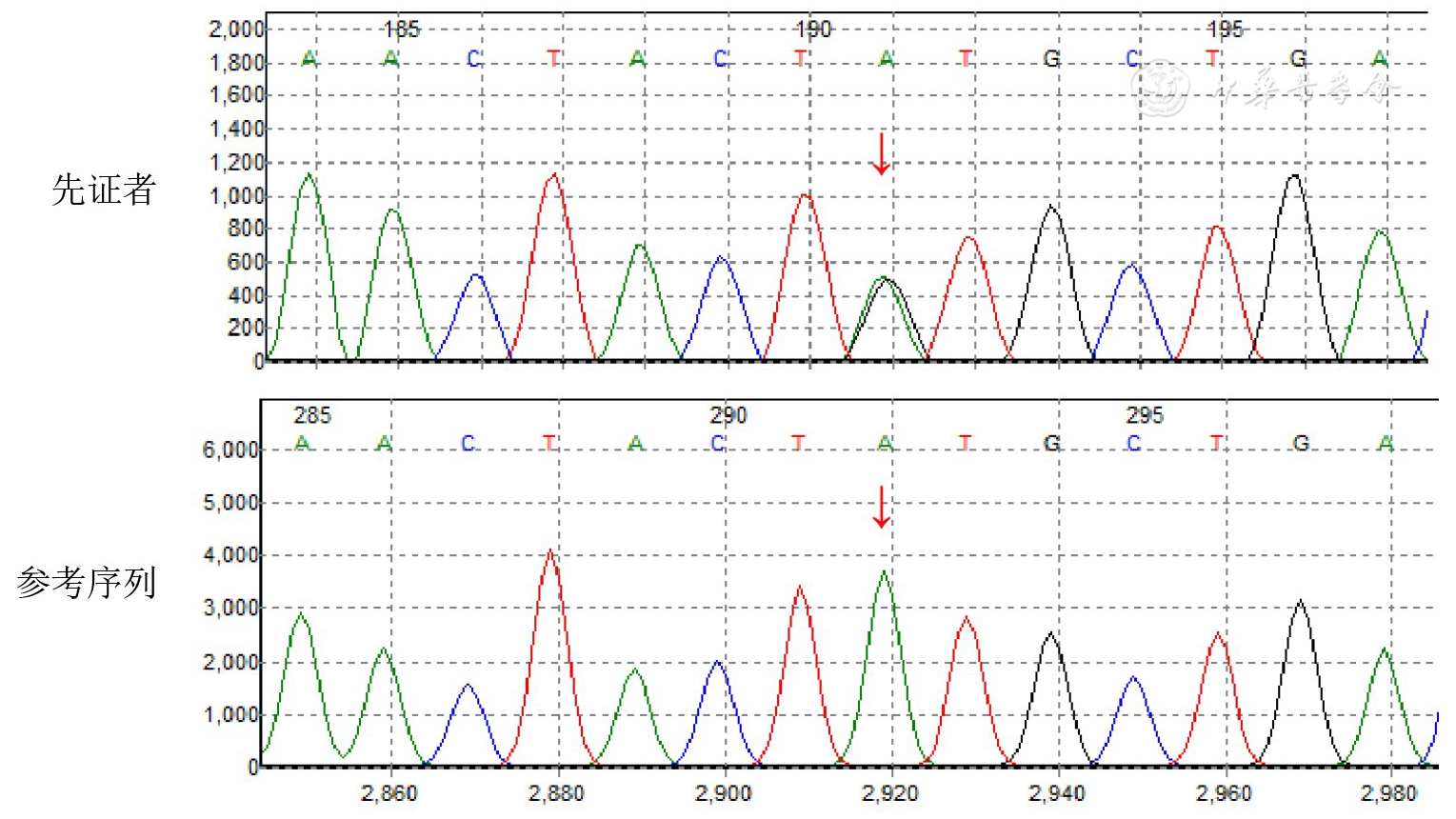
注:c.5099A>G(p.Tyr1700Cys)杂合突变
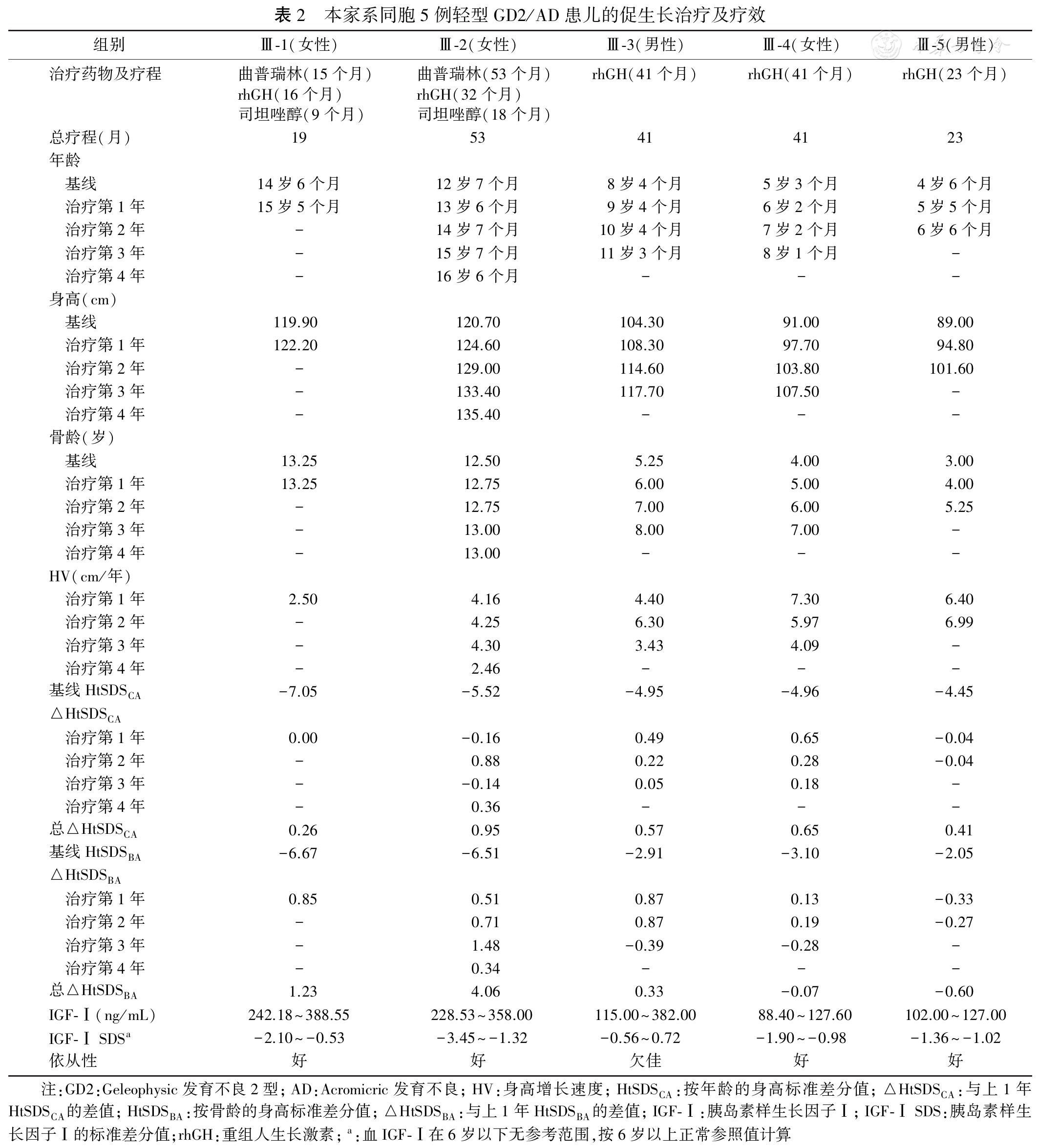
FBN1基因突变导致的严重不匀称矮小GD或AD的促生长治疗研究报道很少。患儿Ⅲ-1~Ⅲ-5的父亲(Ⅱ-2)要求对患儿进行促生长治疗尝试,希望改善成年身高;尤其希望患儿成年身高能达135 cm及以上。在取得家长充分知情同意后,患儿Ⅲ-1~Ⅲ-5分别在年龄14岁6个月(初诊)、12岁7个月(初诊)、8岁4个月、5岁3个月和4岁6个月时开始促生长治疗。5例患儿均采用rhGH促生长治疗,起始剂量1.1~1.2 IU·kg-1·周-1,每周注射6~7次。治疗过程中,根据身高增长速率调整剂量至最大剂量1.4 IU·kg-1·周-1。2例处于青春中后期的女性患儿Ⅲ-1和Ⅲ-2于初诊时非常规使用月缓释型曲普瑞林70 μg/kg,每3周注射1次;GnRHa治疗过程中,因rhGH供应不足或身高增长速率极慢的情况,该2例患儿予加用口服司坦唑醇30 μg·kg-1·d-1,每日1次。Ⅲ-1~Ⅲ-5经过19~53个月治疗,HtSDSCA均有一定程度增加(0.26~0.95),提示身高增长速度加快;联用GnRHa的Ⅲ-1、Ⅲ-2的HtSDSBA亦显著增加(1.23、4.06)。Ⅲ-1在19岁时身高126 cm。具体用药及疗效见
FBN1基因(MIM号134797)定位于常染色体15q21.1,含66个外显子,编码分子量350 kd、含2 871个氨基酸的FBN1。FBN1通过募集含Ⅰ型血小板结合蛋白基序的解聚蛋白样金属蛋白酶(disintegrin and metalloprotease with thrombospondin-1-like domain, ADAMTS)形成微纤维,后者是细胞外基质中的重要组织成分,有助于维持结缔组织的完整性和功能,并通过与潜在转化生长因子-β(transforming growth factor-β,TGF-β)结合蛋白相互作用,调节TGF-β及骨形态发生蛋白(bone morphogenetic factor, BMP)信号通路,改变生长板中细胞外基质成分而影响软骨形成及骨骼生长与矿化,参与骨生长调节[16,17,18]。FBN1基因突变除可导致高身材的马方综合征外,还是多种遗传性肢端发育不良疾病的潜在病因,包括GD2、AD、Weill-Marchesani综合征[4,19]。Cain等[20]研究发现,引起AD/GD的FBN1基因突变会破坏肝素与FBN1的结合,而细胞外的硫酸乙酰肝素相互作用可能对ADAMTS介导的微纤维沉积很重要。目前尚未阐明上述临床表现的发生机制,推测可能与特定修饰基因的参与、非突变型与野生型FBN1等位基因的差异表达,或者FBN1 TB5结构域的突变导致特异性结构和功能改变有关[2]。
GD和AD均属肢端发育不良,临床特征为严重的不匀称矮小,并具共同肌肉骨骼特征,如短指/趾、关节僵硬、假性肌肉发达、皮肤厚而纤维化等,其中GD2及AD均由FBN1基因突变引起;由于AD和GD的临床表现有重叠,早期确定AD或GD困难,通常要通过随诊了解有无合并肝肿大、心脏瓣膜异常、气道狭窄等多系统损害来诊断GD。随着分子生物学的进展,不断有轻型AD病例(仅严重身材矮小及轻度面部特征)、轻型GD病例(仅严重身材矮小及轻度肝肿大或心脏杂音)的报道出现[21,22,23]。本家系7例患者除有严重不匀称性矮小及浓眉、长睫毛外,均无GD/AD的典型特殊面容,无特征性骨骼、肌肉改变,影像学上仅存在轻度骨龄延迟,无骨骺异常或掌骨切迹等GD/AD典型的影像学表现,因此该家系为轻型/非经典型的肢端发育不良。结合随诊观察临床表现及腹部超声、心脏超声等检查,Ⅱ-1(男性)因"肺动脉瓣狭窄"行球囊扩张术,归为GD;Ⅱ-3(女性)已41岁,未出现心肺并发症,日常生活工作正常,归为AD;Ⅲ-1、Ⅲ-2和Ⅲ-5因无瓣膜异常归为AD;Ⅲ-3和Ⅲ-4因"主动脉瓣及升主动脉管壁回声增强"归为GD。
在PubMed、万方数据库进行文献检索发现,迄今为止,包括本家系,共有28例FBN1基因突变相关的GD(GD2)/AD中国患者被报道[17,22,23,24,25,26,27,28],其中15例为GD2。有详细病例资料的13例中国GD2患者中,有轻度至典型面部特征者为92%,合并心脏病变为77%,关节畸形为46%,肝脏肿大为31%。
以家系报道的FBN1所致GD/AD共7个家系、20例患者[17,21,22,23,29](其中1个家系为三代6例患病),包括本家系,均呈常染色体显性遗传。理论上,常染色体显性遗传性疾病每位子代的发病概率为50%,然而,本家系中Ⅱ-1和Ⅱ-2的所有子代Ⅲ-1~Ⅲ-5均为患者,提示该位点的基因突变(或该位点的此种突变)可能存在遗传优势,更容易传递至下一代,值得进一步研究。
本家系7例患者中行基因检测的6例均检测到FBN1基因杂合致病突变c.5099A>G(p.Tyr1700Cys)。同位点突变曾出现于2011年报道的1个中国经典型AD家系的2例患者(母亲和孩子)[17];本家系临床表现各异,但均为轻型/非经典型的肢端发育不良,部分患者因心脏瓣膜受累而归为GD,不同于上述报道的经典型AD。2011年,Le Goff等[17]同样发现,FBN1基因相同的突变c.5096A>G(p.Tyr1699Cys)和c.5182G>A(p.Ala1728Thr)的临床表型可为GD或AD。此外,c.5183C>T(p.Ala1728Val)虽首次以GD2被发现,但后续发现相同突变可导致孤立的严重匀称性矮小表型,并因此将FBN1纳入为孤立性矮身材的遗传性致病基因之一[21,30]。因此,本家系的基因和临床表型进一步证实了FBN1基因的多效性,并扩大了c.5099A>G(p.Tyr1700Cys)位点突变的疾病表型谱(轻型/非经典型~经典型,GD2或AD)。这可能由导致临床表型差异的未知疾病修饰物所引起[28]。
GD2/AD可自出生后第1年起出现身高增长缓慢[3],并逐渐偏离正常生长轨迹[22,31]。本家系5例患儿出生身长、体重正常,出生后生长速率极慢,其中病例Ⅲ-5来诊年龄最小(3岁11个月),身高-4.2 SD,已经呈现严重矮小,可以推断其生长缓慢发生更早、甚至婴儿期。
因此,对于严重矮小的GD/AD,尤其轻型,临床上促生长治疗非常重要。但目前相关数据很少,仅限于个案报道,结果各异。如2016年巴西、2017年韩国和2022年德国报道的3例AD男童,分别经过1年、3.5年和7年的rhGH治疗,HtSDSCA分别增加0.4、0.98和1.6,提示rhGH具近期疗效[21,32,29]。2018年美国报道的2例具有严重多器官受累的重型GD患儿,应用高剂量rhGH治疗,其身高增长仍极缓慢,因患儿是重型GD,rhGH治疗无效的原因复杂[33]。因此,rhGH治疗的疗效值得进一步研究。值得重视的是,由于遗传性骨骼发育不良性疾病常存在遗传异质性和(或)表型变异性,疗效评估有困难[34]。此外,由于该类疾病进行性生长衰减的特性,患者身高随着年龄增长逐渐负向偏离正常的生长轨迹,也难以通过现有数据对其进行成年身高的预测[22]。目前,对于rhGH疗效的评估,公认应综合病因,对于遗传综合征不应使用正常人群的标准生长曲线作为参考,是否有效关键在于能否一定程度上克服原发疾病带来的生长衰减,形成或接近正常人群的生长轨迹[35]。
本家系中处于青春中后期的Ⅲ-1和Ⅲ-2,因就诊时骨龄大、剩余生长潜能小,为延长生长时间,结合本中心在GnRHa应用于大骨龄女性患儿的临床经验,非常规予GnRHa治疗,并应用了司坦唑醇[8,9]。GnRHa应用于GD/AD患者见于2016年巴西的个案报道[21]。但并未见对GD/AD等肢端发育不良疾病的患儿使用司坦唑醇治疗的报道。司坦唑醇属于蛋白同化类固醇激素,因有较好的促生长作用而已被应用于改善体质性生长和青春发育迟缓、Turner综合征等患儿的生长和成年身高[7,8]。在本研究中,GnRHa+rhGH/司坦唑醇治疗有效地促进身高增长并抑制骨龄进展,实现了身高对年龄和骨龄的双重追赶;且Ⅲ-1已达成年身高126 cm,超过按正常女性人群骨龄13.25岁(完成成年身高的96.7%)的预测成年身高124.0 cm(BPaverage法[36]);Ⅲ-2在末次随诊时骨龄13.25岁,身高135.6 cm,也已经远远超过治疗前按正常女性人群骨龄12.5岁(完成成年身高的94.1%)的预测成年身高128.26 cm,同时因尚未达成年身高,预计其成年身高>135.6 cm;因此,两者促进生长的近期疗效与改善成年身高的远期疗效是肯定的。对于Ⅲ-3~Ⅲ-5,高剂量rhGH治疗促进了身高增长,虽然按照正常儿童人群的标准,生长追赶不明显,且Ⅲ-3治疗依从性欠佳,但均一定程度上克服了肢端发育不良衰减性生长的特点、维持了正常生长速率,因而有促生长的近期疗效,至于改善成年身高的远期疗效则有待进一步随诊。治疗过程中,监测血糖、肝功能、胰岛素、甲状腺功能等均正常;Ⅲ-1和Ⅲ-2在司坦唑醇治疗过程中,未见明显男性化表现。因此,在本家系5例轻型GD2/AD患儿中,GnRHa、rhGH和司坦唑醇的应用安全有效。rhGH/司坦唑醇具有促身高生长的近期疗效,联用GnRHa还对青春期患儿具有改善成年身高的远期疗效。rhGH治疗中,血IGF-Ⅰ的变化与促生长疗效不平行,rhGH改善身高的作用与IGF-Ⅰ关系并不明确,其促生长机制有待进一步研究。本研究中rhGH的促生长疗效呈剂量依赖,5例患儿起始剂量1.1~1.2 IU·kg-1·周-1的rhGH促生长疗效均欠佳,最后均达到1.4 IU·kg-1·周-1。更高剂量的rhGH的促生长疗效,需要更多的临床研究来论证。
综上,本研究报道了FBN1基因杂合突变导致轻型GD2型/AD的一个家系,总结了该家系三代共7例患者的临床特征和基因突变位点及类型,扩大了FBN1基因突变的表型谱。对5例儿童患者进行的促生长治疗(高剂量rhGH,司坦唑醇)在一定程度上克服了GD/AD的进行性生长衰减,部分维持了正常的生长速率,具有促身高增长的近期疗效;对青春中后期的2例女性患儿联合应用GnRHa,有效地实现了身高对年龄和骨龄的双重追赶,改善了成年身高,远期疗效亦是肯定的。本研究为临床GD/AD等肢端发育不良性疾病的促生长治疗提供了参考。更多病例的治疗方案及疗效,仍有待大样本的数据支持,值得进一步研究。
[1] Mortier GR, Cohn DH, Cormier-Daire V, et al. Nosology and classifi-cation of genetic skeletal disorders: 2019 revision[J]. Am J Med Genet A, 2019,179(12):2393-2419.
[2] Stanley S, Balic Z, Hubmacher D. Acromelic dysplasias: how rare musculoskeletal disorders reveal biological functions of extracellular matrix proteins[J]. Ann N Y Acad Sci, 2021,1490(1):57-76.
[3] Marzin P, Thierry B, Dancasius A, et al. Geleophysic and acromicric dysplasias: natural history, genotype-phenotype correlations, and manag-ement guidelines from 38 cases[J]. Genet Med, 2021,23(2):331-340.
[4] Le Goff C, Cormier-Daire V. From tall to short: the role of TGFβ signaling in growth and its disorders[J]. Am J Med Genet C Semin Med Genet, 2012,160C(3):145-153.
[5] 李燕虹,杜敏联,马华梅,等. 吡啶斯的明与左旋多巴联合激发试验对儿童生长激素缺乏症的诊断价值[J]. 中华内分泌代谢杂志,2004,20(3):227-230.
[6] 马华梅,杜敏联,苏喆,等. GnRHa激发试验对性早熟的诊断价值探讨[J]. 中国实用儿科杂志,2002,17(5):290-294.
[7] 中华医学会儿科学分会内分泌遗传代谢学组,《中华儿科杂志》编辑委员会. Turner综合征儿科诊疗共识[J]. 中华儿科杂志,2018,56(6):406-413.
[8] 李燕虹,朱顺叶,马华梅,等. 促性腺激素释放激素类似物联合司坦唑醇治疗改善大骨龄特发性中枢性性早熟女孩成年身高的疗效评价[J]. 中华儿科杂志,2013,51(11):807-812.
[9] 马华梅,杜敏联. 促性腺激素释放激素类似物治疗改善真性性早熟女孩成年身高[J]. 中华内分泌代谢杂志,2005,21(3):240-243.
[10] 李辉,季成叶,宗心南,等. 中国0~18岁儿童、青少年身高、体重的标准化生长曲线[J]. 中华儿科杂志,2009,47(7):487-492.
[11] Fredriks AM, van Buuren S, van Heel WJ, et al. Nationwide age references for sitting height, leg length, and sitting height/height ratio, and their diagnostic value for disproportionate growth disorders[J]. Arch Dis Child, 2005,90(8):807-812.
[12] 张亚钦,李辉,季成叶. 中国0至18岁正常儿童青少年身体比例生长规律的研究[J]. 中国循证儿科杂志,2010,5(5):349-354.
[13] 许珊珊,顾学范,潘慧,等. 儿童青少年血清胰岛素生长因子-1及胰岛素因子结合蛋白-3的正常参考值研究[J]. 临床儿科杂志,2009,27(12):1105-1110.
[14] 中华医学会儿科学分会内分泌遗传代谢学组青春发育调查研究协作组. 中国九大城市男孩睾丸发育、阴毛发育和首次遗精年龄调查[J]. 中华儿科杂志,2010,48(6):418-424.
[15] 中华医学会儿科学分会内分泌遗传代谢学组青春发育调查研究协作组. 中国九大城市女孩第二性征发育和初潮年龄调查[J]. 中华内分泌代谢杂志,2010,26(8):669-675.
[16] Sakai LY, Keene DR, Renard M, et al. FBN1: The disease-causing gene for Marfan syndrome and other genetic disorders[J]. Gene, 2016,591(1):279-291.
[17] Le Goff C, Mahaut C, Wang LW, et al. Mutations in the TGFβ binding-protein-like domain 5 of FBN1 are responsible for acromicric and geleophysic dysplasias[J]. Am J Hum Genet, 2011,89(1):7-14.
[18] Sakai LY, Keene DR. Fibrillin protein pleiotropy: Acromelic dysplasias[J]. Matrix Biol, 2019,80:6-13.
[19] Dietz HC, Cutting GR, Pyeritz RE, et al. Marfan syndrome caused by a recurrent de novo missense mutation in the fibrillin gene[J]. Nature, 1991,352(6333):337-339.
[20] Cain SA, McGovern A, Baldwin AK, et al. Fibrillin-1 mutations causing Weill-Marchesani syndrome and acromicric and geleophysic dysplasias disrupt heparan sulfate interactions[J]. PLoS One, 2012,7(11):e48634.
[21] de Bruin C, Finlayson C, Funari MF, et al. Two patients with severe short stature due to a FBN1 mutation(p.Ala1728Val) with a mild form of Acromicric dysplasia[J]. Horm Res Paediatr, 2016,86(5):342-348.
[22] Shan YC, Yang ZC, Ma L, et al. A review of three Chinese cases of Acromicric/Geleophysic dysplasia with FBN1 mutations[J]. Int J Gen Med, 2021,14:1873-1880.
[23] Cheng SW, Luk HM, Chu Y, et al. A report of three families with FBN1-related acromelic dysplasias and review of literature for genotype-phenotype correlation in geleophysic dysplasia[J]. Eur J Med Genet, 2018,61(4):219-224.
[24] Huang Z, Sun Y, Fan Y, et al. Genetic evaluation of 114 Chinese short stature children in the next generation era: a single center study[J]. Cell Physiol Biochem, 2018,49(1):295-305.
[25] Zhang H, Yang R, Wang Y, et al. A pilot study of gene testing of genetic bone dysplasia using targeted next-generation sequencing[J]. J Hum Genet, 2015,60(12):769-776.
[26] Wang T, Yang Y, Dong Q, et al. Acromicric dysplasia with stiff skin syndrome-like severe cutaneous presentation in an 8-year-old boy with a missense FBN1 mutation: case report and literature review[J]. Mol Genet Genomic Med, 2020,8(7):e1282.
[27] 李阳,武华红,李辉. FBN1基因突变导致Geleophysic发育不良2型1例并文献复习[J]. 亚洲儿科病例研究,2018,6(3):27-34.
[28] Wang Y, Zhang H, Ye J, et al. Three novel mutations of the FBN1 gene in Chinese children with acromelic dysplasia[J]. J Hum Genet, 2014,59(10):563-567.
[29] Quitter F, Flury M, Waldmueller S, et al. Acromicric dysplasia due to a novel missense mutation in the fibrillin 1 gene in a three-generation family[J]. J Pediatr Endocrinol Metab, 2022,35(11):1443-1447.
[30] Jee YH, Baron J, Nilsson O. New developments in the genetic diagnosis of short stature[J]. Curr Opin Pediatr, 2018,30(4):541-547.
[31] Faivre L, Le Merrer M, Baumann C, et al. Acromicric dysplasia: long term outcome and evidence of autosomal dominant inheritance[J]. J Med Genet, 2001,38(11):745-749.
[32] Jin HS, Song HY, Cho SY, et al. Acromicric dysplasia caused by a novel heterozygous mutation of FBN1 and effects of growth hormone treatment[J]. Ann Lab Med, 2017,37(1):92-94.
[33] Globa E, Zelinska N, Dauber A. The clinical cases of Geleophysic dysplasia: one gene, different phenotypes[J]. Case Rep Endocrinol, 2018,2018:8212417.
[34] Hagen?s L, Hertel T. Skeletal dysplasia, growth hormone treatment and body proportion: comparison with other syndromic and non-syndromic short children[J]. Horm Res, 2003,60(
[35] Collett-Solberg PF, Ambler G, Backeljauw PF, et al. Diagnosis, Genetics, and Therapy of Short Stature in Children: A Growth Hormone Research Society International Perspective[J]. Horm Res Paediatr, 2019,92(1):1-14.
[36] Bayley N, Pinneau SR. Tables for predicting adult height from skeletal age: revised for use with the Greulich-Pyle hand standards[J]. J Pediatr, 1952,40(4):423-441.
