列线图预测北京社区成年人2型糖尿病风险的研究
2023年1月
中华内科杂志,第62卷第1期 第54页-第60页
柳洪宙,王安平,王雅静,杜锦,谷伟军,吕朝晖,窦京涛,母义明
糖尿病是常见的慢性病之一,已成为严重的全球健康问题。2021年全球20~79岁人群的糖尿病患病率估计为10.5%(5.366亿人),到2045年将上升至12.2%(7.832亿人)[1]。此外,2型糖尿病(T2DM)可导致多种并发症,如心血管疾病、糖尿病肾病、糖尿病视网膜病变、糖尿病神经病变和糖尿病肺部并发症[2]。T2DM是一种以胰岛素抵抗和相对胰岛素缺乏引起的高血糖为特征的疾病,占所有糖尿病的90%~95%[3]。T2DM的病因多种多样。虽然具体的病因尚不清楚,但有几项研究表明,T2DM可能由生活方式、遗传和环境因素引起[4, 5]。由于T2DM患病率不断上升、经济成本巨大、并发症严重,调查T2DM的高危因素、估计发病率并及时干预对于预防或推迟T2DM的发病至关重要。但是既往的研究大多是研究单一的危险因素与T2DM的关系,预测效能较差。列线图是一种直观的图形预测模型,近年来已被广泛开发,由于其能综合考虑多种危险因素,故经常作为一种新的工具来预测各种疾病的发生和预后[6]。准确估计T2DM发病率可以帮助高危人群及时采取干预措施,降低糖尿病相关的发病率和死亡率。本研究构建并验证了1个综合多个T2DM独立危险因素的列线图,以更好地评估受试者4年后T2DM发病率。
前瞻性队列研究。本研究是上海交通大学医学院附属瑞金医院牵头的中国2型糖尿病患者恶性肿瘤发生风险的流行病学研究(REACTION研究)[7]的一部分。在2011年12月至2012年4月对北京市石景山区苹果园社区年龄≥40岁的居民进行了第1次基线标准化问卷调查,在2015年4月至2015年10月进行了现场随访调查,随访时间为4年。2次调查均进行了标准化问卷调查、体格检查、生化指标及糖化血红蛋白(HbA1c)检测、75 g口服葡萄糖耐量试验(OGTT)。排除在第1次基线调查时患有糖尿病或高血压、数据资料不完整以及第2次现场随访调查失访的人群,最后共有8 058名受试者纳入研究。研究方案经上海交通大学医学院附属瑞金医院伦理委员会批准(批文号:2011-14),所有研究对象均签署知情同意书。
1.病史采集:对每名研究对象进行标准化的问卷调查,采集人口学资料、既往病史等情况。所有调查人员均经过统一培训。
2.体格检查:所有研究对象接受常规体格检查,包括身高、体重、腰围、臀围、静息状态血压(测量3次取平均值)、心率,均由经过统一培训的人员完成,使用同一台身高体重测量仪和标尺。测量时被测者脱去鞋子、帽子和厚重外套,立于木板台上,取立正姿势,身高精确到0.1 cm,体重测量精确到0.1 kg。体重指数(BMI)=体重(kg)/身高2(m2)。腰围以脐水平为测量位置,臀围为臀部向后最突出部位的水平围长,测量值精确到0.1 cm。腰臀比=腰围/臀围。
3.血压测定:研究对象静坐5 min后,用同一台电子血压计测量3次,每次间隔至少1 min,最后计算平均值纳入研究,高血压诊断标准:定义为收缩压≥140 mmHg(1 mmHg=0.133 kPa)和(或)舒张压≥90 mmHg以及既往有明确高血压病史[8]。
4.血糖、HbA1c测定及糖尿病诊断:研究对象在试验前一晚禁食8 h,于第2日清晨进行标准的75 g OGTT,抽取空腹以及服糖后2 h静脉血。采用葡萄糖氧化酶法测定空腹血糖(FPG)、餐后2 h血糖(2hPG);采用高效液相法(美国BIO-RAD公司)检测HbA1c。糖尿病诊断标准:FPG≥7.0 mmol/L或2hPG≥11.1 mmol/L,以及既往有明确的糖尿病史[9]。
5.血生化检测:留取空腹静脉血样,γ-谷氨酰转移酶(GGT)、丙氨酸转氨酶(ALT)和天冬氨酸转氨酶(AST)、甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)等生化指标由全自动生化分析仪(c16000型,美国雅培公司)检测。
6.分组:采用简单随机抽样方法,使用计算机生成随机数字,将纳入的受试者按照7∶3分成建模组和验证组。
所有数据均使用SPSS 23.0软件进行分析,并使用R版本3.6.3中的rms软件包,基于多因素预测模型生成列线图(
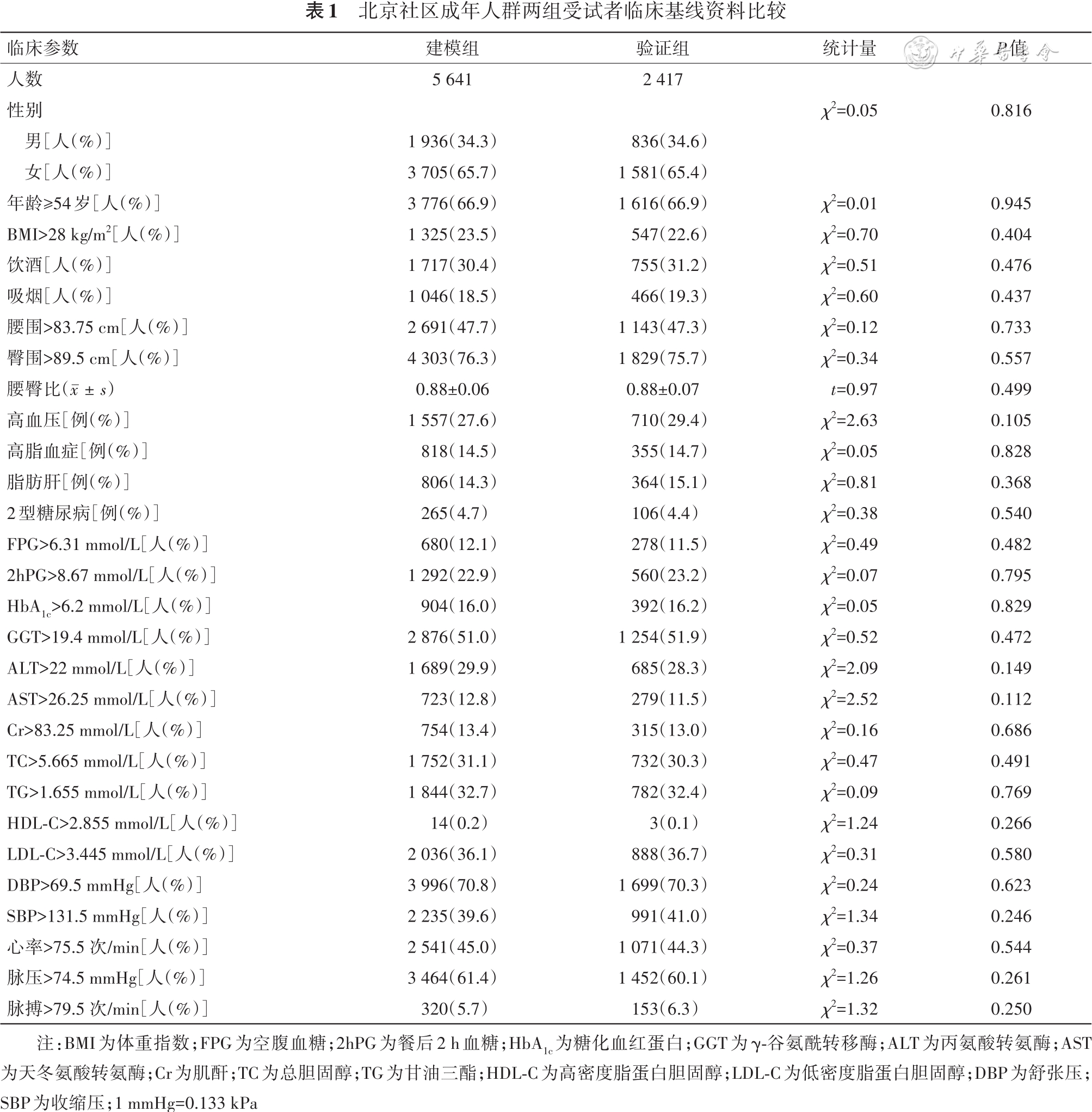
共纳入8 058名基线检查时无T2DM的受试者,分为建模组5 641名,验证组2 417名,随访4年时建模组和验证组分别有265例和106例发生T2DM。建模组和验证组的基线特征如
如
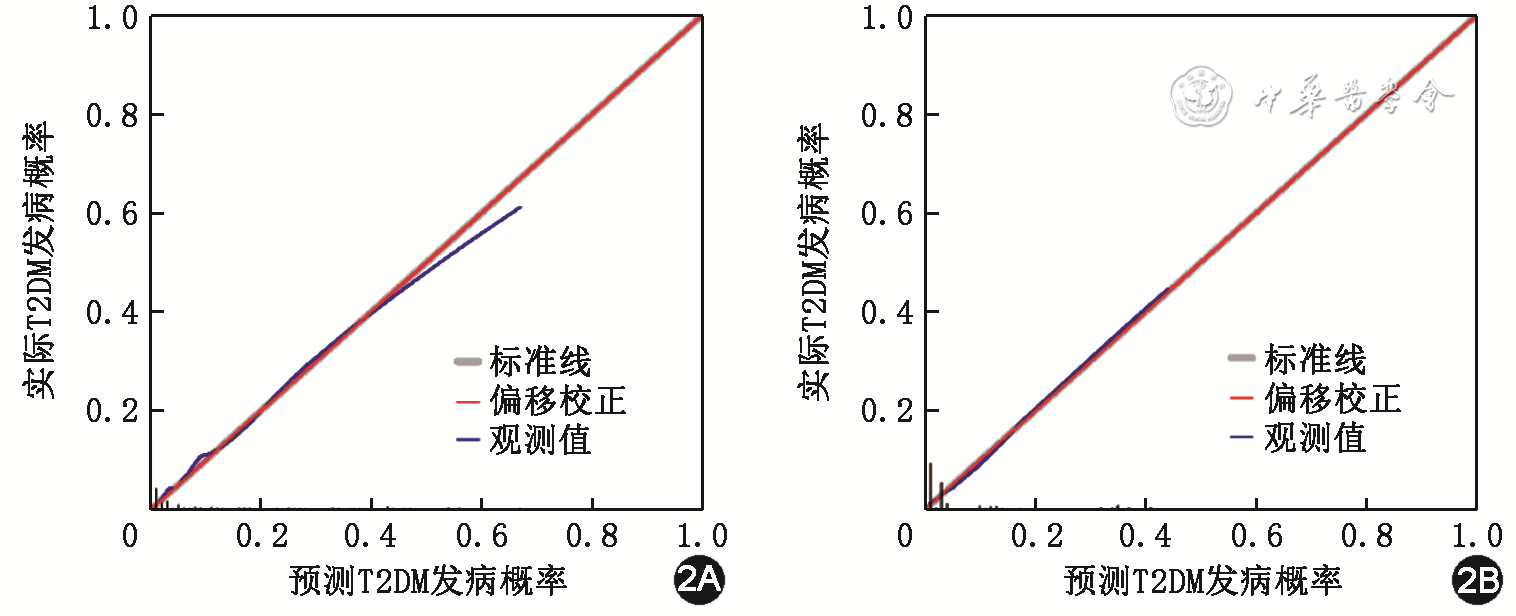
本研究构建了一个基于大规模北京社区人群T2DM调查研究的列线图。既往研究也建立了T2DM发病风险预测模型,但很少是基于亚裔群体,尤其是中国人群[10]。既往的研究一般是分析单一的危险因素和T2DM发病率的关系,但是多种危险因素一起,其发病风险往往互相影响。列线图由于能够给每个危险因素评分,根据评分的结果综合、定量评估多种因素与疾病诊断或预后的关系,故其预测效能要高于其他模型。此外,因为大多数已报道的研究是横断面研究,所以无法准确预测T2DM的未来发展。本研究构建的列线图在建模组和验证组中C指数分别为0.906(95%CI 0.888~0.925)和0.844(95%CI 0.796~0.892),在验证组中的令人满意的结果表明本列线图预测模型具有良好的预测性和可推广性。
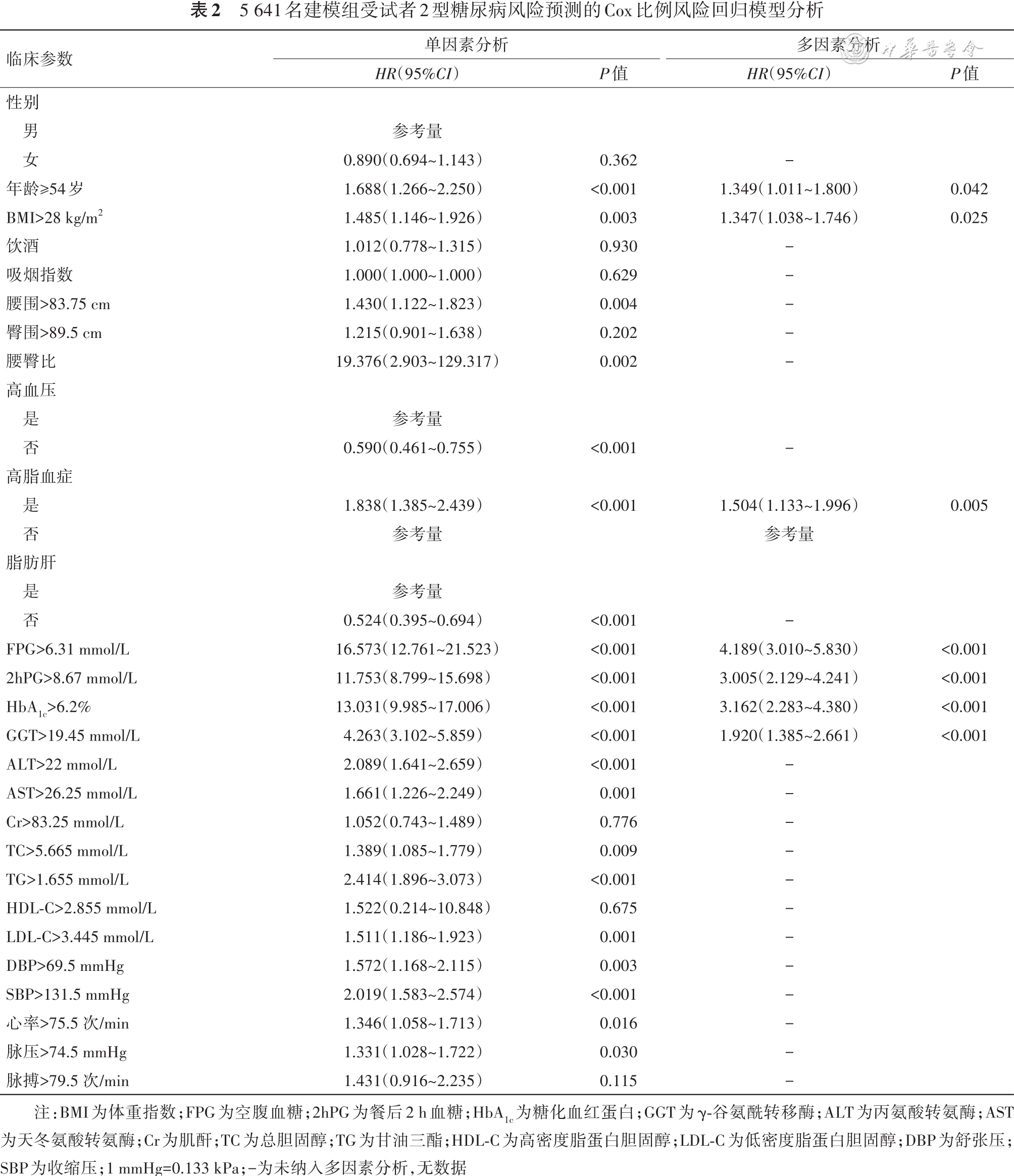
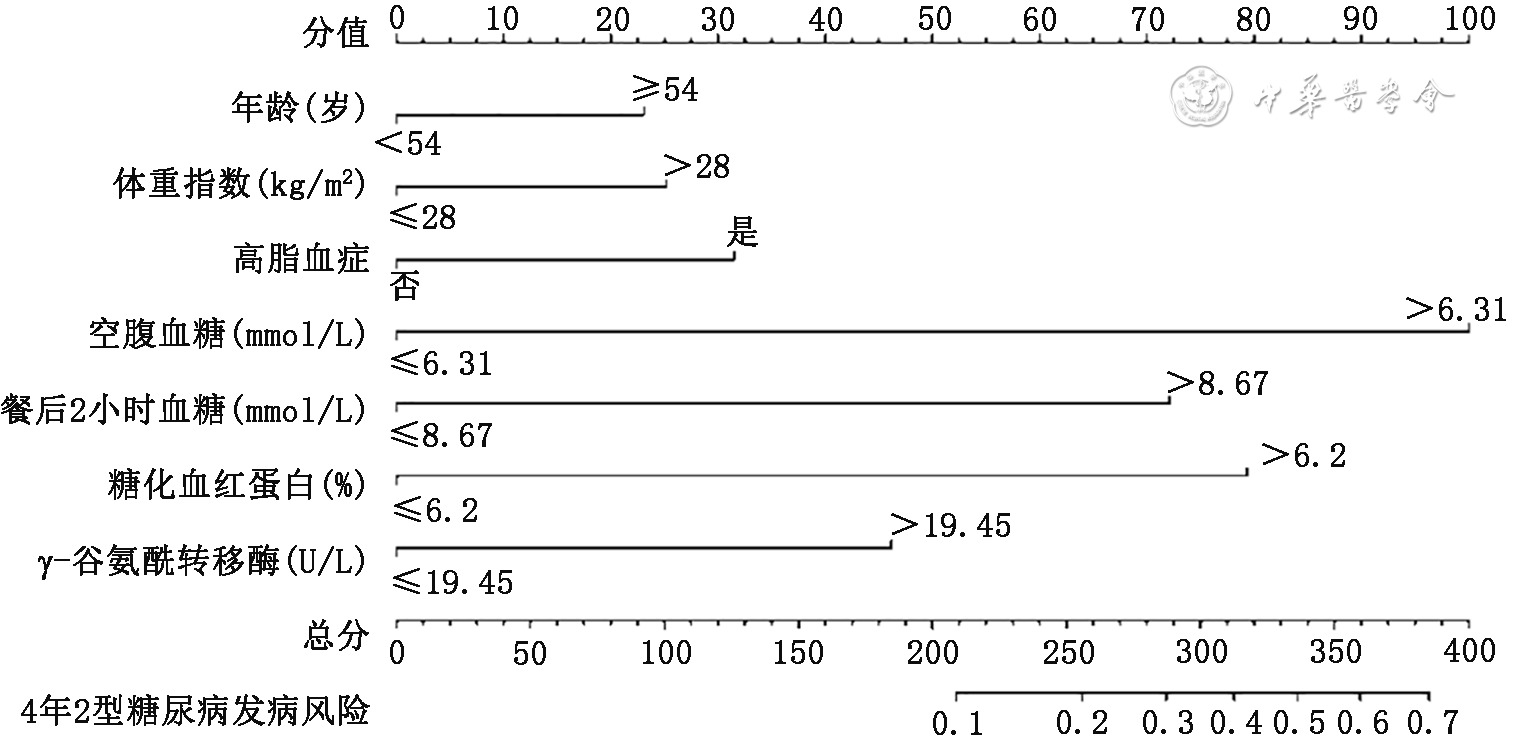
本研究列线图预测模型包括年龄、BMI、高脂血症、FPG、2hPG、HbA1c和GGT,这些被确定为T2DM危险因素的变量,与之前发表的研究结果契合。T2DM通常发生在成年人,更常见于老年人。衰老的β细胞表现为较低的葡萄糖反应性和葡萄糖敏感性,衰老可能会影响胰岛的基因表达和胰岛素分泌[11],这些会导致高血糖和T2DM。本研究发现,年龄≥54岁的人患T2DM的风险是年龄<54岁的人的1.349倍,所以年龄≥54岁的人应更加注重对T2DM的预防。BMI>28 kg/m2也是T2DM发病的主要危险因素之一。众所周知,T2DM通常与超重和肥胖个体有关。大多数胰岛素抵抗患者超重或肥胖,肥胖引起的代谢紊乱、脂肪器官功能障碍和脂肪代谢过程的改变在胰岛素抵抗中起着基础性作用,能量过剩通过抑制肥胖患者的腺苷一磷酸活化蛋白激酶信号通路诱导胰岛素抵抗[12],进而导致T2DM的发生。
血脂异常也是公认的T2DM风险因素。TG本身可能直接导致糖代谢紊乱[13],HDL可以通过保护β细胞免受胆固醇诱导的β细胞功能障碍、应激诱导的凋亡和胰岛炎症的影响,从而增加胰岛素分泌[14]。低水平的HDL-C可能会加剧异常的葡萄糖稳态[15]。相反,氧化LDL-C可以抑制葡萄糖刺激的胰岛素分泌,甚至导致β细胞凋亡[15]。这些因素异常都会导致高脂血症,进而加大T2DM的发病风险。在本研究中,高脂血症患者患有T2DM的风险更高。
肝脏是葡萄糖代谢和调节的主要器官。GGT常被用作肝功能的生物标志。GGT是一种转移酶,催化γ-谷氨酰官能团从谷胱甘肽转移到其他受体以调节氧化还原状态,其在T2DM的发病机制中发挥作用[16]。一项横断面研究显示,GGT与糖尿病之间存在持续的正相关性,且无阈值效应[17]。而在一项Meta分析中显示GGT以非线性剂量反应模式增加了T2DM的风险[18]。本研究结果也证明GGT与T2DM之间存在相关性。此外,本研究结果表明当FPG>6.31 mmol/L时,其4年患T2DM的风险是FPG≤6.31 mmol/L的4.189倍;当2hPG>8.67 mmol/L时,其4年患T2DM的风险是FPG≤8.67 mmol/L的3.005倍;当HbA1c>6.2%时,其4年患T2DM的风险是HbA1c≤6.2%的3.162倍。这提示了可以用来预测4年T2DM发病情况的HbA1c、FPG和2hPG临界值。
尽管列线图在建模组和验证组中的C指数及校准曲线结果良好,但本研究仍有一些局限性。首先,本研究是对北京市石景山区以及苹果园社区≥40岁的居民进行的调查,从区域还是年龄来说均不足以代表整个北京成年人群体,此外有限的样本量仍然是实现更有效统计分析的一个问题。建议此列线图需要在扩大患者队列的进一步研究中进行验证。其次,其他因素也可能影响预后,需要进一步研究评估其他预后因素。最后,本研究基于单个机构的数据,需要通过多中心研究进一步验证。
综上所述,本研究结果表明年龄、BMI、高脂血症、FPG、2hPG、HbA1c和GGT都是T2DM的独立危险因素,建立的列线图来预测个体T2DM的发病风险,显示了很高的预测准确性,这种应用有助于及时干预,以降低T2DM的发病率。
[1]
[2]
[3]
[4]
[5]
[6]
[7]
[8]
[9]
[10]
[11]
[12]
[13]
[14]
[15]
[16]
[17]
[18]
