多发性大动脉炎患者血浆外泌体携带的差异微小RNA和蛋白表达谱分析
2023年1月
中华内科杂志,第62卷第1期 第61页-第69页
黄碧青,李菁,田新平,曾小峰
多发性大动脉炎(TAK)是一种少见的大血管炎,主要累及主动脉及其一级分支,亚洲育龄女性好发,临床常表现为颈动脉压痛、跛行、眼部疾患(包括视力减退、复视、视网膜血管炎等)、中枢神经系统异常和脉搏减弱[1]。TAK病因未明,可能与遗传因素、感染、性激素和免疫等有关[1]。外泌体是细胞外囊泡的一种亚型,直径30~150 nm,存在于血液、尿液、脑脊液等各种体液中,其可通过携带的蛋白质、脂质、核酸等生物大分子参与细胞间交流,对受体细胞的生物学特性进行调控,包括炎症、自身免疫反应、内皮功能障碍/损伤、促凝血、血管生成和内膜增生等与血管炎有关的病理机制,从而影响细胞的生理活动[2]。由于外泌体携带物质的种类和数量可能与患者的疾病状态有关,因此外泌体有望作为疾病诊断的标志物。本研究通过检测TAK患者血浆外泌体携带的微小RNA和蛋白,初步探究其能否作为TAK的生物标志物及TAK的发病机制。
1.选2020年6月至11月北京协和医院风湿免疫科确诊的10例TAK初治患者,男性2例,女性8例,中位发病年龄27(16~44)岁。TAK患者纳入标准:(1)符合1990年美国风湿病学会制定的TAK分类标准;(2)未接受糖皮质激素或免疫抑制剂治疗者。排除标准:乙型肝炎病毒和艾滋病病毒感染者。
2.另选同期健康对照者5例,男性1例,女性4例,中位年龄24(22~26)岁,与TAK患者的年龄匹配,差异无统计学意义(P>0.05),无风湿病史。
3.本研究方案符合北京协和医院伦理学要求(批文号:S-478),已获得患者的知情同意。
1.外泌体的分离和鉴定:(1)采集两者外周血10 ml,4 ℃、800× g离心10 min,取上清4 ℃、3 000× g离心15 min获取血浆。(2)将血浆过滤、稀释,通过外泌体纯化试剂盒排阻柱纯化,收集目的馏分。(3)超滤法用于提取微小RNA:目的馏分通过截留相对分子质量为100 000的超滤管(Amicon?)获得外泌体。超离法用于提取蛋白:将目的馏分于4 ℃、100 000× g离心2 h获得外泌体颗粒。重复上述操作1次,最后加100 μl磷酸盐缓冲液(PBS)重悬颗粒获得外泌体。通过透射电镜观察外泌体形态,纳米颗粒追踪分析技术检测外泌体直径大小,蛋白印迹法检测外泌体蛋白。
2.外泌体微小RNA测序和生物信息学分析:采用微小RNA提取试剂盒(miRNeasy? Mini Kit)分离出外泌体总RNA,评估RNA的浓度和纯度。在高通量测序平台(Illumina Hiseq)进行双端测序,对测序数据进行处理。
(1)筛选差异表达微小RNA及靶基因预测:通过R语言的测序计数数据差异分析软件包(edgeR),基于差异表达倍数≥1.5、P≤0.05,且平均表达量高于10作为筛选标准,筛选差异表达微小RNA。通过人类微小RNA靶基因数据库(miRDIP)对差异表达微小RNA的靶基因进行预测,设置分数≥0.9,分值等级为非常高,搜索微小RNA与靶基因有关记录的数据库≥15(结合多个微小RNA数据库验证不同算法算出的微小RNA靶基因是否一致)为该微小RNA的靶基因。
(2)差异表达微小RNA的靶基因的功能和信号通路富集分析:分别通过基因本体及京都基因和基因组百科全书(KEGG)数据库的信息,对差异表达微小RNA的靶基因进行基因本体功能注释和KEGG信号通路富集分析,以获取与TAK相关的分子和信号通路。
(3)血浆外泌体中与TAK相关的微小RNA的鉴定:以“Takayasus arteritis”为关键词,在比较毒理基因组学数据库(CTD数据库)、疾病相关基因数据库(DisGeNET数据库)、美国国家生物技术信息中心的全部已测序物种的基因信息数据库(GENE数据库)和人类基因综合数据库(GeneCards数据库)进行检索,物种限定为人类,获得关于TAK的基因,对4个数据库取交集分析,鉴定血浆外泌体中与TAK相关的微小RNA。
3.外泌体蛋白质谱分析和生物信息学分析:提取外泌体总蛋白,并进行质量检测。通过UniProt蛋白质数据库检索蛋白质谱检测的原始数据。使用Proteome Discoverer 2.2软件对蛋白质酶解肽段进行质谱分析。
(1)筛选差异表达蛋白:通过R语言的差异分析软件包(limma),基于差异表达倍数≥1.5、P≤0.05作为筛选标准,筛选差异表达蛋白。分别通过基因本体、KEGG数据库、蛋白质结构域家族数据库(Pfam数据库)对差异表达蛋白进行功能、信号通路和结构域富集分析。通过蛋白质相互作用分析数据库(String数据库)及网络可视化及分析软件(Cytoscape)构建差异表达蛋白的相互作用网络图。
(2)血浆外泌体中与TAK相关的重要蛋白的鉴定:以“Takayasus arteritis”为关键词,在CTD数据库、DisGeNET数据库、GENE数据库和GeneCards数据库中筛选与TAK有关的基因,并与差异表达蛋白取交集分析,构建花瓣图,鉴定血浆外泌体中与TAK相关的蛋白。在CTD数据库中搜索并下载有关TAK基因-化学物质关系数据,通过网络可视化及分析软件(cytoscape)构建TAK-蛋白-药物关联网络图。
采用SPSS 25.0软件进行统计学分析,计量资料通过Kolmogorov-Smirnov test检验正态分布,正态分布连续变量以
10例TAK患者均出现血管造影异常,表现为主动脉一级分支或上下肢近端的大动脉狭窄或闭塞。7例患者出现全身症状(包括低热、乏力、体重下降>2 kg),7例患者出现双侧上肢血压差>10 mmHg(1 mmHg=0.133 kPa),4例患者出现高血压,4例患者出现血管杂音,3例患者出现神经系统症状,3例患者出现颈动脉压痛,2例患者出现脉搏减弱或消失,2例患者出现肢体跛行。10例患者红细胞沉降率为(55.10±46.12) mm/1h,超敏C反应蛋白为(36.95±43.70) mg/L,肿瘤坏死因子(TNF)α为(6.58±2.42) ng/L,白细胞介素(IL)6为(11.18±15.86) ng/L。
透射电镜可见清晰的杯状囊泡,直径30~150 nm(
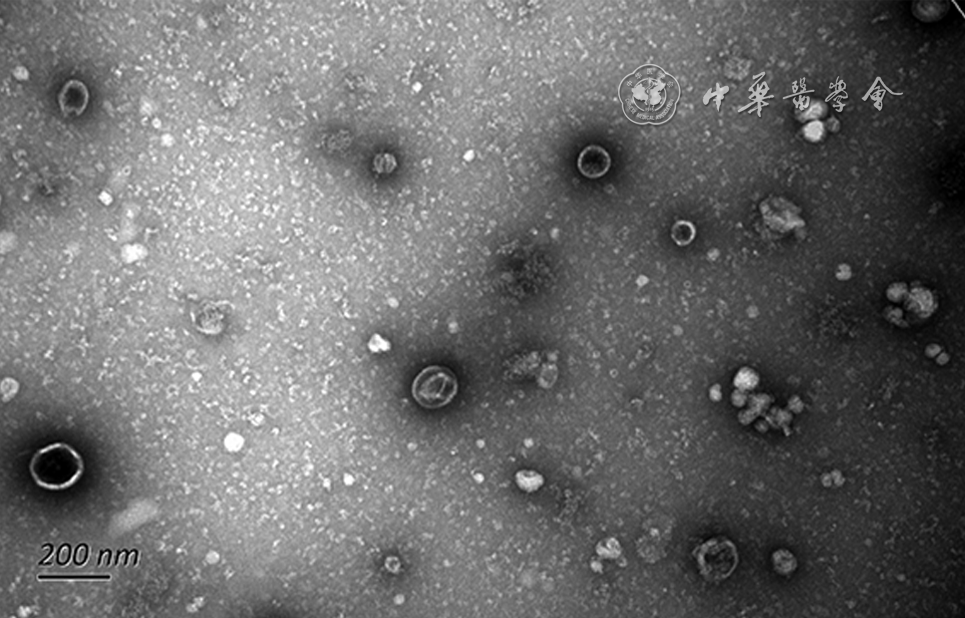
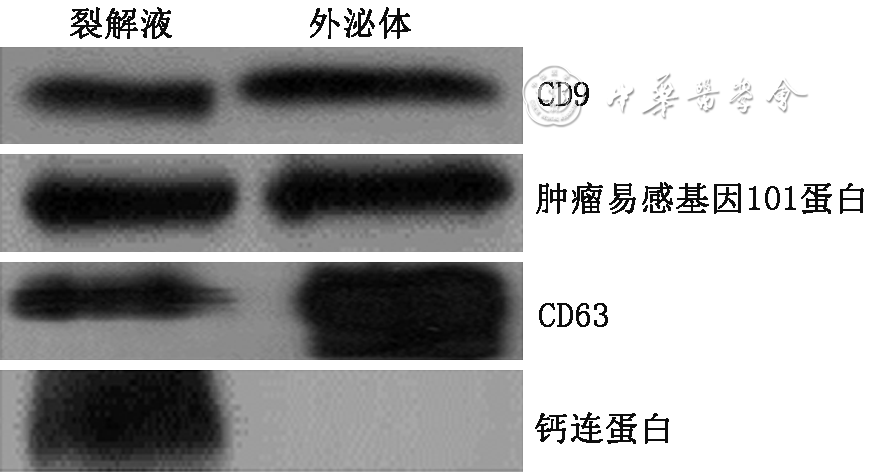
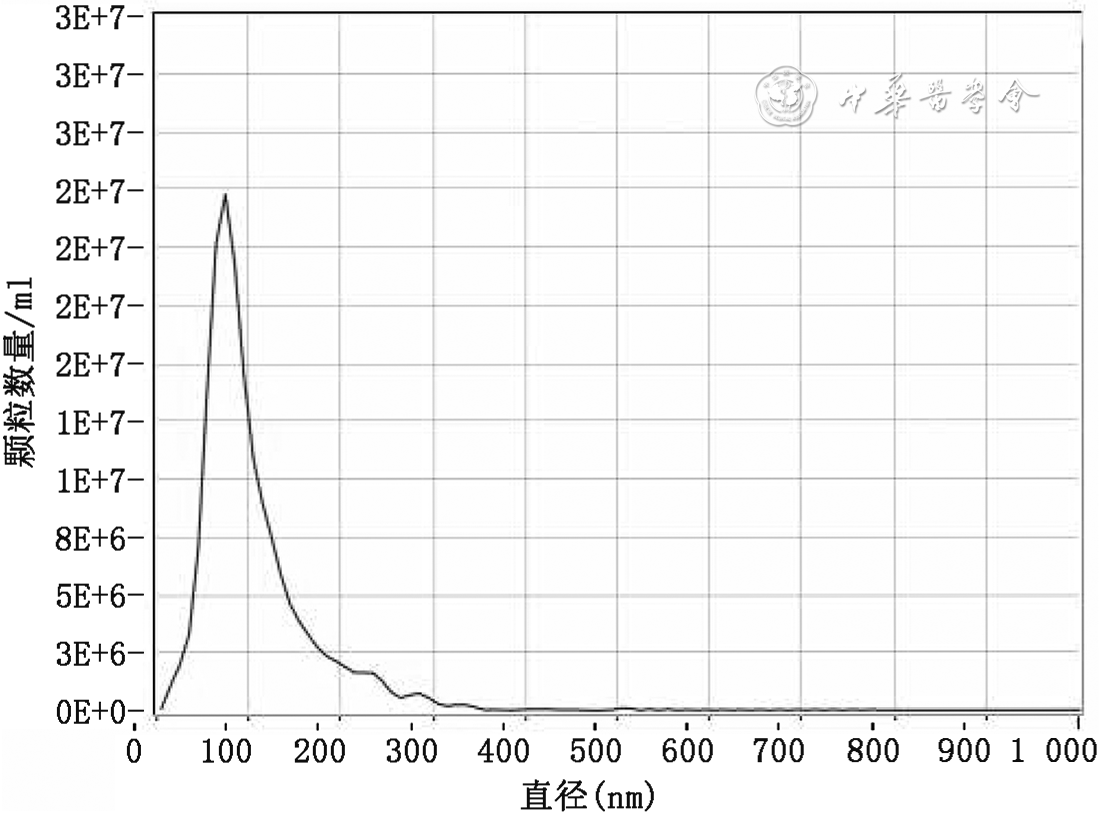
所有样本的外泌体RNA纯度满足OD260/280介于1.8~2.2,RNA浓度≥300 pg/μl,Ct(微小RNA-130b) ≤23,16S阴性,质量控制均合格,满足后续建库要求。所有样本的外泌体蛋白浓度满足>400 pg/μl,总量>100 μg,质量控制均合格,满足后续实验要求。
1.差异表达微小RNA的筛选:与健康对照者比,TAK患者血浆外泌体中差异表达微小RNA 29个,其中miR-101-3p、miR-122-5p、miR-143-3p、miR-185-3p、miR-192-5p、miR-194-5p、miR-19a-3p、miR-19b-3p、miR-20b-5p、miR-21-5p、miR-22-3p、miR-335-5p、miR-34a-5p、miR-3613-5p、miR-548ad-5p、miR-590-3p、miR-7-5p表达上调,miR-1249-3p、miR-141-3p、miR-199a-5p、miR-199b-5p、miR-200a-3p、miR-200c-3p、miR-204-5p、miR-29c-5p、miR-335-3p、miR-381-3p、miR-4433b-5p、miR-584-5p表达下调。
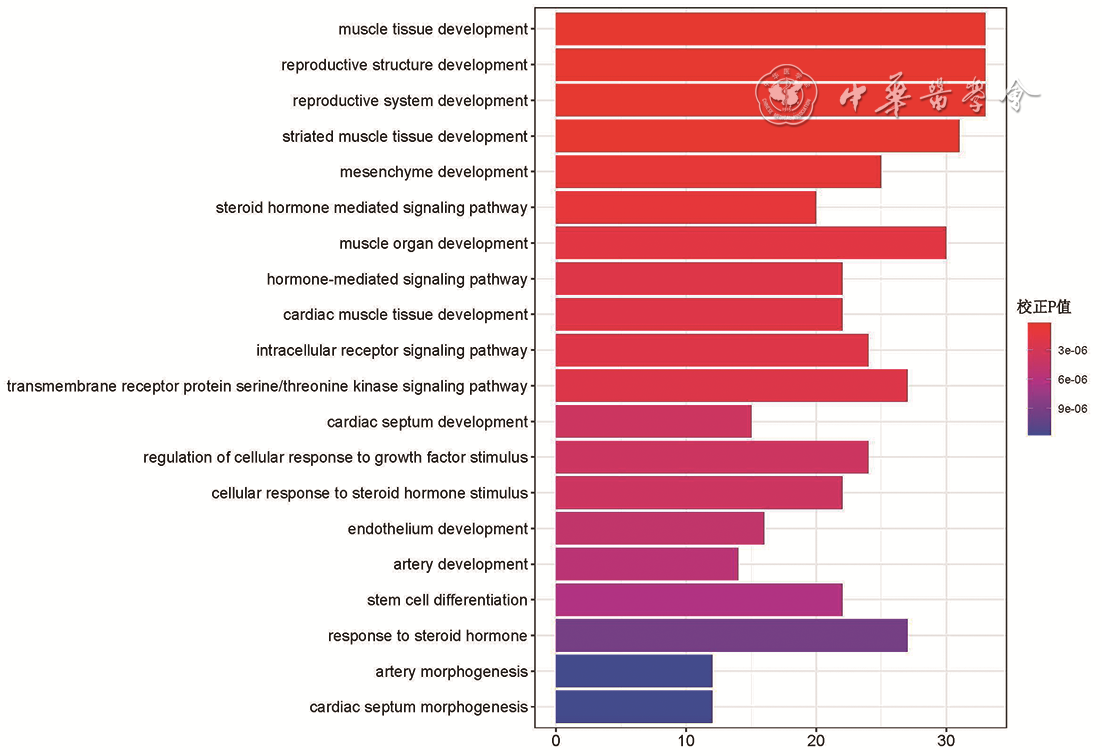
2.差异表达微小RNA的靶基因预测及基因本体和KEGG富集分析:基于差异表达微小RNA的靶基因筛选标准,共筛选出17个差异表达微小RNA,对应631个靶基因。对差异表达微小RNA的靶基因进行功能注释,结果显示,差异表达微小RNA的靶基因主要与肌肉组织发育、生殖系统发育、激素介导的信号通路等生物过程有关(
对差异表达微小RNA的靶基因进行信号通路富集分析可见,差异表达微小RNA的靶基因主要与自噬调节、细胞内非受体酪氨酸激酶家族-信号转导因子和转录激活因子(JAK-STAT)信号通路、细胞黏附分子相关信号通路、细胞因子及其受体相互作用信号通路、炎症性肠病等有关(
3.血浆外泌体中与TAK相关的微小RNA的鉴定:比较CTD数据库、DisGeNET数据库、GENE数据库和GeneCards数据库皆收录的与TAK相关的基因分别为TNF、IL-6、IL-10、髓样分化因子88(MYD88)、Max样蛋白X(MLX)、核糖体蛋白S9(RPS-9)、人类白细胞抗原A(HLA-A)、碱性成纤维细胞生长因子2(FGF-2)、基质金属蛋白酶2(MMP-2),是TAK的重要基因,与差异表达微小RNA靶基因交集的为FGF-2、IL-10、TNF、MMP-2、RPS-9、MLX、HLA-A,最终筛选出血浆外泌体携带的miR-21-5p、miR-200c-3p、miR-34a-5p、miR-22-3p、miR-143-3p可能参与TAK的发病机制。
1.差异表达蛋白的筛选:与健康对照者比,TAK患者血浆外泌体中差异表达蛋白357个,其中236个表达上调,121个表达下调。
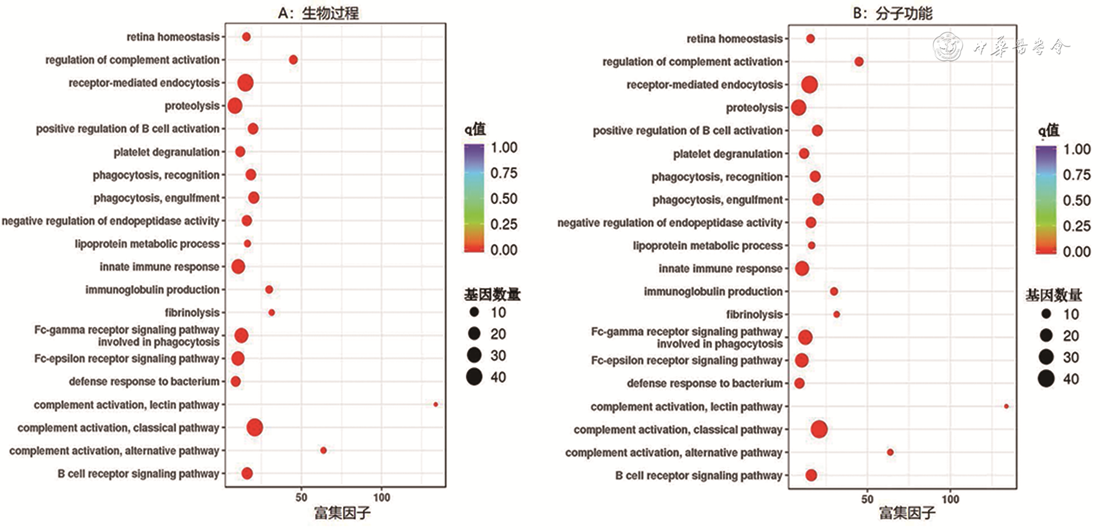
2.差异表达蛋白的功能、信号通路和结构域富集分析:差异表达蛋白的功能富集分析见
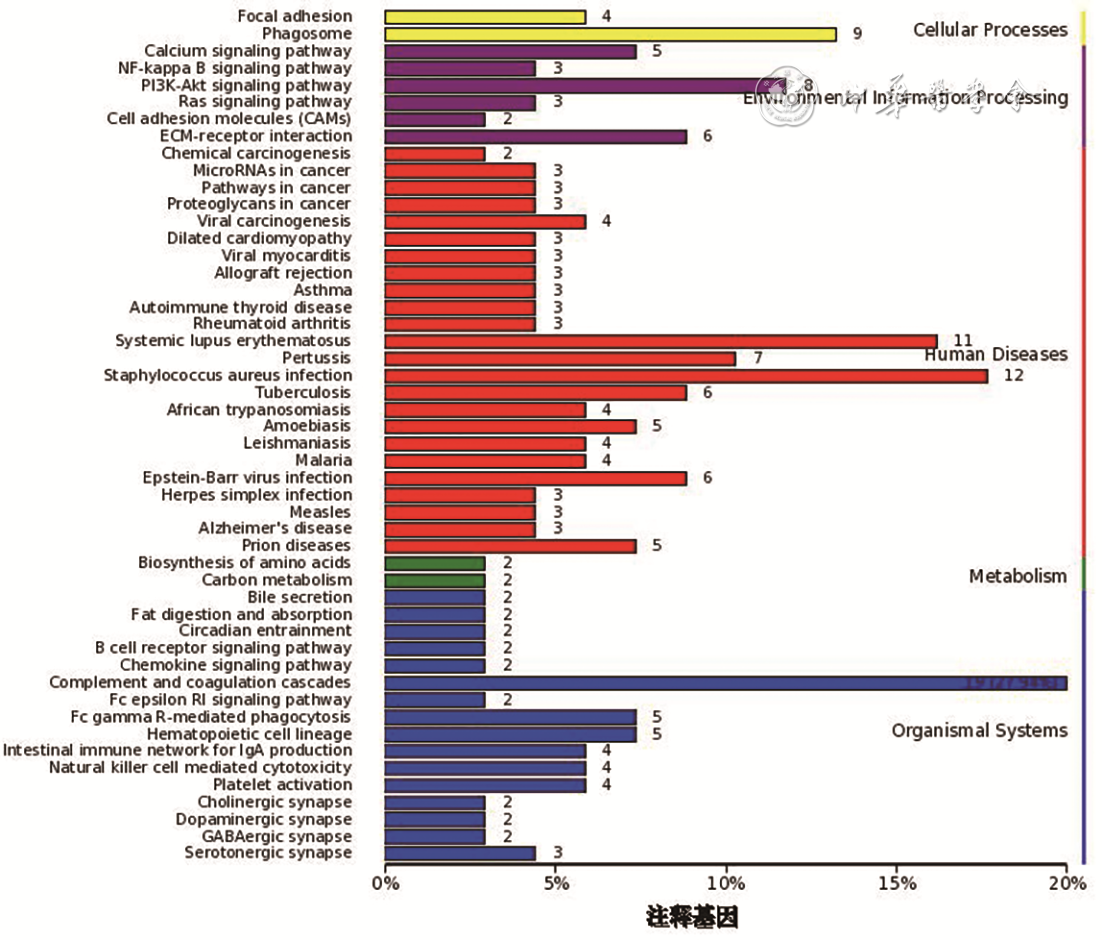
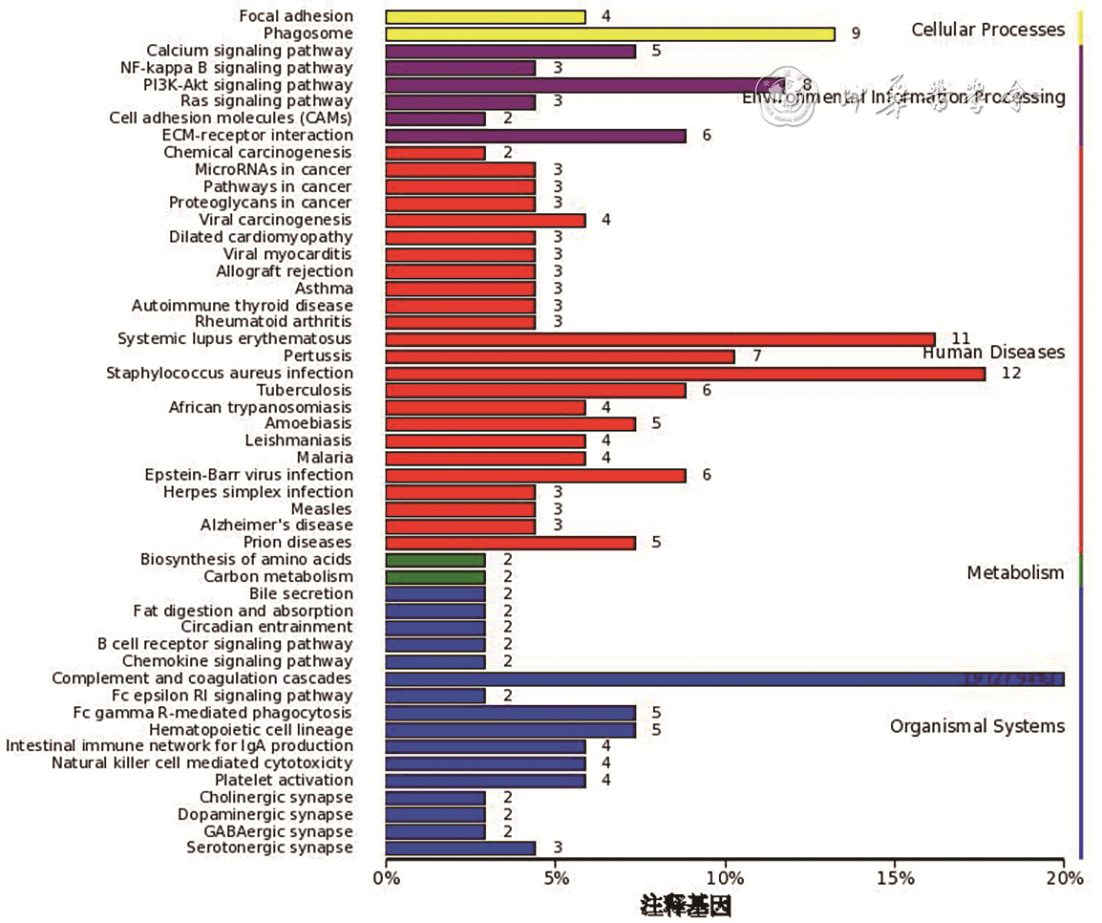
差异表达蛋白信号通路富集分析见
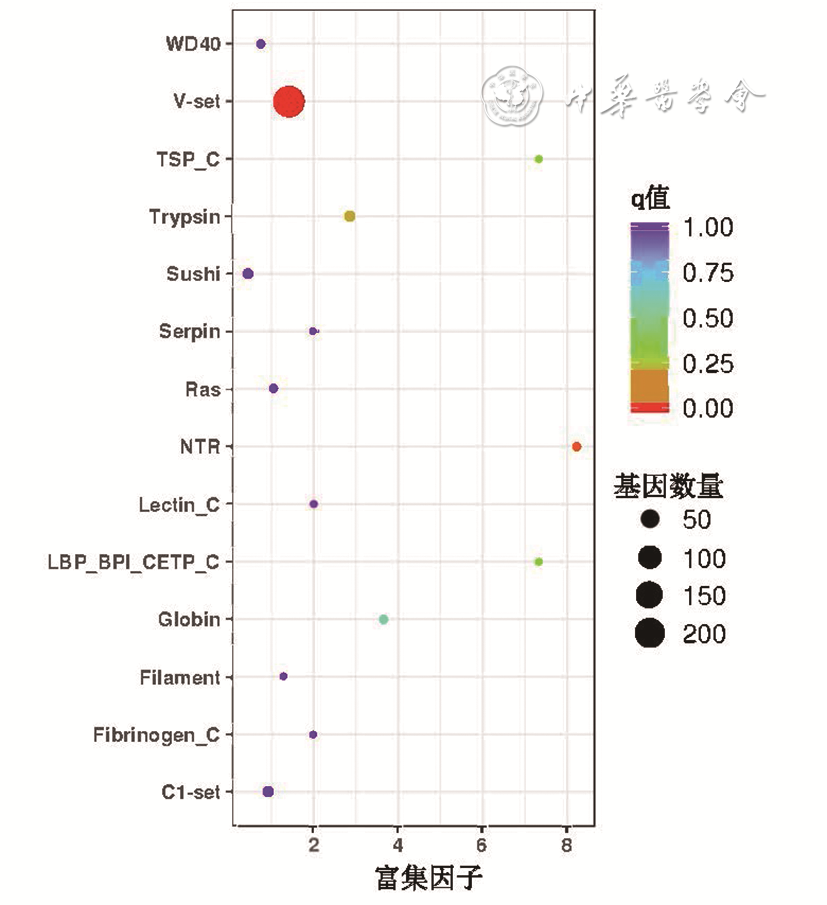
差异表达蛋白结构域富集分析可以预测功能未知的蛋白,结构域富集图见
3.蛋白-蛋白相互作用网络的构建及瓶颈(Hub)蛋白鉴定:通过蛋白质相互作用分析数据库(string)及网络可视化及分析软件(cytoscape)构建差异表达蛋白的相互作用网络图(
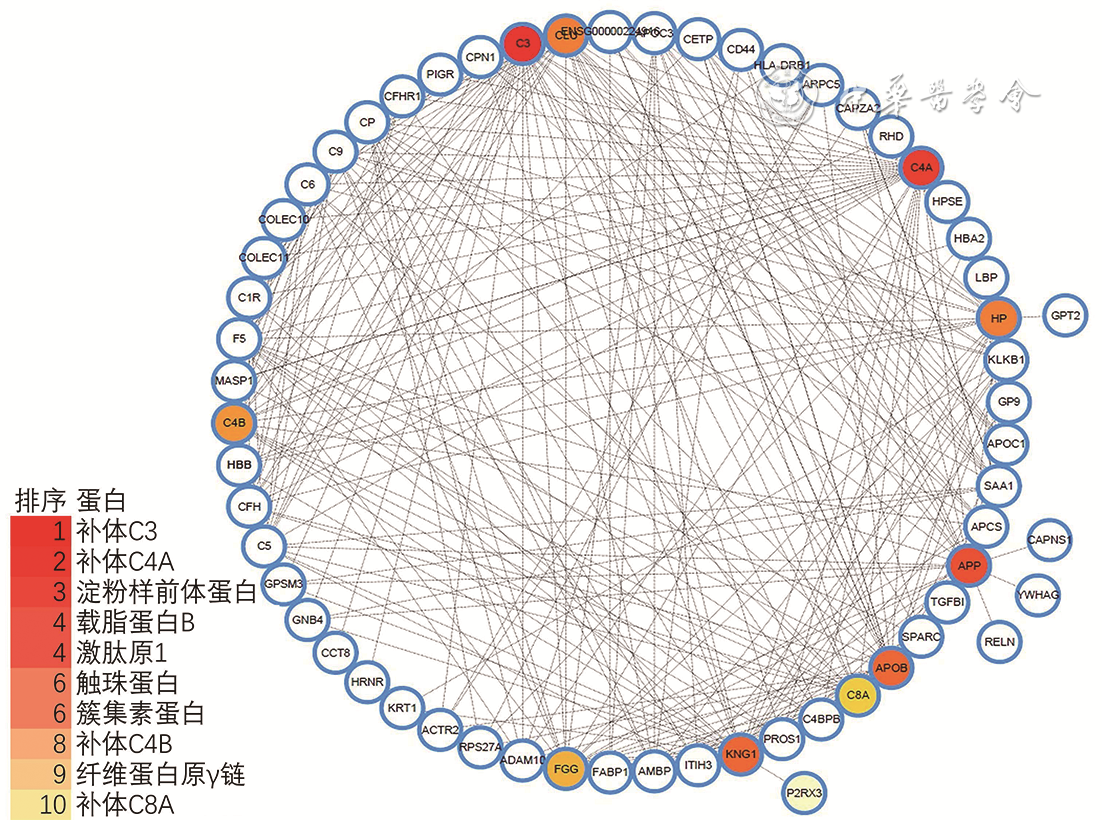
每个圈代表一个蛋白,颜色梯度由红色至橙色代表节点度由大至小
4.血浆外泌体中与TAK相关的重要蛋白的鉴定:比较CTD数据库、DisGeNET数据库、GENE数据库和GeneCards数据库中收录的与TAK相关的基因,与差异表达蛋白对应的基因的交集20个。目前比较CTD数据库中收录的关于治疗大动脉炎的药物有来氟米特、羟氯喹(
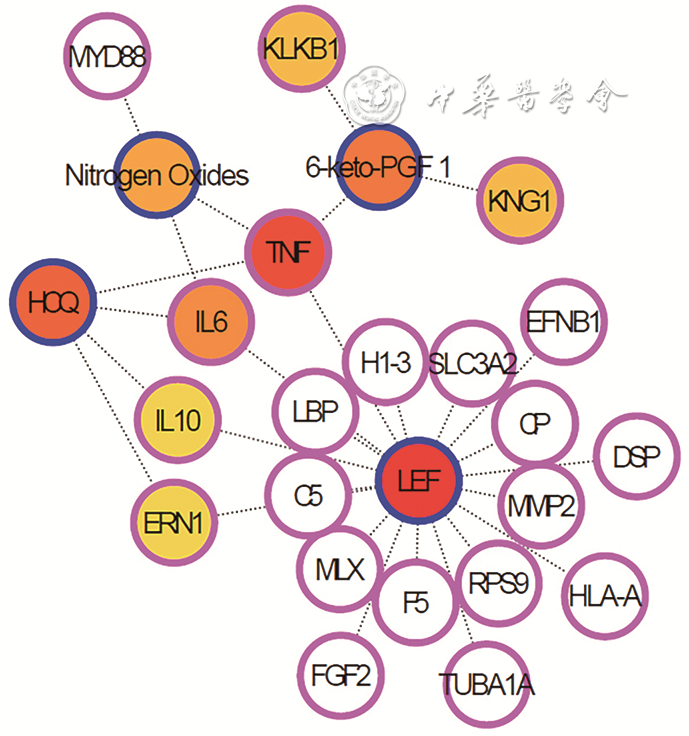
粉红色圈代表基因,蓝色圈代表化学物质,颜色梯度由红色至橙色代表节点度由大至小;LEF为来氟米特;HCQ为羟氯喹;6-keto-PGF 1为6-酮前列腺素F1α;Nitrogen Oxides为氮氧化物;KLKB1为前激肽释放酶;KNG1为激肽原1;DSP为桥粒蛋白;TNF为肿瘤坏死因子;IL为白细胞介素;ERN1为内质网核心信号1;C5为补体C5;CP为铜蓝蛋白;EFNB1为肝配蛋白B1;F5为凝血因子Ⅴ;FGF2为碱性成纤维细胞生长因子2;H1-3为H1组蛋白成员3;HLA-A为人类白细胞抗原A;LBP为脂多糖结合蛋白;MLX为Max样蛋白X;MMP?2为基质金属蛋白酶2;RPS9为核糖体蛋白S9;SLC3A2为Ⅱ型膜蛋白;TUBA1A为微管蛋白α1A;MYD88为髓样分化因子88
结合多个数据库收录的关于TAK的重要基因或蛋白,血浆外泌体差异表达蛋白构建的相互作用网络图,基于节点度排名前10的蛋白,比较CTD数据库中与大动脉炎有关的药物-基因关联分析,最终筛选出血浆外泌体携带的前激肽释放酶、激肽原1、桥粒蛋白可能参与TAK的发病机制,具有作为TAK生物标志物的潜能。
本研究通过微小RNA测序技术、蛋白质谱分析技术、生物信息学方法,并依据差异表达微小RNA、差异表达蛋白在血管炎中的重要性,筛选出血浆外泌体携带的miR-34a-5p、miR-200c-3p、miR-143-3p、miR-22-3p、miR-21-5p、前激肽释放酶、激肽原1、桥粒蛋白可能参与了TAK的发病机制,具有作为TAK生物标志物的潜能。与健康对照者比,初治TAK患者血浆外泌体携带miR-200c-3p表达下调,miR-34a-5p、miR-143-3p、miR-22-3p、miR-21-5p、前激肽释放酶、激肽原1、桥粒蛋白表达上调。
miR-34a-5p是血管功能的重要调节剂,参与内皮细胞的分化、增殖和血管生成等过程,在血管相关性疾病中具有重要作用。内皮细胞中miR-34a-5p过度表达会加剧内皮细胞障碍、炎症和血管损伤,该过程与沉默信息调节因子1(Sirtuin-1)表达减少及内皮细胞中p53表达增加有关[3]。具体机制可能是miR-34a-5p导致p53和B淋巴细胞瘤-2基因相关蛋白X(Bax)易位至线粒体区室,破坏线粒体膜电位,将细胞色素C释放至细胞质中,启动线粒体介导的内皮细胞凋亡级联反应[3]。miR-34a-5p过表达亦通过抑制叉头盒蛋白M1(FoxIM1)表达,从而抑制细胞活力和血管生成活性、促进细胞凋亡及炎症因子的产生,并抑制核红细胞2(NRF2)相关因子2/血红素氧合酶1(HO-1)通路加重脂多糖诱导血管内皮细胞损伤[4]。miR-34a-5p在调节血管生理中的重要作用,表明其具有作为血管性疾病生物标志物的潜在价值。已有研究发现,miR-34a-5p在抗中性粒细胞胞质抗体(ANCA)相关性血管炎患者血浆[5]中表达上调,可作为ANCA相关性血管炎的诊断标志物。
miR-200c-3p在调节血管内皮细胞生理过程中具有重要作用,可通过靶向Notch信号通路抑制血管内皮细胞增殖[6];靶向锌指E盒结合同源异型盒2 (ZEB2)抑制血管紧张素Ⅱ诱导肾动脉内皮细胞增殖和迁移[7]。另外,miR-200c-3p抑制Fermitin家族成员2(FERM2)促进内皮-间充质转化及新生内膜增生[8],这些机制为通过调控miR-200c-3p/FERM2信号轴治疗血管疾病提供了新策略。miR-200c-3p在炎症性疾病及自身免疫病的发病机制中亦具有重要作用。miR-200c-3p通过调节炎症反应参与川崎病的发病机制[9],是狼疮肾炎的诊断标志物[10]。
miR-143-3p在多种血管疾病中表达异常,可能参与了血管生理、炎症反应及自身免疫反应等过程。有研究发现,miR-143-3p在升主动脉瘤、胸主动脉瘤、肺动脉高压等血管疾病的动脉组织中表达上调[11]。其可能是通过抑制自噬相关蛋白2B(ATG2B)表达促进内皮祖细胞的活力、迁移、侵袭和血管生成[12];通过抑制胶原蛋白V-α2的生物合成促进细胞外基质重组,参与血管重塑[13];其过表达可诱导血管平滑肌细胞增殖和迁移[14],而抑制miR-143-3p表达可减轻股动脉结扎术诱导的小鼠肺动脉高压[13]。
miR-22-3p在调节血管生理过程中具有重要作用,miR-22-3p通过调节单剪同源异形盒1(ONECUT1)/血管内皮生长因子A信号通路抑制内皮祖细胞增殖和迁移[15];靶向高迁移率族蛋白B1抑制人动脉血管平滑肌细胞增殖和迁移[16];抑制人脐静脉内皮细胞中血管内皮细胞钙黏蛋白5增强血管通透性[17];亦可通过下调血管生成抑制蛋白(vasohibin-1)表达促进新内膜形成增加,同时伴随外膜血管生成、外膜巨噬细胞积累和中/新内膜增殖细胞增加[18]。血管生成抑制蛋白是一种由内皮细胞合成的血管生成抑制因子,可以增加内皮细胞的应激耐受性,该功能对维持血管完整性至关重要[18]。miR-22-3p亦参与调节多种免疫细胞的功能和炎症反应,通过抑制单核细胞线粒体凋亡途径增加单核细胞存活率[19];通过抑制核苷酸寡聚化结构域(NOD)样受体热蛋白结构域相关蛋白3(NLRP3)减轻炎症反应[20]。靶向miR-22-3p为治疗TAK提供了一种潜在策略。
miR-21-5p在调节血管生理和血管重塑中具有重要作用,可通过抑制血小板反应蛋白的表达,促进内皮细胞增殖、迁移和血管形成能力[21];通过抑制激活蛋白的表达,促进人主动脉血管平滑肌细胞增殖和迁移等过程,从而参与血管生成[22]。miR-21-5p亦具有调节多种免疫细胞的功能,可通过调节IL-2信号通路影响T细胞活化,抑制程序性细胞死亡因子4(PDCD4)表达调节T细胞反应,或作为Toll样受体8(TLR8)的内源性配体,激活先天性免疫途径[23];通过抑制信号转导因子和转录激活因子3(STAT3)表达和激活,促进信号转导因子和转录激活因子5(STAT5)/磷酸化信号转导因子和转录激活因子5(pSTAT5)蛋白和叉头盒蛋白P3(Foxp3) mRNA表达,调节辅助性T淋巴细胞17和调节性T细胞,具有作为T细胞分化和稳态的新型调节剂的潜能[24];通过抑制IL-6受体/STAT3信号通路,降低单核巨噬细胞(RAW264.7细胞)凋亡水平[25],靶向miR-21-5p可能是一种有价值的治疗TAK的策略。
KLKB1是一种丝氨酸蛋白酶,可通过切割血管平滑肌细胞中的蛋白酶激活受体,调节表皮生长因子受体的表达,参与血管反应[26]。有研究发现,KLKB1与1型糖尿病患者的颈内动脉内中膜厚度呈正相关,是糖尿病增殖性玻璃体视网膜病变的危险因素:糖尿病性黄斑水肿患者玻璃体液中KLKB1表达增加,可独立于血管内皮生长因子导致视网膜增厚和视网膜血管通透性增加,亦可介导TNF-α和血管内皮生长因子诱导的视网膜血管通透性增加、血管舒张和视网膜增厚,对糖尿病大鼠施用激肽释放酶(PK)抑制剂和缓激肽B1受体拮抗剂(B1R)可显著改善视网膜血管通透性过高及炎症反应[27]。上诉研究提示,KLKB1是糖尿病性黄斑水肿的潜在治疗靶点。
KNG1具有多种生物学功能,通过抑制血管内皮生长因子表达,抑制内皮细胞增殖,发挥抗血管生成特性[28]。KNG1缺陷的大鼠,主动脉血管平滑肌细胞中MMP-2 mRNA表达增加,导致细胞外基质成分降解,在动脉瘤形成中起关键作用[29]。KNG1可作为IgA血管炎[30]、增殖性玻璃体视网膜病变[31]的生物标志物,以及具有区分川崎病伴冠状动脉扩张和冠状动脉瘤的潜在作用[32]。
DSP编码桥粒蛋白,存在于毛细血管内皮细胞间的细胞连接中,是体外血管形成中的一种重要蛋白质。桥粒蛋白在稳定桥粒和毛细血管形成中发挥重要作用,DSP缺陷的小鼠发生毛细血管渗漏和/或毛细血管畸形,体外实验中利用小干扰RNA敲低DSP表达,内皮细胞在基质胶上无法形成微血管;DSP表达异常影响内皮细胞的血管生成,参与脑动静脉畸形的发病机制[33]。另外有研究发现,显微镜下多血管炎和髓过氧化物酶阳性的ANCA相关性血管炎患者,DSP rs2076295G 显著增加,DSP可能是显微镜下多血管炎和髓过氧化物酶阳性的ANCA相关性血管炎的易感基因[34]。本研究结果显示,与健康对照者比,TAK患者血浆外泌体DSP表达上调,DSP可能是通过调节血管生理过程参与TAK的发病机制。
通过微小RNA测序技术、蛋白质谱技术、生物信息学方法分析了TAK患者血浆外泌体中微小RNA和蛋白,结合其他数据库进行验证,并依据差异表达微小RNA和差异表达蛋白在血管炎病理过程中的重要性,筛选出miR-34a-5p、miR-200c-3p、miR-143-3p、miR-22-3p、miR-21-5p、KLKB1、KNG1、DSP可能通过调节血管生理、血管重塑、炎症信号通路及自身免疫等过程参与血管炎的发病机制,在TAK的发病机制中可能亦具有重要的价值,具有作为TAK生物标志物和治疗靶点的潜在作用,可进一步在体内外功能研究中进行探究。
[1]
[2]
[3]
[4]
[5]
[6]
[7]
[8]
[9]
[10]
[11]
[12]
[13]
[14]
[15]
[16]
[17]
[18]
[19]
[20]
[21]
[22]
[23]
[24]
[25]
[26]
[27]
[28]
[29]
[30]
[31]
[32]
[33]
[34]
